5.3化学反应中的有关计算课时练习--2021-2022学年九年级化学鲁教版上册(word版 含解析)
文档属性
| 名称 | 5.3化学反应中的有关计算课时练习--2021-2022学年九年级化学鲁教版上册(word版 含解析) |  | |
| 格式 | zip | ||
| 文件大小 | 224.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-30 10:11:47 | ||
图片预览



文档简介
第五单元定量研究化学反应第三节化学反应中的有关计算课时练习鲁教版初中化学九年级上册
一、单选题(共12题)
1.汽车尾气处理过程中发生反应的微观示意图如下,下列说法正确的是(
)
A.1个甲分子中有3个原子
B.该化学反应前后分子的个数不变
C.属于氧化物的物质有3种
D.参加反应的甲和乙的质量比为17:45
2.一定质量的乙醇和氧气在密闭容器中充分燃烧后生成一氧化碳、二氧化碳和水分子的个数比不可能是(
)
A.1:1:3
B.1:2:5
C.1:3:6
D.2:4:9
3.构建化学基本观念是学好化学的基础,下列对化学基本观念的认识错误的是(
)
A.元素观:一氧化碳、二氧化碳都是由碳元素和氧元素组成的
B.微粒观:保持水的化学性质的最小微粒是水分子
C.转化观:氯化镁在一定条件下可直接转化为金属镁
D.守恒观:8g氢气和8g氧气充分反应,一定生成16g水
4.一定条件下,在一密闭容器中发生某反应,测得反应过程中各物质的质量如下表所示:
物质
X
Y
Z
Q
第一次测得的质量/g
32
51
漏测
6
第二次测得的质量/g
60
17
11
12
下列判断正确的是(
)
A.该反应中X和Q的质量变化之比为5:1
B.该反应的化学方程式可表示为:Y→X+Z+Q
C.Z可能是该反应的催化剂
D.该反应可能是化合反应
5.用特殊催化剂将甲烷在更温和条件下转化为其它有机物是重要的研究课题。如图为某反应原理,有关说法错误的是(
)
A.甲烷是重要的燃料
B.丙化学式为CH4O
C.反应前后原子的种类不变
D.参加反应的甲和乙的质量比是1:1
6.某物质在点燃的条件下发生反应,甲、乙、丙、丁表示所有的反应物和生成物,它们的微观示意图和反应前后的质量如下表所示。
物质序号
甲
乙
丙
丁
微观示意图
?
反应前质量/g
68
100
1
0
反应后质量/g
0
4
待测
128
下列说法不正确的是( )
A.根据质量守恒,推测反应后丙物质的质量为37g
B.根据元素守恒,推测丙物质中一定含有氢元素
C.根据原子守恒,甲和乙的化学计量数之比为1:1
D.根据表中信息,参加反应的乙和反应生成的丁的质量比为3:4
7.CO和CO2的混合气体18g,通入足量的灼热的CuO充分反应后,得到CO2的总质量为22g,则原混合气体中碳元素和氧元素的质量比为(
)
A.1:1
B.1:2
C.2:1
D.3:8
8.在化学反应A+3B=2C+3D中,已知8gA跟0.3gB恰好完全反应生成2.7gD。又知B的相对分子质量为2,则C的相对分子质量为(
)
A.18
B.28
C.40
D.56
9.一定质量的
CH4可与常见物质
M
反应,同时放出少量热量,将所的产物
Cu2O
与
O2反应又生成M,同时放出较多热量。其反应原理如图,下列说法不正确的是(
)
A.M
中铜元素的质量分数比
Cu2O
中的低
B.理论上反应每生成
44g
CO2,同时生成
18g
H2O
C.理论上每
16g
CH4参与反应,最终消耗
64g
O2
D.整个过程都不需要一直添加物质
M
10.在化学反应A+2B=C+D中,已知16gA和20gB恰好完全反应,生成C和D的质量比为7∶2,则生成C的质量为(
)
A.8g
B.28g
C.36g
D.16g
11.下图表示在催化剂作用下,将尾气中的一氧化碳、二氧化氮转化为无害气体的反应原理。下列有关说法正确的是(
)
A.生成的两种物质的质量比为22:7
B.参加反应的两种分子的个数比为
1︰1
C.反应前后各元素的化合价不变
D.反应前后原子的种类和数目都没有发生改变
12.草酸晶体(H2C2O4·xH2O)受热时完全分解产生H2O、CO2和CO。某研究小组称取6.3
g草酸晶体,测定草酸晶体中x的值,进行下图实验(假设装置气密性良好,各装置内均充分反应)。下列说法正确的是(
)
A.装置丁中漏斗的作用是防止倒吸
B.实验结束后测得装置甲增重2.7
g,则x的值为2
C.若装置甲、乙位置对调,则无法测定x的值
D.可通过装置丙的质量变化来测定x的值
二、综合题(共4题)
13.氧气在生产生活中有广泛的用途。
(1)实验室可用高锰酸钾、氯酸钾或过氧化氢制氧气的理由是_____,在氯酸钾制氧气、过氧化氢制取氧气时,要加入二氧化锰,二氧化锰的作用是_____。
(2)在空气中点燃镁条,看到的现象是_____,反应中固体质量变化如图所示。固体质量在t1前没有发生变化,从燃烧条件分析原因是_____。
(3)根据图示信息,2.4g镁条完全燃烧计算生成氧化镁的质量是多少g?_____
14.氢气作为新能源有很多优点,制取与储存氢气是氢能源利用领域的研究热点。
Ⅰ.制氢:铁酸锌(ZnFe2O4)可用于循环分解水制气,其反应可表示为:6ZnFe2O46ZnO+4Fe3O4+O2↑;3ZnO+2Fe3O4+H2O3ZnFe2O4+H2↑
(1)ZnFe2O4中Fe的化合价为_____。
(2)该循环制氢中不断消耗的物质是_____(填化学式),得到H2和O2的质量比为_____。
Ⅱ.贮氢:合金Mg2Cu是一种潜在的贮氢材料,高温时在氩气保护下,由一定质量比的Mg、Cu单质熔炼获得。该合金在一定条件下完全吸氢生成氢化物和另一种合金,其化学方程式为:2Mg2Cu+3H23MgH2+MgCu2。
(1)熔炼制备Mg2Cu合金时,通入氩气的目的是_____。
(2)氢化物MgH2与水反应生成一种碱,并释放出H2。其化学反应方程式为_____。
(3)11.2gMg2Cu完全吸氢后所得混合物与过量盐酸反应,放出H2的质量为_____g。
15.阅读下列科普短文,回答问题。
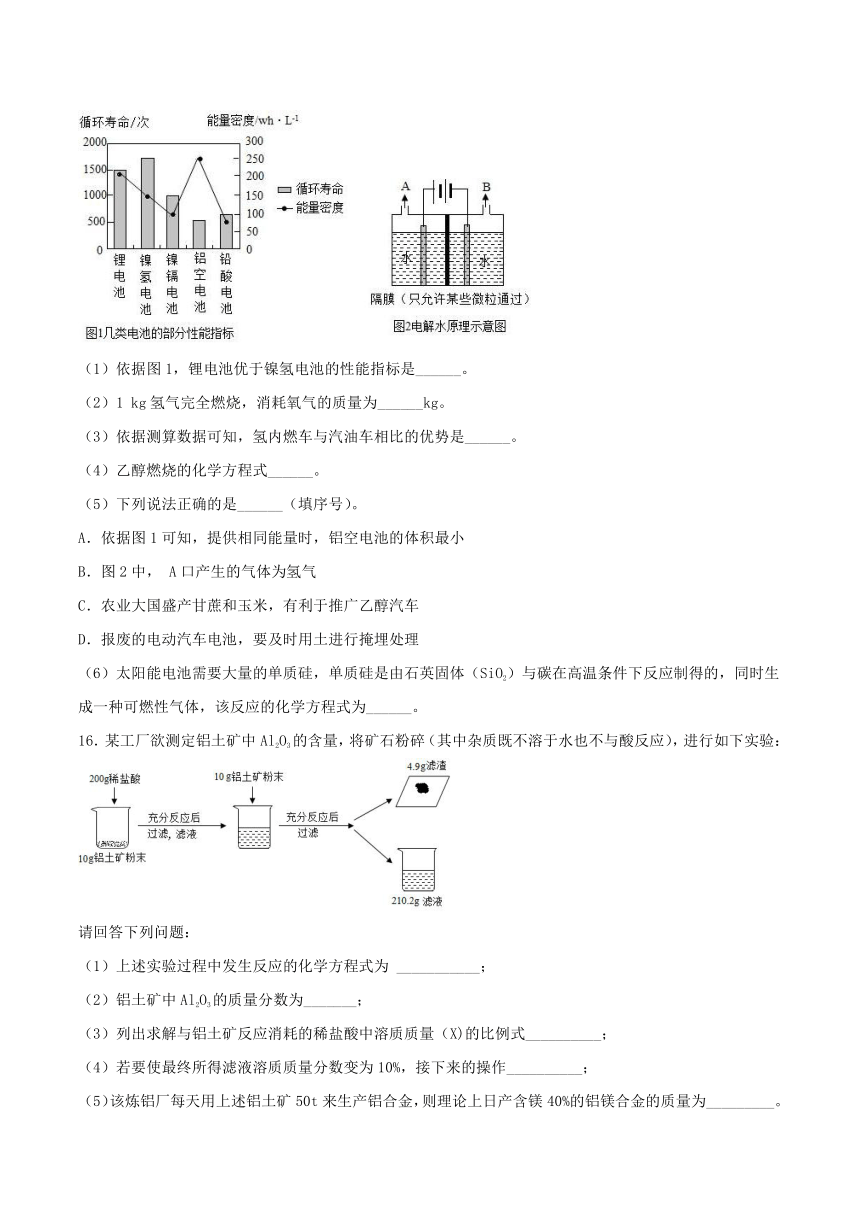
新能源汽车已经走进了我们的生活。与传统汽车使用化石燃料不同,新能源汽车的能量来源更加多元化。电动汽车:电池能为电动汽车提供动力,几类电池的部分性能指标如图1所示。其中能量密度表示单位体积的电池所具有的能量;氢内燃车:氢内燃车以氢气为燃料,不排放任何污染物。氢气可通过电解水(原理如图2)等多种方式获得。据测算,1
kg氢气完全燃烧可释放14.3×104
kJ的热量,1
kg汽油完全燃烧可释放4.6×104
kJ的热量;乙醇汽车:乙醇汽车以乙醇为燃料,乙醇是可再生能源,可以通过发酵甘蔗、玉米等农作物,或发酵粮食收割后剩余的秸秆大量提取;太阳能汽车:以太阳能电池驱动,低碳环保,真正实现了零排放。我国新能源汽车发展迅速,未来可期。
(1)依据图1,锂电池优于镍氢电池的性能指标是______。
(2)1
kg氢气完全燃烧,消耗氧气的质量为______kg。
(3)依据测算数据可知,氢内燃车与汽油车相比的优势是______。
(4)乙醇燃烧的化学方程式______。
(5)下列说法正确的是______(填序号)。
A.依据图1可知,提供相同能量时,铝空电池的体积最小
B.图2中,
A口产生的气体为氢气
C.农业大国盛产甘蔗和玉米,有利于推广乙醇汽车
D.报废的电动汽车电池,要及时用土进行掩埋处理
(6)太阳能电池需要大量的单质硅,单质硅是由石英固体(SiO2)与碳在高温条件下反应制得的,同时生成一种可燃性气体,该反应的化学方程式为______。
16.某工厂欲测定铝土矿中Al2O3的含量,将矿石粉碎(其中杂质既不溶于水也不与酸反应),进行如下实验:
请回答下列问题:
(1)上述实验过程中发生反应的化学方程式为
___________;
(2)铝土矿中Al2O3的质量分数为_______;
(3)列出求解与铝土矿反应消耗的稀盐酸中溶质质量(X)的比例式__________;
(4)若要使最终所得滤液溶质质量分数变为10%,接下来的操作__________;
(5)该炼铝厂每天用上述铝土矿50t来生产铝合金,则理论上日产含镁40%的铝镁合金的质量为_________。
参考答案
1.D
【分析】
由微观示意图可知:
【详解】
A、由微观示意图可知,一个NH3分子中有1个N原子和3个H原子,共4个原子,故A错误;
B、由微观示意图分析出的化学式可知,该化学反应前后分子的个数改变,故B错误;
C、NH3和NO是化合物,H2O是氧化物,N2是单质,故C错误;
D、参加反应的甲和乙的质量比为=[6×(14+6)]:[4×(14+1×3)]=17:45,故D正确。
故选:D
2.B
【详解】
乙醇的分子式为,乙醇分子中碳、氢原子个数比为2:6=1:3;每个一氧化碳、二氧化碳分子中均含一个碳原子,每个水分子中含2个氢原子;
A、若生成一氧化碳、二氧化碳和水分子的个数比1:1:3,则碳、氢原子个数比为2:6,符合质量守恒定律;
B、若生成一氧化碳、二氧化碳和水分子的个数比1:2:5,则碳、氢原子个数比为3:10,不符合质量守恒定律;
C、若生成一氧化碳、二氧化碳和水分子的个数比1:3:6,则碳、氢原子个数比为4:12=1:3,符合质量守恒定律;
D、若生成一氧化碳、二氧化碳和水分子的个数比2:4:9,则碳、氢原子个数比为6:18=1:3,符合质量守恒定律;
故选:B。
3.D
【详解】
A、一氧化碳、二氧化碳都是由碳元素和氧元素组成的,故A正确;
B、分子是保持物质化学性质的最小微粒,水是由水分子构成的,保持水的化学性质的最小微粒是水分子,故B正确;
C、氧化镁在一定条件下可直接转化为金属镁,如电解熔融氧化镁时,氧化镁分解生成镁和氧气,故C正确;
D、氢气与氧气的反应化学方程式为:,由方程式可知参加反应的氢气和氧气的质量比为1:8,即8g氧气与1g氢气恰好完全反应,故8g氢气和8g氧气充分反应时氢气有剩余,故生成水的质量小于16g,故D错误;
故选D。
4.C
【详解】
略
5.D
【详解】
A、甲烷具有可燃性,在燃烧时能放出大量的热,是重要的燃料,A正确;
B、根据物质的微观示意图可知,丙的化学式为CH4O,B正确;
C、该反应有新物质生成,属于化学反应,化学反应都遵守质量定律,反应前后原子的种类不变,C正确;
D、甲烷和水在催化剂作用下生成甲醇和氧气,反应的化学方程式及其质量关系:CH4+H2OCH3OH+H2,故参加反应的甲和乙的质量比是16:18=8:9,D错误。
故选D。
6.C
【分析】
根据质量守恒,则有68g+100g+1g+0=0+4g
+待测+128g,则待测=37g,反应后质量增多的物质是生成物,质量减少的物质是反应物,差量是生成的质量或参加反应的质量。甲反应后质量减少,是反应物,参加反应的质量为68g-0g=68g,乙反应后质量减少,是反应物,参加反应的质量为100g-4g=96g,丙的质量增加,丙是生成物,生成的质量为37g-1g=36g,丁的质量增加,丁是生成物,生成的质量为128g-0g=128g;
【详解】
A、由分析可知,反应的丙的质量为37g,选项说法正确;
B、由分析可知,甲+乙→丙+丁,即硫化氢与氧气反应生成丙和二氧化硫;根据元素守恒,反应中的氢元素转化到了丙物质中,即丙物质中一定含有氢元素,该选项说法正确;
C、根据原子守恒,甲(硫化氢)和乙(氧气)的化学计量数之比为:=2:3,该选项说法不正确;
D、根据表中信息可知,该反应中乙和丁的质量比为(100g-4g):(128g-0g)=3:4,该选项说法正确。
故选C。
7.B
【详解】
根据质量守恒定律,化学反应前后,元素的种类和质量不变,生成二氧化碳中碳元素的质量与原混合气体中碳元素的质量相同,故原混合气体中碳元素的质量为:,则原混合气体中碳元素和氧元素的质量比为:6g:(18g-6g)=1:2。
故选B。
8.D
【详解】
根据质量守恒定律,可求出生成C的质量为:。再根据化学方程式可求出C的相对分子质量,设C的相对分子质量为x。
故选D。
9.B
【详解】
A.由题意可知,M是氧化铜,氧化铜、氧化亚铜中铜元素质量分数分别是:
,M
中铜元素的质量分数比
Cu2O
中的低,选项正确;
B.
44g二氧化碳中碳元素质量是12g,含有12g碳元素的甲烷中含有氢元素质量是4g,则生成水的质量是:,理论上反应每生成
44g
CO2,同时生成
36g
H2O,选项错误;
C.
甲烷燃烧生成水和二氧化碳,反应的化学方程式及其质量关系:
,理论上每
16g
CH4
参与反应,最终消耗
64g
O2,选项正确;
D.
一定质量的CH4可与氧化铜反应,同时放出少量热量,将所得产物Cu2O与O2反应又生成氧化铜,同时放出较多热量,整个过程都不需要一直添加物质
M,选项正确。
故选B。
10.B
【详解】
因为16gA和20gB恰好完全反应,所以根据质量守恒定律,生成C和D的质量总和为:16g+20g=36g。又因为C和D的质量比为7∶2,所以生成C的质量为:。故选B。
11.D
【详解】
根据图示反应方程式为
A、由方程式可知,生成的两种物质的质量比为176:28=44:7,错误;
B、由方程式可知,参加反应的两种分子的个数比为
2︰4=1:2,错误;
C、反应前后氮元素的化合价由+4价变为0价,错误;
D、根据质量守恒定律可知,反应前后原子的种类和数目都不发生改变,正确。
故选D。
12.B
【分析】
本题考查学生对实验测定物质质量题型的掌握。
【详解】
A、装置丁的导管并没有连接漏斗管口,不能起到防倒吸的作用;错误;
B、装置甲增加的质量,就是草酸晶体燃烧后产生水的质量,即水的质量为2.7g,草酸晶体分解的化学方程式为:,可得:,求算出x的值为2。
C、若甲、乙位置对调,装置乙增加的质量即为水和二氧化碳的质量,即可得到CO的质量,由CO的质量也能求出x的值;错误;
D、装置丙的变化量为氧元素的质量,而氧元素来源于氧化铜和参加反应的CO,故无法求出x的值;错误。
故选B。
【点睛】
本题要结合质量守恒定律定律并灵活运用。
13.高锰酸钾、氯酸钾和过氧化氢中均含有氧元素
催化
发出耀眼白光
温度未达镁的着火点
4g
【详解】
(1)①高锰酸钾、氯酸钾和过氧化氢这三种物质中都含有氧元素,故可以用来制氧气;②在氯酸钾制氧气、过氧化氢制取氧气时,加入的二氧化锰起催化作用,其只是改变反应的速率,对反应的生成物及生成物的量都没有影响;
(2)③镁在空气中燃烧时,剧烈燃烧发出耀眼白光,放热,生成白色固体;④从燃烧条件分析,固体质量在t1前没有发生变化是因为温度未达镁的着火点;
(3)解:设生成氧化镁的质量为x
答:2.4g镁条完全燃烧计算生成氧化镁的质量为4g。
14.+3
H2O
1:8
防止金属被氧化
0.7
【详解】
Ⅰ:(1)ZnFe2O4中锌的化合价为+2价,氧元素的化合价为-2,设Fe的化合价为x,则有(+2)+2x+(-2)×4=0,x=+3。
(2)该循环制氢中不断消耗的物质是水,其化学式为H2O,得到H2和O2的质量比为4:32=1:8;
Ⅱ:(1)熔炼制备Mg2Cu合金时,通入氩气可以起到保护作用,防止金属被氧化。
(2)氢化物MgH2与水反应生成氢氧化镁,并释放出H2.其化学反应方程式为;
(3)11.2gMg2Cu完全吸氢后所得混合物与过量盐酸反应,其中的氢化镁与水反应生成氢氧化镁和氢气,MgCu2中只有镁与盐酸反应产生氢气,
7.6gMgCu2含有镁的质量为:
故生成氢气的质量为:0.6g+0.1g=0.7g
15.能量密度
8
热值大
AC
【详解】
(1)依据图1,锂电池优于镍氢电池的性能指标是能量密度;
(2)解:设消耗氧气的质量为x
x=8kg
(3)1
kg氢气完全燃烧可释放14.3×104
kJ的热量,1
kg汽油完全燃烧可释放4.6×104
kJ的热量,故氢气燃车与汽油车相比的优势是:热值高;
(4)乙醇燃烧生成二氧化碳和水,该反应的化学方程式为:;
(5)A、依据图1可知,铝空电池的能量密度最大,故提供相同能量时,铝空电池的体积最小,符合题意;
B、在电解水中,“正氧负氢”,A与正极相连,产生的是氧气,不符合题意;
C、乙醇可通过甘蔗和玉米发酵制得,故农业大国盛产甘蔗和玉米,有利于推广乙醇汽车,符合题意;
D、电池属于有害垃圾,应集中回收处理,不能用土掩埋处理,会造成土壤污染,不符合题意。
故选AC;
(6)二氧化硅与碳在高温条件下反应生成硅和一种可燃性气体,根据质量守恒定律,化学反应前后,元素的种类不变,反应物中含Si、O、C,生成物中也应含Si、C、O,故生成的可燃性气体为一氧化碳,该反应的化学方程式为:。
16.
51%
向最终所得滤液中加入56.8g水并混合均匀
22.5t
【详解】
(1)上述实验过程中发生反应的化学方程式为:。
(2)铝土矿中的质量为10g-4.9g=5.1g。
铝土矿中的质量分数为:。
(3)设与铝土矿反应消耗的稀盐酸中溶质质量X,反应生成氯化铝质量为y,则
y=13.35g;
(4)由数据可知,第二次加入10g氧化铝粉末消耗的氧化铝的质量同样为5.1g,所以最终所得滤液溶质质量为13.35g×2=26.7g,使最终所得滤液溶质质量分数变为10%,溶液的质量为,所以需要加入水的质量为267g-210.2g=56.8g;
故填:向最终所得滤液中加入56.8g水并混合均匀;
(5)理论上日产含镁40%的铝镁合金的质量为:.
【点睛】
根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
一、单选题(共12题)
1.汽车尾气处理过程中发生反应的微观示意图如下,下列说法正确的是(
)
A.1个甲分子中有3个原子
B.该化学反应前后分子的个数不变
C.属于氧化物的物质有3种
D.参加反应的甲和乙的质量比为17:45
2.一定质量的乙醇和氧气在密闭容器中充分燃烧后生成一氧化碳、二氧化碳和水分子的个数比不可能是(
)
A.1:1:3
B.1:2:5
C.1:3:6
D.2:4:9
3.构建化学基本观念是学好化学的基础,下列对化学基本观念的认识错误的是(
)
A.元素观:一氧化碳、二氧化碳都是由碳元素和氧元素组成的
B.微粒观:保持水的化学性质的最小微粒是水分子
C.转化观:氯化镁在一定条件下可直接转化为金属镁
D.守恒观:8g氢气和8g氧气充分反应,一定生成16g水
4.一定条件下,在一密闭容器中发生某反应,测得反应过程中各物质的质量如下表所示:
物质
X
Y
Z
Q
第一次测得的质量/g
32
51
漏测
6
第二次测得的质量/g
60
17
11
12
下列判断正确的是(
)
A.该反应中X和Q的质量变化之比为5:1
B.该反应的化学方程式可表示为:Y→X+Z+Q
C.Z可能是该反应的催化剂
D.该反应可能是化合反应
5.用特殊催化剂将甲烷在更温和条件下转化为其它有机物是重要的研究课题。如图为某反应原理,有关说法错误的是(
)
A.甲烷是重要的燃料
B.丙化学式为CH4O
C.反应前后原子的种类不变
D.参加反应的甲和乙的质量比是1:1
6.某物质在点燃的条件下发生反应,甲、乙、丙、丁表示所有的反应物和生成物,它们的微观示意图和反应前后的质量如下表所示。
物质序号
甲
乙
丙
丁
微观示意图
?
反应前质量/g
68
100
1
0
反应后质量/g
0
4
待测
128
下列说法不正确的是( )
A.根据质量守恒,推测反应后丙物质的质量为37g
B.根据元素守恒,推测丙物质中一定含有氢元素
C.根据原子守恒,甲和乙的化学计量数之比为1:1
D.根据表中信息,参加反应的乙和反应生成的丁的质量比为3:4
7.CO和CO2的混合气体18g,通入足量的灼热的CuO充分反应后,得到CO2的总质量为22g,则原混合气体中碳元素和氧元素的质量比为(
)
A.1:1
B.1:2
C.2:1
D.3:8
8.在化学反应A+3B=2C+3D中,已知8gA跟0.3gB恰好完全反应生成2.7gD。又知B的相对分子质量为2,则C的相对分子质量为(
)
A.18
B.28
C.40
D.56
9.一定质量的
CH4可与常见物质
M
反应,同时放出少量热量,将所的产物
Cu2O
与
O2反应又生成M,同时放出较多热量。其反应原理如图,下列说法不正确的是(
)
A.M
中铜元素的质量分数比
Cu2O
中的低
B.理论上反应每生成
44g
CO2,同时生成
18g
H2O
C.理论上每
16g
CH4参与反应,最终消耗
64g
O2
D.整个过程都不需要一直添加物质
M
10.在化学反应A+2B=C+D中,已知16gA和20gB恰好完全反应,生成C和D的质量比为7∶2,则生成C的质量为(
)
A.8g
B.28g
C.36g
D.16g
11.下图表示在催化剂作用下,将尾气中的一氧化碳、二氧化氮转化为无害气体的反应原理。下列有关说法正确的是(
)
A.生成的两种物质的质量比为22:7
B.参加反应的两种分子的个数比为
1︰1
C.反应前后各元素的化合价不变
D.反应前后原子的种类和数目都没有发生改变
12.草酸晶体(H2C2O4·xH2O)受热时完全分解产生H2O、CO2和CO。某研究小组称取6.3
g草酸晶体,测定草酸晶体中x的值,进行下图实验(假设装置气密性良好,各装置内均充分反应)。下列说法正确的是(
)
A.装置丁中漏斗的作用是防止倒吸
B.实验结束后测得装置甲增重2.7
g,则x的值为2
C.若装置甲、乙位置对调,则无法测定x的值
D.可通过装置丙的质量变化来测定x的值
二、综合题(共4题)
13.氧气在生产生活中有广泛的用途。
(1)实验室可用高锰酸钾、氯酸钾或过氧化氢制氧气的理由是_____,在氯酸钾制氧气、过氧化氢制取氧气时,要加入二氧化锰,二氧化锰的作用是_____。
(2)在空气中点燃镁条,看到的现象是_____,反应中固体质量变化如图所示。固体质量在t1前没有发生变化,从燃烧条件分析原因是_____。
(3)根据图示信息,2.4g镁条完全燃烧计算生成氧化镁的质量是多少g?_____
14.氢气作为新能源有很多优点,制取与储存氢气是氢能源利用领域的研究热点。
Ⅰ.制氢:铁酸锌(ZnFe2O4)可用于循环分解水制气,其反应可表示为:6ZnFe2O46ZnO+4Fe3O4+O2↑;3ZnO+2Fe3O4+H2O3ZnFe2O4+H2↑
(1)ZnFe2O4中Fe的化合价为_____。
(2)该循环制氢中不断消耗的物质是_____(填化学式),得到H2和O2的质量比为_____。
Ⅱ.贮氢:合金Mg2Cu是一种潜在的贮氢材料,高温时在氩气保护下,由一定质量比的Mg、Cu单质熔炼获得。该合金在一定条件下完全吸氢生成氢化物和另一种合金,其化学方程式为:2Mg2Cu+3H23MgH2+MgCu2。
(1)熔炼制备Mg2Cu合金时,通入氩气的目的是_____。
(2)氢化物MgH2与水反应生成一种碱,并释放出H2。其化学反应方程式为_____。
(3)11.2gMg2Cu完全吸氢后所得混合物与过量盐酸反应,放出H2的质量为_____g。
15.阅读下列科普短文,回答问题。
新能源汽车已经走进了我们的生活。与传统汽车使用化石燃料不同,新能源汽车的能量来源更加多元化。电动汽车:电池能为电动汽车提供动力,几类电池的部分性能指标如图1所示。其中能量密度表示单位体积的电池所具有的能量;氢内燃车:氢内燃车以氢气为燃料,不排放任何污染物。氢气可通过电解水(原理如图2)等多种方式获得。据测算,1
kg氢气完全燃烧可释放14.3×104
kJ的热量,1
kg汽油完全燃烧可释放4.6×104
kJ的热量;乙醇汽车:乙醇汽车以乙醇为燃料,乙醇是可再生能源,可以通过发酵甘蔗、玉米等农作物,或发酵粮食收割后剩余的秸秆大量提取;太阳能汽车:以太阳能电池驱动,低碳环保,真正实现了零排放。我国新能源汽车发展迅速,未来可期。
(1)依据图1,锂电池优于镍氢电池的性能指标是______。
(2)1
kg氢气完全燃烧,消耗氧气的质量为______kg。
(3)依据测算数据可知,氢内燃车与汽油车相比的优势是______。
(4)乙醇燃烧的化学方程式______。
(5)下列说法正确的是______(填序号)。
A.依据图1可知,提供相同能量时,铝空电池的体积最小
B.图2中,
A口产生的气体为氢气
C.农业大国盛产甘蔗和玉米,有利于推广乙醇汽车
D.报废的电动汽车电池,要及时用土进行掩埋处理
(6)太阳能电池需要大量的单质硅,单质硅是由石英固体(SiO2)与碳在高温条件下反应制得的,同时生成一种可燃性气体,该反应的化学方程式为______。
16.某工厂欲测定铝土矿中Al2O3的含量,将矿石粉碎(其中杂质既不溶于水也不与酸反应),进行如下实验:
请回答下列问题:
(1)上述实验过程中发生反应的化学方程式为
___________;
(2)铝土矿中Al2O3的质量分数为_______;
(3)列出求解与铝土矿反应消耗的稀盐酸中溶质质量(X)的比例式__________;
(4)若要使最终所得滤液溶质质量分数变为10%,接下来的操作__________;
(5)该炼铝厂每天用上述铝土矿50t来生产铝合金,则理论上日产含镁40%的铝镁合金的质量为_________。
参考答案
1.D
【分析】
由微观示意图可知:
【详解】
A、由微观示意图可知,一个NH3分子中有1个N原子和3个H原子,共4个原子,故A错误;
B、由微观示意图分析出的化学式可知,该化学反应前后分子的个数改变,故B错误;
C、NH3和NO是化合物,H2O是氧化物,N2是单质,故C错误;
D、参加反应的甲和乙的质量比为=[6×(14+6)]:[4×(14+1×3)]=17:45,故D正确。
故选:D
2.B
【详解】
乙醇的分子式为,乙醇分子中碳、氢原子个数比为2:6=1:3;每个一氧化碳、二氧化碳分子中均含一个碳原子,每个水分子中含2个氢原子;
A、若生成一氧化碳、二氧化碳和水分子的个数比1:1:3,则碳、氢原子个数比为2:6,符合质量守恒定律;
B、若生成一氧化碳、二氧化碳和水分子的个数比1:2:5,则碳、氢原子个数比为3:10,不符合质量守恒定律;
C、若生成一氧化碳、二氧化碳和水分子的个数比1:3:6,则碳、氢原子个数比为4:12=1:3,符合质量守恒定律;
D、若生成一氧化碳、二氧化碳和水分子的个数比2:4:9,则碳、氢原子个数比为6:18=1:3,符合质量守恒定律;
故选:B。
3.D
【详解】
A、一氧化碳、二氧化碳都是由碳元素和氧元素组成的,故A正确;
B、分子是保持物质化学性质的最小微粒,水是由水分子构成的,保持水的化学性质的最小微粒是水分子,故B正确;
C、氧化镁在一定条件下可直接转化为金属镁,如电解熔融氧化镁时,氧化镁分解生成镁和氧气,故C正确;
D、氢气与氧气的反应化学方程式为:,由方程式可知参加反应的氢气和氧气的质量比为1:8,即8g氧气与1g氢气恰好完全反应,故8g氢气和8g氧气充分反应时氢气有剩余,故生成水的质量小于16g,故D错误;
故选D。
4.C
【详解】
略
5.D
【详解】
A、甲烷具有可燃性,在燃烧时能放出大量的热,是重要的燃料,A正确;
B、根据物质的微观示意图可知,丙的化学式为CH4O,B正确;
C、该反应有新物质生成,属于化学反应,化学反应都遵守质量定律,反应前后原子的种类不变,C正确;
D、甲烷和水在催化剂作用下生成甲醇和氧气,反应的化学方程式及其质量关系:CH4+H2OCH3OH+H2,故参加反应的甲和乙的质量比是16:18=8:9,D错误。
故选D。
6.C
【分析】
根据质量守恒,则有68g+100g+1g+0=0+4g
+待测+128g,则待测=37g,反应后质量增多的物质是生成物,质量减少的物质是反应物,差量是生成的质量或参加反应的质量。甲反应后质量减少,是反应物,参加反应的质量为68g-0g=68g,乙反应后质量减少,是反应物,参加反应的质量为100g-4g=96g,丙的质量增加,丙是生成物,生成的质量为37g-1g=36g,丁的质量增加,丁是生成物,生成的质量为128g-0g=128g;
【详解】
A、由分析可知,反应的丙的质量为37g,选项说法正确;
B、由分析可知,甲+乙→丙+丁,即硫化氢与氧气反应生成丙和二氧化硫;根据元素守恒,反应中的氢元素转化到了丙物质中,即丙物质中一定含有氢元素,该选项说法正确;
C、根据原子守恒,甲(硫化氢)和乙(氧气)的化学计量数之比为:=2:3,该选项说法不正确;
D、根据表中信息可知,该反应中乙和丁的质量比为(100g-4g):(128g-0g)=3:4,该选项说法正确。
故选C。
7.B
【详解】
根据质量守恒定律,化学反应前后,元素的种类和质量不变,生成二氧化碳中碳元素的质量与原混合气体中碳元素的质量相同,故原混合气体中碳元素的质量为:,则原混合气体中碳元素和氧元素的质量比为:6g:(18g-6g)=1:2。
故选B。
8.D
【详解】
根据质量守恒定律,可求出生成C的质量为:。再根据化学方程式可求出C的相对分子质量,设C的相对分子质量为x。
故选D。
9.B
【详解】
A.由题意可知,M是氧化铜,氧化铜、氧化亚铜中铜元素质量分数分别是:
,M
中铜元素的质量分数比
Cu2O
中的低,选项正确;
B.
44g二氧化碳中碳元素质量是12g,含有12g碳元素的甲烷中含有氢元素质量是4g,则生成水的质量是:,理论上反应每生成
44g
CO2,同时生成
36g
H2O,选项错误;
C.
甲烷燃烧生成水和二氧化碳,反应的化学方程式及其质量关系:
,理论上每
16g
CH4
参与反应,最终消耗
64g
O2,选项正确;
D.
一定质量的CH4可与氧化铜反应,同时放出少量热量,将所得产物Cu2O与O2反应又生成氧化铜,同时放出较多热量,整个过程都不需要一直添加物质
M,选项正确。
故选B。
10.B
【详解】
因为16gA和20gB恰好完全反应,所以根据质量守恒定律,生成C和D的质量总和为:16g+20g=36g。又因为C和D的质量比为7∶2,所以生成C的质量为:。故选B。
11.D
【详解】
根据图示反应方程式为
A、由方程式可知,生成的两种物质的质量比为176:28=44:7,错误;
B、由方程式可知,参加反应的两种分子的个数比为
2︰4=1:2,错误;
C、反应前后氮元素的化合价由+4价变为0价,错误;
D、根据质量守恒定律可知,反应前后原子的种类和数目都不发生改变,正确。
故选D。
12.B
【分析】
本题考查学生对实验测定物质质量题型的掌握。
【详解】
A、装置丁的导管并没有连接漏斗管口,不能起到防倒吸的作用;错误;
B、装置甲增加的质量,就是草酸晶体燃烧后产生水的质量,即水的质量为2.7g,草酸晶体分解的化学方程式为:,可得:,求算出x的值为2。
C、若甲、乙位置对调,装置乙增加的质量即为水和二氧化碳的质量,即可得到CO的质量,由CO的质量也能求出x的值;错误;
D、装置丙的变化量为氧元素的质量,而氧元素来源于氧化铜和参加反应的CO,故无法求出x的值;错误。
故选B。
【点睛】
本题要结合质量守恒定律定律并灵活运用。
13.高锰酸钾、氯酸钾和过氧化氢中均含有氧元素
催化
发出耀眼白光
温度未达镁的着火点
4g
【详解】
(1)①高锰酸钾、氯酸钾和过氧化氢这三种物质中都含有氧元素,故可以用来制氧气;②在氯酸钾制氧气、过氧化氢制取氧气时,加入的二氧化锰起催化作用,其只是改变反应的速率,对反应的生成物及生成物的量都没有影响;
(2)③镁在空气中燃烧时,剧烈燃烧发出耀眼白光,放热,生成白色固体;④从燃烧条件分析,固体质量在t1前没有发生变化是因为温度未达镁的着火点;
(3)解:设生成氧化镁的质量为x
答:2.4g镁条完全燃烧计算生成氧化镁的质量为4g。
14.+3
H2O
1:8
防止金属被氧化
0.7
【详解】
Ⅰ:(1)ZnFe2O4中锌的化合价为+2价,氧元素的化合价为-2,设Fe的化合价为x,则有(+2)+2x+(-2)×4=0,x=+3。
(2)该循环制氢中不断消耗的物质是水,其化学式为H2O,得到H2和O2的质量比为4:32=1:8;
Ⅱ:(1)熔炼制备Mg2Cu合金时,通入氩气可以起到保护作用,防止金属被氧化。
(2)氢化物MgH2与水反应生成氢氧化镁,并释放出H2.其化学反应方程式为;
(3)11.2gMg2Cu完全吸氢后所得混合物与过量盐酸反应,其中的氢化镁与水反应生成氢氧化镁和氢气,MgCu2中只有镁与盐酸反应产生氢气,
7.6gMgCu2含有镁的质量为:
故生成氢气的质量为:0.6g+0.1g=0.7g
15.能量密度
8
热值大
AC
【详解】
(1)依据图1,锂电池优于镍氢电池的性能指标是能量密度;
(2)解:设消耗氧气的质量为x
x=8kg
(3)1
kg氢气完全燃烧可释放14.3×104
kJ的热量,1
kg汽油完全燃烧可释放4.6×104
kJ的热量,故氢气燃车与汽油车相比的优势是:热值高;
(4)乙醇燃烧生成二氧化碳和水,该反应的化学方程式为:;
(5)A、依据图1可知,铝空电池的能量密度最大,故提供相同能量时,铝空电池的体积最小,符合题意;
B、在电解水中,“正氧负氢”,A与正极相连,产生的是氧气,不符合题意;
C、乙醇可通过甘蔗和玉米发酵制得,故农业大国盛产甘蔗和玉米,有利于推广乙醇汽车,符合题意;
D、电池属于有害垃圾,应集中回收处理,不能用土掩埋处理,会造成土壤污染,不符合题意。
故选AC;
(6)二氧化硅与碳在高温条件下反应生成硅和一种可燃性气体,根据质量守恒定律,化学反应前后,元素的种类不变,反应物中含Si、O、C,生成物中也应含Si、C、O,故生成的可燃性气体为一氧化碳,该反应的化学方程式为:。
16.
51%
向最终所得滤液中加入56.8g水并混合均匀
22.5t
【详解】
(1)上述实验过程中发生反应的化学方程式为:。
(2)铝土矿中的质量为10g-4.9g=5.1g。
铝土矿中的质量分数为:。
(3)设与铝土矿反应消耗的稀盐酸中溶质质量X,反应生成氯化铝质量为y,则
y=13.35g;
(4)由数据可知,第二次加入10g氧化铝粉末消耗的氧化铝的质量同样为5.1g,所以最终所得滤液溶质质量为13.35g×2=26.7g,使最终所得滤液溶质质量分数变为10%,溶液的质量为,所以需要加入水的质量为267g-210.2g=56.8g;
故填:向最终所得滤液中加入56.8g水并混合均匀;
(5)理论上日产含镁40%的铝镁合金的质量为:.
【点睛】
根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
