江苏省昆山市周市高中2021-2022学年高一上学期第一次模块测试化学试题(Word版含答案)
文档属性
| 名称 | 江苏省昆山市周市高中2021-2022学年高一上学期第一次模块测试化学试题(Word版含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 387.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-30 11:20:51 | ||
图片预览


文档简介
昆山市周市高级中学2021-2022学年第一学期第一次模块测试
高一化学试题
时间:90分钟
满分:100分
可能用到的相对原子质量:H
1;He
4;C
12;N
14;O
16;Na
23;Mg
24;S
32;
Cl
35.5;K
39;Ca
40;Fe
56;Cu
64;Zn
65;Mn
55;Ba
137。
选择题(共62分)
单项选择题(本大题共10小题,每小题3分,共30分。每小题只有一个选项符合题意。)
1.中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700
℃制造出纳米级金刚石粉末。该成果发表在世界权威的《科学》杂志上,立刻被科学家们高度评价为“稻草变黄金”。同学们对此有下列一些理解,其中错误的是(
)
A.金刚石属于金属单质
B.制造过程中元素种类没有改变
C.CCl4是一种化合物
D.这个反应是置换反应
2.用括号里的试剂鉴别下面各组气体或溶液,其中不合理的是(
)
A.二氧化碳、氮气、一氧化碳(澄清石灰水)
B.氯化钠、硝酸银、碳酸钠(稀盐酸)
C.酒精、醋酸、氨水(石蕊试液)
D.硫酸、硝酸钡、氯化钾(碳酸钠溶液)
3.在一定温度和压强下的理想气体,影响其所占体积大小的主要因素是(
)
A.分子间距离的大小
B.分子间引力的大小
C.分子直径的大小
D.分子数目的多少
4.下列物质中,属于电解质的是(
)
A.氧气
B.酒精
C.稀盐酸
D.碳酸氢钠
5.实验室有两瓶溶液,已失去标签,已知其中一瓶是硫酸溶液,另一瓶是蔗糖溶液。同学们设计了下列方案对溶液进行鉴别,其中不正确的是(
)
A.取样,分别向两溶液中滴加盐酸酸化的氯化钡溶液,生成白色溶液的是硫酸溶液,不产生沉淀的是蔗糖溶液
B.取样,分别进行导电性实验,能导电的是硫酸溶液,不能导电的是蔗糖溶液
C.取样,分别取极少量溶液尝一尝,有甜味的是蔗糖溶液,有酸味的是硫酸溶液
D.取样,分别向两溶液中加入少量Na2CO3溶液,产生气体的是硫酸溶液,不产生气体的是蔗糖溶液
6.苏州是一个轻度缺碘的地区,市民补碘需要科学适量。市场上销售的某种“加碘食盐”中加入含碘元素的物质是碘酸钾(KClO3),碘酸钾属于(
)
A.酸
B.碱
C.盐
D.氧化物
7.当光束通过下列分散系时,能观察到丁达尔效应的是(
)
A.白酒
B.稀豆浆
C.食盐水
D.白糖水
8.氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于阴影部分的是
A.CaO
+
H2O===Ca(OH)2
B.Zn
+
H2SO4
===ZnSO4
+
H2↑
C.Fe2O3+3CO2Fe+3CO2
D.CaCO3+2HCl===CaCl2+
H2O+CO2
↑
9.下列化学式所表示的物质属于酸性氧化物的是(
)
A.CO
B.SiO2
C.Na2O
D.H2O2
10.甘氨酸的化学式为C2H5O2N,关于0.5
mol
C2H5O2N计算结果错误的是(
)
A.分子个数约为:3.01×1023
B.相对分子质量:75
C.原子的物质的量的总和:4.5
mol
D.氧元素质量:16
g
不定项选择(本题包括8小题,每小题4分,共32分。每小题只有一个或两个选项符合题意。若正确答案只包含一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得4分,但只要选错一个该小题就为0分。)
11.在标准状况下,相同质量的下列气体中体积最大的是(
)
A.Cl2
B.N2
C.O2
D.CO2
12.下列说法中正确的是(
)
A.碳酸氢钠在水溶液中的电离方程式为NaHCO3=Na++H++CO32-
B.胶体区别于其他分散系的外在特征是能发生丁达尔效应
C.物质的量就是物质的质量的另一种表达方式,单位是g·mol-1
D.氢氧化铁胶体能吸附水中的悬浮颗粒并沉降,起到净水作用
13.下列各组物质仅用蒸馏水不能鉴别的是(
)
A.固体碘、氧化铜、高锰酸钾
B.汽油、酒精、四氯化碳
C.食盐、烧碱、溴化钾
D.无水硫酸铜、碳酸钙、氯化铵
14.用NA表示阿伏加德罗常数的值,下列叙述正确的是(
)
A.常温常压下,1.8
g
NH4+
中含有的电子数为NA
B.标准状况下,11.2
L水中含有的原子数为1.5
NA
C.通常状况下,1
mol·L-1的氯化铜溶液中含有的氯离子数为2
NA
D.标准状况下,1
mol
H2与O2的混合气体中含有的分子数为2
NA
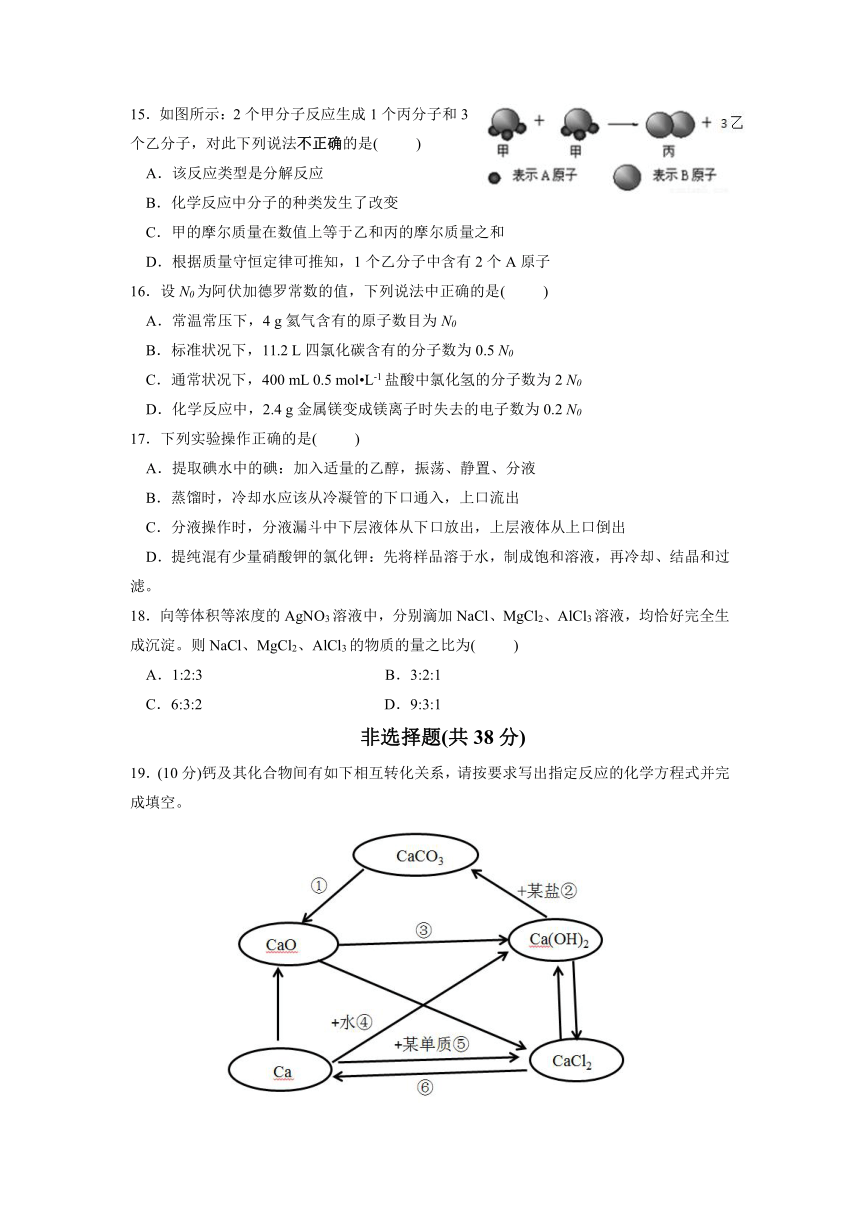
15.如图所示:2个甲分子反应生成1个丙分子和3个乙分子,对此下列说法不正确的是(
)
A.该反应类型是分解反应
B.化学反应中分子的种类发生了改变
C.甲的摩尔质量在数值上等于乙和丙的摩尔质量之和
D.根据质量守恒定律可推知,1个乙分子中含有2个A原子
16.设N0为阿伏加德罗常数的值,下列说法中正确的是(
)
A.常温常压下,4
g氦气含有的原子数目为N0
B.标准状况下,11.2
L四氯化碳含有的分子数为0.5
N0
C.通常状况下,400
mL
0.5
mol L-1盐酸中氯化氢的分子数为2
N0
D.化学反应中,2.4
g金属镁变成镁离子时失去的电子数为0.2
N0
17.下列实验操作正确的是(
)
A.提取碘水中的碘:加入适量的乙醇,振荡、静置、分液
B.蒸馏时,冷却水应该从冷凝管的下口通入,上口流出
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.提纯混有少量硝酸钾的氯化钾:先将样品溶于水,制成饱和溶液,再冷却、结晶和过滤。
18.向等体积等浓度的AgNO3溶液中,分别滴加NaCl、MgCl2、AlCl3溶液,均恰好完全生成沉淀。则NaCl、MgCl2、AlCl3的物质的量之比为(
)
A.1:2:3
B.3:2:1
C.6:3:2
D.9:3:1
非选择题(共38分)
19.(10分)钙及其化合物间有如下相互转化关系,请按要求写出指定反应的化学方程式并完成填空。
(1)反应②
(2)反应⑤
(3)反应⑥
(4)在反应①~⑥中,属于化合反应的是
(填序号,下同),
属于氧化还原反应的是
20.(20分)按要求完成下列填空。
(1)
49
g
H2SO4中氧原子数为
。
(2)标准状况下,氮气的密度为
。
(3)同温同压下,0.4
g
H2与1.6
g
CH4的体积之比为
;二者混合后,所含H原子总数为
。
(4)
100
mL
0.25
mol L-1
BaCl2溶液加水稀释到500
mL后溶液中Cl—的物质的量浓度为
。
(5)市售浓硫酸中溶质的质量分数为98%,密度为1.84
g cm-3,则该浓硫酸中H2SO4的物质的量浓度为
。
(6)某金属氯化物NCl2
40.5
g,含有0.6
mol
Cl—,则金属N的相对原子质量为
。
(7)将
L氯化氢(标准状况)通入1L水中可得到密度为1.19
g cm-3的36.5%(质量分数)的浓盐酸。
(8)为测定K2SO4溶液的浓度,取25.00
mL待测溶液,向其中加入过量的BaCl2溶液,充分反应后过滤并干燥,得到BaSO4沉淀1.165
g,则K2SO4溶液的物质的量浓度是
。
(9)已经打磨光亮的铁片和铝片,如何用化学方法将其区分(提供的试剂有0.1
mol L-1的盐酸和0.1
mol L-1的NaOH溶液),请设计实验方案
。
21.(8分)已知二氧化锰与浓盐酸在加热条件下发生反应的化学方程式为:
MnO2
+
4HCl(浓)
==
MnCl2
+
Cl2↑
+
2H2O。
用8.7
g二氧化锰与100
g
36.5%
的浓盐酸混合加热,充分反应,计算:
(1)消耗盐酸溶质的物质的量。
(2)产生的Cl2在标准状况下的体积。
(3)将反应后的溶液加水稀释至400
mL,则此溶液中MnCl2的物质的量浓度是多少?
答案
选择题(共62分)
单项选择题(本大题共10小题,每小题3分,共30分。每小题只有一个选项符合题意。)
题号
1
2
3
4
5
6
7
8
9
10
答案
A
A
D
D
C
C
B
C
B
C
不定项选择
题号
11
12
13
14
15
16
17
18
答案
B
BD
C
A
C
AD
BC
C
非选择题(共38分)
19.(10分)(1)
②Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
等
(2分)
(2)
⑤Ca+Cl2=CaCl2
(2分,写加热条件、点燃条件、不写条件也可)
(3)
⑥CaCl2(熔融)=通电=Ca+Cl2↑
(2分)
(4)
③⑤
(2分)
④⑤⑥
(2分)
20.(20分)(1)
1.204×1024
(2分,写2NA不得分)
(2)
1.25
g L-1
(2分)
(3)
2:1
(2分)
4.816×1023
(2分,写0.8NA不得分)
(4)
0.10
mol
L-1
(2分)(写0.1
mol L-1得1分)
(5)
18.4
mol
L-1
(2分)
(6)
64
(2分)
(7)
353
(352.75)
(2分)
(8)
0.2000
mol L-1
(2分)(写0.2mol L-1得1分)
(9)分别取少量铁片和铝片于两支试管中,各加入少量0.1
mol L-1的NaOH溶液。若产生无色气体,则为铝片;若无明显现象,则为铁片。(2分)(其他合理答案均可)
21.(8分)
(有效数字1分,单位1分,过程2分)
(1)
0.40
mol
(2分)
(2)
2.24
L
(3分)
(3)
0.25
mol
L-1
(3分)
高一化学试题
时间:90分钟
满分:100分
可能用到的相对原子质量:H
1;He
4;C
12;N
14;O
16;Na
23;Mg
24;S
32;
Cl
35.5;K
39;Ca
40;Fe
56;Cu
64;Zn
65;Mn
55;Ba
137。
选择题(共62分)
单项选择题(本大题共10小题,每小题3分,共30分。每小题只有一个选项符合题意。)
1.中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700
℃制造出纳米级金刚石粉末。该成果发表在世界权威的《科学》杂志上,立刻被科学家们高度评价为“稻草变黄金”。同学们对此有下列一些理解,其中错误的是(
)
A.金刚石属于金属单质
B.制造过程中元素种类没有改变
C.CCl4是一种化合物
D.这个反应是置换反应
2.用括号里的试剂鉴别下面各组气体或溶液,其中不合理的是(
)
A.二氧化碳、氮气、一氧化碳(澄清石灰水)
B.氯化钠、硝酸银、碳酸钠(稀盐酸)
C.酒精、醋酸、氨水(石蕊试液)
D.硫酸、硝酸钡、氯化钾(碳酸钠溶液)
3.在一定温度和压强下的理想气体,影响其所占体积大小的主要因素是(
)
A.分子间距离的大小
B.分子间引力的大小
C.分子直径的大小
D.分子数目的多少
4.下列物质中,属于电解质的是(
)
A.氧气
B.酒精
C.稀盐酸
D.碳酸氢钠
5.实验室有两瓶溶液,已失去标签,已知其中一瓶是硫酸溶液,另一瓶是蔗糖溶液。同学们设计了下列方案对溶液进行鉴别,其中不正确的是(
)
A.取样,分别向两溶液中滴加盐酸酸化的氯化钡溶液,生成白色溶液的是硫酸溶液,不产生沉淀的是蔗糖溶液
B.取样,分别进行导电性实验,能导电的是硫酸溶液,不能导电的是蔗糖溶液
C.取样,分别取极少量溶液尝一尝,有甜味的是蔗糖溶液,有酸味的是硫酸溶液
D.取样,分别向两溶液中加入少量Na2CO3溶液,产生气体的是硫酸溶液,不产生气体的是蔗糖溶液
6.苏州是一个轻度缺碘的地区,市民补碘需要科学适量。市场上销售的某种“加碘食盐”中加入含碘元素的物质是碘酸钾(KClO3),碘酸钾属于(
)
A.酸
B.碱
C.盐
D.氧化物
7.当光束通过下列分散系时,能观察到丁达尔效应的是(
)
A.白酒
B.稀豆浆
C.食盐水
D.白糖水
8.氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于阴影部分的是
A.CaO
+
H2O===Ca(OH)2
B.Zn
+
H2SO4
===ZnSO4
+
H2↑
C.Fe2O3+3CO2Fe+3CO2
D.CaCO3+2HCl===CaCl2+
H2O+CO2
↑
9.下列化学式所表示的物质属于酸性氧化物的是(
)
A.CO
B.SiO2
C.Na2O
D.H2O2
10.甘氨酸的化学式为C2H5O2N,关于0.5
mol
C2H5O2N计算结果错误的是(
)
A.分子个数约为:3.01×1023
B.相对分子质量:75
C.原子的物质的量的总和:4.5
mol
D.氧元素质量:16
g
不定项选择(本题包括8小题,每小题4分,共32分。每小题只有一个或两个选项符合题意。若正确答案只包含一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得4分,但只要选错一个该小题就为0分。)
11.在标准状况下,相同质量的下列气体中体积最大的是(
)
A.Cl2
B.N2
C.O2
D.CO2
12.下列说法中正确的是(
)
A.碳酸氢钠在水溶液中的电离方程式为NaHCO3=Na++H++CO32-
B.胶体区别于其他分散系的外在特征是能发生丁达尔效应
C.物质的量就是物质的质量的另一种表达方式,单位是g·mol-1
D.氢氧化铁胶体能吸附水中的悬浮颗粒并沉降,起到净水作用
13.下列各组物质仅用蒸馏水不能鉴别的是(
)
A.固体碘、氧化铜、高锰酸钾
B.汽油、酒精、四氯化碳
C.食盐、烧碱、溴化钾
D.无水硫酸铜、碳酸钙、氯化铵
14.用NA表示阿伏加德罗常数的值,下列叙述正确的是(
)
A.常温常压下,1.8
g
NH4+
中含有的电子数为NA
B.标准状况下,11.2
L水中含有的原子数为1.5
NA
C.通常状况下,1
mol·L-1的氯化铜溶液中含有的氯离子数为2
NA
D.标准状况下,1
mol
H2与O2的混合气体中含有的分子数为2
NA
15.如图所示:2个甲分子反应生成1个丙分子和3个乙分子,对此下列说法不正确的是(
)
A.该反应类型是分解反应
B.化学反应中分子的种类发生了改变
C.甲的摩尔质量在数值上等于乙和丙的摩尔质量之和
D.根据质量守恒定律可推知,1个乙分子中含有2个A原子
16.设N0为阿伏加德罗常数的值,下列说法中正确的是(
)
A.常温常压下,4
g氦气含有的原子数目为N0
B.标准状况下,11.2
L四氯化碳含有的分子数为0.5
N0
C.通常状况下,400
mL
0.5
mol L-1盐酸中氯化氢的分子数为2
N0
D.化学反应中,2.4
g金属镁变成镁离子时失去的电子数为0.2
N0
17.下列实验操作正确的是(
)
A.提取碘水中的碘:加入适量的乙醇,振荡、静置、分液
B.蒸馏时,冷却水应该从冷凝管的下口通入,上口流出
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.提纯混有少量硝酸钾的氯化钾:先将样品溶于水,制成饱和溶液,再冷却、结晶和过滤。
18.向等体积等浓度的AgNO3溶液中,分别滴加NaCl、MgCl2、AlCl3溶液,均恰好完全生成沉淀。则NaCl、MgCl2、AlCl3的物质的量之比为(
)
A.1:2:3
B.3:2:1
C.6:3:2
D.9:3:1
非选择题(共38分)
19.(10分)钙及其化合物间有如下相互转化关系,请按要求写出指定反应的化学方程式并完成填空。
(1)反应②
(2)反应⑤
(3)反应⑥
(4)在反应①~⑥中,属于化合反应的是
(填序号,下同),
属于氧化还原反应的是
20.(20分)按要求完成下列填空。
(1)
49
g
H2SO4中氧原子数为
。
(2)标准状况下,氮气的密度为
。
(3)同温同压下,0.4
g
H2与1.6
g
CH4的体积之比为
;二者混合后,所含H原子总数为
。
(4)
100
mL
0.25
mol L-1
BaCl2溶液加水稀释到500
mL后溶液中Cl—的物质的量浓度为
。
(5)市售浓硫酸中溶质的质量分数为98%,密度为1.84
g cm-3,则该浓硫酸中H2SO4的物质的量浓度为
。
(6)某金属氯化物NCl2
40.5
g,含有0.6
mol
Cl—,则金属N的相对原子质量为
。
(7)将
L氯化氢(标准状况)通入1L水中可得到密度为1.19
g cm-3的36.5%(质量分数)的浓盐酸。
(8)为测定K2SO4溶液的浓度,取25.00
mL待测溶液,向其中加入过量的BaCl2溶液,充分反应后过滤并干燥,得到BaSO4沉淀1.165
g,则K2SO4溶液的物质的量浓度是
。
(9)已经打磨光亮的铁片和铝片,如何用化学方法将其区分(提供的试剂有0.1
mol L-1的盐酸和0.1
mol L-1的NaOH溶液),请设计实验方案
。
21.(8分)已知二氧化锰与浓盐酸在加热条件下发生反应的化学方程式为:
MnO2
+
4HCl(浓)
==
MnCl2
+
Cl2↑
+
2H2O。
用8.7
g二氧化锰与100
g
36.5%
的浓盐酸混合加热,充分反应,计算:
(1)消耗盐酸溶质的物质的量。
(2)产生的Cl2在标准状况下的体积。
(3)将反应后的溶液加水稀释至400
mL,则此溶液中MnCl2的物质的量浓度是多少?
答案
选择题(共62分)
单项选择题(本大题共10小题,每小题3分,共30分。每小题只有一个选项符合题意。)
题号
1
2
3
4
5
6
7
8
9
10
答案
A
A
D
D
C
C
B
C
B
C
不定项选择
题号
11
12
13
14
15
16
17
18
答案
B
BD
C
A
C
AD
BC
C
非选择题(共38分)
19.(10分)(1)
②Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
等
(2分)
(2)
⑤Ca+Cl2=CaCl2
(2分,写加热条件、点燃条件、不写条件也可)
(3)
⑥CaCl2(熔融)=通电=Ca+Cl2↑
(2分)
(4)
③⑤
(2分)
④⑤⑥
(2分)
20.(20分)(1)
1.204×1024
(2分,写2NA不得分)
(2)
1.25
g L-1
(2分)
(3)
2:1
(2分)
4.816×1023
(2分,写0.8NA不得分)
(4)
0.10
mol
L-1
(2分)(写0.1
mol L-1得1分)
(5)
18.4
mol
L-1
(2分)
(6)
64
(2分)
(7)
353
(352.75)
(2分)
(8)
0.2000
mol L-1
(2分)(写0.2mol L-1得1分)
(9)分别取少量铁片和铝片于两支试管中,各加入少量0.1
mol L-1的NaOH溶液。若产生无色气体,则为铝片;若无明显现象,则为铁片。(2分)(其他合理答案均可)
21.(8分)
(有效数字1分,单位1分,过程2分)
(1)
0.40
mol
(2分)
(2)
2.24
L
(3分)
(3)
0.25
mol
L-1
(3分)
同课章节目录
