2021-2022学年上学期高一化学人教版(2019)必修第一册第一章物质及其变化第1节第2课时 物质的转化课件(25张ppt)
文档属性
| 名称 | 2021-2022学年上学期高一化学人教版(2019)必修第一册第一章物质及其变化第1节第2课时 物质的转化课件(25张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 525.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-03 17:46:46 | ||
图片预览






文档简介
(共25张PPT)
第一章
物质及其变化
1.1物质的分类
Welcome
to
chemistry
重点:酸碱盐的性质
物质的转化
1
酸碱盐的性质※※
2
物质的转化
※※※
CONTENTS
本节要点
01
酸碱盐的性质
酸碱盐
二、物质的转化
1.酸碱盐的性质
创原家独
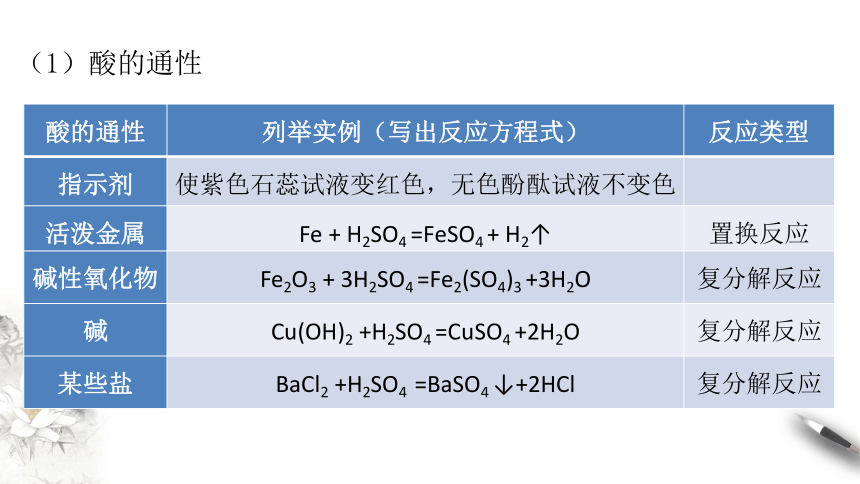
酸的通性
列举实例(写出反应方程式)
反应类型
指示剂
使紫色石蕊试液变红色,无色酚酞试液不变色
活泼金属
Fe
+
H2SO4
=FeSO4
+
H2↑
置换反应
碱性氧化物
Fe2O3
+
3H2SO4
=Fe2(SO4)3
+3H2O
复分解反应
碱
Cu(OH)2
+H2SO4
=CuSO4
+2H2O
复分解反应
某些盐
BaCl2
+H2SO4
=BaSO4
↓+2HCl
复分解反应
(1)酸的通性
(2)碱的通性
碱的通性
列举实例(写出反应方程式)
反应类型
指示剂
使紫色石蕊试液变蓝色,无色酚酞试液变红色
酸
NaOH+HCl=NaCl+H2O
复分解反应
酸性氧化物
CO2+2NaOH
=Na2CO3+H2O
复分解反应
某些盐
2NaOH+CuSO4
=Cu(OH)2
↓+Na2SO4
复分解反应
网
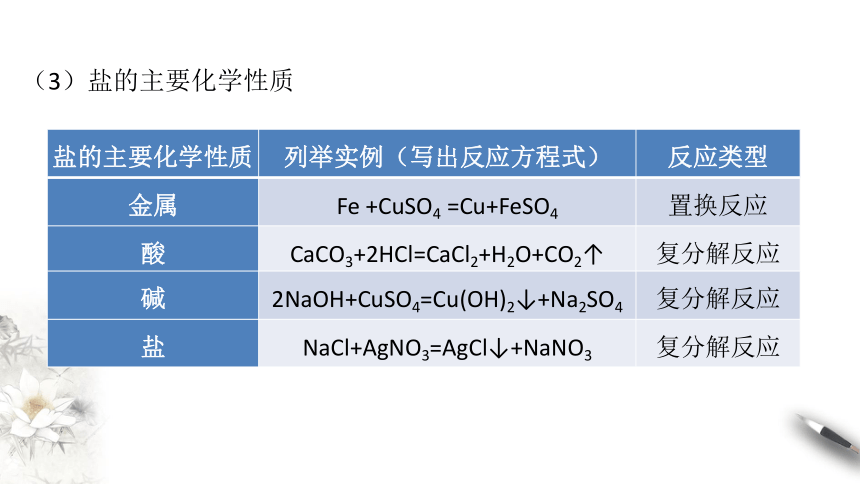
(3)盐的主要化学性质
盐的主要化学性质
列举实例(写出反应方程式)
反应类型
金属
Fe
+CuSO4
=Cu+FeSO4
置换反应
酸
CaCO3+2HCl=CaCl2+H2O+CO2↑
复分解反应
碱
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
复分解反应
盐
NaCl+AgNO3=AgCl↓+NaNO3
复分解反应
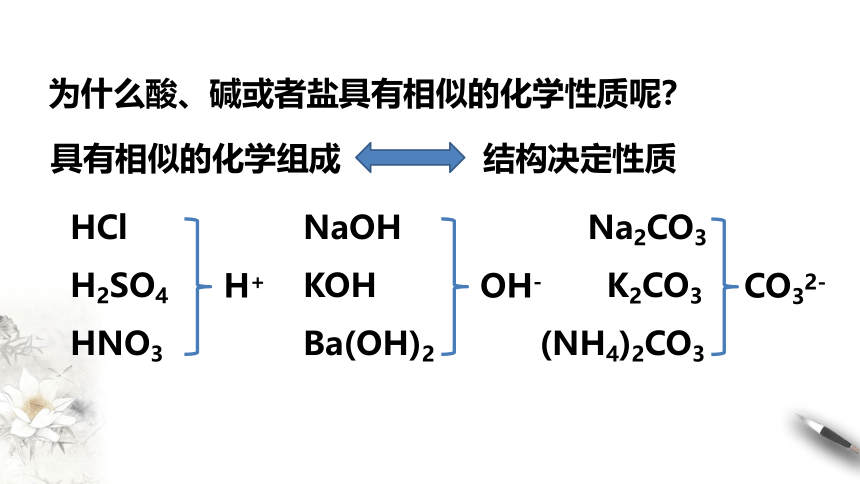
为什么酸、碱或者盐具有相似的化学性质呢?
具有相似的化学组成
结构决定性质
HCl
H2SO4
HNO3
H+
NaOH
KOH
Ba(OH)2
OH-
Na2CO3
K2CO3
(NH4)2CO3
CO32-
学
学
学
四种基本反应类型
反应类型
实例(化学方程式)
化合反应
CaO+H2O=Ca(OH)2
分解反应
2KClO3
2KCl+3O2↑
置换反应
Zn+H2SO4=ZnSO4+H2↑
复分解反应
2HCl+CaCO3=CaCl2+H2O+CO2↑
MnO2
巧记口诀:
多变一
单换单
一变多
沉淀气体水
1.下列物质的分类正确的是( )
碱
酸
盐
碱性氧化物
酸性氧化物
A
KOH
HNO3
CaCO3
CaO
SO2
B
NaOH
HCl
NaHSO4
Na2O
CO
C
Cu2(OH)2CO3
CH3COOH
CaF2
CO
SO2
D
Na2CO3
H2SO4
NaOH
SO2
CO2
【练一练】
A
×
×
×
实验室中的药品常按物质的性质、类别等不同而有规律地放置。在做“酸的性质”实验时,实验桌上部分药品的摆放如图所示。某同学取用KOH溶液后应把试剂瓶放回的位置是( )
2.NaHSO4在水溶液中能够电离出Na+、H+和SO42-。下列对于NaHSO4的分类中不正确的是( )A.NaHSO4是盐
B.NaHSO4是酸
C.NaHSO4是钠盐
D.NaHSO4是酸式盐
【练一练】
B
D
×
×
×
酸
指示剂
盐
碱
3.叙述中,不正确的是( )
A.CaCO3、Ca(HCO3)2、Cu2(OH)2CO3都属于碳酸盐
B.盐酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
C.蓝矾(CuSO4·5H2O)和干冰属于化合物,铁矿石属于混合物D.通过化学反应,可由BaO一步转化生成Ba(OH)2
【练一练】
B
×
Na2CO3
碳酸钠是纯碱属于盐
NaOH
是烧碱火碱属于碱
4.按一定的特点或规律对物质进行分类,为化学学习与研究带来很大的方便。下列各组物质中,按“氧化物—酸—碱—盐”顺序排列的是( )A.CO HNO3 NaOH KNO3B.CO2 H2CO3 Na2CO3 Ca(HCO3)2C.H2SO4 HCl Mg(OH)2 MgCl2D.SO3 NaHCO3 NaOH Na2SO4
A
【练一练】
×
×
×
盐
盐
酸
5.中和反应在生活中有广泛应用。下列应用不属于中和反应的是(
)A.用盐酸除铁锈
B.服用含有氢氧化镁的药物治疗胃酸过多C.用熟石灰改良酸性土壤
D.用硫酸处理印染厂含碱废水
6.下面是某同学进行碱的化学性质实验时记录的实验现象,其中与事实不相符的是( A.在Ca(OH)2溶液中加入稀盐酸,无明显变化B.在NaOH溶液中通入CO2气体,有白色沉淀生成C.在Ca(OH)2溶液中加入几滴石蕊溶液,溶液呈蓝色D.在NaOH溶液中加入CuSO4溶液,有蓝色沉淀生成
A
【练一练】
B
7.氢氧化钾是我国古代纺织业常用于漂洗的洗涤剂。古代制取氢氧化钾的流程如下:
上述流程中没有涉及的化学反应类型是( )
A.化合反应
B.分解反应
C.置换反应
D.复分解反应
已知:CaCO3=====CaO+CO2↑
CaO+H2O===Ca(OH)2
Ca(OH)2+K2CO3===CaCO3↓+2KOH
高温
C
【练一练】
02
物质的转化(重点)
物质的转化
钙转化为硫酸钙的流程:
金属单质
氧气
碱性氧化物
水
碱
酸或酸性氧化物
盐
2Ca+O2=
2CaO
CaO+H2O=Ca(OH)2
Ca(OH)2+H2SO4=CaSO4+
2H2O
重点:
/SO3
【练一练】根据上面的转化过程,写出金属单质Na到对应盐Na2SO4的转化过程。
金属单质
氧气
碱性氧化物
水
碱
盐
酸/酸性氧化物
O2
H2SO4
/SO3
H2O
2Na+O2=Na2O
Na2O+H2O=2NaOH
2NaOH+H2SO4=Na2SO4+
2H2O
物质的转化
碳转化为碳酸钠的流程:
CO2+
H2O
=H2CO3
C
+
O2
=
CO2
H2CO3+
Ca(OH)2=
CaCO3↓+
2H2O
非金属单质
氧气
酸性氧化物
水
酸
碱或碱性氧化物
盐
/Na2O
能实现下列物质间直接转化的元素是( )
A.Fe
B.Cu
C.Si
D.C
【练一练】
D
单质
氧气
氧化物
水
酸或碱
盐
NaOH或HCl
×
×
×
Fe与O2反应生成Fe3O4,但Fe3O4不能与水反应,故A错误,
金属氧化物中只有氧化钙,氧化钡,氧化钠,氧化钾与水反应(重点)
Cu与O2反应生成CuO,但CuO不能与水反应,故B错误
Si与O2反应生成SiO2,但SiO2不能与水反应,故C错误
【练一练】
写出下列的转化过程(写出化学方程式):
1.铁转化为四氧化三铁:
2.钡转化为氧化钡:
4.氢氧化钡转化为硫酸钡(两种方法):
3.氧化钡转化为氢氧化钡:
5.二氧化碳转化为碳酸钙:
6.氢氧化钙转化为氯化钙:
2.以下表示的是碳及其化合物的转化关系,其中涉及的基本反应类型依次是(
)
A.化合、置换、分解、复分解
B.置换、复分解、化合、分解
C.置换、化合、分解、复分解
D.置换、化合、复分解、分解
D
【练一练】
3、A是一种化合物,B、D、E是三种常见气体,其中D、E具有还原性。物质A~F有如下图所示的转化关系:
(1)若A是由两种元素组成的气体,两种元素的质量比为3∶1,则A的化学式为__________;若A由三种元素组成,可用来作内燃机燃料,也可被氧化为醋酸,则A的化学式为__________
。
(2)根据上述转化关系,按要求写化学方程式(每种类型的反应只要求写1条)
①化合反应:__________;②置换反应:__________。
(3)实验室中,检验物质B的试剂是__________;工业上,D和固体乙反应的用途是______
___
。
C2H5OH(或C2H6O)
CH4
澄清的石灰水
金属的冶炼(或炼铁等)
CuO+H2===
Cu+H2O
CO2+C
===2CO
高温
【练一练】
1、酸的通性
2、碱的通性
3、盐的通性
4、金属单质到盐的转化
5、非金属单质到盐的转化
课堂小结
第一章
物质及其变化
1.1物质的分类
Welcome
to
chemistry
重点:酸碱盐的性质
物质的转化
1
酸碱盐的性质※※
2
物质的转化
※※※
CONTENTS
本节要点
01
酸碱盐的性质
酸碱盐
二、物质的转化
1.酸碱盐的性质
创原家独
酸的通性
列举实例(写出反应方程式)
反应类型
指示剂
使紫色石蕊试液变红色,无色酚酞试液不变色
活泼金属
Fe
+
H2SO4
=FeSO4
+
H2↑
置换反应
碱性氧化物
Fe2O3
+
3H2SO4
=Fe2(SO4)3
+3H2O
复分解反应
碱
Cu(OH)2
+H2SO4
=CuSO4
+2H2O
复分解反应
某些盐
BaCl2
+H2SO4
=BaSO4
↓+2HCl
复分解反应
(1)酸的通性
(2)碱的通性
碱的通性
列举实例(写出反应方程式)
反应类型
指示剂
使紫色石蕊试液变蓝色,无色酚酞试液变红色
酸
NaOH+HCl=NaCl+H2O
复分解反应
酸性氧化物
CO2+2NaOH
=Na2CO3+H2O
复分解反应
某些盐
2NaOH+CuSO4
=Cu(OH)2
↓+Na2SO4
复分解反应
网
(3)盐的主要化学性质
盐的主要化学性质
列举实例(写出反应方程式)
反应类型
金属
Fe
+CuSO4
=Cu+FeSO4
置换反应
酸
CaCO3+2HCl=CaCl2+H2O+CO2↑
复分解反应
碱
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
复分解反应
盐
NaCl+AgNO3=AgCl↓+NaNO3
复分解反应
为什么酸、碱或者盐具有相似的化学性质呢?
具有相似的化学组成
结构决定性质
HCl
H2SO4
HNO3
H+
NaOH
KOH
Ba(OH)2
OH-
Na2CO3
K2CO3
(NH4)2CO3
CO32-
学
学
学
四种基本反应类型
反应类型
实例(化学方程式)
化合反应
CaO+H2O=Ca(OH)2
分解反应
2KClO3
2KCl+3O2↑
置换反应
Zn+H2SO4=ZnSO4+H2↑
复分解反应
2HCl+CaCO3=CaCl2+H2O+CO2↑
MnO2
巧记口诀:
多变一
单换单
一变多
沉淀气体水
1.下列物质的分类正确的是( )
碱
酸
盐
碱性氧化物
酸性氧化物
A
KOH
HNO3
CaCO3
CaO
SO2
B
NaOH
HCl
NaHSO4
Na2O
CO
C
Cu2(OH)2CO3
CH3COOH
CaF2
CO
SO2
D
Na2CO3
H2SO4
NaOH
SO2
CO2
【练一练】
A
×
×
×
实验室中的药品常按物质的性质、类别等不同而有规律地放置。在做“酸的性质”实验时,实验桌上部分药品的摆放如图所示。某同学取用KOH溶液后应把试剂瓶放回的位置是( )
2.NaHSO4在水溶液中能够电离出Na+、H+和SO42-。下列对于NaHSO4的分类中不正确的是( )A.NaHSO4是盐
B.NaHSO4是酸
C.NaHSO4是钠盐
D.NaHSO4是酸式盐
【练一练】
B
D
×
×
×
酸
指示剂
盐
碱
3.叙述中,不正确的是( )
A.CaCO3、Ca(HCO3)2、Cu2(OH)2CO3都属于碳酸盐
B.盐酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
C.蓝矾(CuSO4·5H2O)和干冰属于化合物,铁矿石属于混合物D.通过化学反应,可由BaO一步转化生成Ba(OH)2
【练一练】
B
×
Na2CO3
碳酸钠是纯碱属于盐
NaOH
是烧碱火碱属于碱
4.按一定的特点或规律对物质进行分类,为化学学习与研究带来很大的方便。下列各组物质中,按“氧化物—酸—碱—盐”顺序排列的是( )A.CO HNO3 NaOH KNO3B.CO2 H2CO3 Na2CO3 Ca(HCO3)2C.H2SO4 HCl Mg(OH)2 MgCl2D.SO3 NaHCO3 NaOH Na2SO4
A
【练一练】
×
×
×
盐
盐
酸
5.中和反应在生活中有广泛应用。下列应用不属于中和反应的是(
)A.用盐酸除铁锈
B.服用含有氢氧化镁的药物治疗胃酸过多C.用熟石灰改良酸性土壤
D.用硫酸处理印染厂含碱废水
6.下面是某同学进行碱的化学性质实验时记录的实验现象,其中与事实不相符的是( A.在Ca(OH)2溶液中加入稀盐酸,无明显变化B.在NaOH溶液中通入CO2气体,有白色沉淀生成C.在Ca(OH)2溶液中加入几滴石蕊溶液,溶液呈蓝色D.在NaOH溶液中加入CuSO4溶液,有蓝色沉淀生成
A
【练一练】
B
7.氢氧化钾是我国古代纺织业常用于漂洗的洗涤剂。古代制取氢氧化钾的流程如下:
上述流程中没有涉及的化学反应类型是( )
A.化合反应
B.分解反应
C.置换反应
D.复分解反应
已知:CaCO3=====CaO+CO2↑
CaO+H2O===Ca(OH)2
Ca(OH)2+K2CO3===CaCO3↓+2KOH
高温
C
【练一练】
02
物质的转化(重点)
物质的转化
钙转化为硫酸钙的流程:
金属单质
氧气
碱性氧化物
水
碱
酸或酸性氧化物
盐
2Ca+O2=
2CaO
CaO+H2O=Ca(OH)2
Ca(OH)2+H2SO4=CaSO4+
2H2O
重点:
/SO3
【练一练】根据上面的转化过程,写出金属单质Na到对应盐Na2SO4的转化过程。
金属单质
氧气
碱性氧化物
水
碱
盐
酸/酸性氧化物
O2
H2SO4
/SO3
H2O
2Na+O2=Na2O
Na2O+H2O=2NaOH
2NaOH+H2SO4=Na2SO4+
2H2O
物质的转化
碳转化为碳酸钠的流程:
CO2+
H2O
=H2CO3
C
+
O2
=
CO2
H2CO3+
Ca(OH)2=
CaCO3↓+
2H2O
非金属单质
氧气
酸性氧化物
水
酸
碱或碱性氧化物
盐
/Na2O
能实现下列物质间直接转化的元素是( )
A.Fe
B.Cu
C.Si
D.C
【练一练】
D
单质
氧气
氧化物
水
酸或碱
盐
NaOH或HCl
×
×
×
Fe与O2反应生成Fe3O4,但Fe3O4不能与水反应,故A错误,
金属氧化物中只有氧化钙,氧化钡,氧化钠,氧化钾与水反应(重点)
Cu与O2反应生成CuO,但CuO不能与水反应,故B错误
Si与O2反应生成SiO2,但SiO2不能与水反应,故C错误
【练一练】
写出下列的转化过程(写出化学方程式):
1.铁转化为四氧化三铁:
2.钡转化为氧化钡:
4.氢氧化钡转化为硫酸钡(两种方法):
3.氧化钡转化为氢氧化钡:
5.二氧化碳转化为碳酸钙:
6.氢氧化钙转化为氯化钙:
2.以下表示的是碳及其化合物的转化关系,其中涉及的基本反应类型依次是(
)
A.化合、置换、分解、复分解
B.置换、复分解、化合、分解
C.置换、化合、分解、复分解
D.置换、化合、复分解、分解
D
【练一练】
3、A是一种化合物,B、D、E是三种常见气体,其中D、E具有还原性。物质A~F有如下图所示的转化关系:
(1)若A是由两种元素组成的气体,两种元素的质量比为3∶1,则A的化学式为__________;若A由三种元素组成,可用来作内燃机燃料,也可被氧化为醋酸,则A的化学式为__________
。
(2)根据上述转化关系,按要求写化学方程式(每种类型的反应只要求写1条)
①化合反应:__________;②置换反应:__________。
(3)实验室中,检验物质B的试剂是__________;工业上,D和固体乙反应的用途是______
___
。
C2H5OH(或C2H6O)
CH4
澄清的石灰水
金属的冶炼(或炼铁等)
CuO+H2===
Cu+H2O
CO2+C
===2CO
高温
【练一练】
1、酸的通性
2、碱的通性
3、盐的通性
4、金属单质到盐的转化
5、非金属单质到盐的转化
课堂小结
