2021-2022学年高一上学期化学人教版(2019)必修第一册第一章 第2节 第1课时 电解质的电离 课件(33张ppt)
文档属性
| 名称 | 2021-2022学年高一上学期化学人教版(2019)必修第一册第一章 第2节 第1课时 电解质的电离 课件(33张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-03 17:48:35 | ||
图片预览









文档简介
(共33张PPT)
第一章
物质及其变化
1.2离子反应
Welcome
to
chemistry
重点:电解质的电离
1
电解质※※
3
从电离的角度认识酸碱盐
※
CONTENTS
本节要点
2
电离方程式
※※※
01
电解质
石墨、Cu能导电,是因为含有能自由移动的电子而能够导电。那么,NaCl的水溶液、熔融的硝酸钾等能导电吗?为什么?
创设情境
生活常识告诉我们,给电器设备通电时,湿手操作容易发生触电事故,这是为什么?
实验探究
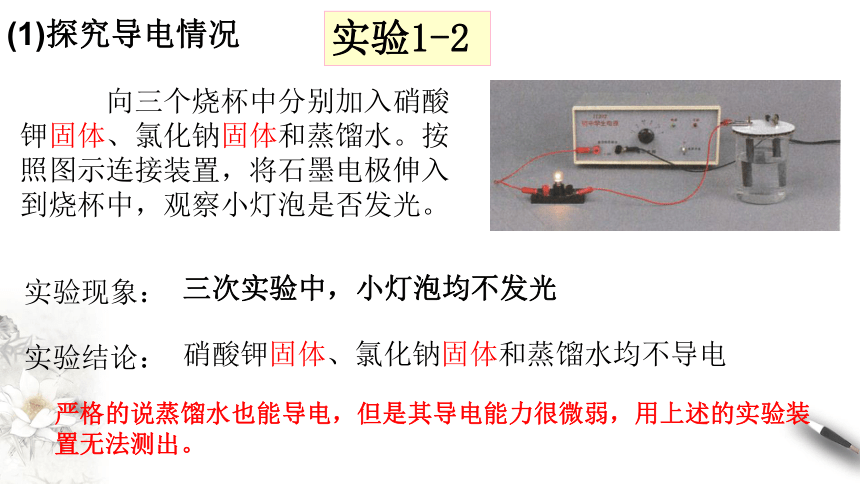
实验1-2
向三个烧杯中分别加入硝酸钾固体、氯化钠固体和蒸馏水。按照图示连接装置,将石墨电极伸入到烧杯中,观察小灯泡是否发光。
实验现象:
三次实验中,小灯泡均不发光
实验结论:
硝酸钾固体、氯化钠固体和蒸馏水均不导电
严格的说蒸馏水也能导电,但是其导电能力很微弱,用上述的实验装置无法测出。
(1)探究导电情况
实验1-2
将少量硝酸钾固体和氯化钠固体加入盛有水的烧杯中,搅拌使其完全溶解转化为相应的溶液(也就是硝酸钾溶液、氯化钠溶液),重复上述的导电性实验,观察小灯泡是否发光。
实验现象:
两次实验中,小灯泡均发光。
实验结论:
硝酸钾溶液和氯化钠溶液和蒸馏水均导电。
实验装置
存在状态
NaCl
KNO3
蒸馏水
纯净物
______
______
______
溶解于水
_____
_____
-
熔融状态
_____
_____
-
物质
混合物
纯净物
化合物
单质
电解质:
非电解质:
非金属氧化物和乙醇、甲烷、蔗糖等大部分有机物。
既不是电解质
,也不是非电解质。
对电解质的理解
酸、碱、盐、水、
活泼金属氧化物。
网
Na2O,
CaO,
K2O,
BaO,
MgO,
Al2O3
在熔融下能导电
CO2,
SO2,
SO3
【思考与讨论】
(1)铁丝、石墨、铜、银能导电,所以他们属于电解质。(
)
答案:(1)因为电解质和非电解质都是化合物,而铁丝、石墨、铜、银是单质,盐酸、氯化钠溶液、硝酸钾溶液是混合物,故他们既不是电解质,也不是非电解质。
盐酸、氯化钠溶液、硝酸钾溶液能导电,他们属于电解质。(
)
×
×
(2)氯化钠晶体不导电,不是电解质。
(
)
(3)HCl在熔融状态下不导电,不是电解质。
(
)
×
×
答案:电解质导电条件:“溶于水”或“熔融时”,两个条件只需具备其一即可。氯化钠、HCl
溶于水后能导电,所以他们是电解质。
(4)NaCl水溶液只有在通电条件下才会电离。
(
)
×
(5)SO2
、CO2
NH3
属于化合物,溶于水可以导电,属于电解质。
(
)
×
答案:电解质是指在水溶液中或熔融状态下能自身电离而导电的化合物。SO2、
CO2、
NH3
溶于水导电是因为生成H2SO3
、
H2CO3
NH3
.H2O
,电离产生自由移动的离子而导电,应该理解为H2SO3
H2CO3
、
NH3
.H2O
是电解质,SO2、
CO2
、
NH3
属于非电解质。
(1)电解质首先必须是化合物,单质和混合物既不是电解质也不是非电解质;
(2)酸、碱、大多数盐、活泼金属的氧化物(Na2O
、Al2O3)都是电解质;除电解质外的化合物都是非电解质,如大多数有机物和非金属氧化物等。;
(3)某些非电解质溶于水时与水反应生成电解质从而使溶液导电,但是该化合物依然是非电解质(例如:CO2)
1.下列属于电解质的是
( )
A.镁
B.酒精
C.硫酸铜
D.食盐水
【练一练】
解析:镁为金属单质,不是电解质;酒精为混合物,不属于电解质;硫酸铜为盐类,是电解质;食盐水为混合物,不是电解质。
C
2.下列关于电解质的叙述中错误的是
( )A.在水溶液里或熔融状态下能够导电的化合物叫电解质B.电解质是对化合物而言,单质不属于此范畴C.电解质在水中一定能导电,在水中导电的化合物一定是电解质D.纯水的导电性很差,但水也是电解质
【练一练】
解析:在水溶液里或熔融状态下能导电的化合物叫电解质,A、B正确;电解质导电是有条件的,电解质在水中不一定能导电,如硫酸钡,在水中导电的化合物也不一定是电解质,如二氧化碳,C错误;水是电解质,D正确。
C
3.下列说法中,正确的是( )
A.液态HCl、固态NaCl均不导电,所以HCl、NaCl均不是电解质
B.NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质
C.蔗糖、酒精在水溶液里或熔融状态时均不导电,所以它们是非电解质
D.铜、石墨均导电,所以它们是电解质
C
进行电解质判断时应该注意什么呢?
【练一练】
5.下列物质中:①氢氧化钠固体,②铜,③氢氧化钠溶液,④稀硫酸,⑤熔融的碳酸钾,⑥硫酸钡,⑦蔗糖溶液,⑧二氧化碳,⑨氯化氢气体,⑩乙醇。
属于电解质的是
。
属于非电解质的是
。
能导电的是
。
①⑤⑥⑨
√
√
√
√
⑧⑩
导电物质:金属,石墨,电解质溶液,熔融的电解质
学
【练一练】
②③④⑤
02
电解质的电离
电解质的电离
2、电离:
实际上氯化钠固体就是由钠离子和氯离子在空间上堆积形成的,为什么在氯化钠固体中存在大量的离子,但是氯化钠固体依然不导电呢?
离子不能移动
如果离子能移动,氯化钠就不会是固体状态了
电解质在溶于水或受热熔化时,形成自由移动的离子的过程。
NaCl在水中的溶解和电离的示意图
物质导电条件:自由移动带电荷的粒子
电解质固体离子不能自由移动,所以不导电,而在水溶液中或熔融状态可以自由移动,故导电。
电解质的电离
3、电离方程式
如:NaCl
=
Na+
+
Cl-
注意:1、拆分要准确(原子团不可拆分,例如NO3-、SO42-、OH-、NH4+、CO32-等不能拆。)。
2、构成物质的原子或原子团的个数在书写成离子时为化学计量数。比如:
3、离子所带的电荷数应等于元素或原子团的化合价数。
4、原子个数守恒,电荷守恒。
Al2(SO4)3==2Al3++3SO42-
【练一练】6.请学生们按照上面的例子,尝试书写以下物质的电离方程式,并将结果进行交流讨论。
KNO3
HNO3
BaCl2
HCl
NaOH
H2SO4
KNO3
=
K+
+
NO3-
HNO3
=
H+
+
NO3
-
BaCl2
=
Ba2+
+
2Cl-
HCl
=
H+
+
Cl-
NaOH
=
Na+
+
OH-
H2SO4
=
2H+
+
SO42-
7.下列电离方程式中正确的是
( )A.Ba(OH)2===Ba2++2(OH-)B.FeCl3===Fe2++3Cl-C.H2SO4===H22++SO42-
D.CuSO4===Cu2++SO42-
【练一练】
解析:A项中氢氧根离子不应加括号;B项中铁为三价铁离子;C项中氢离子应写为2H+。
D
8.下列电离方程式正确的是( )
A.MgCl2==Mg2++Cl2-
B.NaHCO3==Na++H++CO32-
C.H2SO4==H
2++SO42-
D.Ba(OH)2==Ba2++2OH-
【练一练】
D
【提示】NaHCO3
的第一步电离应该电离出Na+和HCO3-
。
03
从电离的角度认识酸碱盐
1.写出下列酸的电离方程式:
HCl
、HNO3、H2SO4
H2SO4==2H+
+SO42-
HCl
==
H+
+Cl-
HNO3==
H+
+NO3-
▲酸:电离时生成的阳离子全部是H+的化合物。
酸、碱、盐的认识
练习:已知HClO4是一种酸,则其溶于水完全电离生成的离子是
和
。
H+
ClO4-
2.写出下列碱的电离方程式:
NaOH、KOH、Ba(OH)2
NaOH
==
Na+
+
OH-
▲碱:电离时生成的阴离子全部是OH-的化合物。
Ba(OH)2
==
Ba2+
+
2OH-
Ca(OH)2
==
Ca2+
+
2OH-
3.写出下列盐的电离方程式:
NaCl、KNO3、Fe2(SO4)3、NaHSO4
NaCl
==
Na+
+
Cl-
▲盐:电离时能生成金属离子和酸根离子的化合物。
KNO3
==
K+
+
NO3-
Fe2(SO4)3
==
2Fe3+
+
3SO42-
NaHSO4==Na+
+
H+
+
SO42-
包括铵根离子
1、电解质:在水溶液里或熔融状态下能导电的化合物。
2、电离:电解质在溶于水或受热熔化时,形成自由移动的离子的过程。
3、电离方程式:离子的拆分要正确,原子个数应该守恒。
4、酸碱盐的拆分:酸拆为氢离子和酸根离子;碱拆为阳离子和氢氧根离子;盐拆为金属阳离子(或铵根离子)和酸根离子。
课堂小结
1.下列物质中属于电解质的是(
)
A.铜
B.盐酸
C.稀硫酸
D.硝酸
2.下列说法正确的是(
)
A.电解质都是易溶于水的物质
B.氧化物都是电解质
C.氢化物都不是电解质
D.酸、碱、盐都是电解质
D
D
课堂训练
3.下列电离方程式正确的是(
)
A.Na2CO3==Na+
+
CO32-
B.Ca(NO3)2==Ca2+
+
NO32-
C.KAl(SO4)2==K+
+
Al3+
+
2SO42-
D.H2SO4==2H+
+
S6+
+
4O2-
C
4.根据电离方程式判断,下列物质中是酸的是(
)
A.KOH
==
K+
+
OH-
B.HI
==
I-
+
H+
C.NaHSO4
==
Na+
+
H+
+
SO42-
D.Ba(OH)Cl
==
Ba2+
+
OH-
+Cl-
B
5.判断正误(正确的打“√”号,错误的打“×”号)。
(1)在水溶液里和熔融状态下都能导电的化合物是电解质( )
(2)Fe、Cu能够导电,说明它们都是电解质( )
(3)电解质发生电离需要通电才能进行( )
(4)Na2SO4在水中的电离方程式为Na2SO4=2Na++SO42-(
)
(5)NaHSO4在水中发生电离产生H+,故NaHSO4属于酸
(
)
答案:(1)× (2)× (3)× (4)√ (5)×
第一章
物质及其变化
1.2离子反应
Welcome
to
chemistry
重点:电解质的电离
1
电解质※※
3
从电离的角度认识酸碱盐
※
CONTENTS
本节要点
2
电离方程式
※※※
01
电解质
石墨、Cu能导电,是因为含有能自由移动的电子而能够导电。那么,NaCl的水溶液、熔融的硝酸钾等能导电吗?为什么?
创设情境
生活常识告诉我们,给电器设备通电时,湿手操作容易发生触电事故,这是为什么?
实验探究
实验1-2
向三个烧杯中分别加入硝酸钾固体、氯化钠固体和蒸馏水。按照图示连接装置,将石墨电极伸入到烧杯中,观察小灯泡是否发光。
实验现象:
三次实验中,小灯泡均不发光
实验结论:
硝酸钾固体、氯化钠固体和蒸馏水均不导电
严格的说蒸馏水也能导电,但是其导电能力很微弱,用上述的实验装置无法测出。
(1)探究导电情况
实验1-2
将少量硝酸钾固体和氯化钠固体加入盛有水的烧杯中,搅拌使其完全溶解转化为相应的溶液(也就是硝酸钾溶液、氯化钠溶液),重复上述的导电性实验,观察小灯泡是否发光。
实验现象:
两次实验中,小灯泡均发光。
实验结论:
硝酸钾溶液和氯化钠溶液和蒸馏水均导电。
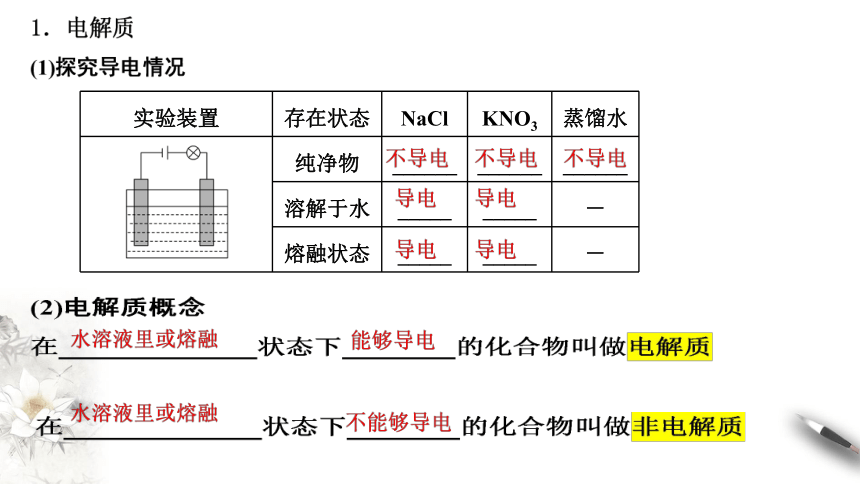
实验装置
存在状态
NaCl
KNO3
蒸馏水
纯净物
______
______
______
溶解于水
_____
_____
-
熔融状态
_____
_____
-
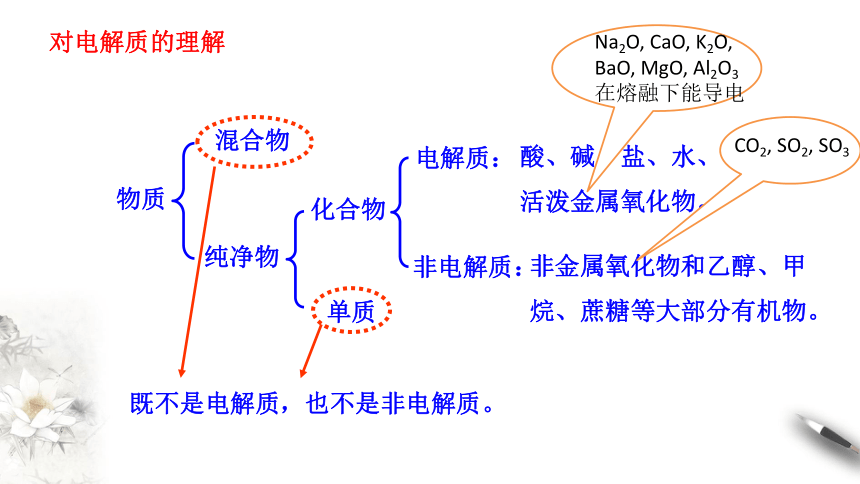
物质
混合物
纯净物
化合物
单质
电解质:
非电解质:
非金属氧化物和乙醇、甲烷、蔗糖等大部分有机物。
既不是电解质
,也不是非电解质。
对电解质的理解
酸、碱、盐、水、
活泼金属氧化物。
网
Na2O,
CaO,
K2O,
BaO,
MgO,
Al2O3
在熔融下能导电
CO2,
SO2,
SO3
【思考与讨论】
(1)铁丝、石墨、铜、银能导电,所以他们属于电解质。(
)
答案:(1)因为电解质和非电解质都是化合物,而铁丝、石墨、铜、银是单质,盐酸、氯化钠溶液、硝酸钾溶液是混合物,故他们既不是电解质,也不是非电解质。
盐酸、氯化钠溶液、硝酸钾溶液能导电,他们属于电解质。(
)
×
×
(2)氯化钠晶体不导电,不是电解质。
(
)
(3)HCl在熔融状态下不导电,不是电解质。
(
)
×
×
答案:电解质导电条件:“溶于水”或“熔融时”,两个条件只需具备其一即可。氯化钠、HCl
溶于水后能导电,所以他们是电解质。
(4)NaCl水溶液只有在通电条件下才会电离。
(
)
×
(5)SO2
、CO2
NH3
属于化合物,溶于水可以导电,属于电解质。
(
)
×
答案:电解质是指在水溶液中或熔融状态下能自身电离而导电的化合物。SO2、
CO2、
NH3
溶于水导电是因为生成H2SO3
、
H2CO3
NH3
.H2O
,电离产生自由移动的离子而导电,应该理解为H2SO3
H2CO3
、
NH3
.H2O
是电解质,SO2、
CO2
、
NH3
属于非电解质。
(1)电解质首先必须是化合物,单质和混合物既不是电解质也不是非电解质;
(2)酸、碱、大多数盐、活泼金属的氧化物(Na2O
、Al2O3)都是电解质;除电解质外的化合物都是非电解质,如大多数有机物和非金属氧化物等。;
(3)某些非电解质溶于水时与水反应生成电解质从而使溶液导电,但是该化合物依然是非电解质(例如:CO2)
1.下列属于电解质的是
( )
A.镁
B.酒精
C.硫酸铜
D.食盐水
【练一练】
解析:镁为金属单质,不是电解质;酒精为混合物,不属于电解质;硫酸铜为盐类,是电解质;食盐水为混合物,不是电解质。
C
2.下列关于电解质的叙述中错误的是
( )A.在水溶液里或熔融状态下能够导电的化合物叫电解质B.电解质是对化合物而言,单质不属于此范畴C.电解质在水中一定能导电,在水中导电的化合物一定是电解质D.纯水的导电性很差,但水也是电解质
【练一练】
解析:在水溶液里或熔融状态下能导电的化合物叫电解质,A、B正确;电解质导电是有条件的,电解质在水中不一定能导电,如硫酸钡,在水中导电的化合物也不一定是电解质,如二氧化碳,C错误;水是电解质,D正确。
C
3.下列说法中,正确的是( )
A.液态HCl、固态NaCl均不导电,所以HCl、NaCl均不是电解质
B.NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质
C.蔗糖、酒精在水溶液里或熔融状态时均不导电,所以它们是非电解质
D.铜、石墨均导电,所以它们是电解质
C
进行电解质判断时应该注意什么呢?
【练一练】
5.下列物质中:①氢氧化钠固体,②铜,③氢氧化钠溶液,④稀硫酸,⑤熔融的碳酸钾,⑥硫酸钡,⑦蔗糖溶液,⑧二氧化碳,⑨氯化氢气体,⑩乙醇。
属于电解质的是
。
属于非电解质的是
。
能导电的是
。
①⑤⑥⑨
√
√
√
√
⑧⑩
导电物质:金属,石墨,电解质溶液,熔融的电解质
学
【练一练】
②③④⑤
02
电解质的电离
电解质的电离
2、电离:
实际上氯化钠固体就是由钠离子和氯离子在空间上堆积形成的,为什么在氯化钠固体中存在大量的离子,但是氯化钠固体依然不导电呢?
离子不能移动
如果离子能移动,氯化钠就不会是固体状态了
电解质在溶于水或受热熔化时,形成自由移动的离子的过程。
NaCl在水中的溶解和电离的示意图
物质导电条件:自由移动带电荷的粒子
电解质固体离子不能自由移动,所以不导电,而在水溶液中或熔融状态可以自由移动,故导电。
电解质的电离
3、电离方程式
如:NaCl
=
Na+
+
Cl-
注意:1、拆分要准确(原子团不可拆分,例如NO3-、SO42-、OH-、NH4+、CO32-等不能拆。)。
2、构成物质的原子或原子团的个数在书写成离子时为化学计量数。比如:
3、离子所带的电荷数应等于元素或原子团的化合价数。
4、原子个数守恒,电荷守恒。
Al2(SO4)3==2Al3++3SO42-
【练一练】6.请学生们按照上面的例子,尝试书写以下物质的电离方程式,并将结果进行交流讨论。
KNO3
HNO3
BaCl2
HCl
NaOH
H2SO4
KNO3
=
K+
+
NO3-
HNO3
=
H+
+
NO3
-
BaCl2
=
Ba2+
+
2Cl-
HCl
=
H+
+
Cl-
NaOH
=
Na+
+
OH-
H2SO4
=
2H+
+
SO42-
7.下列电离方程式中正确的是
( )A.Ba(OH)2===Ba2++2(OH-)B.FeCl3===Fe2++3Cl-C.H2SO4===H22++SO42-
D.CuSO4===Cu2++SO42-
【练一练】
解析:A项中氢氧根离子不应加括号;B项中铁为三价铁离子;C项中氢离子应写为2H+。
D
8.下列电离方程式正确的是( )
A.MgCl2==Mg2++Cl2-
B.NaHCO3==Na++H++CO32-
C.H2SO4==H
2++SO42-
D.Ba(OH)2==Ba2++2OH-
【练一练】
D
【提示】NaHCO3
的第一步电离应该电离出Na+和HCO3-
。
03
从电离的角度认识酸碱盐
1.写出下列酸的电离方程式:
HCl
、HNO3、H2SO4
H2SO4==2H+
+SO42-
HCl
==
H+
+Cl-
HNO3==
H+
+NO3-
▲酸:电离时生成的阳离子全部是H+的化合物。
酸、碱、盐的认识
练习:已知HClO4是一种酸,则其溶于水完全电离生成的离子是
和
。
H+
ClO4-
2.写出下列碱的电离方程式:
NaOH、KOH、Ba(OH)2
NaOH
==
Na+
+
OH-
▲碱:电离时生成的阴离子全部是OH-的化合物。
Ba(OH)2
==
Ba2+
+
2OH-
Ca(OH)2
==
Ca2+
+
2OH-
3.写出下列盐的电离方程式:
NaCl、KNO3、Fe2(SO4)3、NaHSO4
NaCl
==
Na+
+
Cl-
▲盐:电离时能生成金属离子和酸根离子的化合物。
KNO3
==
K+
+
NO3-
Fe2(SO4)3
==
2Fe3+
+
3SO42-
NaHSO4==Na+
+
H+
+
SO42-
包括铵根离子
1、电解质:在水溶液里或熔融状态下能导电的化合物。
2、电离:电解质在溶于水或受热熔化时,形成自由移动的离子的过程。
3、电离方程式:离子的拆分要正确,原子个数应该守恒。
4、酸碱盐的拆分:酸拆为氢离子和酸根离子;碱拆为阳离子和氢氧根离子;盐拆为金属阳离子(或铵根离子)和酸根离子。
课堂小结
1.下列物质中属于电解质的是(
)
A.铜
B.盐酸
C.稀硫酸
D.硝酸
2.下列说法正确的是(
)
A.电解质都是易溶于水的物质
B.氧化物都是电解质
C.氢化物都不是电解质
D.酸、碱、盐都是电解质
D
D
课堂训练
3.下列电离方程式正确的是(
)
A.Na2CO3==Na+
+
CO32-
B.Ca(NO3)2==Ca2+
+
NO32-
C.KAl(SO4)2==K+
+
Al3+
+
2SO42-
D.H2SO4==2H+
+
S6+
+
4O2-
C
4.根据电离方程式判断,下列物质中是酸的是(
)
A.KOH
==
K+
+
OH-
B.HI
==
I-
+
H+
C.NaHSO4
==
Na+
+
H+
+
SO42-
D.Ba(OH)Cl
==
Ba2+
+
OH-
+Cl-
B
5.判断正误(正确的打“√”号,错误的打“×”号)。
(1)在水溶液里和熔融状态下都能导电的化合物是电解质( )
(2)Fe、Cu能够导电,说明它们都是电解质( )
(3)电解质发生电离需要通电才能进行( )
(4)Na2SO4在水中的电离方程式为Na2SO4=2Na++SO42-(
)
(5)NaHSO4在水中发生电离产生H+,故NaHSO4属于酸
(
)
答案:(1)× (2)× (3)× (4)√ (5)×
