2021-2022学年高中化学苏教版(2019)选择性必修2专题1揭示物质结构的奥秘专题练(含解析)
文档属性
| 名称 | 2021-2022学年高中化学苏教版(2019)选择性必修2专题1揭示物质结构的奥秘专题练(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 347.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-04 07:09:22 | ||
图片预览




文档简介
专题1揭示物质结构的奥秘章节专题练——2021-2022学年高中化学苏教版(2019)选择性必修2
一、单选题(共17题)
1.和两种粒子中,①核内质子数
②核外电子数
③核内中子数
④核外电子层数,其中相同的是(
)
A.①③
B.①④
C.②③
D.②③④
2.下列有关和的说法正确的是(
)
A.和是中子数不同质子数相同的同种核素
B.的质子数等于中子数
C.5.2g中所含的电子数约为
D.和的质子数和核外电子数均不同,中子数相同
3.下列说法正确的是(
)
A.18O2与16O2互为同位素
B.18O与16O是同一种核素
C.原子核都是由质子和中子构成的
D.Na2O中阳离子和阴离子的个数比为2:1
4.下列说法正确的是(
)
A.单质硫有S2、S4、S6等,它们都是硫的同素异形体
B.石墨导电、金刚石不导电,故二者不是同素异形体
C.有的复分解反应属于氧化还原反应
D.红磷转化为白磷,属于物理变化
5.最近,科学家开发出一种低成本光伏材料一蜂窝状石墨烯。生产原理是:Na2O+
2CO
Na2CO3
+C(石墨烯),然后除去Na2CO3
,即可制得蜂窝状石墨烯。下列说法不正确的是(
)
A.石墨烯与金刚石互为同素异形体
B.该生产石墨烯的反应中CO只作还原剂
C.Na2O属于碱性氧化物,Na2CO3属于盐
D.自然界中钠元素只有化合态
6.下列说法正确的是(
)
A.和互为同位素
B.正丁烷和异丁烷互为同分异构体
C.和是具有相同质子数的不同核素
D.和是同分异构体
7.重水()是重要的核工业原料,下列说法错误的是(
)
A.氘(D)原子核外有1个电子
B.与D互为同位素
C.与互为同素异形体
D.与的相对分子质量相同
8.硒是人体必需的一种微量元素。下列关于说法正确的是(
)
A.核电荷数为45
B.核外电子数为34
C.质量数为113
D.中子数为79
9.核内中子数为N的R2+离子,质量数为A,则ng它的氧化物所含电子物质的量为(
)
A.(A-N+8)mol
B.(A-N+10)mol
C.(A-N+2)mol
D.(A-N+6)mol
10.日本福岛核电站泄漏的核燃料衰变产物有放射性元素、等,其中可以用来治疗甲状腺癌,但是如果没有癌症,它也可能诱发甲状腺癌。下列有关说法中不正确的是(
)
A.131I的原子核所含中子数是78
B.核能的利用证实了原子的可分性
C.127I和放射性131I互为同位素
D.127I和131I的质子数不同
11.下列说法正确的是(
)
A.互为同素异形体的物质必然具有相同的性质
B.碳酸钠固体中不存在阴、阳离子
C.氢化锂“三兄弟”——、、三种物质的质子数之比为
D.同素异形体之间的相互转化一定是化学变化
12.下列各组物质互为同分异构体的是(
)
A.和
B.、、
C.和
D.和
13.中国科学院近代物理研究所人员成功合成了新核素,主要用于宇航飞行器的热源。可由转化而成,下列有关、的说法中正确的是(
)
A.核外电子数分别为116、118
B.、化学性质相同
C.、在周期表中的位置不同
D.物质的量相等的、质量相同
14.下列化学用语表示正确的是(
)
A.H2的摩尔质量是2g
B.氯原子的原子结构示意图:
C.质子数为6,中子数为8的微粒:C
D.NaHSO4在水中的电离方程式:NaHSO4=Na++H++SO
15.下列有关化学用语正确的是(
)
A.N2的结构式:
B.质子数为53,中子数为78的碘原子:I
C.Cl-的结构示意图:
D.NH4Cl的电子式:
16.2020
年12月17日1时59分,嫦娥五号返回器携带“月球土特产”在内蒙古四子王旗预定区域安全着陆,探月工程嫦娥五号任务取得圆满成功。经探测,月壤中含有大量3He
,这是一种未来可能进行热核聚变发电的清洁能源,而地球上主要是
4He。下列有关说法中正确的是(
)
A.1
个
3
He
原子中有
3
个中子
B.3
He
与
4
He
互为同位素
C.3
He
与
4
He
互为同素异形体
D.3
He
与
4
He
的性质完全相同
17.呼吸法在医学上常用于幽门螺旋杆菌的诊新,可用来测定文物年代,下列有关和的说法不正确的是(
)
A.和原子中均含有6个质子
B.的原子结构示意图:
C.和互为同位素
D.和原子的核外电子排布相同
二、综合题(共3题)
18.按要求回答下列问题。
(1)甲烷的电子式为___________。
(2)相对分子质量为72的烷烃的分子式为___________,写出其所有同分异构体的结构简式___________
其中直链烷烃的习惯命名为___________
(3)下列物质中互为同分异构体的有___________,互为同素异形体的有___________,互为同位素的有___________,是同一种物质的有___________(填序号)。
①液氯
②氯气
③石墨
④金刚石
⑤35Cl
⑥37Cl
⑦CH3CH2CH2CH3
⑧(CH3)2CHCH3
⑨异丁烷
19.有A、B、C、D、E五种微粒:
I.A微粒不带电,其质量数为1;
II.B微粒呈电中性,得2个电子后,其电子层结构与Ne相同;
III.C微粒带有一个单位的正电荷,核电荷数为11;
IV.D微粒核内有14个中子,核外M层上有3个电子;
V.E微粒核外有18个电子,当失去一个电子时呈电中性。
(1)写出A微粒的符号_______,B微粒的结构示意图_______,C微粒的电子式_______,D微粒的质量数_______,E微粒的结构示意图_______;
(2)B、C、E所属三种元素可组成多种物质,请写出它们的化学式_______、_______。
20.乙二胺在电刷镀铜溶液中能起到稳定剂的作用。回答下列问题。
(1)基态Cu原子最高能级组电子数为___________个。
(2)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子,如图所示:
①配离子中含有的化学键类型有___________。
②C、N、O的第一电离能由大到小的顺序是___________。
③乙二胺分子中氮原子轨道的杂化类型为___________。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是___________。
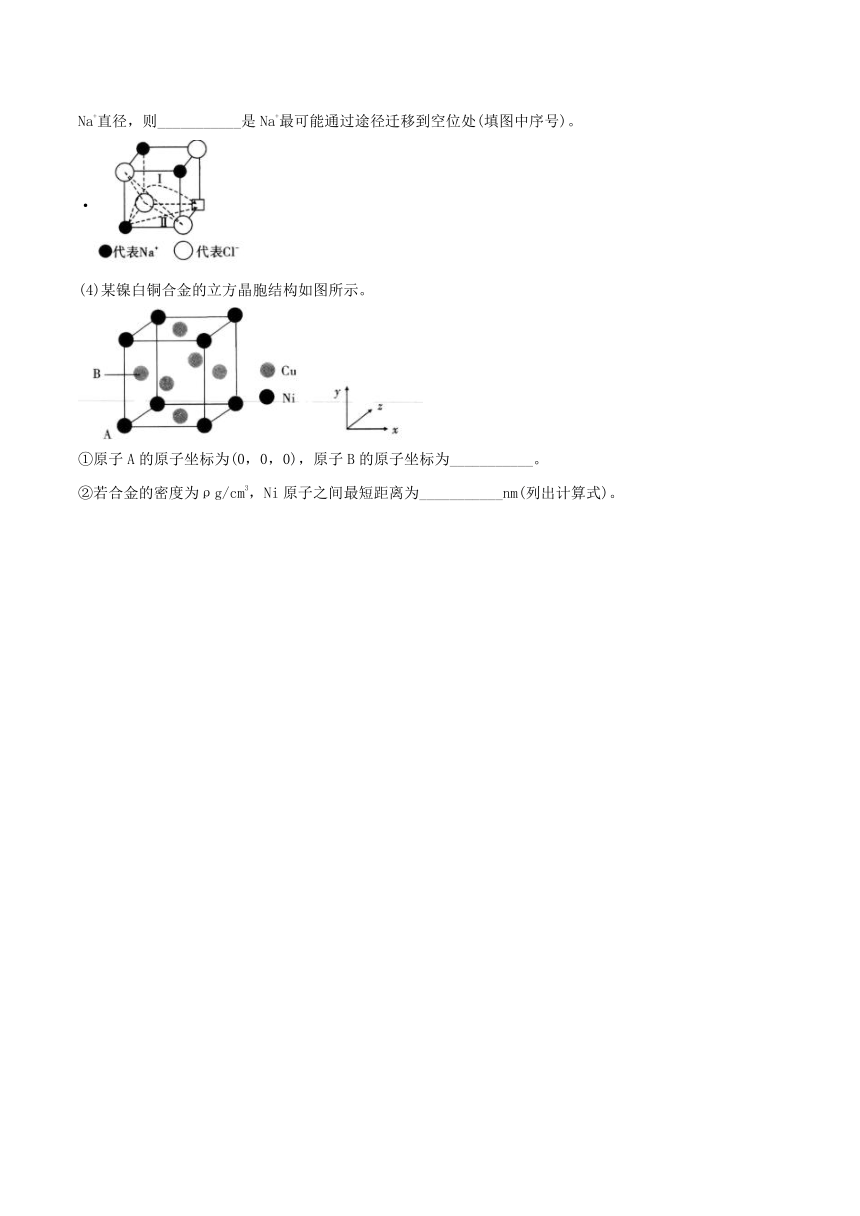
(3)温度升高时,NaCl晶体出现缺陷,如图所示(当图中方格内填入Na+时,恰好构成氯化钠晶胞的
,此时晶体的导电性大大增强,导电性增强的原因___________;在氯化钠晶体中两个相邻Cl-之间的间隙小于Na+直径,则___________是Na+最可能通过途径迁移到空位处(填图中序号)。
·
(4)某镍白铜合金的立方晶胞结构如图所示。
①原子A的原子坐标为(0,0,0),原子B的原子坐标为___________。
②若合金的密度为ρg/cm3,Ni原子之间最短距离为___________nm(列出计算式)。
参考答案
1.B
【详解】
和两种粒子中,①核内质子数均为17,相同;②核外电子数均为17,相同;③核内中子数分别为35-17=18和37-17=20,不相同;
④核外电子层数均为3层,相同。
综上所述,①④符合题意,故选B。
【点睛】
同位素质子数相同,中子数不同。质量数等于质子数和中子数之和。
2.C
【详解】
A.和的中子数不同,质子数相同,互为同位素,是铍元素的不同核素,故A错误;
B.铍元素的质子数为4,的中子数,其质子数不等于中子数,故B错误;
C.的物质的量约是0.2mol,每个铝离子含有10个电子,故中所含的电子数约为,故C正确;
D.和的质子数分别为13、12,核外电子数分别为13、12,中子数分别为13、14,中子数不同,故D错误;
故选C。
3.D
【详解】
A.同位素是质子数相同中子数不同的同一元素的不同原子,对象是原子,18O2与16O2是单质,故A错误;
B.18O与16O是质子数相同中子数不同的两种原子,为不同的核素,故B错误;
C.原子核是由质子和中子构成的,但不一定含有中子,如1H不含有中子,故C错误;
D.Na2O由钠离子和氧离子构成,即阳离子和阴离子的个数比为2:1,故D正确。
故选D。
4.A
【详解】
A.S2、S4、S6为S元素形成的不同单质,属于同素异形体,故A正确;
B.石墨和金刚石为C元素形成的不同单质,属于同素异形体,故B错误;
C.复分解反应中各元素均没有化合价的变化,不属于氧化还原反应,故C错误;
D.红磷和白磷属于不同种物质,二者的转化为化学变化,故D错误;
综上所述答案为A。
5.B
【详解】
A.
同种元素的不同单质互为同素异形体,石墨烯与金刚石都是碳单质,互为同素异形体,故A不选;
B.
反应中存在化合价的变化的反应属于氧化还原反应,反应中C元素的化合价降低,CO只作氧化剂,故B选;
C.
Na2O与酸反应只生成盐和水,属于碱性氧化物,
Na2CO3属于盐,故C不选;
D.
钠是活泼金属在自然界中不存在单质,自然界中钠元素以化合态形式存在,故D不选;
故选:B。
6.B
【详解】
A.同位素的研究对象为原子,而和为单质,互为同素异形体,A项错误;
B.正丁烷和异丁烷分子式相同,结构不同,二者互为同分异构体,B项正确;
C.核素的研究对象是原子,和均为单质,C项错误;
D.的分子式为,而的分子式为,分子式不同,两者不是同分异构体,D项错误。
答案选B。
7.C
【详解】
A.,氘(D)原子的质子数是1,所以原子核外有1个电子,故A正确;
B.与D的质子数相同,中子数不同,二者互为同位素,故B正确;
C.由同一种元素形成的性质不同的单质互为同素异形体,水是化合物,故C错误;
D.与的相对分子质量都是20,故D正确。
故答案选:C。
8.B
【详解】
A.表示质子数为34,核电荷数=质子数=34,故A错误;
B.表示质子数为34,核外电子数=质子数=34,故B正确;
C.表示质量数为79,故C错误;
D.表示质量数为79,质子数为34,中子数=质量数-质子数=79-34=45,故D错误;
故选B。
9.A
【详解】
核内中子数为N的R2+离子,质量数为A,质子数为A-N,该离子的相对原子质量在数值上等于其质量数;该离子带2个单位正电荷,所以其氧化物的化学式为RO;该氧化物的摩尔质量为(A+16)g/mol,n
g它的氧化物的物质的量为mol。一个氧化物分子中含有(A-N+8)个质子,质子数和电子数相等,所以ng它的氧化物中所含电子的物质的量为:(A-N+8)mol,A项正确;
答案选A。
10.D
【详解】
A.碘为53号元素,131I的原子核所含中子数是131-52=78,故A正确;
B.原子在化学变化中不能再分,但在核反应中可以再分,所以核能的利用证实了原子的可分性,故B正确;
C.127I和放射性131I质子数相同,中子数不同,互为同位素,故C正确;
D.127I和131I都是碘元素,质子数都是53,故D错误;
故选D。
11.D
【详解】
A.同素异形体的物理性质不同,化学性质相似,故A错误;
B.碳酸钠是由和形成的,存在阴、阳离子,故B错误;
C.H、D和T的质子数都为1,、、三种物质的质子数之比为1∶1∶1,故C错误;
D.同素异形体是不同的物质,所以同素异形体之间的相互转化一定是化学变化,故D正确;
故答案:D。
12.D
【详解】
A.O2和O3为氧元素形成的不同单质,互为同素异形体,A项不选;
B.、、为氢元素的三种不同核素,互为同位素,B项不选;
C.和结构相似,分子组成相差1个CH2,两者互为同系物,C项不选;
D.和分子式相同,结构不同,互为同分异构体,D项选;
答案选D。
13.B
【详解】
A.、质子数相同,核外电子数相同均为89,中子数不同分别为116、118,A错误;
B.、的核外电子排布相同,故二者的化学性质几乎相同,B正确;
C.、互为同位素,质子数相同,在元素周期表中的位置相同,C错误;
D.、的质量数不同,故相同物质的量的和的质量不同,D错误;
故选B。
14.D
【详解】
A.H2的摩尔质量是2g/mol,A错误;
B.氯原子的原子结构示意图为,B错误;
C.质子数为6,中子数为8的微粒表示为C,C错误;
D.NaHSO4在水中完全电离出钠离子和氢离子和硫酸根离子,NaHSO4在水中的电离方程式:NaHSO4=Na++H++SO,D正确;
答案选D。
15.C
【详解】
A.氮气分子中含有氮氮三键,正确的结构式为:,故A错误;
B.质子数为53,中子数为78的碘原子的质量数为:53+78=131,该碘原子可以表示为:,故B错误;
C.氯离子的核电荷数为17,核外电子总数为18,最外层达到8电子稳定结构,氯离子正确的结构示意图为:,故C正确;
D.氯化铵属于离子化合物,铵根离子和氯离子都需要标出所带电荷及原子的最外层电子,氯化铵正确的电子式为:,故D错误;
故选C。
【点睛】
本题考查了结构简式、电子式、离子结构示意图、元素符号等化学用语的判断,题目难度中等,注意掌握常见化学用语的概念及正确的表示方法,明确结构简式与结构式、原子结构示意图与离子结构示意图的区别。
16.B
【详解】
A.1个3He
原子中质量数为3,含有1个中子,A说法错误;
B.3He与4He含有的质子数相同,而中子数不同,互为同位素,B说法正确;
C.同素异形体为同种元素形成的不同单质,3He与4He互为同位素,C说法错误;
D.3He与4He的化学性质相同,物理性质不同,D说法错误;
答案为B。
17.B
【详解】
A.和原子都属于6号C元素,原子核中均含有6个质子,A正确;
B.的原子核外有6个电子,核外电子排布是2、4,故原子结构示意图为:,B错误;
C.和质子数相同,中子数不同,二者互为同位素,C正确;
D.和原子核外都有6个电子,核外电子排布是2、4,故它们的核外电子排布相同,D正确;
故合理选项是B。
18.
(1)
(2)
C5H12
CH3CH2CH2CH2CH3、CH3CH(CH3)
CH2CH3、C(CH3)4
正戊烷
(3)
⑦⑧
③④
⑤⑥
①②
【分析】
(1)
甲烷的分子式为CH4,碳原子和4
氢原子形成4条共价键,其电子式为,故答案:。
(2)
饱和烷烃的通式为CnH2n+2,所以相对分子质量为72的烷烃的分子式为C5H12,其所有同分异构体有三种:正戊烷CH3CH2CH2CH2CH3;异戊烷
(2-甲基丁烷):CH3CH(CH3)
CH2CH3;新戊烷(2,2-二甲基丙烷)
C(CH3)4,故答案:C5H12;CH3CH2CH2CH2CH3、CH3CH(CH3)
CH2CH3、C(CH3)4;正戊烷。
(3)
同分异构体是分子式相同,结构不同,所以⑦CH3CH2CH2CH3
⑧(CH3)2CHCH3互为同分异构体;同素异形体由同种元素组成的不同单质,所以③石墨
④金刚石互为同素异形体;同位素是质子数相同,中子数不同,所以⑤35Cl
⑥37Cl互为同位素;①液氯是氯气的液态,所以①液氯②氯气是同一种物质。故答案:⑦⑧;③④;⑤⑥;①②。
19.
(1)
H
Na+
27
(2)
NaClO
NaClO3
【分析】
A微粒不带电,其质量数为1,则A为H;B微粒呈电中性,得2个电子后,其电子层结构与Ne相同,则B为O;C微粒带有一个单位的正电荷,核电荷数为11,则C为Na;D微粒核内有14个中子,核外M层上有3个电子,则D为Al;E微粒核外有18个电子,当失去一个电子时呈电中性,则E为Cl。
(1)
A微粒的符号H,B微粒的结构示意图,C微粒的电子式Na+,D微粒的质量数27,E微粒的结构示意图。
(2)
B、C、E所属三种元素可组成多种物质,如NaClO、NaClO3。
20.11
配位键、共价键
N>O>C
sp3
乙二胺分子间可形成氢键
该晶体导电时,Na+在电场作用下迁移到空位上,形成电流
I
【详解】
(1)电子填充能级组如图所示,29号元素铜的电子排布式为,最高能级组为3d4s,所以基态Cu原子最高能级组电子数为11个,故答案为11;
(2)①该配离子中存在的共价键有碳氢键、氮氢键、碳碳单键、碳氮单键,此外四个氮原子给铜离子形成四条配位键,故答案为配位键、共价键;
②C、N、O位于同周期,第一电离能从左至右递增,位于第五主族的元素氮电子排布式为,2p能级为半充满稳定结构,所以氮的第一电离能高于同周期相邻元素,故第一电离能由大到小顺序为N>O>C,故答案为N>O>C;
③利用价层电子对互斥理论计算乙二胺分子中氮原子的价层电子对数,价层电子对数为4对,所以杂化方式为sp3杂化,故答案为sp3;
乙二胺和三甲胺[N(CH3)3]均属于胺,均为分子晶体,影响分子晶体的熔沸点因素为分子间氢键和范德华力,观察分析乙二胺的结构简式H2N-CH2-CH2-NH2可知,可形成乙二胺分子间氢键,观察分析三甲胺的结构简式N(CH3)3可知,三甲胺不能形成分子间氢键,分子间通过范德华力相互作用,由于形成分子间氢键后物质的熔沸点会提高,所以乙二胺比三甲胺的沸点高得多,故答案为乙二胺分子间可形成氢键;
(3))利用题干中信息当温度升高时,NaCl晶体出现缺陷,此时图中方块位置没有钠离子,当晶体导电时,Na+在电场作用下迁移到空位上,带电粒子定向移动,增强晶体导电性,所以晶体的导电性大大增强,故答案为该晶体导电时,Na+在电场作用下迁移到空位上,形成电流;
图中钠离子移动到空格处,有路径Ⅰ和Ⅱ两种方式,由于在氯化钠晶体中两个相邻Cl-之间的间隙小于Na+直径,所以路径Ⅱ对钠离子的移动起到空间位阻效应,路径Ⅱ不是Na+迁移到空位处的途径,故答案为Ⅰ;
(4)①如图原子A的原子坐标为(0,0,0),所以A为坐标系的原点,认为晶胞的边长相对长度为1,则B原子位于yoz象限的面心,所以B的原子坐标为,故答案为;
②均摊法计算该晶胞含有铜原子个数,镍原子个数,设Ni原子之间最短距离为anm,也就是晶胞的边长为anm,利用合金的密度为ρg/cm3列出下列等式:,解得a=nm,故答案为。
一、单选题(共17题)
1.和两种粒子中,①核内质子数
②核外电子数
③核内中子数
④核外电子层数,其中相同的是(
)
A.①③
B.①④
C.②③
D.②③④
2.下列有关和的说法正确的是(
)
A.和是中子数不同质子数相同的同种核素
B.的质子数等于中子数
C.5.2g中所含的电子数约为
D.和的质子数和核外电子数均不同,中子数相同
3.下列说法正确的是(
)
A.18O2与16O2互为同位素
B.18O与16O是同一种核素
C.原子核都是由质子和中子构成的
D.Na2O中阳离子和阴离子的个数比为2:1
4.下列说法正确的是(
)
A.单质硫有S2、S4、S6等,它们都是硫的同素异形体
B.石墨导电、金刚石不导电,故二者不是同素异形体
C.有的复分解反应属于氧化还原反应
D.红磷转化为白磷,属于物理变化
5.最近,科学家开发出一种低成本光伏材料一蜂窝状石墨烯。生产原理是:Na2O+
2CO
Na2CO3
+C(石墨烯),然后除去Na2CO3
,即可制得蜂窝状石墨烯。下列说法不正确的是(
)
A.石墨烯与金刚石互为同素异形体
B.该生产石墨烯的反应中CO只作还原剂
C.Na2O属于碱性氧化物,Na2CO3属于盐
D.自然界中钠元素只有化合态
6.下列说法正确的是(
)
A.和互为同位素
B.正丁烷和异丁烷互为同分异构体
C.和是具有相同质子数的不同核素
D.和是同分异构体
7.重水()是重要的核工业原料,下列说法错误的是(
)
A.氘(D)原子核外有1个电子
B.与D互为同位素
C.与互为同素异形体
D.与的相对分子质量相同
8.硒是人体必需的一种微量元素。下列关于说法正确的是(
)
A.核电荷数为45
B.核外电子数为34
C.质量数为113
D.中子数为79
9.核内中子数为N的R2+离子,质量数为A,则ng它的氧化物所含电子物质的量为(
)
A.(A-N+8)mol
B.(A-N+10)mol
C.(A-N+2)mol
D.(A-N+6)mol
10.日本福岛核电站泄漏的核燃料衰变产物有放射性元素、等,其中可以用来治疗甲状腺癌,但是如果没有癌症,它也可能诱发甲状腺癌。下列有关说法中不正确的是(
)
A.131I的原子核所含中子数是78
B.核能的利用证实了原子的可分性
C.127I和放射性131I互为同位素
D.127I和131I的质子数不同
11.下列说法正确的是(
)
A.互为同素异形体的物质必然具有相同的性质
B.碳酸钠固体中不存在阴、阳离子
C.氢化锂“三兄弟”——、、三种物质的质子数之比为
D.同素异形体之间的相互转化一定是化学变化
12.下列各组物质互为同分异构体的是(
)
A.和
B.、、
C.和
D.和
13.中国科学院近代物理研究所人员成功合成了新核素,主要用于宇航飞行器的热源。可由转化而成,下列有关、的说法中正确的是(
)
A.核外电子数分别为116、118
B.、化学性质相同
C.、在周期表中的位置不同
D.物质的量相等的、质量相同
14.下列化学用语表示正确的是(
)
A.H2的摩尔质量是2g
B.氯原子的原子结构示意图:
C.质子数为6,中子数为8的微粒:C
D.NaHSO4在水中的电离方程式:NaHSO4=Na++H++SO
15.下列有关化学用语正确的是(
)
A.N2的结构式:
B.质子数为53,中子数为78的碘原子:I
C.Cl-的结构示意图:
D.NH4Cl的电子式:
16.2020
年12月17日1时59分,嫦娥五号返回器携带“月球土特产”在内蒙古四子王旗预定区域安全着陆,探月工程嫦娥五号任务取得圆满成功。经探测,月壤中含有大量3He
,这是一种未来可能进行热核聚变发电的清洁能源,而地球上主要是
4He。下列有关说法中正确的是(
)
A.1
个
3
He
原子中有
3
个中子
B.3
He
与
4
He
互为同位素
C.3
He
与
4
He
互为同素异形体
D.3
He
与
4
He
的性质完全相同
17.呼吸法在医学上常用于幽门螺旋杆菌的诊新,可用来测定文物年代,下列有关和的说法不正确的是(
)
A.和原子中均含有6个质子
B.的原子结构示意图:
C.和互为同位素
D.和原子的核外电子排布相同
二、综合题(共3题)
18.按要求回答下列问题。
(1)甲烷的电子式为___________。
(2)相对分子质量为72的烷烃的分子式为___________,写出其所有同分异构体的结构简式___________
其中直链烷烃的习惯命名为___________
(3)下列物质中互为同分异构体的有___________,互为同素异形体的有___________,互为同位素的有___________,是同一种物质的有___________(填序号)。
①液氯
②氯气
③石墨
④金刚石
⑤35Cl
⑥37Cl
⑦CH3CH2CH2CH3
⑧(CH3)2CHCH3
⑨异丁烷
19.有A、B、C、D、E五种微粒:
I.A微粒不带电,其质量数为1;
II.B微粒呈电中性,得2个电子后,其电子层结构与Ne相同;
III.C微粒带有一个单位的正电荷,核电荷数为11;
IV.D微粒核内有14个中子,核外M层上有3个电子;
V.E微粒核外有18个电子,当失去一个电子时呈电中性。
(1)写出A微粒的符号_______,B微粒的结构示意图_______,C微粒的电子式_______,D微粒的质量数_______,E微粒的结构示意图_______;
(2)B、C、E所属三种元素可组成多种物质,请写出它们的化学式_______、_______。
20.乙二胺在电刷镀铜溶液中能起到稳定剂的作用。回答下列问题。
(1)基态Cu原子最高能级组电子数为___________个。
(2)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子,如图所示:
①配离子中含有的化学键类型有___________。
②C、N、O的第一电离能由大到小的顺序是___________。
③乙二胺分子中氮原子轨道的杂化类型为___________。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是___________。
(3)温度升高时,NaCl晶体出现缺陷,如图所示(当图中方格内填入Na+时,恰好构成氯化钠晶胞的
,此时晶体的导电性大大增强,导电性增强的原因___________;在氯化钠晶体中两个相邻Cl-之间的间隙小于Na+直径,则___________是Na+最可能通过途径迁移到空位处(填图中序号)。
·
(4)某镍白铜合金的立方晶胞结构如图所示。
①原子A的原子坐标为(0,0,0),原子B的原子坐标为___________。
②若合金的密度为ρg/cm3,Ni原子之间最短距离为___________nm(列出计算式)。
参考答案
1.B
【详解】
和两种粒子中,①核内质子数均为17,相同;②核外电子数均为17,相同;③核内中子数分别为35-17=18和37-17=20,不相同;
④核外电子层数均为3层,相同。
综上所述,①④符合题意,故选B。
【点睛】
同位素质子数相同,中子数不同。质量数等于质子数和中子数之和。
2.C
【详解】
A.和的中子数不同,质子数相同,互为同位素,是铍元素的不同核素,故A错误;
B.铍元素的质子数为4,的中子数,其质子数不等于中子数,故B错误;
C.的物质的量约是0.2mol,每个铝离子含有10个电子,故中所含的电子数约为,故C正确;
D.和的质子数分别为13、12,核外电子数分别为13、12,中子数分别为13、14,中子数不同,故D错误;
故选C。
3.D
【详解】
A.同位素是质子数相同中子数不同的同一元素的不同原子,对象是原子,18O2与16O2是单质,故A错误;
B.18O与16O是质子数相同中子数不同的两种原子,为不同的核素,故B错误;
C.原子核是由质子和中子构成的,但不一定含有中子,如1H不含有中子,故C错误;
D.Na2O由钠离子和氧离子构成,即阳离子和阴离子的个数比为2:1,故D正确。
故选D。
4.A
【详解】
A.S2、S4、S6为S元素形成的不同单质,属于同素异形体,故A正确;
B.石墨和金刚石为C元素形成的不同单质,属于同素异形体,故B错误;
C.复分解反应中各元素均没有化合价的变化,不属于氧化还原反应,故C错误;
D.红磷和白磷属于不同种物质,二者的转化为化学变化,故D错误;
综上所述答案为A。
5.B
【详解】
A.
同种元素的不同单质互为同素异形体,石墨烯与金刚石都是碳单质,互为同素异形体,故A不选;
B.
反应中存在化合价的变化的反应属于氧化还原反应,反应中C元素的化合价降低,CO只作氧化剂,故B选;
C.
Na2O与酸反应只生成盐和水,属于碱性氧化物,
Na2CO3属于盐,故C不选;
D.
钠是活泼金属在自然界中不存在单质,自然界中钠元素以化合态形式存在,故D不选;
故选:B。
6.B
【详解】
A.同位素的研究对象为原子,而和为单质,互为同素异形体,A项错误;
B.正丁烷和异丁烷分子式相同,结构不同,二者互为同分异构体,B项正确;
C.核素的研究对象是原子,和均为单质,C项错误;
D.的分子式为,而的分子式为,分子式不同,两者不是同分异构体,D项错误。
答案选B。
7.C
【详解】
A.,氘(D)原子的质子数是1,所以原子核外有1个电子,故A正确;
B.与D的质子数相同,中子数不同,二者互为同位素,故B正确;
C.由同一种元素形成的性质不同的单质互为同素异形体,水是化合物,故C错误;
D.与的相对分子质量都是20,故D正确。
故答案选:C。
8.B
【详解】
A.表示质子数为34,核电荷数=质子数=34,故A错误;
B.表示质子数为34,核外电子数=质子数=34,故B正确;
C.表示质量数为79,故C错误;
D.表示质量数为79,质子数为34,中子数=质量数-质子数=79-34=45,故D错误;
故选B。
9.A
【详解】
核内中子数为N的R2+离子,质量数为A,质子数为A-N,该离子的相对原子质量在数值上等于其质量数;该离子带2个单位正电荷,所以其氧化物的化学式为RO;该氧化物的摩尔质量为(A+16)g/mol,n
g它的氧化物的物质的量为mol。一个氧化物分子中含有(A-N+8)个质子,质子数和电子数相等,所以ng它的氧化物中所含电子的物质的量为:(A-N+8)mol,A项正确;
答案选A。
10.D
【详解】
A.碘为53号元素,131I的原子核所含中子数是131-52=78,故A正确;
B.原子在化学变化中不能再分,但在核反应中可以再分,所以核能的利用证实了原子的可分性,故B正确;
C.127I和放射性131I质子数相同,中子数不同,互为同位素,故C正确;
D.127I和131I都是碘元素,质子数都是53,故D错误;
故选D。
11.D
【详解】
A.同素异形体的物理性质不同,化学性质相似,故A错误;
B.碳酸钠是由和形成的,存在阴、阳离子,故B错误;
C.H、D和T的质子数都为1,、、三种物质的质子数之比为1∶1∶1,故C错误;
D.同素异形体是不同的物质,所以同素异形体之间的相互转化一定是化学变化,故D正确;
故答案:D。
12.D
【详解】
A.O2和O3为氧元素形成的不同单质,互为同素异形体,A项不选;
B.、、为氢元素的三种不同核素,互为同位素,B项不选;
C.和结构相似,分子组成相差1个CH2,两者互为同系物,C项不选;
D.和分子式相同,结构不同,互为同分异构体,D项选;
答案选D。
13.B
【详解】
A.、质子数相同,核外电子数相同均为89,中子数不同分别为116、118,A错误;
B.、的核外电子排布相同,故二者的化学性质几乎相同,B正确;
C.、互为同位素,质子数相同,在元素周期表中的位置相同,C错误;
D.、的质量数不同,故相同物质的量的和的质量不同,D错误;
故选B。
14.D
【详解】
A.H2的摩尔质量是2g/mol,A错误;
B.氯原子的原子结构示意图为,B错误;
C.质子数为6,中子数为8的微粒表示为C,C错误;
D.NaHSO4在水中完全电离出钠离子和氢离子和硫酸根离子,NaHSO4在水中的电离方程式:NaHSO4=Na++H++SO,D正确;
答案选D。
15.C
【详解】
A.氮气分子中含有氮氮三键,正确的结构式为:,故A错误;
B.质子数为53,中子数为78的碘原子的质量数为:53+78=131,该碘原子可以表示为:,故B错误;
C.氯离子的核电荷数为17,核外电子总数为18,最外层达到8电子稳定结构,氯离子正确的结构示意图为:,故C正确;
D.氯化铵属于离子化合物,铵根离子和氯离子都需要标出所带电荷及原子的最外层电子,氯化铵正确的电子式为:,故D错误;
故选C。
【点睛】
本题考查了结构简式、电子式、离子结构示意图、元素符号等化学用语的判断,题目难度中等,注意掌握常见化学用语的概念及正确的表示方法,明确结构简式与结构式、原子结构示意图与离子结构示意图的区别。
16.B
【详解】
A.1个3He
原子中质量数为3,含有1个中子,A说法错误;
B.3He与4He含有的质子数相同,而中子数不同,互为同位素,B说法正确;
C.同素异形体为同种元素形成的不同单质,3He与4He互为同位素,C说法错误;
D.3He与4He的化学性质相同,物理性质不同,D说法错误;
答案为B。
17.B
【详解】
A.和原子都属于6号C元素,原子核中均含有6个质子,A正确;
B.的原子核外有6个电子,核外电子排布是2、4,故原子结构示意图为:,B错误;
C.和质子数相同,中子数不同,二者互为同位素,C正确;
D.和原子核外都有6个电子,核外电子排布是2、4,故它们的核外电子排布相同,D正确;
故合理选项是B。
18.
(1)
(2)
C5H12
CH3CH2CH2CH2CH3、CH3CH(CH3)
CH2CH3、C(CH3)4
正戊烷
(3)
⑦⑧
③④
⑤⑥
①②
【分析】
(1)
甲烷的分子式为CH4,碳原子和4
氢原子形成4条共价键,其电子式为,故答案:。
(2)
饱和烷烃的通式为CnH2n+2,所以相对分子质量为72的烷烃的分子式为C5H12,其所有同分异构体有三种:正戊烷CH3CH2CH2CH2CH3;异戊烷
(2-甲基丁烷):CH3CH(CH3)
CH2CH3;新戊烷(2,2-二甲基丙烷)
C(CH3)4,故答案:C5H12;CH3CH2CH2CH2CH3、CH3CH(CH3)
CH2CH3、C(CH3)4;正戊烷。
(3)
同分异构体是分子式相同,结构不同,所以⑦CH3CH2CH2CH3
⑧(CH3)2CHCH3互为同分异构体;同素异形体由同种元素组成的不同单质,所以③石墨
④金刚石互为同素异形体;同位素是质子数相同,中子数不同,所以⑤35Cl
⑥37Cl互为同位素;①液氯是氯气的液态,所以①液氯②氯气是同一种物质。故答案:⑦⑧;③④;⑤⑥;①②。
19.
(1)
H
Na+
27
(2)
NaClO
NaClO3
【分析】
A微粒不带电,其质量数为1,则A为H;B微粒呈电中性,得2个电子后,其电子层结构与Ne相同,则B为O;C微粒带有一个单位的正电荷,核电荷数为11,则C为Na;D微粒核内有14个中子,核外M层上有3个电子,则D为Al;E微粒核外有18个电子,当失去一个电子时呈电中性,则E为Cl。
(1)
A微粒的符号H,B微粒的结构示意图,C微粒的电子式Na+,D微粒的质量数27,E微粒的结构示意图。
(2)
B、C、E所属三种元素可组成多种物质,如NaClO、NaClO3。
20.11
配位键、共价键
N>O>C
sp3
乙二胺分子间可形成氢键
该晶体导电时,Na+在电场作用下迁移到空位上,形成电流
I
【详解】
(1)电子填充能级组如图所示,29号元素铜的电子排布式为,最高能级组为3d4s,所以基态Cu原子最高能级组电子数为11个,故答案为11;
(2)①该配离子中存在的共价键有碳氢键、氮氢键、碳碳单键、碳氮单键,此外四个氮原子给铜离子形成四条配位键,故答案为配位键、共价键;
②C、N、O位于同周期,第一电离能从左至右递增,位于第五主族的元素氮电子排布式为,2p能级为半充满稳定结构,所以氮的第一电离能高于同周期相邻元素,故第一电离能由大到小顺序为N>O>C,故答案为N>O>C;
③利用价层电子对互斥理论计算乙二胺分子中氮原子的价层电子对数,价层电子对数为4对,所以杂化方式为sp3杂化,故答案为sp3;
乙二胺和三甲胺[N(CH3)3]均属于胺,均为分子晶体,影响分子晶体的熔沸点因素为分子间氢键和范德华力,观察分析乙二胺的结构简式H2N-CH2-CH2-NH2可知,可形成乙二胺分子间氢键,观察分析三甲胺的结构简式N(CH3)3可知,三甲胺不能形成分子间氢键,分子间通过范德华力相互作用,由于形成分子间氢键后物质的熔沸点会提高,所以乙二胺比三甲胺的沸点高得多,故答案为乙二胺分子间可形成氢键;
(3))利用题干中信息当温度升高时,NaCl晶体出现缺陷,此时图中方块位置没有钠离子,当晶体导电时,Na+在电场作用下迁移到空位上,带电粒子定向移动,增强晶体导电性,所以晶体的导电性大大增强,故答案为该晶体导电时,Na+在电场作用下迁移到空位上,形成电流;
图中钠离子移动到空格处,有路径Ⅰ和Ⅱ两种方式,由于在氯化钠晶体中两个相邻Cl-之间的间隙小于Na+直径,所以路径Ⅱ对钠离子的移动起到空间位阻效应,路径Ⅱ不是Na+迁移到空位处的途径,故答案为Ⅰ;
(4)①如图原子A的原子坐标为(0,0,0),所以A为坐标系的原点,认为晶胞的边长相对长度为1,则B原子位于yoz象限的面心,所以B的原子坐标为,故答案为;
②均摊法计算该晶胞含有铜原子个数,镍原子个数,设Ni原子之间最短距离为anm,也就是晶胞的边长为anm,利用合金的密度为ρg/cm3列出下列等式:,解得a=nm,故答案为。
