2021-2022学年高一上学期化学苏教版(2019)必修第一册专题2研究物质的基本方法专题练(含解析)
文档属性
| 名称 | 2021-2022学年高一上学期化学苏教版(2019)必修第一册专题2研究物质的基本方法专题练(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 461.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-04 07:10:38 | ||
图片预览


文档简介
专题2研究物质的基本方法章节专题练——2021-2022学年高一上学期化学苏教版(2019)必修第一册
一、单选题(共16题)
1.用1.0moL/L氯化钠溶液配制100mL0.20moL/L氯化钠溶液,下列仪器中不需要的是(
)
A.烧杯
B.量筒
C.分液漏斗
D.玻璃棒
2.下列关于物质分类的说法正确的是(
)
A.金刚石、白磷都属于单质
B.漂白粉、石英都属于纯净物
C.氯化氢、一水合氨都属于强电解质
D.葡萄糖、蛋白质都属于高分子化合物
3.某试剂瓶标签上的安全标志如图所示,其中的试剂可能是(
)
A.碳酸钠
B.氢氧化钠
C.乙醇
D.氯化钠
4.盛装浓硫酸的运输槽应贴有的安全标志是
(
)
A
B
C
D
腐蚀品
易燃气体
自燃物品
剧毒品
A.A
B.B
C.C
D.D
5.密度为ρg·cm-3VLAl2(SO4)3溶液,硫酸根的物质的量浓度为cmol/L
则该溶液铝元素的质量分数为(
)
A.54c/
ρ
B.18c/
ρ
C.9c/(500ρ)
D.500ρ/27c
6.XSO4(
aq)与NaOH(aq)反应,定量生成X3(OH)4SO4(s)和Na2SO4(ag)。1.0
mol·L-1的XSO4溶液和1.0
mol·L-1NaOH溶液混合,总体积为50
mL(体积可加合)。为了得到最大的沉淀量,这两种溶液的体积应取(
)
A.29
mL
NaOH
+21
mL
XSO4
B.21
mL
NaOH
+29
mL
XSO4
C.15mLNaOH+35mL
XSO4
D.20mLNaOH+30mL
XSO4
7.等体积的硫酸铝、硫酸锌、硫酸钠溶液分别与足量氯化钡溶液反应,若生成硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐的物质的量浓度之比为(
)
A.1:2:3
B.1:6:9
C.1:3:3
D.1:3:6
8.将4.6g钠与95.6g水混合反应得到溶液①,向①中加入50mL硫酸溶液得到中性溶液②,下列说法错误的是(
)
A.①中NaOH的质量分数为8%
B.c(H2SO4)=2mol·L-1
C.②中n(Na2SO4)=0.1mol
D.钠与水反应时生成了2.24L气体
9.实验室用FeCO3和甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如图所示。下列说法错误的是(
)
A.盐酸、石灰石可分别用稀硫酸和碳酸氢钠代替
B.装置B中的试剂应选用饱和NaHCO3溶液
C.实验时澄清石灰水变浑浊后方可打开b恒压滴液漏斗的旋塞
D.装置D的作用是尾气处理
10.下列除杂质的方法可行的是(
)
A.加入新制的生石灰,然后加热蒸馏,可以除去乙醇中少量的水
B.通过装有氢氧化钠溶液的洗气瓶,可以除去氯气中的氯化氢气体
C.用苯通过萃取分液的方法,可以除去溴苯中的溴
D.用氢氧化钠溶液,通过分液的方法,可以除去乙酸乙酯中的乙酸
11.实验室预配制200
mL与该试剂瓶中所装浓度相同的硫酸铜溶液(如图),则下列说法正确的是
(
)
A.实验室配置该溶液用到的玻璃仪器:200
mL容量瓶、胶头滴管、烧杯、玻璃棒
B.该硫酸铜溶液中溶质物质的量浓度为0.4
mol/L
C.在实验室用胆矾配制该浓度溶液,需在托盘天平上称取胆矾31.3
g
D.在实验室配制该浓度溶液,若定容时俯视液面,将导致所配溶液浓度偏小
12.300mL某浓度的NaOH溶液中含有60g溶质。现欲配制1mol/LNaOH溶液,应取原溶液与稀释后溶液的体积比约为(
)
A.1∶4
B.1∶5
C.2∶1
D.2∶3
13.下列说法正确的是(
)
A.1molO2的体积为22.4L
B.28g丁烯所含碳原子数是28g乙烯所含碳原子数的2倍
C.0.1mol/LAlCl3溶液中Cl-的物质的量为0.3mol
D.5.6gFe与足量C12反应,转移电子的物质的量为0.3mol
14.使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况:①使用托盘天平(使用游码)称量固体药品时,被称量物与砝码位置放颠倒了;②用滴定管量取液体溶质时,开始时平视读数,结束后俯视读数;③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤;④转移溶液前容量瓶内有少量蒸馏水;⑤定容时,仰视容量瓶刻度线;会使所配溶液浓度偏低的是(
)
A.①③⑤
B.①②⑤
C.②③④
D.③④⑤
15.下列关于物质的量浓度表述正确的是(
)
A.0.3mol L﹣1的Na2SO4溶液中含有Na+和SO的总物质的量为0.9mol
B.当1L水吸收22.4L氨气时所得氨水的浓度不是1mol L﹣1,只有当22.4L氨气溶于水制得1L氨水时,其浓度才是1mol L﹣1
C.10℃时,0.35mol L﹣1的KCl饱和溶液100mL蒸发掉5g水,冷却到10℃时,其体积小于100mL,它的物质的量浓度仍为0.35mol L﹣1
D.配置480mL
0.2mol L﹣1的NaClO溶液,需要NaClO固体质量为7.2g
16.下列仪器和仪器名称正确的是(
)
A.坩埚
B.分液漏斗
C.冷却管
D.溶量瓶
二、综合题(共4题)
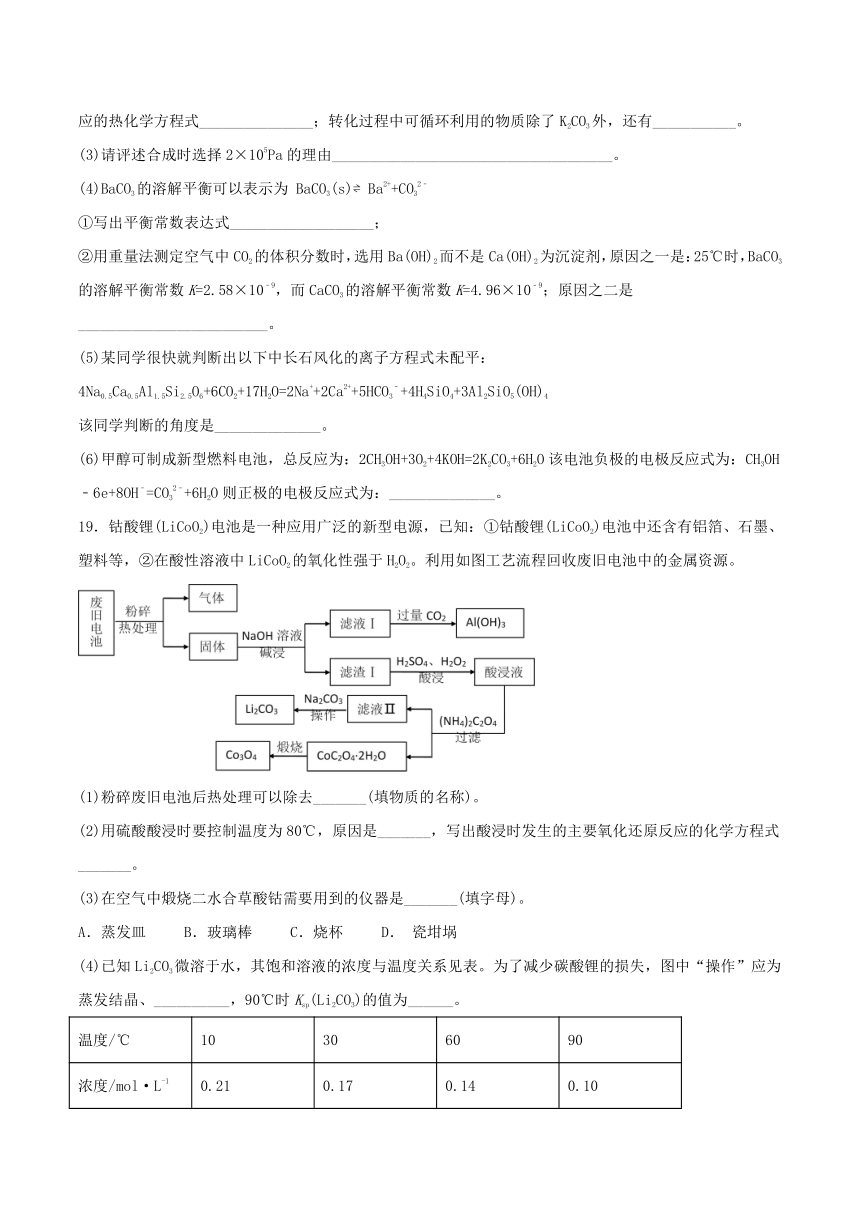
17.现在工业上主要采用离子交换膜法电解饱和食盐水制取NaOH、H2和Cl2。阳离子交换膜有一种特殊的性质,即它只允许阳离子通过,而阻止阴离子和气体通过。
请回答下列问题:
(1)电解之前,食盐水需要精制,目的是除去粗盐中的Ca2+、Mg2+、等杂质离子,使用的试剂有:a.Na2CO3溶液,
b.Ba(OH)2溶液,
c.稀盐酸,其合理的加入顺序为(填试剂序号)_____。
(2)在电解过程中,对水的电离是_________的(填“促进”或“抑制”或“没有影响”);与电源正极相连的电极上所发生的电极反应式为________。
(3)如果在容积为10L的离子交换膜电解槽中,1min后在阴极可产生11.2L(标准状况)H2,这时溶液的pH值是_________(填“升高”、“降低”或“不变”),溶液中c(OH-)为(设体积保持不变)________。
(4)若没有阳离子交换膜的存在,改用下图电解发生器(b为电源正极,用石墨作电极),可制备家用环保型消毒液(NaClO溶液)。则此实验时电解饱和食盐水的总化学方程式是
_________。
(5)室温条件下,该消毒液(NaClO)溶液的pH>7,原因是_____(用离子方程式表示)。
18.最近有科学家提出“绿色自由”的构想:把含有CO2的空气吹入K2CO3溶液中,然后再用高温水气分解出CO2,经与H2化合后转变为甲醇燃料.
(1)在整个生产过程中饱和K2CO3溶液的作用是_______;不用KOH溶液的理由是_________。
(2)在合成塔中,每44g
CO2与足量H2完全反应生成甲醇时,可放出49.5kJ的热量,试写出合成塔中发生反应的热化学方程式_______________;转化过程中可循环利用的物质除了K2CO3外,还有___________。
(3)请评述合成时选择2×105Pa的理由_____________________________________。
(4)BaCO3的溶解平衡可以表示为
BaCO3(s) Ba2++CO32﹣
①写出平衡常数表达式___________________;
②用重量法测定空气中CO2的体积分数时,选用Ba(OH)2而不是Ca(OH)2为沉淀剂,原因之一是:25℃时,BaCO3的溶解平衡常数K=2.58×10﹣9,而CaCO3的溶解平衡常数K=4.96×10﹣9;原因之二是_________________________。
(5)某同学很快就判断出以下中长石风化的离子方程式未配平:
4Na0.5Ca0.5Al1.5Si2.5O6+6CO2+17H2O=2Na++2Ca2++5HCO3﹣+4H4SiO4+3Al2SiO5(OH)4
该同学判断的角度是______________。
(6)甲醇可制成新型燃料电池,总反应为:2CH3OH+3O2+4KOH=2K2CO3+6H2O该电池负极的电极反应式为:CH3OH﹣6e+8OH﹣=CO32﹣+6H2O则正极的电极反应式为:______________。
19.钴酸锂(LiCoO2)电池是一种应用广泛的新型电源,已知:①钴酸锂(LiCoO2)电池中还含有铝箔、石墨、塑料等,②在酸性溶液中LiCoO2的氧化性强于H2O2。利用如图工艺流程回收废旧电池中的金属资源。
(1)粉碎废旧电池后热处理可以除去_______(填物质的名称)。
(2)用硫酸酸浸时要控制温度为80℃,原因是_______,写出酸浸时发生的主要氧化还原反应的化学方程式_______。
(3)在空气中煅烧二水合草酸钴需要用到的仪器是_______(填字母)。
A.蒸发皿
B.玻璃棒
C.烧杯
D.
瓷坩埚
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见表。为了减少碳酸锂的损失,图中“操作”应为蒸发结晶、__________,90℃时Ksp(Li2CO3)的值为______。
温度/℃
10
30
60
90
浓度/mol·L-1
0.21
0.17
0.14
0.10
20.利用钛白工业的副产物硫酸亚铁[含TiOSO4及少量Fe2(SO4)3]制取铁红的工艺流程如图所示。已知:TiOSO4溶于水,在水中可以电离为TiO2+和SO。
(1)加热近沸条件下“精制”硫酸亚铁的过程中,其中的Ti元素会与水作用生成偏钛酸(H2TiO3)沉淀,此反应的离子方程式为___,加入铁屑的作用是___(用离子方程式表示)。
(2)“氧化”工序中发生反应的化学方程式有___。
(3)滤渣2在加热条件下生成铁红,反应的化学方程式为___。
(4)副产品M的化学式为___,由滤液得到M的操作为蒸发浓缩、___、___、洗涤、干燥。
参考答案
1.C
【详解】
用1.0moL/L氯化钠溶液配制100mL0.20moL/L氯化钠溶液,稀释过程中氯化钠的物质的量不变,则1.0moL/L×V=100mL×0.20moL/L,V=20.0mL,则用量筒准确量取20.0mL1.0moL/L氯化钠溶液,转移至100mL烧杯中,用玻璃棒引流转移到100
mL的容量瓶中,用蒸馏水洗涤烧杯和玻璃棒2~3次,将洗涤液全部转移到容量瓶中,再稀释、定容、摇匀。则不需要的仪器是分液漏斗,C满足;
答案选C。
2.A
【详解】
A.金刚石是碳元素形成的单质,白磷是磷元素形成的单质,A项正确;
B.漂白粉是CaCl2和Ca(ClO)2的混合物,石英的主要成分是二氧化硅,常含有Al2O3、CaO、MgO等杂质,为混合物,B项错误;
C.氯化氢为强电解质,一水合氨为弱碱,是弱电解质,C项错误;
D.葡萄糖是小分子化合物,蛋白质是高分子化合物,D项错误;
故选:A。
3.B
【详解】
A.碳酸钠属于盐,没有腐蚀性,故A不符合题意;
B.氢氧化钠是碱,具有腐蚀性,故B符合题意;
C.乙醇属于有机物,没有腐蚀性,故C不符合题意;
D.氯化钠是盐,没有腐蚀性,故D不符合题意;
故选B。
4.A
【详解】
浓硫酸是腐蚀品,所以应该贴有腐蚀品标志,故答案为:A
5.C
【详解】
密度为ρg·cm-3VLAl2(SO4)3溶液,硫酸根的物质的量浓度为cmol/L,则硫酸根的物质的量为cvmol,铝离子的物质的量cvmol,铝元素的质量分数为,C满足;
答案选C。
6.A
【详解】
略
7.B
【详解】
设硫酸铝、硫酸锌、硫酸钠溶液的物质的量浓度分别为c1mol/L、c2mol/L、c3mol/L,生成硫酸钡沉淀的质量比为1:2:3,即三种溶液中含有的的物质的量之比为:1:2:3,即3c1V:c2V:c3V=1:2:3,故c1:c2:c3=1:6:9,故答案为:B。
8.D
【详解】
A.
由可求出,钠反应完后可得到,溶液①的质量的质量分数,A项正确;
B.
溶液②显中性说明硫酸、恰好反应完全,由可求出,B项正确;
C.
由B分析可知,C项正确;
D.
由于没有限定温度、压强,无法计算氢气的体积,D项错误;
故选D。
9.D
【详解】
A.装置A是制备CO2的装置,可以用稀硫酸与碳酸氢钠反应制取CO2,区别于稀硫酸与碳酸钙,因产生的硫酸钙微溶而不能用于制备CO2气体,A正确;
B.装置B的作用是除去CO2中的HCl气体,选用饱和NaHCO3溶液,B正确;
C.A装置制备CO2的目的是排净装置内的空气,防止Fe2+被氧化,澄清石灰水变浑浊,说明已经排净装置内的空气,可以打开b的旋塞,C正确;
D.装置D中澄清石灰水的作用一是检验装置内空气是否排净,二是水封,防止外界的空气进人反应装置将Fe2+氧化,D错误。
故选:D。
10.A
【详解】
A.生石灰极易吸水生成氢氧化钙,而乙醇的沸点低,蒸馏即可,A正确;
B.氯气能和NaOH溶液反应:Cl2+2NaOH=NaCl+NaClO+H2O,B错误;
C.苯和溴苯是互溶的,不能用苯萃取溴苯中的溴,应该用NaOH溶液除去溴苯中的溴,C错误;
D.应该加入饱和碳酸钠溶液后分液,乙酸乙酯和乙酸均能和氢氧化钠溶液反应,D错误;
答案选A。
【点睛】
在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则:不能引入新的杂质(水除外),即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中;分离提纯后的物质状态不变;实验过程和操作方法简单易行,即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则。
11.C
【详解】
A.实验室没有200
mL规格的容量瓶,应该选择250
mL容量瓶,选项A错误;
B.依据计算公式可计算得到该溶液溶质的浓度为0.5
mol/L,选项B错误;
C.在实验室用胆矾配制溶液,需在托盘天平上称取胆矾,选项C正确;
D.实验室配制该浓度溶液,若定容时俯视液面所加蒸馏水不足,体积偏小,导致所配溶液浓度偏大,选项D错误;
答案选C。
12.B
【详解】
原溶液中含有溶质的物质的量为
,要用来配制1
mol·L-1
NaOH溶液,则所得溶液的体积为
,而原溶液的体积为300mL,则应取原溶液与稀释后溶液的体积比约为1:5,故B项正确。
答案选B。
13.D
【详解】
A.未指明温度与压强,不能利用22.4L/mol计算1molO2的体积,A不正确;
B.28g丁烯所含碳原子数为2mol,28g乙烯所含碳原子数也为2mol,B不正确;
C.题中没有告诉0.1mol/LAlCl3溶液的体积,无法计算Cl-的物质的量,C不正确;
D.5.6gFe与足量C12反应,转移电子的物质的量为×3=0.3mol,D正确;
故选D。
14.A
【详解】
①被称量物与砝码的位置放颠倒了,会导致称量出的药品的质量变小,故所配溶液浓度偏低;
②滴定管量取液体时,开始时平视读数,结束时俯视读数,会导致所取溶液体积偏大,所配溶液浓度偏高;
③移液后烧杯及玻璃棒未用蒸馏水洗涤,会导致溶质的损失,故使所配溶液浓度偏低;
④转移溶液前容量瓶内有少量蒸馏水对所配溶液的浓度无影响;
⑤定容时,仰视容量瓶的刻度线,会导致溶液体积偏大,故使所配溶液浓度偏低;
故选:A。
15.C
【详解】
A.没有告诉Na2SO4溶液的体积,无法计算溶液中Na+和SO的物质的量之和,故A错误;
B.不是标况下,题中条件无法计算22.4L氨气的物质的量,则无法计算该溶液的物质的量浓度,故B错误;
C.10℃时0.35 mol L-1的KCl饱和溶液100 mL,蒸发掉5 g水,冷却到10℃时,其体积小于100 mL,但是此时仍然为饱和溶液,则它的物质的量浓度仍为0.35 mol L-1,故C正确;
D.配置480mL
0.2mol L﹣1的NaClO溶液,选取500ml容量瓶,需要NaClO固体的物质的量为0.1mol,质量为:0.1mol×74.5g/mol=7.45g,故D错误;
答案选C。
16.B
【详解】
A.根据仪器图示可知该仪器名称为研钵,不是坩埚,A错误;
B.图示仪器与名称吻合,B正确;
C.图示仪器名称为直形冷凝管,不是冷却管,C错误;
D.图示仪器名称为容量瓶,不是溶量瓶,要注意同音字的书写,D错误;
故合理选项是B。
17.bac
促进
2Cl--2e-===Cl2↑
升高
0.1mol/
L
NaCl+H2ONaClO+H2↑
ClO-
+H2OHClO+OH-
【分析】
(1)盐酸要放在最后,来除去过量的氢氧化钠和碳酸钠,要先加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除过量的钡离子;
(2)电解NaCl溶液时,水电离出来的氢离子在阴极反应,阳极上氯离子放电生成氯气;
(3)阴极电极反应式为
2H++2e-=H2↑,生成11.2L氢气消耗1mol氢离子,溶液中生成1mol氢氧根离子,据此分析;
(4)若采用无隔膜电解食盐水,Cl2和NaOH充分接触,产物是NaClO和H2,则阳极上氯离子放电生成次氯酸钠、阴极上氢离子放电,据此分析解答;
(5)NaClO是弱酸强碱盐,其水解导致溶液显碱性.
【详解】
(1)要先除硫酸根离子,然后再除钙离子,Na2CO3可以除去过量的钡离子,否则过量的钡离子不能完全除尽,至于加NaOH除去镁离子顺序不受限制,可放在加入BaCl2之前或之后,因为过量的NaOH加HCl就可以调节了,只要将三种离子完全除去,过滤即可,最后加HCl除去过量的氢氧根离子和碳酸根离子;
故答案为:bac;
(2)电解NaCl溶液时,水电离出来的氢离子在阴极反应,促进了水的电离,阳极上氯离子放电生成氯气,电极反应式为2Cl--2e-===Cl2↑;
故答案为:促进;
2Cl--2e-===Cl2↑;
(3)阴极电极反应式为
2H++2e-=H2↑,生成11.2L氢气即0.5mol氢气,消耗1mol氢离子,溶液中生成1mol氢氧根离子,所以pH升高,c(OH-)
=
1mol
÷
10L
=
0.1mol/L;
故答案为:升高;0.1mol/L;
(4)若采用无隔膜电解食盐水,Cl2和NaOH充分接触,产物是NaClO和H2,,则阳极上氯离子放电生成次氯酸钠、阴极上氢离子放电,电池反应式为NaCl+H2ONaClO+H2↑;
故答案为:NaCl+H2ONaClO+H2↑;
(5)NaClO是弱酸强碱盐,其水解导致溶液显碱性,水解方程式为ClO-
+H2OHClO+OH-,故答案为:ClO-
+H2OHClO+OH-。
【点睛】
本题考查原电池和电解池原理、电极反应式的书写、盐类水解,明确电极上得失电子及反应物质是解题关键,电极反应式的书写是学习难点,要注意结合电解质溶液的酸碱性书写,难度中等。
18.富集CO2
生成的K2CO3难分解产生CO2
CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=﹣49.5kJ/mol
水蒸气
适当加压有利于提高反应速率和原料利用率,但压强太高增大成本
K=
c(Ba2+)c(CO32﹣)
BaCO3的式量大,相对误差小
未配平两边电荷数
O2+2H2O+4e-=4
OH﹣
【分析】
(1)碳酸氢钾不稳定,加热时分解生成碳酸钾和二氧化碳、水,碳酸钾不分解;
(2)4.4kgCO2的物质的量是100mol,100mol二氧化碳和足量氢气反应放出4947KJ热量,据此计算1mol二氧化碳与足量氢气反应放出的热量,从而写出其热化学反应方程式;根据合成甲醇的方程可知,反应生成甲醇和水蒸气,水蒸气可以给碳酸氢钾分解提供能量;
(3)合成甲醇的反应为体积减小的反应,增大压强平衡正移;
(4)①溶解平衡方程式书写平衡常数表达式;
②重量法测定空气中CO2的体积分数,要求称量准确,误差小;
(5)书写离子方程式要注意原子守恒和电荷守恒;
(6)碱性甲醇燃料电池中,甲醇在负极失电子,氧气在正极得电子。
【详解】
(1)在整个生产过程中饱和K2CO3溶液的作用是富集二氧化碳,二氧化碳和饱和的碳酸钾溶液反应生成碳酸氢钾,碳酸氢钾不稳定,加热时分解生成碳酸钾、二氧化碳和水,KOH溶液与二氧化碳是碳酸钾,K2CO3难分解产生CO2;
(2)44gCO2的物质的量是1mol,1mol二氧化碳和足量氢气反应放出49.5kJ热量,所以其热化学反应方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=﹣49.5kJ/mol;根据合成甲醇的方程可知,反应生成甲醇和水蒸气,水蒸气可以给碳酸氢钾分解提供能量,所以转化过程中可循环利用的物质除了K2CO3外,还有水蒸气;
(3)合成甲醇的反应为体积减小的反应,增大压强平衡正移,有利于提高反应速率和原料利用率,但是压强太高对反应的设备要求很高,又提高了生产成本,所以不能太高;
4)①BaCO3的溶解平衡可以表示为
BaCO3(s) Ba2++CO32﹣,平衡常数表达式为K=
c(Ba2+)c(CO32﹣);
②重量法测定空气中CO2的体积分数,要求称量准确,误差小,BaCO3的式量大,称量的相对误差小;
(5)书写离子方程式要注意原子守恒和电荷守恒,4Na0.5Ca0.5Al1.5Si2.5O6+6CO2+17H2O=2Na++2Ca2++5HCO3﹣+4H4SiO4+3Al2SiO5(OH)4中电荷不守恒,原子个数也不守恒,所以离子方程式错误;
(6)碱性甲醇燃料电池中,甲醇在负极失电子,氧气在正极得电子生成氢氧根离子,则正极反应式为:O2+2H2O+4e-=4OH﹣。
19.石墨和塑料
H2O2不稳定,温度高于80℃会促进H2O2分解,产率降低,温度低于80℃反应速率又太小
2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O
BD
趁热过滤
4.0×10-3
【分析】
废旧电池粉碎后进行热处理,石墨与氧气反应生成二氧化碳,塑料与氧气反应也生成气体,固体中Al与氢氧化钠溶液反应生成偏铝酸钠和氢气,滤渣钴酸锂(LiCoO2)与硫酸、双氧水反应生成硫酸锂和硫酸钴,向混合液中加入草酸铵,得到草酸钴沉淀,煅烧得到四氧化三钴,过滤,向滤液中加入碳酸钠生成碳酸锂。
【详解】
(1)粉碎废旧电池后热处理,石墨与氧气反应生成二氧化碳,塑料与氧气反应,因此可以除去石墨和塑料;故答案为:石墨和塑料。
(2)用硫酸酸浸时要控制温度为80℃,钴酸锂(LiCoO2)与硫酸、双氧水反应,双氧水不稳定,在温度较高时易分解,会降低产率,温度低于80℃反应速率又太小,酸浸时LiCoO2与H2O2、H2SO4反应生成Li2SO4、CoSO4、O2和H2O,因此发生的主要氧化还原反应的化学方程式2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O;故答案为:H2O2不稳定,温度高于80℃会促进H2O2分解,产率降低,温度低于80℃反应速率又太小;2LiCoO2+H2O2+3H2SO4
=
Li2SO4+2CoSO4+O2↑+4H2O。
(3)在空气中煅烧二水合草酸钴需要用到的仪器是酒精灯,三脚架、泥三角、坩埚、坩埚钳、玻璃棒等,故答案为BD。
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见表,碳酸锂的溶解度随温度升高而逐渐降低,因此为了减少碳酸锂的损失,图中“操作”应为蒸发结晶、趁热过滤,90℃时Li2CO3的浓度为0.10
mol·L 1,电离出的c(Li+)=0.2
mol·L 1,c(CO32 )=0.1
mol·L 1,因此Ksp(Li2CO3)=0.22×0.1=4.0×10 3;故答案为:趁热过滤;4.0×10 3。
【点睛】
化工流程是常考题型,主要考查工艺流程、实际工艺中的分析、氧化还原反应方程式、实验仪器、溶度积的计算等。
20.TiO2++2H2OH2TiO3↓+2H+
2Fe3++Fe=3Fe2+
H2SO4+2NH3·H2O=(NH4)2SO4+2H2O、FeSO4+2NH3·H2O=Fe(OH)2↓+(NH4)2SO4,4Fe(OH)2+O2+2H2O=4Fe(OH)3
2Fe(OH)3Fe2O3+3H2O
(NH4)2SO4
冷却结晶
过滤
【分析】
“精制”步骤加入铁屑,发生Fe+2Fe3+=3Fe2+,将Fe3+转化成Fe2+,根据问题(1),Ti元素转化成H2TiO3沉淀,过滤1,得到滤渣1为H2TiO3和过量的铁屑,滤液为FeSO4,“氧化”步骤中Fe2++2NH3·H2O=Fe(OH)2↓+2,4Fe(OH)2+O2+2H2O=4Fe(OH)3,滤渣2为Fe(OH)3,氢氧化铁加热得到铁红(Fe2O3),滤液中主要溶质为(NH4)2SO4,据此分析;
【详解】
(1)TiOSO4溶于水,在水中可以电离为TiO2+和SO,“精制”过程中Ti元素与水作用生成H2TiO3沉淀,其离子方程式为TiO2++2H2OH2TiO3↓+2H+;硫酸亚铁中含有少量的Fe2(SO4)3,加入铁屑的目的是将Fe3+转化成Fe2+,其离子方程式为Fe+2Fe3+=3Fe2+;
故答案为TiO2++2H2OH2TiO3↓+2H+;Fe+2Fe3+=3Fe2+;
(2)过滤1后的溶液中含有Fe2+、SO,“氧化”步骤中发生的反应有Fe2++2NH3·H2O=Fe(OH)2↓+2,4Fe(OH)2+O2+2H2O=4Fe(OH)3;
故答案为FeSO4+2NH3·H2O=Fe(OH)2↓+(NH4)2SO4,4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)氢氧化铁不稳定,受热分解成Fe2O3,其反应的化学方程式为2Fe(OH)3Fe2O3+3H2O;
故答案为2Fe(OH)3Fe2O3+3H2O;
(4)根据上述分析,M应为(NH4)2SO4;从滤液中获得(NH4)2SO4,需要蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
故答案为(NH4)2SO4;冷却结晶;过滤。
一、单选题(共16题)
1.用1.0moL/L氯化钠溶液配制100mL0.20moL/L氯化钠溶液,下列仪器中不需要的是(
)
A.烧杯
B.量筒
C.分液漏斗
D.玻璃棒
2.下列关于物质分类的说法正确的是(
)
A.金刚石、白磷都属于单质
B.漂白粉、石英都属于纯净物
C.氯化氢、一水合氨都属于强电解质
D.葡萄糖、蛋白质都属于高分子化合物
3.某试剂瓶标签上的安全标志如图所示,其中的试剂可能是(
)
A.碳酸钠
B.氢氧化钠
C.乙醇
D.氯化钠
4.盛装浓硫酸的运输槽应贴有的安全标志是
(
)
A
B
C
D
腐蚀品
易燃气体
自燃物品
剧毒品
A.A
B.B
C.C
D.D
5.密度为ρg·cm-3VLAl2(SO4)3溶液,硫酸根的物质的量浓度为cmol/L
则该溶液铝元素的质量分数为(
)
A.54c/
ρ
B.18c/
ρ
C.9c/(500ρ)
D.500ρ/27c
6.XSO4(
aq)与NaOH(aq)反应,定量生成X3(OH)4SO4(s)和Na2SO4(ag)。1.0
mol·L-1的XSO4溶液和1.0
mol·L-1NaOH溶液混合,总体积为50
mL(体积可加合)。为了得到最大的沉淀量,这两种溶液的体积应取(
)
A.29
mL
NaOH
+21
mL
XSO4
B.21
mL
NaOH
+29
mL
XSO4
C.15mLNaOH+35mL
XSO4
D.20mLNaOH+30mL
XSO4
7.等体积的硫酸铝、硫酸锌、硫酸钠溶液分别与足量氯化钡溶液反应,若生成硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐的物质的量浓度之比为(
)
A.1:2:3
B.1:6:9
C.1:3:3
D.1:3:6
8.将4.6g钠与95.6g水混合反应得到溶液①,向①中加入50mL硫酸溶液得到中性溶液②,下列说法错误的是(
)
A.①中NaOH的质量分数为8%
B.c(H2SO4)=2mol·L-1
C.②中n(Na2SO4)=0.1mol
D.钠与水反应时生成了2.24L气体
9.实验室用FeCO3和甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如图所示。下列说法错误的是(
)
A.盐酸、石灰石可分别用稀硫酸和碳酸氢钠代替
B.装置B中的试剂应选用饱和NaHCO3溶液
C.实验时澄清石灰水变浑浊后方可打开b恒压滴液漏斗的旋塞
D.装置D的作用是尾气处理
10.下列除杂质的方法可行的是(
)
A.加入新制的生石灰,然后加热蒸馏,可以除去乙醇中少量的水
B.通过装有氢氧化钠溶液的洗气瓶,可以除去氯气中的氯化氢气体
C.用苯通过萃取分液的方法,可以除去溴苯中的溴
D.用氢氧化钠溶液,通过分液的方法,可以除去乙酸乙酯中的乙酸
11.实验室预配制200
mL与该试剂瓶中所装浓度相同的硫酸铜溶液(如图),则下列说法正确的是
(
)
A.实验室配置该溶液用到的玻璃仪器:200
mL容量瓶、胶头滴管、烧杯、玻璃棒
B.该硫酸铜溶液中溶质物质的量浓度为0.4
mol/L
C.在实验室用胆矾配制该浓度溶液,需在托盘天平上称取胆矾31.3
g
D.在实验室配制该浓度溶液,若定容时俯视液面,将导致所配溶液浓度偏小
12.300mL某浓度的NaOH溶液中含有60g溶质。现欲配制1mol/LNaOH溶液,应取原溶液与稀释后溶液的体积比约为(
)
A.1∶4
B.1∶5
C.2∶1
D.2∶3
13.下列说法正确的是(
)
A.1molO2的体积为22.4L
B.28g丁烯所含碳原子数是28g乙烯所含碳原子数的2倍
C.0.1mol/LAlCl3溶液中Cl-的物质的量为0.3mol
D.5.6gFe与足量C12反应,转移电子的物质的量为0.3mol
14.使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况:①使用托盘天平(使用游码)称量固体药品时,被称量物与砝码位置放颠倒了;②用滴定管量取液体溶质时,开始时平视读数,结束后俯视读数;③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤;④转移溶液前容量瓶内有少量蒸馏水;⑤定容时,仰视容量瓶刻度线;会使所配溶液浓度偏低的是(
)
A.①③⑤
B.①②⑤
C.②③④
D.③④⑤
15.下列关于物质的量浓度表述正确的是(
)
A.0.3mol L﹣1的Na2SO4溶液中含有Na+和SO的总物质的量为0.9mol
B.当1L水吸收22.4L氨气时所得氨水的浓度不是1mol L﹣1,只有当22.4L氨气溶于水制得1L氨水时,其浓度才是1mol L﹣1
C.10℃时,0.35mol L﹣1的KCl饱和溶液100mL蒸发掉5g水,冷却到10℃时,其体积小于100mL,它的物质的量浓度仍为0.35mol L﹣1
D.配置480mL
0.2mol L﹣1的NaClO溶液,需要NaClO固体质量为7.2g
16.下列仪器和仪器名称正确的是(
)
A.坩埚
B.分液漏斗
C.冷却管
D.溶量瓶
二、综合题(共4题)
17.现在工业上主要采用离子交换膜法电解饱和食盐水制取NaOH、H2和Cl2。阳离子交换膜有一种特殊的性质,即它只允许阳离子通过,而阻止阴离子和气体通过。
请回答下列问题:
(1)电解之前,食盐水需要精制,目的是除去粗盐中的Ca2+、Mg2+、等杂质离子,使用的试剂有:a.Na2CO3溶液,
b.Ba(OH)2溶液,
c.稀盐酸,其合理的加入顺序为(填试剂序号)_____。
(2)在电解过程中,对水的电离是_________的(填“促进”或“抑制”或“没有影响”);与电源正极相连的电极上所发生的电极反应式为________。
(3)如果在容积为10L的离子交换膜电解槽中,1min后在阴极可产生11.2L(标准状况)H2,这时溶液的pH值是_________(填“升高”、“降低”或“不变”),溶液中c(OH-)为(设体积保持不变)________。
(4)若没有阳离子交换膜的存在,改用下图电解发生器(b为电源正极,用石墨作电极),可制备家用环保型消毒液(NaClO溶液)。则此实验时电解饱和食盐水的总化学方程式是
_________。
(5)室温条件下,该消毒液(NaClO)溶液的pH>7,原因是_____(用离子方程式表示)。
18.最近有科学家提出“绿色自由”的构想:把含有CO2的空气吹入K2CO3溶液中,然后再用高温水气分解出CO2,经与H2化合后转变为甲醇燃料.
(1)在整个生产过程中饱和K2CO3溶液的作用是_______;不用KOH溶液的理由是_________。
(2)在合成塔中,每44g
CO2与足量H2完全反应生成甲醇时,可放出49.5kJ的热量,试写出合成塔中发生反应的热化学方程式_______________;转化过程中可循环利用的物质除了K2CO3外,还有___________。
(3)请评述合成时选择2×105Pa的理由_____________________________________。
(4)BaCO3的溶解平衡可以表示为
BaCO3(s) Ba2++CO32﹣
①写出平衡常数表达式___________________;
②用重量法测定空气中CO2的体积分数时,选用Ba(OH)2而不是Ca(OH)2为沉淀剂,原因之一是:25℃时,BaCO3的溶解平衡常数K=2.58×10﹣9,而CaCO3的溶解平衡常数K=4.96×10﹣9;原因之二是_________________________。
(5)某同学很快就判断出以下中长石风化的离子方程式未配平:
4Na0.5Ca0.5Al1.5Si2.5O6+6CO2+17H2O=2Na++2Ca2++5HCO3﹣+4H4SiO4+3Al2SiO5(OH)4
该同学判断的角度是______________。
(6)甲醇可制成新型燃料电池,总反应为:2CH3OH+3O2+4KOH=2K2CO3+6H2O该电池负极的电极反应式为:CH3OH﹣6e+8OH﹣=CO32﹣+6H2O则正极的电极反应式为:______________。
19.钴酸锂(LiCoO2)电池是一种应用广泛的新型电源,已知:①钴酸锂(LiCoO2)电池中还含有铝箔、石墨、塑料等,②在酸性溶液中LiCoO2的氧化性强于H2O2。利用如图工艺流程回收废旧电池中的金属资源。
(1)粉碎废旧电池后热处理可以除去_______(填物质的名称)。
(2)用硫酸酸浸时要控制温度为80℃,原因是_______,写出酸浸时发生的主要氧化还原反应的化学方程式_______。
(3)在空气中煅烧二水合草酸钴需要用到的仪器是_______(填字母)。
A.蒸发皿
B.玻璃棒
C.烧杯
D.
瓷坩埚
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见表。为了减少碳酸锂的损失,图中“操作”应为蒸发结晶、__________,90℃时Ksp(Li2CO3)的值为______。
温度/℃
10
30
60
90
浓度/mol·L-1
0.21
0.17
0.14
0.10
20.利用钛白工业的副产物硫酸亚铁[含TiOSO4及少量Fe2(SO4)3]制取铁红的工艺流程如图所示。已知:TiOSO4溶于水,在水中可以电离为TiO2+和SO。
(1)加热近沸条件下“精制”硫酸亚铁的过程中,其中的Ti元素会与水作用生成偏钛酸(H2TiO3)沉淀,此反应的离子方程式为___,加入铁屑的作用是___(用离子方程式表示)。
(2)“氧化”工序中发生反应的化学方程式有___。
(3)滤渣2在加热条件下生成铁红,反应的化学方程式为___。
(4)副产品M的化学式为___,由滤液得到M的操作为蒸发浓缩、___、___、洗涤、干燥。
参考答案
1.C
【详解】
用1.0moL/L氯化钠溶液配制100mL0.20moL/L氯化钠溶液,稀释过程中氯化钠的物质的量不变,则1.0moL/L×V=100mL×0.20moL/L,V=20.0mL,则用量筒准确量取20.0mL1.0moL/L氯化钠溶液,转移至100mL烧杯中,用玻璃棒引流转移到100
mL的容量瓶中,用蒸馏水洗涤烧杯和玻璃棒2~3次,将洗涤液全部转移到容量瓶中,再稀释、定容、摇匀。则不需要的仪器是分液漏斗,C满足;
答案选C。
2.A
【详解】
A.金刚石是碳元素形成的单质,白磷是磷元素形成的单质,A项正确;
B.漂白粉是CaCl2和Ca(ClO)2的混合物,石英的主要成分是二氧化硅,常含有Al2O3、CaO、MgO等杂质,为混合物,B项错误;
C.氯化氢为强电解质,一水合氨为弱碱,是弱电解质,C项错误;
D.葡萄糖是小分子化合物,蛋白质是高分子化合物,D项错误;
故选:A。
3.B
【详解】
A.碳酸钠属于盐,没有腐蚀性,故A不符合题意;
B.氢氧化钠是碱,具有腐蚀性,故B符合题意;
C.乙醇属于有机物,没有腐蚀性,故C不符合题意;
D.氯化钠是盐,没有腐蚀性,故D不符合题意;
故选B。
4.A
【详解】
浓硫酸是腐蚀品,所以应该贴有腐蚀品标志,故答案为:A
5.C
【详解】
密度为ρg·cm-3VLAl2(SO4)3溶液,硫酸根的物质的量浓度为cmol/L,则硫酸根的物质的量为cvmol,铝离子的物质的量cvmol,铝元素的质量分数为,C满足;
答案选C。
6.A
【详解】
略
7.B
【详解】
设硫酸铝、硫酸锌、硫酸钠溶液的物质的量浓度分别为c1mol/L、c2mol/L、c3mol/L,生成硫酸钡沉淀的质量比为1:2:3,即三种溶液中含有的的物质的量之比为:1:2:3,即3c1V:c2V:c3V=1:2:3,故c1:c2:c3=1:6:9,故答案为:B。
8.D
【详解】
A.
由可求出,钠反应完后可得到,溶液①的质量的质量分数,A项正确;
B.
溶液②显中性说明硫酸、恰好反应完全,由可求出,B项正确;
C.
由B分析可知,C项正确;
D.
由于没有限定温度、压强,无法计算氢气的体积,D项错误;
故选D。
9.D
【详解】
A.装置A是制备CO2的装置,可以用稀硫酸与碳酸氢钠反应制取CO2,区别于稀硫酸与碳酸钙,因产生的硫酸钙微溶而不能用于制备CO2气体,A正确;
B.装置B的作用是除去CO2中的HCl气体,选用饱和NaHCO3溶液,B正确;
C.A装置制备CO2的目的是排净装置内的空气,防止Fe2+被氧化,澄清石灰水变浑浊,说明已经排净装置内的空气,可以打开b的旋塞,C正确;
D.装置D中澄清石灰水的作用一是检验装置内空气是否排净,二是水封,防止外界的空气进人反应装置将Fe2+氧化,D错误。
故选:D。
10.A
【详解】
A.生石灰极易吸水生成氢氧化钙,而乙醇的沸点低,蒸馏即可,A正确;
B.氯气能和NaOH溶液反应:Cl2+2NaOH=NaCl+NaClO+H2O,B错误;
C.苯和溴苯是互溶的,不能用苯萃取溴苯中的溴,应该用NaOH溶液除去溴苯中的溴,C错误;
D.应该加入饱和碳酸钠溶液后分液,乙酸乙酯和乙酸均能和氢氧化钠溶液反应,D错误;
答案选A。
【点睛】
在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则:不能引入新的杂质(水除外),即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中;分离提纯后的物质状态不变;实验过程和操作方法简单易行,即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则。
11.C
【详解】
A.实验室没有200
mL规格的容量瓶,应该选择250
mL容量瓶,选项A错误;
B.依据计算公式可计算得到该溶液溶质的浓度为0.5
mol/L,选项B错误;
C.在实验室用胆矾配制溶液,需在托盘天平上称取胆矾,选项C正确;
D.实验室配制该浓度溶液,若定容时俯视液面所加蒸馏水不足,体积偏小,导致所配溶液浓度偏大,选项D错误;
答案选C。
12.B
【详解】
原溶液中含有溶质的物质的量为
,要用来配制1
mol·L-1
NaOH溶液,则所得溶液的体积为
,而原溶液的体积为300mL,则应取原溶液与稀释后溶液的体积比约为1:5,故B项正确。
答案选B。
13.D
【详解】
A.未指明温度与压强,不能利用22.4L/mol计算1molO2的体积,A不正确;
B.28g丁烯所含碳原子数为2mol,28g乙烯所含碳原子数也为2mol,B不正确;
C.题中没有告诉0.1mol/LAlCl3溶液的体积,无法计算Cl-的物质的量,C不正确;
D.5.6gFe与足量C12反应,转移电子的物质的量为×3=0.3mol,D正确;
故选D。
14.A
【详解】
①被称量物与砝码的位置放颠倒了,会导致称量出的药品的质量变小,故所配溶液浓度偏低;
②滴定管量取液体时,开始时平视读数,结束时俯视读数,会导致所取溶液体积偏大,所配溶液浓度偏高;
③移液后烧杯及玻璃棒未用蒸馏水洗涤,会导致溶质的损失,故使所配溶液浓度偏低;
④转移溶液前容量瓶内有少量蒸馏水对所配溶液的浓度无影响;
⑤定容时,仰视容量瓶的刻度线,会导致溶液体积偏大,故使所配溶液浓度偏低;
故选:A。
15.C
【详解】
A.没有告诉Na2SO4溶液的体积,无法计算溶液中Na+和SO的物质的量之和,故A错误;
B.不是标况下,题中条件无法计算22.4L氨气的物质的量,则无法计算该溶液的物质的量浓度,故B错误;
C.10℃时0.35 mol L-1的KCl饱和溶液100 mL,蒸发掉5 g水,冷却到10℃时,其体积小于100 mL,但是此时仍然为饱和溶液,则它的物质的量浓度仍为0.35 mol L-1,故C正确;
D.配置480mL
0.2mol L﹣1的NaClO溶液,选取500ml容量瓶,需要NaClO固体的物质的量为0.1mol,质量为:0.1mol×74.5g/mol=7.45g,故D错误;
答案选C。
16.B
【详解】
A.根据仪器图示可知该仪器名称为研钵,不是坩埚,A错误;
B.图示仪器与名称吻合,B正确;
C.图示仪器名称为直形冷凝管,不是冷却管,C错误;
D.图示仪器名称为容量瓶,不是溶量瓶,要注意同音字的书写,D错误;
故合理选项是B。
17.bac
促进
2Cl--2e-===Cl2↑
升高
0.1mol/
L
NaCl+H2ONaClO+H2↑
ClO-
+H2OHClO+OH-
【分析】
(1)盐酸要放在最后,来除去过量的氢氧化钠和碳酸钠,要先加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除过量的钡离子;
(2)电解NaCl溶液时,水电离出来的氢离子在阴极反应,阳极上氯离子放电生成氯气;
(3)阴极电极反应式为
2H++2e-=H2↑,生成11.2L氢气消耗1mol氢离子,溶液中生成1mol氢氧根离子,据此分析;
(4)若采用无隔膜电解食盐水,Cl2和NaOH充分接触,产物是NaClO和H2,则阳极上氯离子放电生成次氯酸钠、阴极上氢离子放电,据此分析解答;
(5)NaClO是弱酸强碱盐,其水解导致溶液显碱性.
【详解】
(1)要先除硫酸根离子,然后再除钙离子,Na2CO3可以除去过量的钡离子,否则过量的钡离子不能完全除尽,至于加NaOH除去镁离子顺序不受限制,可放在加入BaCl2之前或之后,因为过量的NaOH加HCl就可以调节了,只要将三种离子完全除去,过滤即可,最后加HCl除去过量的氢氧根离子和碳酸根离子;
故答案为:bac;
(2)电解NaCl溶液时,水电离出来的氢离子在阴极反应,促进了水的电离,阳极上氯离子放电生成氯气,电极反应式为2Cl--2e-===Cl2↑;
故答案为:促进;
2Cl--2e-===Cl2↑;
(3)阴极电极反应式为
2H++2e-=H2↑,生成11.2L氢气即0.5mol氢气,消耗1mol氢离子,溶液中生成1mol氢氧根离子,所以pH升高,c(OH-)
=
1mol
÷
10L
=
0.1mol/L;
故答案为:升高;0.1mol/L;
(4)若采用无隔膜电解食盐水,Cl2和NaOH充分接触,产物是NaClO和H2,,则阳极上氯离子放电生成次氯酸钠、阴极上氢离子放电,电池反应式为NaCl+H2ONaClO+H2↑;
故答案为:NaCl+H2ONaClO+H2↑;
(5)NaClO是弱酸强碱盐,其水解导致溶液显碱性,水解方程式为ClO-
+H2OHClO+OH-,故答案为:ClO-
+H2OHClO+OH-。
【点睛】
本题考查原电池和电解池原理、电极反应式的书写、盐类水解,明确电极上得失电子及反应物质是解题关键,电极反应式的书写是学习难点,要注意结合电解质溶液的酸碱性书写,难度中等。
18.富集CO2
生成的K2CO3难分解产生CO2
CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=﹣49.5kJ/mol
水蒸气
适当加压有利于提高反应速率和原料利用率,但压强太高增大成本
K=
c(Ba2+)c(CO32﹣)
BaCO3的式量大,相对误差小
未配平两边电荷数
O2+2H2O+4e-=4
OH﹣
【分析】
(1)碳酸氢钾不稳定,加热时分解生成碳酸钾和二氧化碳、水,碳酸钾不分解;
(2)4.4kgCO2的物质的量是100mol,100mol二氧化碳和足量氢气反应放出4947KJ热量,据此计算1mol二氧化碳与足量氢气反应放出的热量,从而写出其热化学反应方程式;根据合成甲醇的方程可知,反应生成甲醇和水蒸气,水蒸气可以给碳酸氢钾分解提供能量;
(3)合成甲醇的反应为体积减小的反应,增大压强平衡正移;
(4)①溶解平衡方程式书写平衡常数表达式;
②重量法测定空气中CO2的体积分数,要求称量准确,误差小;
(5)书写离子方程式要注意原子守恒和电荷守恒;
(6)碱性甲醇燃料电池中,甲醇在负极失电子,氧气在正极得电子。
【详解】
(1)在整个生产过程中饱和K2CO3溶液的作用是富集二氧化碳,二氧化碳和饱和的碳酸钾溶液反应生成碳酸氢钾,碳酸氢钾不稳定,加热时分解生成碳酸钾、二氧化碳和水,KOH溶液与二氧化碳是碳酸钾,K2CO3难分解产生CO2;
(2)44gCO2的物质的量是1mol,1mol二氧化碳和足量氢气反应放出49.5kJ热量,所以其热化学反应方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=﹣49.5kJ/mol;根据合成甲醇的方程可知,反应生成甲醇和水蒸气,水蒸气可以给碳酸氢钾分解提供能量,所以转化过程中可循环利用的物质除了K2CO3外,还有水蒸气;
(3)合成甲醇的反应为体积减小的反应,增大压强平衡正移,有利于提高反应速率和原料利用率,但是压强太高对反应的设备要求很高,又提高了生产成本,所以不能太高;
4)①BaCO3的溶解平衡可以表示为
BaCO3(s) Ba2++CO32﹣,平衡常数表达式为K=
c(Ba2+)c(CO32﹣);
②重量法测定空气中CO2的体积分数,要求称量准确,误差小,BaCO3的式量大,称量的相对误差小;
(5)书写离子方程式要注意原子守恒和电荷守恒,4Na0.5Ca0.5Al1.5Si2.5O6+6CO2+17H2O=2Na++2Ca2++5HCO3﹣+4H4SiO4+3Al2SiO5(OH)4中电荷不守恒,原子个数也不守恒,所以离子方程式错误;
(6)碱性甲醇燃料电池中,甲醇在负极失电子,氧气在正极得电子生成氢氧根离子,则正极反应式为:O2+2H2O+4e-=4OH﹣。
19.石墨和塑料
H2O2不稳定,温度高于80℃会促进H2O2分解,产率降低,温度低于80℃反应速率又太小
2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O
BD
趁热过滤
4.0×10-3
【分析】
废旧电池粉碎后进行热处理,石墨与氧气反应生成二氧化碳,塑料与氧气反应也生成气体,固体中Al与氢氧化钠溶液反应生成偏铝酸钠和氢气,滤渣钴酸锂(LiCoO2)与硫酸、双氧水反应生成硫酸锂和硫酸钴,向混合液中加入草酸铵,得到草酸钴沉淀,煅烧得到四氧化三钴,过滤,向滤液中加入碳酸钠生成碳酸锂。
【详解】
(1)粉碎废旧电池后热处理,石墨与氧气反应生成二氧化碳,塑料与氧气反应,因此可以除去石墨和塑料;故答案为:石墨和塑料。
(2)用硫酸酸浸时要控制温度为80℃,钴酸锂(LiCoO2)与硫酸、双氧水反应,双氧水不稳定,在温度较高时易分解,会降低产率,温度低于80℃反应速率又太小,酸浸时LiCoO2与H2O2、H2SO4反应生成Li2SO4、CoSO4、O2和H2O,因此发生的主要氧化还原反应的化学方程式2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O;故答案为:H2O2不稳定,温度高于80℃会促进H2O2分解,产率降低,温度低于80℃反应速率又太小;2LiCoO2+H2O2+3H2SO4
=
Li2SO4+2CoSO4+O2↑+4H2O。
(3)在空气中煅烧二水合草酸钴需要用到的仪器是酒精灯,三脚架、泥三角、坩埚、坩埚钳、玻璃棒等,故答案为BD。
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见表,碳酸锂的溶解度随温度升高而逐渐降低,因此为了减少碳酸锂的损失,图中“操作”应为蒸发结晶、趁热过滤,90℃时Li2CO3的浓度为0.10
mol·L 1,电离出的c(Li+)=0.2
mol·L 1,c(CO32 )=0.1
mol·L 1,因此Ksp(Li2CO3)=0.22×0.1=4.0×10 3;故答案为:趁热过滤;4.0×10 3。
【点睛】
化工流程是常考题型,主要考查工艺流程、实际工艺中的分析、氧化还原反应方程式、实验仪器、溶度积的计算等。
20.TiO2++2H2OH2TiO3↓+2H+
2Fe3++Fe=3Fe2+
H2SO4+2NH3·H2O=(NH4)2SO4+2H2O、FeSO4+2NH3·H2O=Fe(OH)2↓+(NH4)2SO4,4Fe(OH)2+O2+2H2O=4Fe(OH)3
2Fe(OH)3Fe2O3+3H2O
(NH4)2SO4
冷却结晶
过滤
【分析】
“精制”步骤加入铁屑,发生Fe+2Fe3+=3Fe2+,将Fe3+转化成Fe2+,根据问题(1),Ti元素转化成H2TiO3沉淀,过滤1,得到滤渣1为H2TiO3和过量的铁屑,滤液为FeSO4,“氧化”步骤中Fe2++2NH3·H2O=Fe(OH)2↓+2,4Fe(OH)2+O2+2H2O=4Fe(OH)3,滤渣2为Fe(OH)3,氢氧化铁加热得到铁红(Fe2O3),滤液中主要溶质为(NH4)2SO4,据此分析;
【详解】
(1)TiOSO4溶于水,在水中可以电离为TiO2+和SO,“精制”过程中Ti元素与水作用生成H2TiO3沉淀,其离子方程式为TiO2++2H2OH2TiO3↓+2H+;硫酸亚铁中含有少量的Fe2(SO4)3,加入铁屑的目的是将Fe3+转化成Fe2+,其离子方程式为Fe+2Fe3+=3Fe2+;
故答案为TiO2++2H2OH2TiO3↓+2H+;Fe+2Fe3+=3Fe2+;
(2)过滤1后的溶液中含有Fe2+、SO,“氧化”步骤中发生的反应有Fe2++2NH3·H2O=Fe(OH)2↓+2,4Fe(OH)2+O2+2H2O=4Fe(OH)3;
故答案为FeSO4+2NH3·H2O=Fe(OH)2↓+(NH4)2SO4,4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)氢氧化铁不稳定,受热分解成Fe2O3,其反应的化学方程式为2Fe(OH)3Fe2O3+3H2O;
故答案为2Fe(OH)3Fe2O3+3H2O;
(4)根据上述分析,M应为(NH4)2SO4;从滤液中获得(NH4)2SO4,需要蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
故答案为(NH4)2SO4;冷却结晶;过滤。
