吉林省延边第二重点高中2020-2021学年高一下学期期末考试化学试题(Word版含答案)
文档属性
| 名称 | 吉林省延边第二重点高中2020-2021学年高一下学期期末考试化学试题(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 962.5KB | ||
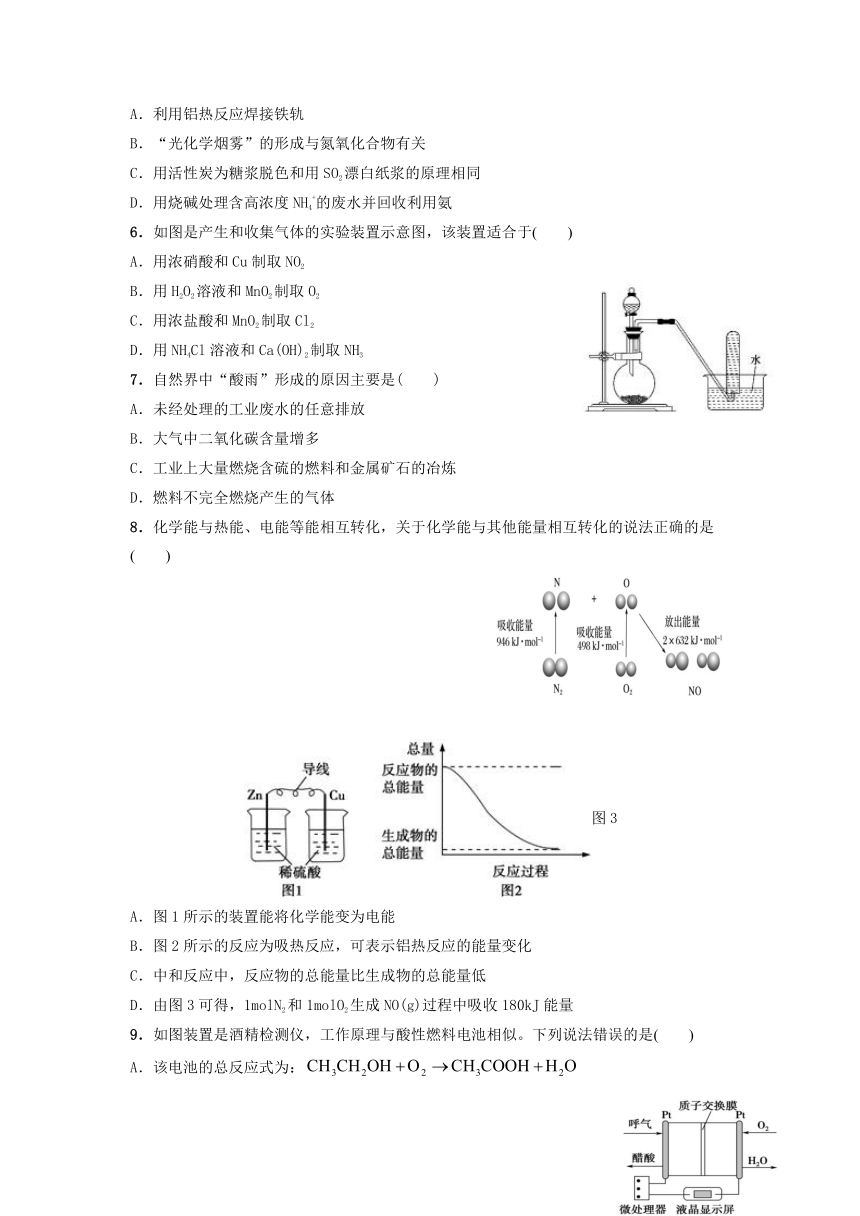
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-04 09:18:32 | ||
图片预览




文档简介
延边第二中学2020~2021学年度第二学期期末考试
高一年级化学学科试卷
考试说明:本试卷分第Ⅰ卷(选择题60分)和第Ⅱ卷(非选择题55分),试卷共8页,共30小题,总分115分,考试时间100分钟。可能用到的相对原子质量:H:1
C:12
N:14
O:16
Zn:65
Ⅰ部分(共60分)
单项选择题(15小题,每小题2分,共30分)
1.化学在人类生活中扮演着重要角色,下列说法正确的是( )
A.聚乙烯塑料不会对环境造成污染
B.与煤、柴油相比较,天然气是一种比较清洁的化石燃料
C.通过蒸发可从海水中提取溴、碘、镁
D.煤经过气化和液化等物理变化可以转化为清洁燃料
2.结构简式为的高聚物的单体是( )
A.和
B.和
C.
D.
3.某实验小组探究乙醇氧化反应,实验装置如图所示,以下叙述错误的是( )
A.在总反应中乙醇被氧化,而铜并未消耗
B.甲烧杯中为热水,乙烧杯中为冰水
C.试管a收集到的液体是纯净物
D.水槽中集气瓶收集到的气体:>4
4.下列反应中热量变化与图像不一致的是( )
A.CO与O2反应
B.NaOH溶液和HNO3溶液反应
C.镁条和盐酸反应
D.NH4Cl晶体和Ba(OH)2·8H2O晶体反应
5.
化学与人类生产、生活密切相关,下列有关说法错误的是( )
A.利用铝热反应焊接铁轨
B.“光化学烟雾”的形成与氮氧化合物有关
C.用活性炭为糖浆脱色和用SO2漂白纸浆的原理相同
D.用烧碱处理含高浓度NH4+的废水并回收利用氨
6.如图是产生和收集气体的实验装置示意图,该装置适合于( )
A.用浓硝酸和Cu制取NO2
B.用H2O2溶液和MnO2制取O2
C.用浓盐酸和MnO2制取Cl2
D.用NH4Cl溶液和Ca(OH)2制取NH3
7.自然界中“酸雨”形成的原因主要是( )
A.未经处理的工业废水的任意排放
B.大气中二氧化碳含量增多
C.工业上大量燃烧含硫的燃料和金属矿石的冶炼
D.燃料不完全燃烧产生的气体
8.化学能与热能、电能等能相互转化,关于化学能与其他能量相互转化的说法正确的是( )
图3
A.图1所示的装置能将化学能变为电能
B.图2所示的反应为吸热反应,可表示铝热反应的能量变化
C.中和反应中,反应物的总能量比生成物的总能量低
D.由图3可得,1molN2和1molO2生成NO(g)过程中吸收180kJ能量
9.如图装置是酒精检测仪,工作原理与酸性燃料电池相似。下列说法错误的是( )
A.该电池的总反应式为:
B.当右侧Pt电极表面有0.2mol发生还原反应时,会有0.8mol向左移动
C.电流由所在的铂电极经外电路流向另一电极
D.该装置实现了化学能转化为电能
10.一定温度下,反应N2(g)+O2(g) 2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是( )
A.缩小体积使压强增大
B.恒容,充入N2
C.恒容,充入He
D.恒压,充入He
11.用如右图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )
A.上下移动①中铜丝可控制SO2的量
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确认CuSO4生成,向①中加水,观察颜色
12.下列化学反应的离子方程式正确的是( )
A.在稀氨水中通入过量
CO2
:2NH3·H2O+CO2=2NH+CO+2H2O
B.少量
SO2
通入
Ca(ClO)2
溶液中:SO2+H2O+Ca2++2ClO-=CaSO3+2HClO
C.碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH+OH-=NH3+H2O
D.KHCO3
溶液中加入NaHSO4
溶液:HCO+H+=H2O+CO2↑
13.工业制硫酸中的一步重要反应是SO2在400-500℃下的催化氧化:,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是( )
A.在上述条件下,SO2不可能100%地转化为SO3
B.使用催化剂是为了加快反应速率,提高生产效率
C.达到平衡时,SO2与O2的浓度比始终保持2:1
D.为了提高SO2的转化率,可以适当提高O2的浓度
14.某有机物的结构简式如图所示,下列说法错误的是( )
A.该有机物可以与溴水发生加成反应
B.该有机物可以与乙酸发生酯化反应
C.该有机物既能与Na反应,还能与NaOH、Na2CO3反应
D.1mol该有机物最多可以和6molH2发生加成反应
15.普通锌锰干电池的简图如图,该电池工作时的总反应为。关于锌锰干电池的下列说法中正确的是( )
A.当该电池电压逐渐下降后,能重新充电复原
B.电池工作一段时间后,碳棒会逐渐变细
C.电池工作时,电流由负极通过外电路流向正极
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
二、单项选择题(10小题,每小题3分,共30分)
16.A是一种正盐,D相对分子质量比C相对分子质量大16,E是酸,当X无论是强酸还是强碱时都有如图转化关系。当X是强酸时,A、B、C、D、E均含有同一种元素;当X是强碱时,A、B、C、D、E均含有另一种元素;下列说法错误的是( )
A.D生成E的反应可能是氧化还原反应
B.当X是强碱时,C在常温下是气态单质
C.当X是强酸时,E是H2SO4
D.当X是强碱时,E是HNO3
17.足量的铜与一定量的浓硝酸充分反应,得到4.48L(标准状况)NO2与NO的混合气体,这些气体与一定体积的O2混合后通入水中,恰好被完全吸收生成硝酸。向所得硝酸铜溶液中加入100mL4mol·L-1NaOH溶液,Cu2+恰好沉淀完全。下列说法正确的是( )
A.此反应过程中转移了0.5mol的电子
B.消耗氧气的体积为1.12L(标准状况)
C.参加反应的HNO3是0.4mol
D.混合气体中含2.24L(标准状况)NO
18.下列说法中正确的是( )
A.
已知t1
℃时,反应C+CO22CO ΔH>0的速率为v,若升高温度,逆反应速率减小
B.
恒压容器中发生反应N2+O22NO,若在容器中充入He,正、逆反应的速率均不变
C.
当一定量的锌粉和过量的6
mol·L-1盐酸反应时,为了减慢反应速率,又不影响产生H2的总量,可向反应器中加入一些水、CH3COONa溶液或NaNO3溶液
D.
对任何一个化学反应,温度发生变化,化学反应速率一定发生变化
19.根据所学知识和右图(能量变化示意图),判断下列说法正确的是( )
A.断开1molHCl(g)中的H-Cl键需要吸收bkJ能量
B.反应H2(g)+Cl2(g)=2HCl(g),反应物的总能量小于生成物的总能量
C.H2(g)+Cl2(g)=2HCl(g)生成2mol氯化氢气体放出(b-a)kJ热量
D.2molHCl(l)分解成lmolH2(g)和1molCl2(g)需要吸收ckJ热量
20.2SO2(g)+O2(g)2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
A.催化剂V2O5不改变该反应的逆反应速率
B.恒压,通入稀有气体,反应速率不变
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是cl、c2,则时间间隔t1 t2内,SO2(g)消耗的平均速率为
v=
21.研究HCOOH燃料电池性能的装置如图所示,两电极区间用允许K+、H+通过的离子交换膜隔开,下列说法错误的是( )
A.该燃料电池的总反应方程式为:HCOOH+Fe3+=CO2↑+H2O+Fe2+
B.放电过程中,K+向右移动
C.放电过程中需要补充的物质A为H2SO4
D.电池负极电极反应式为:HCOO-+2OH--2e-=+H2O
22.已知4NH3+5O2=4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示。则正确的关系是( )
A.v(NH3)=v(O2)
B.v(O2)=v(H2O)
C.v(NH3)=v(H2O)
D.v(O2)=v(NO)
23.如图所示是某短周期元素的“价类二维图”,该元素最高正价和最低负价之和为4,f、h均为正盐,且焰色实验的火焰颜色与食盐水的焰色实验火焰颜色相同,下列说法正确的是( )
A.h只具有还原性
B.d能使品红溶液褪色
C.e的浓溶液不能与非金属单质反应
D.a和c反应可以生成b
24.有一化学平衡mA(g)+nB(g)
pC(g)+qD(g),如图所示的是A的转化率与压强、温度的关系。下列叙述正确的是( )
A.正反应是放热反应;m+n>p+q
B.正反应是吸热反应;m+nC.正反应是放热反应;m+nD.正反应是吸热反应;m+n>p+q
25.氨基甲酸铵分解反应为NH2COONH4(s)2NH3(g)+CO2(g),在一体积恒定的容器里,发生上面的反应,可以判断该反应已经达到平衡的是( )
A.密闭容器中氨气的体积分数不变
B.1
mol
NH2COONH4分解同时有17g
NH3消耗
C.密闭容器中混合气体的密度不变
D.混合气体的平均相对分子质量不变
Ⅱ部分(共55分)
三、填空题(共40分)
26.Ⅰ(4分)
一定温度下,在容积为2L的密闭容器中进行反应:aN(g)bM(g),M、N的物质的量随时间的变化曲线如下图所示:
(1)此反应的化学方程式中,已知计量系数比为最简整数比,则b=______。
(2)若t2-t1=10
min,则从t1到t2时刻,以M的浓度变化表示该反应的平均反应速率,计算出来的结果为_____________mol/(L·min)。
Ⅱ
(6分)一定条件下,向2L恒容密闭容器中充入1mol
PCl5,发生反应:PCl5(g)PCl3(g)+Cl2(g)反应过程中测定的部分数据见表(反应过程中条件不变);
t/s
0
60
150
250
350
450
n(PCl3)/mol
0
0.12
0.19
0.2
0.2
x
请回答下列问题:
(1)x的值是__________。
(2)60s时,PCl5的转化率是___________。
(4)达平衡时,容器中Cl2的体积分数是________________(结果保留一位小数)
27.(10分)铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3、MgO。工业上从铝土矿中提取铝可采用如下工艺流程:
请回答下列问题:
(1)沉淀B的成分是____________(填化学式,下同);
(2)沉淀C的成分是__________;
(3)沉淀F转化为物质M的化学方程式为_____________________________________________;
(4)由物质M制取铝的化学方程式为_________________________________________________;
(5)溶液D中通入过量CO2生成沉淀F的离子方程式为__________________________________。
28.(共10分)工业中很多重要的化工原料都来源于石油化工,如图中的对二甲苯、丙烯、有机物A等,其中
A
的产量可以用来衡量一个国家的石油化工发展水平。请回答下列问题:
(1)对苯二甲酸的分子式为
_____________,丙烯酸中含氧官能团的名称为________________
(2)B和CH3COOH生成乙酸乙酯的反应类型为_________________________;等质量的A和乙烷完全燃烧后,耗氧量:A
______________B(填“>”、“<”或“=”)。
(3)下列说法正确的是__________
A.分馏属于物理变化,催化重整属于化学变化
B.A与丙烯互为同系物,乙酸与丙烯酸也互为同系物
C.除去乙酸乙酯中的乙酸,加饱和碳酸钠溶液、分液
D.聚丙烯酸甲酯能够使酸性高锰酸钾溶液褪色
(4)对二甲苯的苯环上的二氯代物有____种。
(5)写出下列反应的化学方程式:B→
CH3CHO____________________________________________,丙烯酸→丙烯酸甲酯________________________________________________________________
29.(10分)某学习小组用氨催化氧化法(已知:)在实验室模拟制硝酸,设计如图2所示装置。
(1)写出实验室以图1装置A作发生装置制备氨气的化学方程式_____________________。
(2)仪器B的名称是__________________。
(3)按图2所示连接好装置,首先_________________________,接着装好药品,按一定比例通入氧气、氨气,在催化剂、加热条件下反应。
(4)若没有装置D,可以观察到F中有白烟生成,则白烟成分是_____________
(写化学式)。装置D盛放的试剂是_____________
(写名称)。
附加题(共15分)
30.
Ⅰ(9分)已知碳化铝(Al4C3)与水反应生成氢氧化铝和甲烷。为了探究甲烷性质,某同学设计如下实验方案:
甲方案:探究甲烷与氧化剂反应(如图1所示);
乙方案:探究甲烷与氯气反应的条件(如图2所示)。
甲方案实验现象:溴水不褪色,无水硫酸铜变蓝色,澄清石灰水变浑浊。
乙方案实验操作过程:通过排饱和食盐水的方法收集两瓶甲烷与氯气(体积比为1:4)的混合气体,I瓶放在光亮处,II瓶用预先准备好的黑色纸套套上,按图2安装好装置,并加紧弹簧夹a和b。
(1)碳化铝与稀硫酸反应的化学方程式为________________________________________。
(2)—段时间后,观察到图2装置中出现的实验现象是
____________________________;然后打开弹簧夹a、b,现察到的实验现象是_________________________________________________。
Ⅱ(3分)已知X(g)和Y(g)可以相互转化:2X(g)Y(g) 反应正向放热。现将一定量X(g)和Y(g)的混合气体通入体积为1L的恒温恒容密闭容器中,反应物及生成物的浓度随时间变化的关系如图所示。则下列说法不正确的是( )
A.若混合气体的压强不变,则说明反应已达化学平衡状态
B.a、b、c、d四个点表示的反应体系中,表示化学反应处于平衡状态的只有b点
C.25~30min内用X表示的平均化学反应速率是0.08mol·L-1·min-1
D.反应进行至25min时,曲线发生变化的原因是增加Y的浓度
Ⅲ(3分)在“绿色化学工艺”中,理想状态是原子利用率为100%。在用CH3C≡CH合成CH2===C(CH3)COOCH3的过程中,欲使原子利用率达到最高,还需要其他的反应物有( )
A.CO和CH3OH
B.CO2和H2O
C.H2和CO2
D.CH3OH和H2
1-25.【答案】BBCDC
BCDBC
DDCDD
BDDCD
ADDDC
26.
(每空2分)
1
0.05
0.2
12%
16.7%
27.
(每空2分)(1)SiO2
(2)Fe(OH)3、Mg(OH)2
(3)
2Al(OH)3Al2O3+3H2O
(4)2Al2O3(熔融)4Al+3O2↑
(5)AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
28.
(前6个空每空1分,后2个空每空2分,)(1)C8H6O4
羧基
(2)
酯化反应
<
(3)A、C
(4)3
(5)
2CH3CH2OH
+
O2
2CH3CHO
+
2H2O
CH2=CHCOOH
+
CH3OHCH2=CHCOOCH3
+
H2O
29.
(每空2分)(1)
(2)(球形)干燥管
(3)检查装置的气密性
(4)NH4NO3
浓硫酸
30.
(每空3分)Ⅰ(1)Al4C3+6H2SO4=2Al2(SO4)3+3CH4↑
(2)在I瓶中,气体颜色逐渐变浅,瓶壁上出现油状液滴,II瓶中无现象。水倒吸入I瓶中,同时I瓶中出现少量白雾,II瓶中无现象。
ⅡD
ⅢA
高一年级化学学科试卷
考试说明:本试卷分第Ⅰ卷(选择题60分)和第Ⅱ卷(非选择题55分),试卷共8页,共30小题,总分115分,考试时间100分钟。可能用到的相对原子质量:H:1
C:12
N:14
O:16
Zn:65
Ⅰ部分(共60分)
单项选择题(15小题,每小题2分,共30分)
1.化学在人类生活中扮演着重要角色,下列说法正确的是( )
A.聚乙烯塑料不会对环境造成污染
B.与煤、柴油相比较,天然气是一种比较清洁的化石燃料
C.通过蒸发可从海水中提取溴、碘、镁
D.煤经过气化和液化等物理变化可以转化为清洁燃料
2.结构简式为的高聚物的单体是( )
A.和
B.和
C.
D.
3.某实验小组探究乙醇氧化反应,实验装置如图所示,以下叙述错误的是( )
A.在总反应中乙醇被氧化,而铜并未消耗
B.甲烧杯中为热水,乙烧杯中为冰水
C.试管a收集到的液体是纯净物
D.水槽中集气瓶收集到的气体:>4
4.下列反应中热量变化与图像不一致的是( )
A.CO与O2反应
B.NaOH溶液和HNO3溶液反应
C.镁条和盐酸反应
D.NH4Cl晶体和Ba(OH)2·8H2O晶体反应
5.
化学与人类生产、生活密切相关,下列有关说法错误的是( )
A.利用铝热反应焊接铁轨
B.“光化学烟雾”的形成与氮氧化合物有关
C.用活性炭为糖浆脱色和用SO2漂白纸浆的原理相同
D.用烧碱处理含高浓度NH4+的废水并回收利用氨
6.如图是产生和收集气体的实验装置示意图,该装置适合于( )
A.用浓硝酸和Cu制取NO2
B.用H2O2溶液和MnO2制取O2
C.用浓盐酸和MnO2制取Cl2
D.用NH4Cl溶液和Ca(OH)2制取NH3
7.自然界中“酸雨”形成的原因主要是( )
A.未经处理的工业废水的任意排放
B.大气中二氧化碳含量增多
C.工业上大量燃烧含硫的燃料和金属矿石的冶炼
D.燃料不完全燃烧产生的气体
8.化学能与热能、电能等能相互转化,关于化学能与其他能量相互转化的说法正确的是( )
图3
A.图1所示的装置能将化学能变为电能
B.图2所示的反应为吸热反应,可表示铝热反应的能量变化
C.中和反应中,反应物的总能量比生成物的总能量低
D.由图3可得,1molN2和1molO2生成NO(g)过程中吸收180kJ能量
9.如图装置是酒精检测仪,工作原理与酸性燃料电池相似。下列说法错误的是( )
A.该电池的总反应式为:
B.当右侧Pt电极表面有0.2mol发生还原反应时,会有0.8mol向左移动
C.电流由所在的铂电极经外电路流向另一电极
D.该装置实现了化学能转化为电能
10.一定温度下,反应N2(g)+O2(g) 2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是( )
A.缩小体积使压强增大
B.恒容,充入N2
C.恒容,充入He
D.恒压,充入He
11.用如右图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )
A.上下移动①中铜丝可控制SO2的量
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确认CuSO4生成,向①中加水,观察颜色
12.下列化学反应的离子方程式正确的是( )
A.在稀氨水中通入过量
CO2
:2NH3·H2O+CO2=2NH+CO+2H2O
B.少量
SO2
通入
Ca(ClO)2
溶液中:SO2+H2O+Ca2++2ClO-=CaSO3+2HClO
C.碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH+OH-=NH3+H2O
D.KHCO3
溶液中加入NaHSO4
溶液:HCO+H+=H2O+CO2↑
13.工业制硫酸中的一步重要反应是SO2在400-500℃下的催化氧化:,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是( )
A.在上述条件下,SO2不可能100%地转化为SO3
B.使用催化剂是为了加快反应速率,提高生产效率
C.达到平衡时,SO2与O2的浓度比始终保持2:1
D.为了提高SO2的转化率,可以适当提高O2的浓度
14.某有机物的结构简式如图所示,下列说法错误的是( )
A.该有机物可以与溴水发生加成反应
B.该有机物可以与乙酸发生酯化反应
C.该有机物既能与Na反应,还能与NaOH、Na2CO3反应
D.1mol该有机物最多可以和6molH2发生加成反应
15.普通锌锰干电池的简图如图,该电池工作时的总反应为。关于锌锰干电池的下列说法中正确的是( )
A.当该电池电压逐渐下降后,能重新充电复原
B.电池工作一段时间后,碳棒会逐渐变细
C.电池工作时,电流由负极通过外电路流向正极
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
二、单项选择题(10小题,每小题3分,共30分)
16.A是一种正盐,D相对分子质量比C相对分子质量大16,E是酸,当X无论是强酸还是强碱时都有如图转化关系。当X是强酸时,A、B、C、D、E均含有同一种元素;当X是强碱时,A、B、C、D、E均含有另一种元素;下列说法错误的是( )
A.D生成E的反应可能是氧化还原反应
B.当X是强碱时,C在常温下是气态单质
C.当X是强酸时,E是H2SO4
D.当X是强碱时,E是HNO3
17.足量的铜与一定量的浓硝酸充分反应,得到4.48L(标准状况)NO2与NO的混合气体,这些气体与一定体积的O2混合后通入水中,恰好被完全吸收生成硝酸。向所得硝酸铜溶液中加入100mL4mol·L-1NaOH溶液,Cu2+恰好沉淀完全。下列说法正确的是( )
A.此反应过程中转移了0.5mol的电子
B.消耗氧气的体积为1.12L(标准状况)
C.参加反应的HNO3是0.4mol
D.混合气体中含2.24L(标准状况)NO
18.下列说法中正确的是( )
A.
已知t1
℃时,反应C+CO22CO ΔH>0的速率为v,若升高温度,逆反应速率减小
B.
恒压容器中发生反应N2+O22NO,若在容器中充入He,正、逆反应的速率均不变
C.
当一定量的锌粉和过量的6
mol·L-1盐酸反应时,为了减慢反应速率,又不影响产生H2的总量,可向反应器中加入一些水、CH3COONa溶液或NaNO3溶液
D.
对任何一个化学反应,温度发生变化,化学反应速率一定发生变化
19.根据所学知识和右图(能量变化示意图),判断下列说法正确的是( )
A.断开1molHCl(g)中的H-Cl键需要吸收bkJ能量
B.反应H2(g)+Cl2(g)=2HCl(g),反应物的总能量小于生成物的总能量
C.H2(g)+Cl2(g)=2HCl(g)生成2mol氯化氢气体放出(b-a)kJ热量
D.2molHCl(l)分解成lmolH2(g)和1molCl2(g)需要吸收ckJ热量
20.2SO2(g)+O2(g)2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
A.催化剂V2O5不改变该反应的逆反应速率
B.恒压,通入稀有气体,反应速率不变
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是cl、c2,则时间间隔t1 t2内,SO2(g)消耗的平均速率为
v=
21.研究HCOOH燃料电池性能的装置如图所示,两电极区间用允许K+、H+通过的离子交换膜隔开,下列说法错误的是( )
A.该燃料电池的总反应方程式为:HCOOH+Fe3+=CO2↑+H2O+Fe2+
B.放电过程中,K+向右移动
C.放电过程中需要补充的物质A为H2SO4
D.电池负极电极反应式为:HCOO-+2OH--2e-=+H2O
22.已知4NH3+5O2=4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示。则正确的关系是( )
A.v(NH3)=v(O2)
B.v(O2)=v(H2O)
C.v(NH3)=v(H2O)
D.v(O2)=v(NO)
23.如图所示是某短周期元素的“价类二维图”,该元素最高正价和最低负价之和为4,f、h均为正盐,且焰色实验的火焰颜色与食盐水的焰色实验火焰颜色相同,下列说法正确的是( )
A.h只具有还原性
B.d能使品红溶液褪色
C.e的浓溶液不能与非金属单质反应
D.a和c反应可以生成b
24.有一化学平衡mA(g)+nB(g)
pC(g)+qD(g),如图所示的是A的转化率与压强、温度的关系。下列叙述正确的是( )
A.正反应是放热反应;m+n>p+q
B.正反应是吸热反应;m+n
25.氨基甲酸铵分解反应为NH2COONH4(s)2NH3(g)+CO2(g),在一体积恒定的容器里,发生上面的反应,可以判断该反应已经达到平衡的是( )
A.密闭容器中氨气的体积分数不变
B.1
mol
NH2COONH4分解同时有17g
NH3消耗
C.密闭容器中混合气体的密度不变
D.混合气体的平均相对分子质量不变
Ⅱ部分(共55分)
三、填空题(共40分)
26.Ⅰ(4分)
一定温度下,在容积为2L的密闭容器中进行反应:aN(g)bM(g),M、N的物质的量随时间的变化曲线如下图所示:
(1)此反应的化学方程式中,已知计量系数比为最简整数比,则b=______。
(2)若t2-t1=10
min,则从t1到t2时刻,以M的浓度变化表示该反应的平均反应速率,计算出来的结果为_____________mol/(L·min)。
Ⅱ
(6分)一定条件下,向2L恒容密闭容器中充入1mol
PCl5,发生反应:PCl5(g)PCl3(g)+Cl2(g)反应过程中测定的部分数据见表(反应过程中条件不变);
t/s
0
60
150
250
350
450
n(PCl3)/mol
0
0.12
0.19
0.2
0.2
x
请回答下列问题:
(1)x的值是__________。
(2)60s时,PCl5的转化率是___________。
(4)达平衡时,容器中Cl2的体积分数是________________(结果保留一位小数)
27.(10分)铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3、MgO。工业上从铝土矿中提取铝可采用如下工艺流程:
请回答下列问题:
(1)沉淀B的成分是____________(填化学式,下同);
(2)沉淀C的成分是__________;
(3)沉淀F转化为物质M的化学方程式为_____________________________________________;
(4)由物质M制取铝的化学方程式为_________________________________________________;
(5)溶液D中通入过量CO2生成沉淀F的离子方程式为__________________________________。
28.(共10分)工业中很多重要的化工原料都来源于石油化工,如图中的对二甲苯、丙烯、有机物A等,其中
A
的产量可以用来衡量一个国家的石油化工发展水平。请回答下列问题:
(1)对苯二甲酸的分子式为
_____________,丙烯酸中含氧官能团的名称为________________
(2)B和CH3COOH生成乙酸乙酯的反应类型为_________________________;等质量的A和乙烷完全燃烧后,耗氧量:A
______________B(填“>”、“<”或“=”)。
(3)下列说法正确的是__________
A.分馏属于物理变化,催化重整属于化学变化
B.A与丙烯互为同系物,乙酸与丙烯酸也互为同系物
C.除去乙酸乙酯中的乙酸,加饱和碳酸钠溶液、分液
D.聚丙烯酸甲酯能够使酸性高锰酸钾溶液褪色
(4)对二甲苯的苯环上的二氯代物有____种。
(5)写出下列反应的化学方程式:B→
CH3CHO____________________________________________,丙烯酸→丙烯酸甲酯________________________________________________________________
29.(10分)某学习小组用氨催化氧化法(已知:)在实验室模拟制硝酸,设计如图2所示装置。
(1)写出实验室以图1装置A作发生装置制备氨气的化学方程式_____________________。
(2)仪器B的名称是__________________。
(3)按图2所示连接好装置,首先_________________________,接着装好药品,按一定比例通入氧气、氨气,在催化剂、加热条件下反应。
(4)若没有装置D,可以观察到F中有白烟生成,则白烟成分是_____________
(写化学式)。装置D盛放的试剂是_____________
(写名称)。
附加题(共15分)
30.
Ⅰ(9分)已知碳化铝(Al4C3)与水反应生成氢氧化铝和甲烷。为了探究甲烷性质,某同学设计如下实验方案:
甲方案:探究甲烷与氧化剂反应(如图1所示);
乙方案:探究甲烷与氯气反应的条件(如图2所示)。
甲方案实验现象:溴水不褪色,无水硫酸铜变蓝色,澄清石灰水变浑浊。
乙方案实验操作过程:通过排饱和食盐水的方法收集两瓶甲烷与氯气(体积比为1:4)的混合气体,I瓶放在光亮处,II瓶用预先准备好的黑色纸套套上,按图2安装好装置,并加紧弹簧夹a和b。
(1)碳化铝与稀硫酸反应的化学方程式为________________________________________。
(2)—段时间后,观察到图2装置中出现的实验现象是
____________________________;然后打开弹簧夹a、b,现察到的实验现象是_________________________________________________。
Ⅱ(3分)已知X(g)和Y(g)可以相互转化:2X(g)Y(g) 反应正向放热。现将一定量X(g)和Y(g)的混合气体通入体积为1L的恒温恒容密闭容器中,反应物及生成物的浓度随时间变化的关系如图所示。则下列说法不正确的是( )
A.若混合气体的压强不变,则说明反应已达化学平衡状态
B.a、b、c、d四个点表示的反应体系中,表示化学反应处于平衡状态的只有b点
C.25~30min内用X表示的平均化学反应速率是0.08mol·L-1·min-1
D.反应进行至25min时,曲线发生变化的原因是增加Y的浓度
Ⅲ(3分)在“绿色化学工艺”中,理想状态是原子利用率为100%。在用CH3C≡CH合成CH2===C(CH3)COOCH3的过程中,欲使原子利用率达到最高,还需要其他的反应物有( )
A.CO和CH3OH
B.CO2和H2O
C.H2和CO2
D.CH3OH和H2
1-25.【答案】BBCDC
BCDBC
DDCDD
BDDCD
ADDDC
26.
(每空2分)
1
0.05
0.2
12%
16.7%
27.
(每空2分)(1)SiO2
(2)Fe(OH)3、Mg(OH)2
(3)
2Al(OH)3Al2O3+3H2O
(4)2Al2O3(熔融)4Al+3O2↑
(5)AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
28.
(前6个空每空1分,后2个空每空2分,)(1)C8H6O4
羧基
(2)
酯化反应
<
(3)A、C
(4)3
(5)
2CH3CH2OH
+
O2
2CH3CHO
+
2H2O
CH2=CHCOOH
+
CH3OHCH2=CHCOOCH3
+
H2O
29.
(每空2分)(1)
(2)(球形)干燥管
(3)检查装置的气密性
(4)NH4NO3
浓硫酸
30.
(每空3分)Ⅰ(1)Al4C3+6H2SO4=2Al2(SO4)3+3CH4↑
(2)在I瓶中,气体颜色逐渐变浅,瓶壁上出现油状液滴,II瓶中无现象。水倒吸入I瓶中,同时I瓶中出现少量白雾,II瓶中无现象。
ⅡD
ⅢA
同课章节目录
