原子的构成 马秀丽
图片预览






文档简介
(共22张PPT)
原子的构成
马秀丽
教材分析
教学过程
板书设计
教法和学法指导
教法分析
说课程序
教材分析
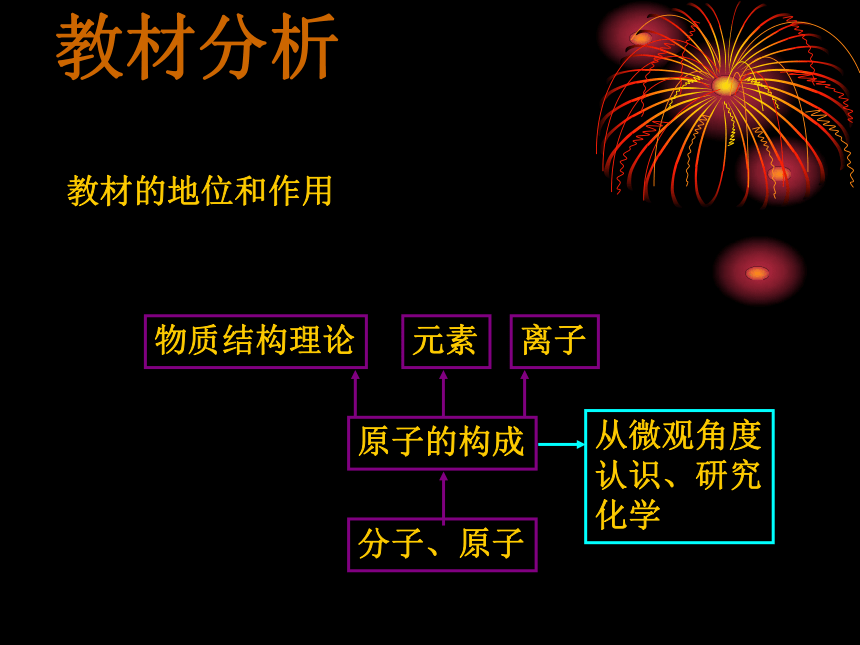
1、教材的地位和作用
本课题是在第三单元学习分子与原子知识后,对原子内部结构的进一步研究,既是对前面知识的延伸和深化,也是后面正确理解元素、离子等知识的必要铺垫,起到重要的承上启下作用。同时也有利于建立起“物质无限可分”的微观概念,逐步学会从微观的角度认识和研究化学。
原子的构成
元素
物质结构理论
离子
分子、原子
从微观角度
认识、研究
化学
教材分析
教材的地位和作用
教材分析
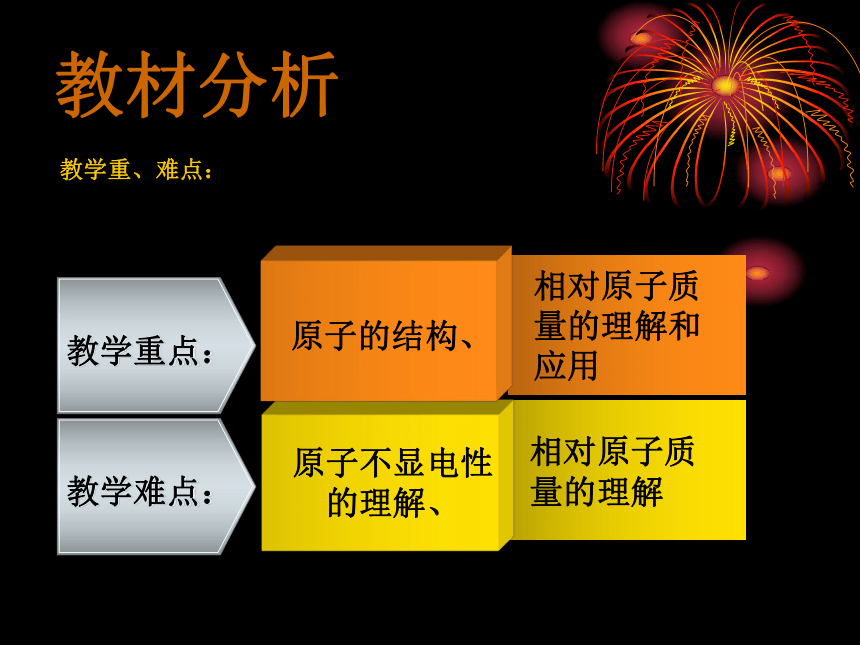
2、教学重、难点:
因为化学的学习中,对微观世界的认识才刚刚开始,对抽像的事物理解起来有一定的困难,而且根据本节对后续内容所起的重要作用,确定本节内容的重、难点为:
原子不显电性的理解、
教学重点:
教学难点:
相对原子质量的理解
原子的结构、
相对原子质量的理解和应用
教材分析
教学重、难点:
教材分析
新课标对本节的要求仅限于“了解”和“初步了解”水平层次,且学生已经对分子、原子的知识有一定程度的了解,但在学生心目中对原子还没有形成较完整的概念,而后继学习又必须是建立在原子内部结构知识的基础上的,因此,确定本节课的三维目标如下:
3、三维目标
教材分析
情感态度价值观:
过程与方法:
知识与技能:
Description of the contents
① 理解原子、原子核的构成,整个原子呈电中性。
②理解核电荷数、质子数和核外电子数的关系,并能进行简单的计算。
①充分发挥学生的空间想象力
②学习运用对比、归纳的方法在微观世界和宏观世界之间架起一座桥梁。
1)对学生进行物质可分性的辩证唯物主义观点教育。
2) 结合资料,培养爱国主义情感。
3.三维目标
教法分析
根据新课程“课堂教学是学生在教师指导下自主学习的过程”的理念,为培养学生自主学习的能力,结合本课题内容抽像的特点,在教学中采用:指导阅读与组织讨论相结合为主的探究性学习。
充分利用各种资料和手段,激发学生学习的兴趣,培养抽象思维和空间想象能力。
教法和学法指导
教学对象分析——说学生
加强过程与方法的培养
想象能力
求知欲
好奇心
良好的思维习惯
过程设计
本课题拟采用我校‘主动探究——分层递进’课堂教学模式。
创设情境
引入新课
深化质疑
归纳结论
课堂反馈
分层递进
带着问题
探究讨论
1、创设情境,引入新课
※温故知新
电解水的实验
回忆旧知识:
分子,原子的概念
化学变化的实质
原子是化学变化中的最小粒子。
※提出猜想
从原子弹爆炸
引出新知识:
原子可以再分
α 粒子束发生偏转示意图
α 粒子束(带正电)
1、绝大多数能够直接穿过,说明几乎没有遇到阻力,即:原子内有很大的空间
2、少数发生偏转,说明原子中存在一个很小的、带正电的微粒
3、极少数被弹回,说明遇到很大阻力,即:存在一个不仅带正电,而且质量很大的微粒—原子核
2、交流讨论,归纳结论
※问题探究
卢瑟福轰击金箔的实验:
1、大部分穿过(99.9%)
2、少数角度偏离
3、极少数反弹
分组讨论
获得结论
1、原子中有很大的空间
2、原子内部有一个很小的核
3、电子围绕着核高速运转
粒子种类 电性 质量(Kg)
质子 1个单位正电荷 1.6726×10-27
中子 不带电 1.6749×10-27
电子 1个单位负电荷 质子质量的1/1836
原子种类 质子数 中子数 核外电子数
氢 1 0 1
碳 6 6 6
氧 8 8 8
钠 11 12 11
氯 17 18 17
表1 构成原子的粒子的电性和质量
表2 几种原子的构成
2 、原子核所带的电量与核外电子所带的电量相等,电性相反,所以原子不显电性
核电荷数=质子数=核外电子数
3、不同类的原子,核内质子数不同,核外的电子数也不相同
1 、原子核在中央,体积很小,但原子的质量几乎集中在原子核上;核外电子绕核高速运转占空间很大,质量很小,忽略不计。
原子
(不显电性)
原子核
(带正电)
核外电子:带一个单位负电荷
质子:带一个单位正电荷
中子:不带电
核电荷数=核内质子数=核外电子数
核内质子与核外电子所带电性相反,数目相等,所以原子不显电性
学生经过讨论、交流,最后总结出原子结构
阅读教材,主动探究:
请大家观察下面一组数据,哪列数据更便于记忆和使用?
原子 实际质量(kg) 相对原子质量
氢 1.6726×10-27 1
氧 2.6780×10-26 16
碳 2.0085×10-26 12
钠 3.8450×10-26 23
相对原子质量是以这些原子的实际质量与某一共同的数字( 1.66×10-27Kg)的比值,由于大家都除以相同的数,所以比例不变。计算方法:
演 示 氧的相对原子质量的计算方法
学生练习 钠的相对原子质量计算
得出相对原子质量的概念:
相对原子质量(Ar)=
某原子的实际质量
碳-12原子质量×1/12
(单位为1,通常不写出)
通过结合比较碳-12原子的质量的1/12与一个质子或中子质量的关系,得出它们大致相等,因此相对原子质量近似等于质子数与中子数之和,即:
相对原子质量(Ar)=
某原子的实际质量
碳-12原子质量×1/12
=质子数+中子
将表4-2与教材P75常见原子量表相结合观察,使学生对上述公式理解更深
练习:完成下列表格
原子 质子数 中子数 电子数 相对原子质量
氢 1 0 1 1
碳 6 6 6 12
氧 8 8 8 16
硫 16 16 16 32
钠 11 12 11 23
查相对原子质量表
学习张青莲教授的事迹
完成课后习题并评讲
板书设计:
一、原子的构成
原子
原子核
核外电子:带一个单位负电荷
质子:带一个单位正电荷
中子:不带电
核电荷数=核内质子数=核外电子数
二、相对原子质量
相对原子质量(Ar)=
某原子的实际质量
碳-12原子质量×1/12
=质子数+中子数
原子的构成
马秀丽
教材分析
教学过程
板书设计
教法和学法指导
教法分析
说课程序
教材分析
1、教材的地位和作用
本课题是在第三单元学习分子与原子知识后,对原子内部结构的进一步研究,既是对前面知识的延伸和深化,也是后面正确理解元素、离子等知识的必要铺垫,起到重要的承上启下作用。同时也有利于建立起“物质无限可分”的微观概念,逐步学会从微观的角度认识和研究化学。
原子的构成
元素
物质结构理论
离子
分子、原子
从微观角度
认识、研究
化学
教材分析
教材的地位和作用
教材分析
2、教学重、难点:
因为化学的学习中,对微观世界的认识才刚刚开始,对抽像的事物理解起来有一定的困难,而且根据本节对后续内容所起的重要作用,确定本节内容的重、难点为:
原子不显电性的理解、
教学重点:
教学难点:
相对原子质量的理解
原子的结构、
相对原子质量的理解和应用
教材分析
教学重、难点:
教材分析
新课标对本节的要求仅限于“了解”和“初步了解”水平层次,且学生已经对分子、原子的知识有一定程度的了解,但在学生心目中对原子还没有形成较完整的概念,而后继学习又必须是建立在原子内部结构知识的基础上的,因此,确定本节课的三维目标如下:
3、三维目标
教材分析
情感态度价值观:
过程与方法:
知识与技能:
Description of the contents
① 理解原子、原子核的构成,整个原子呈电中性。
②理解核电荷数、质子数和核外电子数的关系,并能进行简单的计算。
①充分发挥学生的空间想象力
②学习运用对比、归纳的方法在微观世界和宏观世界之间架起一座桥梁。
1)对学生进行物质可分性的辩证唯物主义观点教育。
2) 结合资料,培养爱国主义情感。
3.三维目标
教法分析
根据新课程“课堂教学是学生在教师指导下自主学习的过程”的理念,为培养学生自主学习的能力,结合本课题内容抽像的特点,在教学中采用:指导阅读与组织讨论相结合为主的探究性学习。
充分利用各种资料和手段,激发学生学习的兴趣,培养抽象思维和空间想象能力。
教法和学法指导
教学对象分析——说学生
加强过程与方法的培养
想象能力
求知欲
好奇心
良好的思维习惯
过程设计
本课题拟采用我校‘主动探究——分层递进’课堂教学模式。
创设情境
引入新课
深化质疑
归纳结论
课堂反馈
分层递进
带着问题
探究讨论
1、创设情境,引入新课
※温故知新
电解水的实验
回忆旧知识:
分子,原子的概念
化学变化的实质
原子是化学变化中的最小粒子。
※提出猜想
从原子弹爆炸
引出新知识:
原子可以再分
α 粒子束发生偏转示意图
α 粒子束(带正电)
1、绝大多数能够直接穿过,说明几乎没有遇到阻力,即:原子内有很大的空间
2、少数发生偏转,说明原子中存在一个很小的、带正电的微粒
3、极少数被弹回,说明遇到很大阻力,即:存在一个不仅带正电,而且质量很大的微粒—原子核
2、交流讨论,归纳结论
※问题探究
卢瑟福轰击金箔的实验:
1、大部分穿过(99.9%)
2、少数角度偏离
3、极少数反弹
分组讨论
获得结论
1、原子中有很大的空间
2、原子内部有一个很小的核
3、电子围绕着核高速运转
粒子种类 电性 质量(Kg)
质子 1个单位正电荷 1.6726×10-27
中子 不带电 1.6749×10-27
电子 1个单位负电荷 质子质量的1/1836
原子种类 质子数 中子数 核外电子数
氢 1 0 1
碳 6 6 6
氧 8 8 8
钠 11 12 11
氯 17 18 17
表1 构成原子的粒子的电性和质量
表2 几种原子的构成
2 、原子核所带的电量与核外电子所带的电量相等,电性相反,所以原子不显电性
核电荷数=质子数=核外电子数
3、不同类的原子,核内质子数不同,核外的电子数也不相同
1 、原子核在中央,体积很小,但原子的质量几乎集中在原子核上;核外电子绕核高速运转占空间很大,质量很小,忽略不计。
原子
(不显电性)
原子核
(带正电)
核外电子:带一个单位负电荷
质子:带一个单位正电荷
中子:不带电
核电荷数=核内质子数=核外电子数
核内质子与核外电子所带电性相反,数目相等,所以原子不显电性
学生经过讨论、交流,最后总结出原子结构
阅读教材,主动探究:
请大家观察下面一组数据,哪列数据更便于记忆和使用?
原子 实际质量(kg) 相对原子质量
氢 1.6726×10-27 1
氧 2.6780×10-26 16
碳 2.0085×10-26 12
钠 3.8450×10-26 23
相对原子质量是以这些原子的实际质量与某一共同的数字( 1.66×10-27Kg)的比值,由于大家都除以相同的数,所以比例不变。计算方法:
演 示 氧的相对原子质量的计算方法
学生练习 钠的相对原子质量计算
得出相对原子质量的概念:
相对原子质量(Ar)=
某原子的实际质量
碳-12原子质量×1/12
(单位为1,通常不写出)
通过结合比较碳-12原子的质量的1/12与一个质子或中子质量的关系,得出它们大致相等,因此相对原子质量近似等于质子数与中子数之和,即:
相对原子质量(Ar)=
某原子的实际质量
碳-12原子质量×1/12
=质子数+中子
将表4-2与教材P75常见原子量表相结合观察,使学生对上述公式理解更深
练习:完成下列表格
原子 质子数 中子数 电子数 相对原子质量
氢 1 0 1 1
碳 6 6 6 12
氧 8 8 8 16
硫 16 16 16 32
钠 11 12 11 23
查相对原子质量表
学习张青莲教授的事迹
完成课后习题并评讲
板书设计:
一、原子的构成
原子
原子核
核外电子:带一个单位负电荷
质子:带一个单位正电荷
中子:不带电
核电荷数=核内质子数=核外电子数
二、相对原子质量
相对原子质量(Ar)=
某原子的实际质量
碳-12原子质量×1/12
=质子数+中子数
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
