2021-2022学年高二上学期化学鲁科版(2019)选择性必修1第三章《物质在水溶液中的行为》测试题 (含答案)
文档属性
| 名称 | 2021-2022学年高二上学期化学鲁科版(2019)选择性必修1第三章《物质在水溶液中的行为》测试题 (含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 743.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-04 09:53:48 | ||
图片预览



文档简介
第三章《物质在水溶液中的行为》测试题
一、单选题(共15题)
1.下列离子方程式正确的是
A.大理石与盐酸反应:
B.碳酸氢铵溶液中加入足量烧碱后共热:
C.氯化铁溶液腐蚀铜板:
D.通入水中制硝酸:
2.化学来源于生活又服务于生活,下列物质用途与所涉及的化学知识均正确且有对应关系的是
选项
物质用途
化学知识
A
用P2O5作食品干燥剂
P2O5有吸水性
B
用过氧乙酸(CH3COOOH)对环境消毒
过氧乙酸溶液显酸性
C
用新制Cu(OH)2悬浊液检验血糖含量
Cu(OH)2能溶于含糖溶液
D
用聚乳酸塑料代替聚乙烯塑料包装食品
聚乳酸塑料无毒、易降解
A.A
B.B
C.C
D.D
3.下列方法中,不能用来鉴别乙醇和乙酸的是
A.加入金属钠
B.扇动闻气味
C.滴加溶液
D.滴加紫色石蕊溶液
4.下列说法正确的是
A.醋酸溶液的浓度增大,醋酸的电离度随之增大
B.0.1
mol·L-1的CH3COOH溶液,升高温度,CH3COOH的电离度增大
C.在0.1
mol·L-1的醋酸溶液中,水电离出的H+浓度为10-13mol·L-1
D.盐酸溶液中的c(H+)比醋酸溶液中的c(H+)大
5.已知:。现有浓度均为1mol/L的、的混合溶液(滴有少量KSCN溶液)10mL,向其中通入标准状况时溶液红色褪去。下列有关说法正确的是
A.当溶液中、全部被还原时转移电子0.03mol
B.、溶液混合后发生的反应离子方程式为
C.氧化性
D.通入足量反应后溶液中可以存在、、、
6.下列实验操作、现象和结论均正确的是
选项
实验操作
现象
结论
A
用双氧水滴定KI-淀粉溶液
溶液变蓝
达到滴定终点
B
用湿润的淀粉碘化钾试纸鉴别、溴蒸气
试纸变蓝
该气体为溴蒸气
C
向食用加碘盐中加入食醋和KI溶液,再加入振荡,静置
下层呈紫红色
该食用加碘盐中含有
D
最后试管有浅黄色沉淀
有机物中含有溴原子
A.A
B.B
C.C
D.D
7.设为阿伏加德罗常数的值.下列说法正确的是
A.标准状况下,乙醇中碳氢键的数目为
B.与水充分反应转移的电子数日为
C.和的混合物中含有的电子数为
D.的溶液中,阴离子数为
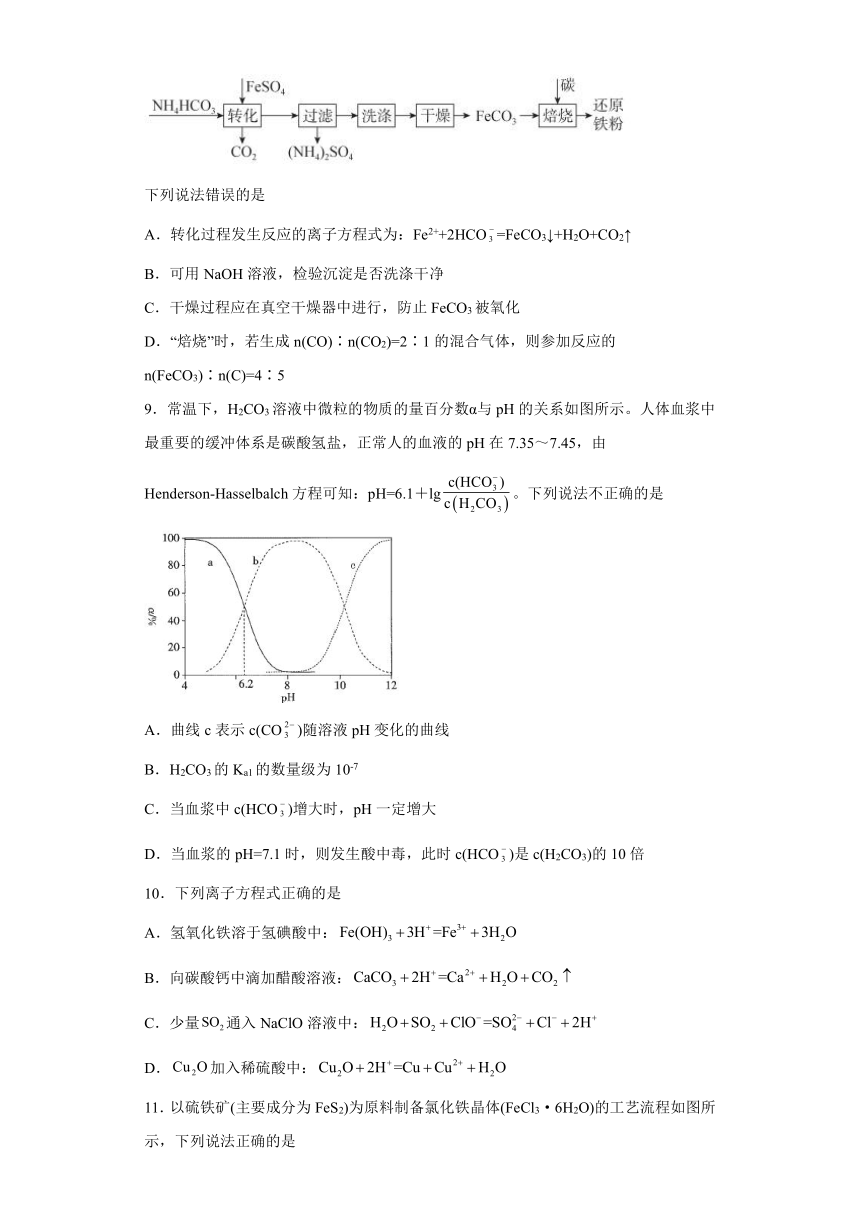
8.利用FeSO4制备还原铁粉的工艺流程如图:
下列说法错误的是
A.转化过程发生反应的离子方程式为:Fe2++2HCO=FeCO3↓+H2O+CO2↑
B.可用NaOH溶液,检验沉淀是否洗涤干净
C.干燥过程应在真空干燥器中进行,防止FeCO3被氧化
D.“焙烧”时,若生成n(CO)∶n(CO2)=2∶1的混合气体,则参加反应的n(FeCO3)∶n(C)=4∶5
9.常温下,H2CO3溶液中微粒的物质的量百分数α与pH的关系如图所示。人体血浆中最重要的缓冲体系是碳酸氢盐,正常人的血液的pH在7.35~7.45,由Henderson-Hasselbalch方程可知:pH=6.1+lg。下列说法不正确的是
A.曲线c表示c(CO)随溶液pH变化的曲线
B.H2CO3的Ka1的数量级为10-7
C.当血浆中c(HCO)增大时,pH一定增大
D.当血浆的pH=7.1时,则发生酸中毒,此时c(HCO)是c(H2CO3)的10倍
10.下列离子方程式正确的是
A.氢氧化铁溶于氢碘酸中:
B.向碳酸钙中滴加醋酸溶液:
C.少量通入NaClO溶液中:
D.加入稀硫酸中:
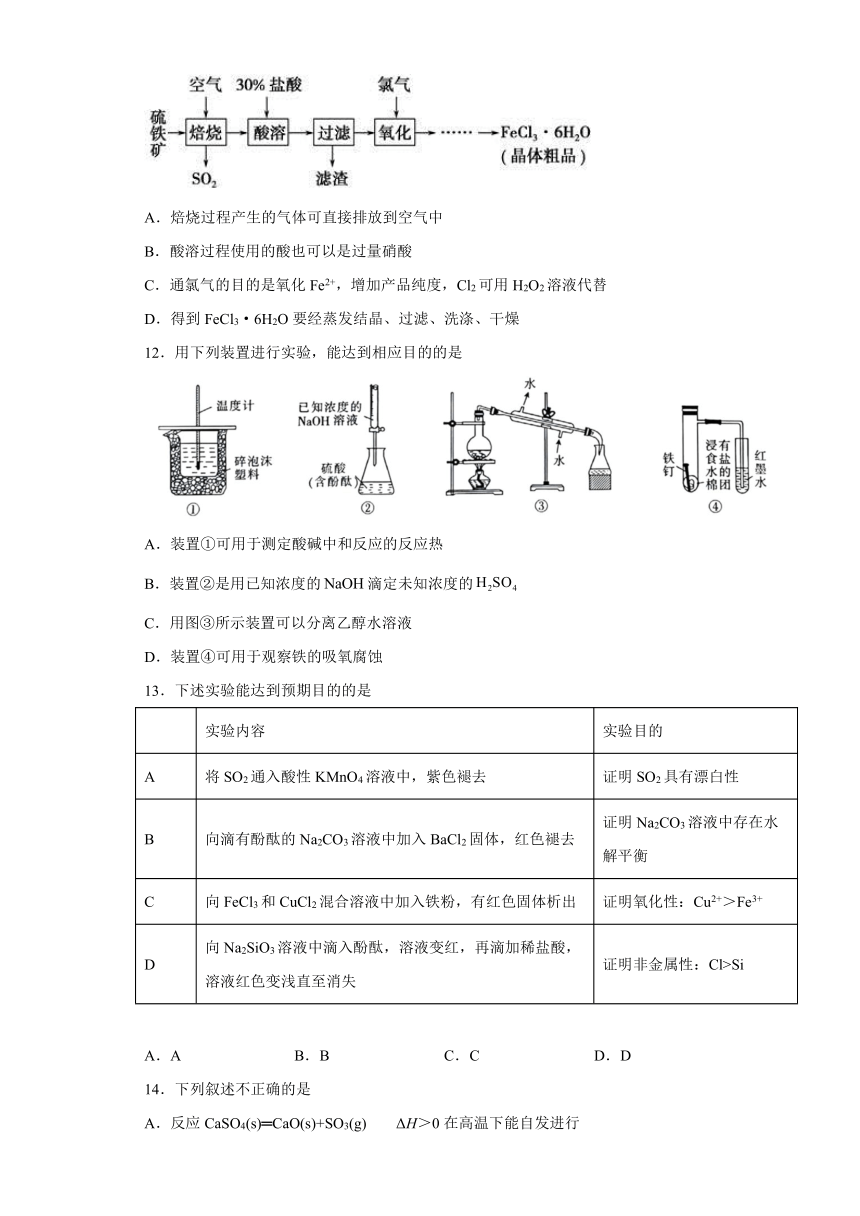
11.以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如图所示,下列说法正确的是
A.焙烧过程产生的气体可直接排放到空气中
B.酸溶过程使用的酸也可以是过量硝酸
C.通氯气的目的是氧化Fe2+,增加产品纯度,Cl2可用H2O2溶液代替
D.得到FeCl3·6H2O要经蒸发结晶、过滤、洗涤、干燥
12.用下列装置进行实验,能达到相应目的的是
A.装置①可用于测定酸碱中和反应的反应热
B.装置②是用已知浓度的滴定未知浓度的
C.用图③所示装置可以分离乙醇水溶液
D.装置④可用于观察铁的吸氧腐蚀
13.下述实验能达到预期目的的是
实验内容
实验目的
A
将SO2通入酸性KMnO4溶液中,紫色褪去
证明SO2具有漂白性
B
向滴有酚酞的Na2CO3溶液中加入BaCl2固体,红色褪去
证明Na2CO3溶液中存在水解平衡
C
向FeCl3和CuCl2混合溶液中加入铁粉,有红色固体析出
证明氧化性:Cu2+>Fe3+
D
向Na2SiO3溶液中滴入酚酞,溶液变红,再滴加稀盐酸,溶液红色变浅直至消失
证明非金属性:Cl>Si
A.A
B.B
C.C
D.D
14.下列叙述不正确的是
A.反应CaSO4(s)═CaO(s)+SO3(g)
ΔH>0在高温下能自发进行
B.用标准HCl溶液滴定NaHCO3溶液来测定其浓度,选择甲基橙为指示剂
C.平衡正向移动,反应物的转化率一定增大
D.当碰撞的分子具有足够的能量和适当的取向时,才能发生化学反应
15.常温下,下列各组离子在指定溶液中可能大量共存的是
A.滴加甲基橙显黄色的溶液:Fe3+、、Cl-、
B.pH=1的溶液:Fe2+、Na+、Mg2+、
C.水电离出来的c(H+)=10-13mol/L的溶液:K+、、Br-、
D.所含溶质为Na2CO3的溶液:K+、Cl-、、Al3+
二、填空题(共8题)
16.雌黄(As2S3)和雄黄(As4S4)都是自然界中常见的含砷化合物,早期都曾用作绘画颜料,也可入药。回答下列问题:
(1)砷元素有+2、+3两种常见价态。一定条件下,雌黄和雄黄的转化关系如图所示。物质a为_______(填化学式);可用双氧水将As2O3(砒霜)转化为无毒的H3AsO4,写出该反应的化学方程式:_______。
(2)亚砷酸(H3AsO3)可以用于治疗白血病,其在溶液中存在多种形态,25℃时,各种形态的物质的量分数与溶液pH的关系如图所示:
①人体血液的pH在7.35~7.45之间,用药后血液中砷元素的主要形态是_______。
②下列说法正确的是_______(填标号)。
A.n(H3AsO3):n(H2AsO)=1:1时,溶液显碱性
B.随着pH增大,逐渐增大
C.pH=12时,溶液中c(H2AsO)+2c(HAsO)+3c(AsO)+c(OH-)=c(H+)
D.pH=14时,c(AsO)>c(HAsO)>c(H2AsO)>c(OH-)
③将KOH溶液滴入亚砷酸溶液至pH为11时,反应的离子方程式为_______。
(3)P和As属于同主族元素,工业制备亚磷酸的装置如图所示:
①产品室中反应的离子方程式为_______;
②得到1
mol亚磷酸的同时,阴极室能制得_______g
NaOH。
17.去除水体中砷的技术主要有物理吸附法及化学氧化法。
(1)物理吸附法
用活性炭负载纳米二氧化钛吸附水中的砷,纳米二氧化钛投加量对活性炭去除砷效果如图1所示:
①纳米二氧化钛投加量为____时,砷的吸附量可达最大。
②未加二氧化钛时就有一定的吸附砷的能力,可能的原因是____。
③若要提高废水中As(III)的去除率,可采取的措施___。
(2)化学氧化法
该方法须将废水中的As(III)用空气或铁离子氧化为As(V),然后再去除,为了探究As(III)被哪种氧化剂氧化,设计如下实验:取含As(III)废水,在pH分别为1~10条件下反应1h后,过滤,测定滤液中三价铁和二价铁的含量,得出不同pH下三价铁和二价铁的浓度随pH变化如图2所示:
①pH在3~4时Fe3+浓度变化的主要原因为____。
②由实验可知废水中的As(III)主要被___氧化为As(V),理由为___。
18.Ⅰ、研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(1)溶于海水的CO2主要以4种无机碳形式存在,其中HCO3-占95%。写出CO2溶于水产生HCO3-的方程式:___、___。
(2)在海洋碳循环中,通过如图所示的途径固碳。写出钙化作用的离子方程式:___。
Ⅱ、为探究绿色固体X(含四种元素)的组成和性质,设计并完成如下实验:
请回答:(1)X的化学式是____。
(2)绿色溶液C蒸干灼烧得到固体M,总反应的化学方程式是___。
(3)加热条件气体B能与氧气发生置换反应,写出该反应的化学方程式___。
19.甲、乙、丙、丁四种可溶的化合物(所含离子各不同),分别由阳离子NH4+、Ba2+、Al3+、H+和阴离子OH﹣、Cl﹣、HCO3﹣、SO42﹣两两组合而成.为了确定这四种化合物的成分,某同学进行了如下实验操作:
①将四种化合物各取适量配成溶液,分别装入四支试管;
②测得0.1mol/L甲溶液中c(H+)>0.1mol/L;
③分别向其它三种物质的溶液中加入少量乙溶液,均有白色沉淀生成;继续加入乙溶液至过量,丙中沉淀完全溶解.
(1)写出下列物质的化学式:甲_________,乙_________,丁_________
(2)甲和丁反应的离子方程式为________.
(3)若要检验丙中的阴离子,所需加入的试剂为_____________;写出向丙中加入过量乙的离子方程式________.
20.国家标准规定酿造食醋总酸含量不得低于3.5g/100mL,为测定某品牌市售醋酸的浓度,用移液管移取25mL,定容至250mL。取25.00mL溶液,用0.2000
mol L 1
NaOH标准溶液滴定至终点。重复实验,数据如下:
序号
滴定前读数/mL
滴定终点读数/mL
1
0.00
19.98
2
2.40
22.40
3
1.54
21.56
已知:常温下,Ka(CH3COOH)=1.8×10 5,=2.236
(1)该市售醋酸的含量为______g/100mL
(2)该市售醋酸c(H+)约等于______(保留小数点后一位)
21.已知水在25℃和95℃时,其电离平衡曲线如图所示:
(1)25℃时,将pH=12的NaOH溶液100mL,要使溶液pH降为11,需加入水的体积约为:___________。
(2)25℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,a+b=___________。
(3)95℃下,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=___________。
22.工业上常利用含硫废水生产Na2S2O3.5H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程。
烧瓶C中发生反应如下:
注明,aq表示溶液,s表示固体,1
表示液体,g表示气体。
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若_______,则整个装置气密性良好。装置D的作用是_______。装置E中为______溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为_____
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择______。
a.蒸馏水
b.饱和Na2SO3溶液
c.饱和NaHSO3溶液
d.饱和NaHCO3溶液
已知反应(III)
相对较慢,则烧瓶C中反应达到完成的现象是________。反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器含有_____。
a.烧杯
b.蒸发皿
c.试管
d
.锥形瓶
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩,冷却结晶即可析出Na2S2O3·5H2O,其中可能含有Na2SO3.Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论:__________已知Na2S2O3·5H2O遇酸易分解:
S2O+2H+=S↓+
SO2↑+
H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2
溶液、AgNO3溶液
23.已知:是重要的硫-氮二元化合物,室温下为橙黄色的固体,178~187℃熔化并分解,可用氨气与反应制得。某同学利用下图装置制取,然后制取。已知:为红棕色液体,有刺激性臭味,熔点:,沸点:60℃,易水解。
反应步骤:①反应时先向三颈烧瓶中通入干燥的氯气,使硫粉与氯气在50℃下反应生成。
②待三颈烧瓶中的硫粉全部反应后,关闭B、C之间的止水夹,撤掉A、B装置。
③连接制氨气的装置,通入氨气,反应制得。
试回答下列问题。
(1)仪器a的名称为_______,a中三氧化铬(还原产物中铬为+3价)可与浓盐酸快速反应制得氯气,写出反应的离子方程式_______。
(2)B装置中应选择的试剂为_______。制取过程中,b导管末端应连接下图中的_______(填序号)。
(3)向制得的中通入,生成的同时还生成一种常见固体单质和一种盐,写出反应的化学方程式_______。所得产物分离后,检验所得盐中阳离子的具体操作步骤和现象_______。
(4)在碱性条件下发生水解反应氮元素转化为氨气,用硼酸吸收,滴定氨气释放量可进一步测定的纯度。称取样品,加入NaOH溶液,并加热,释放出的氨气用足量硼酸溶液吸收[反应方程式为,假定反应过程中溶液体积不变]。反应后的硼酸溶滚,以甲基红-亚甲蓝为指示剂,再用的盐酸[滴定反应方程式为]进行滴定,重复三次实验。实验数据记录如下表所示:
实验序号
初始读数
最终读数
I
0.10
20.14
II
0.50
24.75
III
1.00
20.96
则制得的的纯度为_______。
参考答案
1.B
2.D
3.A
4.B
5.C
6.C
7.C
8.B
9.C
10.D
11.C
12.D
13.B
14.C
15.C
16.SO2
As2O3+2H2O2+H2O=2H3AsO4
H3AsO3
AB
H3AsO3+OH-=
+H2O;
+2H+=H3PO3
80
17.20mg g-1
活性炭具有疏松多孔的结构,可吸附水中的As(V)和As(III)
加入氧化剂,将三价砷转化为五价砷
pH由3→4时,溶液中Fe3+的水解程度显著增大,几乎全部转变成Fe(OH)3而沉降下来
空气中的O2
若As(III)被Fe3+氧化,则还原得到的Fe2+会使溶液中Fe2+的浓度会增大,这与图2所示溶液中的Fe2+的浓度一直接近为0的实验事实相悖
18.CO2+H2O H2CO3
H2CO3 H++HCO3-
2HCO3-+Ca2+=CaCO3↓+CO2↑+H2O
Cu2(OH)3Cl
CuCl2+H2OCuO+2HCl
4HCl+O22H2O+2Cl2
19.H2SO4
Ba(OH)2
NH4HCO3
H++HCO3﹣=H2O+CO2↑
AgNO3溶液和HNO3溶液
Al3++4OH﹣=AlO2﹣+2H2O
20.9.6
5.4×10 3
21.900mL
16
9:11
22.液柱高度保持不变
防止倒吸
NaOH
2:1
c
溶液变澄清
ad
取少量产品溶于足量稀盐酸,静置,取上层溶液(或过滤,取滤液),滴加BaCl2
溶液,若出现沉淀,则说明含有Na2SO4杂质
23.
(1)
蒸馏烧瓶
(2)
浓硫酸
C
(3)
取少量固体粉末于试管中,加入NaOH溶液并加热,在试管口放置湿润的红色石蕊试纸,若试纸变蓝色,则盐中的阳离子为铵根离子
(4)92%
一、单选题(共15题)
1.下列离子方程式正确的是
A.大理石与盐酸反应:
B.碳酸氢铵溶液中加入足量烧碱后共热:
C.氯化铁溶液腐蚀铜板:
D.通入水中制硝酸:
2.化学来源于生活又服务于生活,下列物质用途与所涉及的化学知识均正确且有对应关系的是
选项
物质用途
化学知识
A
用P2O5作食品干燥剂
P2O5有吸水性
B
用过氧乙酸(CH3COOOH)对环境消毒
过氧乙酸溶液显酸性
C
用新制Cu(OH)2悬浊液检验血糖含量
Cu(OH)2能溶于含糖溶液
D
用聚乳酸塑料代替聚乙烯塑料包装食品
聚乳酸塑料无毒、易降解
A.A
B.B
C.C
D.D
3.下列方法中,不能用来鉴别乙醇和乙酸的是
A.加入金属钠
B.扇动闻气味
C.滴加溶液
D.滴加紫色石蕊溶液
4.下列说法正确的是
A.醋酸溶液的浓度增大,醋酸的电离度随之增大
B.0.1
mol·L-1的CH3COOH溶液,升高温度,CH3COOH的电离度增大
C.在0.1
mol·L-1的醋酸溶液中,水电离出的H+浓度为10-13mol·L-1
D.盐酸溶液中的c(H+)比醋酸溶液中的c(H+)大
5.已知:。现有浓度均为1mol/L的、的混合溶液(滴有少量KSCN溶液)10mL,向其中通入标准状况时溶液红色褪去。下列有关说法正确的是
A.当溶液中、全部被还原时转移电子0.03mol
B.、溶液混合后发生的反应离子方程式为
C.氧化性
D.通入足量反应后溶液中可以存在、、、
6.下列实验操作、现象和结论均正确的是
选项
实验操作
现象
结论
A
用双氧水滴定KI-淀粉溶液
溶液变蓝
达到滴定终点
B
用湿润的淀粉碘化钾试纸鉴别、溴蒸气
试纸变蓝
该气体为溴蒸气
C
向食用加碘盐中加入食醋和KI溶液,再加入振荡,静置
下层呈紫红色
该食用加碘盐中含有
D
最后试管有浅黄色沉淀
有机物中含有溴原子
A.A
B.B
C.C
D.D
7.设为阿伏加德罗常数的值.下列说法正确的是
A.标准状况下,乙醇中碳氢键的数目为
B.与水充分反应转移的电子数日为
C.和的混合物中含有的电子数为
D.的溶液中,阴离子数为
8.利用FeSO4制备还原铁粉的工艺流程如图:
下列说法错误的是
A.转化过程发生反应的离子方程式为:Fe2++2HCO=FeCO3↓+H2O+CO2↑
B.可用NaOH溶液,检验沉淀是否洗涤干净
C.干燥过程应在真空干燥器中进行,防止FeCO3被氧化
D.“焙烧”时,若生成n(CO)∶n(CO2)=2∶1的混合气体,则参加反应的n(FeCO3)∶n(C)=4∶5
9.常温下,H2CO3溶液中微粒的物质的量百分数α与pH的关系如图所示。人体血浆中最重要的缓冲体系是碳酸氢盐,正常人的血液的pH在7.35~7.45,由Henderson-Hasselbalch方程可知:pH=6.1+lg。下列说法不正确的是
A.曲线c表示c(CO)随溶液pH变化的曲线
B.H2CO3的Ka1的数量级为10-7
C.当血浆中c(HCO)增大时,pH一定增大
D.当血浆的pH=7.1时,则发生酸中毒,此时c(HCO)是c(H2CO3)的10倍
10.下列离子方程式正确的是
A.氢氧化铁溶于氢碘酸中:
B.向碳酸钙中滴加醋酸溶液:
C.少量通入NaClO溶液中:
D.加入稀硫酸中:
11.以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如图所示,下列说法正确的是
A.焙烧过程产生的气体可直接排放到空气中
B.酸溶过程使用的酸也可以是过量硝酸
C.通氯气的目的是氧化Fe2+,增加产品纯度,Cl2可用H2O2溶液代替
D.得到FeCl3·6H2O要经蒸发结晶、过滤、洗涤、干燥
12.用下列装置进行实验,能达到相应目的的是
A.装置①可用于测定酸碱中和反应的反应热
B.装置②是用已知浓度的滴定未知浓度的
C.用图③所示装置可以分离乙醇水溶液
D.装置④可用于观察铁的吸氧腐蚀
13.下述实验能达到预期目的的是
实验内容
实验目的
A
将SO2通入酸性KMnO4溶液中,紫色褪去
证明SO2具有漂白性
B
向滴有酚酞的Na2CO3溶液中加入BaCl2固体,红色褪去
证明Na2CO3溶液中存在水解平衡
C
向FeCl3和CuCl2混合溶液中加入铁粉,有红色固体析出
证明氧化性:Cu2+>Fe3+
D
向Na2SiO3溶液中滴入酚酞,溶液变红,再滴加稀盐酸,溶液红色变浅直至消失
证明非金属性:Cl>Si
A.A
B.B
C.C
D.D
14.下列叙述不正确的是
A.反应CaSO4(s)═CaO(s)+SO3(g)
ΔH>0在高温下能自发进行
B.用标准HCl溶液滴定NaHCO3溶液来测定其浓度,选择甲基橙为指示剂
C.平衡正向移动,反应物的转化率一定增大
D.当碰撞的分子具有足够的能量和适当的取向时,才能发生化学反应
15.常温下,下列各组离子在指定溶液中可能大量共存的是
A.滴加甲基橙显黄色的溶液:Fe3+、、Cl-、
B.pH=1的溶液:Fe2+、Na+、Mg2+、
C.水电离出来的c(H+)=10-13mol/L的溶液:K+、、Br-、
D.所含溶质为Na2CO3的溶液:K+、Cl-、、Al3+
二、填空题(共8题)
16.雌黄(As2S3)和雄黄(As4S4)都是自然界中常见的含砷化合物,早期都曾用作绘画颜料,也可入药。回答下列问题:
(1)砷元素有+2、+3两种常见价态。一定条件下,雌黄和雄黄的转化关系如图所示。物质a为_______(填化学式);可用双氧水将As2O3(砒霜)转化为无毒的H3AsO4,写出该反应的化学方程式:_______。
(2)亚砷酸(H3AsO3)可以用于治疗白血病,其在溶液中存在多种形态,25℃时,各种形态的物质的量分数与溶液pH的关系如图所示:
①人体血液的pH在7.35~7.45之间,用药后血液中砷元素的主要形态是_______。
②下列说法正确的是_______(填标号)。
A.n(H3AsO3):n(H2AsO)=1:1时,溶液显碱性
B.随着pH增大,逐渐增大
C.pH=12时,溶液中c(H2AsO)+2c(HAsO)+3c(AsO)+c(OH-)=c(H+)
D.pH=14时,c(AsO)>c(HAsO)>c(H2AsO)>c(OH-)
③将KOH溶液滴入亚砷酸溶液至pH为11时,反应的离子方程式为_______。
(3)P和As属于同主族元素,工业制备亚磷酸的装置如图所示:
①产品室中反应的离子方程式为_______;
②得到1
mol亚磷酸的同时,阴极室能制得_______g
NaOH。
17.去除水体中砷的技术主要有物理吸附法及化学氧化法。
(1)物理吸附法
用活性炭负载纳米二氧化钛吸附水中的砷,纳米二氧化钛投加量对活性炭去除砷效果如图1所示:
①纳米二氧化钛投加量为____时,砷的吸附量可达最大。
②未加二氧化钛时就有一定的吸附砷的能力,可能的原因是____。
③若要提高废水中As(III)的去除率,可采取的措施___。
(2)化学氧化法
该方法须将废水中的As(III)用空气或铁离子氧化为As(V),然后再去除,为了探究As(III)被哪种氧化剂氧化,设计如下实验:取含As(III)废水,在pH分别为1~10条件下反应1h后,过滤,测定滤液中三价铁和二价铁的含量,得出不同pH下三价铁和二价铁的浓度随pH变化如图2所示:
①pH在3~4时Fe3+浓度变化的主要原因为____。
②由实验可知废水中的As(III)主要被___氧化为As(V),理由为___。
18.Ⅰ、研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(1)溶于海水的CO2主要以4种无机碳形式存在,其中HCO3-占95%。写出CO2溶于水产生HCO3-的方程式:___、___。
(2)在海洋碳循环中,通过如图所示的途径固碳。写出钙化作用的离子方程式:___。
Ⅱ、为探究绿色固体X(含四种元素)的组成和性质,设计并完成如下实验:
请回答:(1)X的化学式是____。
(2)绿色溶液C蒸干灼烧得到固体M,总反应的化学方程式是___。
(3)加热条件气体B能与氧气发生置换反应,写出该反应的化学方程式___。
19.甲、乙、丙、丁四种可溶的化合物(所含离子各不同),分别由阳离子NH4+、Ba2+、Al3+、H+和阴离子OH﹣、Cl﹣、HCO3﹣、SO42﹣两两组合而成.为了确定这四种化合物的成分,某同学进行了如下实验操作:
①将四种化合物各取适量配成溶液,分别装入四支试管;
②测得0.1mol/L甲溶液中c(H+)>0.1mol/L;
③分别向其它三种物质的溶液中加入少量乙溶液,均有白色沉淀生成;继续加入乙溶液至过量,丙中沉淀完全溶解.
(1)写出下列物质的化学式:甲_________,乙_________,丁_________
(2)甲和丁反应的离子方程式为________.
(3)若要检验丙中的阴离子,所需加入的试剂为_____________;写出向丙中加入过量乙的离子方程式________.
20.国家标准规定酿造食醋总酸含量不得低于3.5g/100mL,为测定某品牌市售醋酸的浓度,用移液管移取25mL,定容至250mL。取25.00mL溶液,用0.2000
mol L 1
NaOH标准溶液滴定至终点。重复实验,数据如下:
序号
滴定前读数/mL
滴定终点读数/mL
1
0.00
19.98
2
2.40
22.40
3
1.54
21.56
已知:常温下,Ka(CH3COOH)=1.8×10 5,=2.236
(1)该市售醋酸的含量为______g/100mL
(2)该市售醋酸c(H+)约等于______(保留小数点后一位)
21.已知水在25℃和95℃时,其电离平衡曲线如图所示:
(1)25℃时,将pH=12的NaOH溶液100mL,要使溶液pH降为11,需加入水的体积约为:___________。
(2)25℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,a+b=___________。
(3)95℃下,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=___________。
22.工业上常利用含硫废水生产Na2S2O3.5H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程。
烧瓶C中发生反应如下:
注明,aq表示溶液,s表示固体,1
表示液体,g表示气体。
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若_______,则整个装置气密性良好。装置D的作用是_______。装置E中为______溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为_____
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择______。
a.蒸馏水
b.饱和Na2SO3溶液
c.饱和NaHSO3溶液
d.饱和NaHCO3溶液
已知反应(III)
相对较慢,则烧瓶C中反应达到完成的现象是________。反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器含有_____。
a.烧杯
b.蒸发皿
c.试管
d
.锥形瓶
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩,冷却结晶即可析出Na2S2O3·5H2O,其中可能含有Na2SO3.Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论:__________已知Na2S2O3·5H2O遇酸易分解:
S2O+2H+=S↓+
SO2↑+
H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2
溶液、AgNO3溶液
23.已知:是重要的硫-氮二元化合物,室温下为橙黄色的固体,178~187℃熔化并分解,可用氨气与反应制得。某同学利用下图装置制取,然后制取。已知:为红棕色液体,有刺激性臭味,熔点:,沸点:60℃,易水解。
反应步骤:①反应时先向三颈烧瓶中通入干燥的氯气,使硫粉与氯气在50℃下反应生成。
②待三颈烧瓶中的硫粉全部反应后,关闭B、C之间的止水夹,撤掉A、B装置。
③连接制氨气的装置,通入氨气,反应制得。
试回答下列问题。
(1)仪器a的名称为_______,a中三氧化铬(还原产物中铬为+3价)可与浓盐酸快速反应制得氯气,写出反应的离子方程式_______。
(2)B装置中应选择的试剂为_______。制取过程中,b导管末端应连接下图中的_______(填序号)。
(3)向制得的中通入,生成的同时还生成一种常见固体单质和一种盐,写出反应的化学方程式_______。所得产物分离后,检验所得盐中阳离子的具体操作步骤和现象_______。
(4)在碱性条件下发生水解反应氮元素转化为氨气,用硼酸吸收,滴定氨气释放量可进一步测定的纯度。称取样品,加入NaOH溶液,并加热,释放出的氨气用足量硼酸溶液吸收[反应方程式为,假定反应过程中溶液体积不变]。反应后的硼酸溶滚,以甲基红-亚甲蓝为指示剂,再用的盐酸[滴定反应方程式为]进行滴定,重复三次实验。实验数据记录如下表所示:
实验序号
初始读数
最终读数
I
0.10
20.14
II
0.50
24.75
III
1.00
20.96
则制得的的纯度为_______。
参考答案
1.B
2.D
3.A
4.B
5.C
6.C
7.C
8.B
9.C
10.D
11.C
12.D
13.B
14.C
15.C
16.SO2
As2O3+2H2O2+H2O=2H3AsO4
H3AsO3
AB
H3AsO3+OH-=
+H2O;
+2H+=H3PO3
80
17.20mg g-1
活性炭具有疏松多孔的结构,可吸附水中的As(V)和As(III)
加入氧化剂,将三价砷转化为五价砷
pH由3→4时,溶液中Fe3+的水解程度显著增大,几乎全部转变成Fe(OH)3而沉降下来
空气中的O2
若As(III)被Fe3+氧化,则还原得到的Fe2+会使溶液中Fe2+的浓度会增大,这与图2所示溶液中的Fe2+的浓度一直接近为0的实验事实相悖
18.CO2+H2O H2CO3
H2CO3 H++HCO3-
2HCO3-+Ca2+=CaCO3↓+CO2↑+H2O
Cu2(OH)3Cl
CuCl2+H2OCuO+2HCl
4HCl+O22H2O+2Cl2
19.H2SO4
Ba(OH)2
NH4HCO3
H++HCO3﹣=H2O+CO2↑
AgNO3溶液和HNO3溶液
Al3++4OH﹣=AlO2﹣+2H2O
20.9.6
5.4×10 3
21.900mL
16
9:11
22.液柱高度保持不变
防止倒吸
NaOH
2:1
c
溶液变澄清
ad
取少量产品溶于足量稀盐酸,静置,取上层溶液(或过滤,取滤液),滴加BaCl2
溶液,若出现沉淀,则说明含有Na2SO4杂质
23.
(1)
蒸馏烧瓶
(2)
浓硫酸
C
(3)
取少量固体粉末于试管中,加入NaOH溶液并加热,在试管口放置湿润的红色石蕊试纸,若试纸变蓝色,则盐中的阳离子为铵根离子
(4)92%
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
