第2章 酸与碱 章节复习训练(含答案)
文档属性
| 名称 | 第2章 酸与碱 章节复习训练(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 261.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-10-04 14:11:52 | ||
图片预览

文档简介
本章复习
1.
如图所示,下列实验操作正确的是(
)
2.
下列有关氢氧化钠的说法,错误的是(
)
A.
氢氧化钠俗称烧碱
B.
氢氧化钠有强烈的腐蚀性
C.
氢氧化钠固体可用于干燥二氧化碳气体
D.
氢氧化钠可用于制肥皂、洗涤剂、造纸、纺织工业等
3.
如图是物质经一步反应实现转化的两种途径,相关说法正确的是(
)
A.
氧化物为SO2
B.
X只能是硫酸
C.
①②属于复分解反应
D.
②可能有沉淀生成
4.
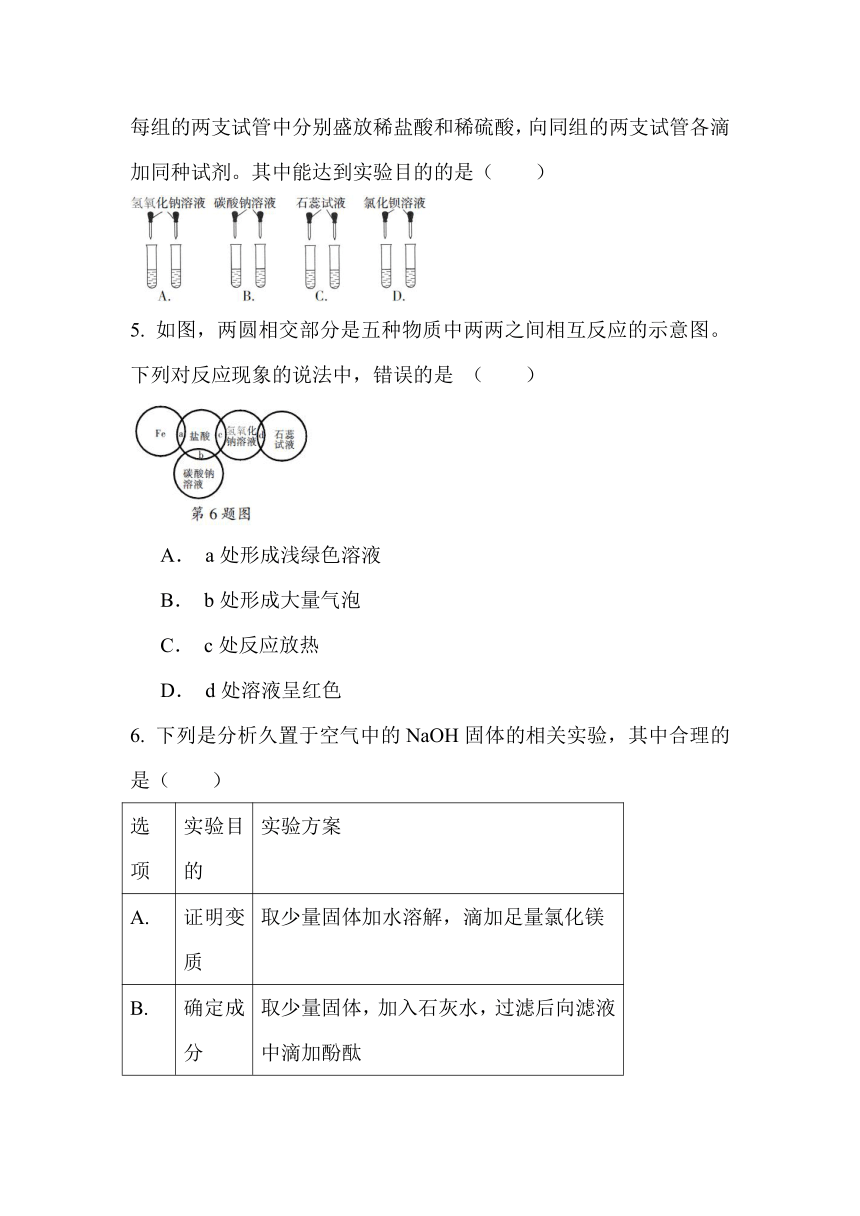
为区别稀盐酸和稀硫酸,小强同学设计如图所示的实验方案:在每组的两支试管中分别盛放稀盐酸和稀硫酸,向同组的两支试管各滴加同种试剂。其中能达到实验目的的是(
)
5.
如图,两圆相交部分是五种物质中两两之间相互反应的示意图。下列对反应现象的说法中,错误的是
(
)
A.
a处形成浅绿色溶液
B.
b处形成大量气泡
C.
c处反应放热
D.
d处溶液呈红色
6.
下列是分析久置于空气中的NaOH固体的相关实验,其中合理的是(
)
选项
实验目的
实验方案
A.
证明变质
取少量固体加水溶解,滴加足量氯化镁
B.
确定成分
取少量固体,加入石灰水,过滤后向滤液中滴加酚酞
C.
测定纯度
取ag样品与足量氯化钡溶液反应,得到mg沉淀
D.
除去杂质
取固体加水溶解,滴加氯化钙溶液至恰好完全反应
7.
下列曲线示意图正确的是(
)
A.
向pH=2的盐酸中滴加过量的氢氧化钠溶液
B.
将等质量的镁和铝分别与等体积、等质量分数的足量盐酸反应
C.
等质量CaCO3分别与等体积、等质量分数的足量稀盐酸反应
D.
向BaCl2和NaOH的混合溶液中加入过量的稀硫酸溶液
8.
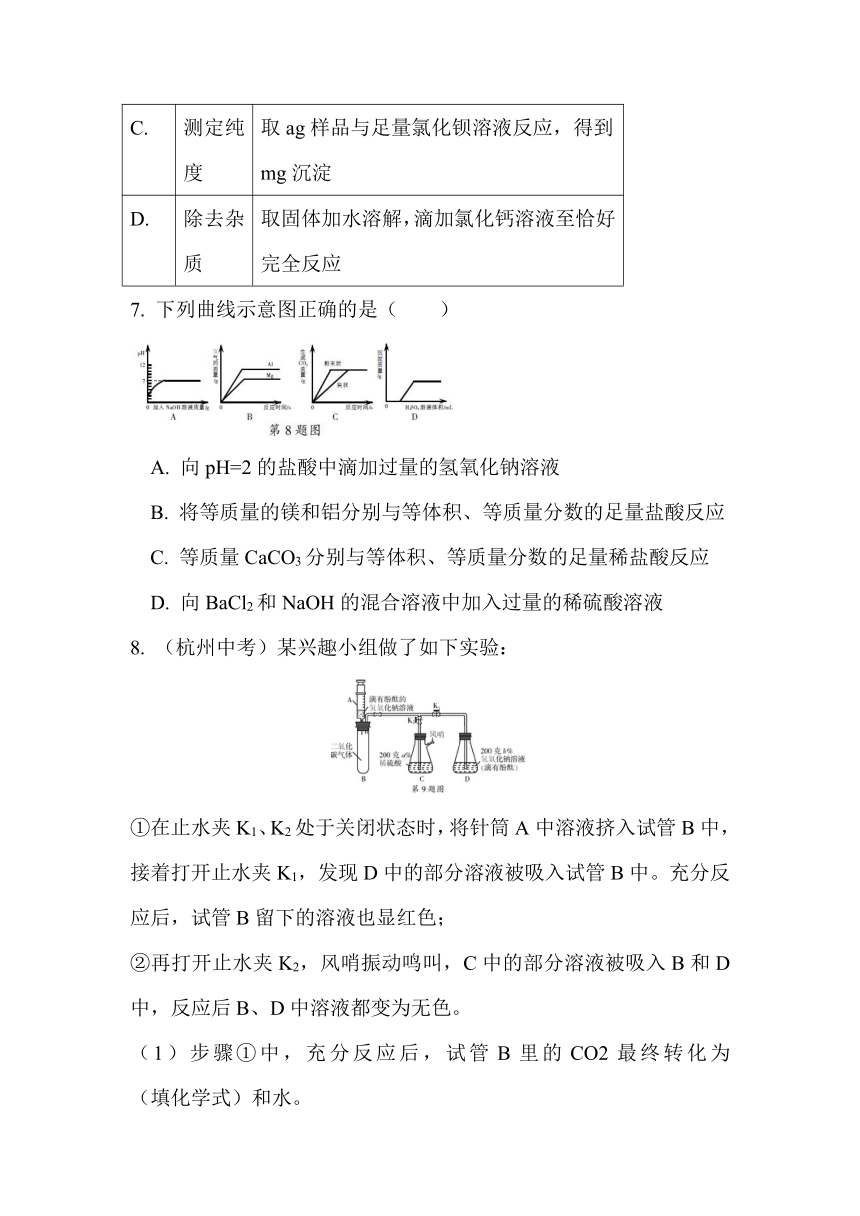
(杭州中考)某兴趣小组做了如下实验:
①在止水夹K1、K2处于关闭状态时,将针筒A中溶液挤入试管B中,接着打开止水夹K1,发现D中的部分溶液被吸入试管B中。充分反应后,试管B留下的溶液也显红色;
②再打开止水夹K2,风哨振动鸣叫,C中的部分溶液被吸入B和D中,反应后B、D中溶液都变为无色。
(1)步骤①中,充分反应后,试管B里的CO2最终转化为
(填化学式)和水。
(2)解释步骤②中“风哨振动鸣叫”的原因:
。
(3)实验开始时C、D中两种溶液中溶质质量分数大小关系为:a%
b%(填“>”“=”或“<”)。
9.
如图是甲、乙两位同学一起在实验室进行的氢氧化钠与盐酸中和反应的实验。
(说明:图中A1、A2、A3、B1、B2、B3均为溶液编号)
根据图中实验,请你与甲、乙同学一起完成下列探究:
探究环节
甲同学的探究
乙同学的探究
提出问题
A3溶液为什么不变红?
B3溶液中溶质成分是什么?(酚酞不计)
作出猜想
实验过程中,酚酞变质了
猜想一:NaCl
猜想二:NaCl、HCl
实验验证
(1)取少量A3溶液于另一试管中,向其中滴加NaOH溶液,溶液变红,说明甲同学的猜想
(填“成立”或“不成立”)。(2)你认为,在常温下A2溶液测出的pH应
(填“>”“=”或“<”)7。
取少量B3溶液加入盛有少量铁粉的试管中,观察到有无色气泡产生,固体逐渐减少,溶液由无色变
,据此,你认为乙同学的猜想
(填“一”或“二”)成立。
交流反思
(1)甲、乙同学的实验中,反应均涉及到的化学方程式是
。(2)A3溶液未变红,你认为原因是A2溶液中
较多,加入的NaOH溶液未将其完全中和或恰好完全中和。(3)甲、乙同学经过实验对比探究,一致认为做化学实验时应注意药品用量的控制。
10.
(嘉兴、舟山中考)用久的热水瓶内胆有一层水垢[主要成分是CaCO3和Mg(OH)2],兴趣小组为了解具体成分进行了实验。他们取样品25g放入质量为100g的锥形瓶中,置于电子天平上,往瓶内加入150g稀盐酸时,恰好完全反应(样品中的杂质不与稀盐酸反应),此时天平示数如图。对所得混合物进行过滤、洗涤、干燥、称量,得到固体4.2g。请回答下列问题:
(1)恰好完全反应时,溶液中的溶质为
(填化学式)。
(2)样品中CaCO3的质量分数是多少?
(3)反应结束时溶液中MgCl2的质量分数是多少?(精确到0.1%)
参考答案
本章复习
1.
.
A
2.
C
3.
D
4.
D
5.
D
6.
C
7.
C
8.
(1)Na2CO3
(2)B中CO2气体跟氢氧化钠溶液反应使装置内气压下降,小于外部气压,气流从风哨进入
(3)>
9.
实验验证:甲:(1)不成立
(2)<
乙:浅绿色
二
交流反思:(1)NaOH+HClNaCl+H2O
(2)盐酸
10.
(1)CaCl2、MgCl2
(2)设样品中CaCO3的质量为x,
CO2的质量:25g+100g+150g-268.4g=6.6g
CaCO3+2HClCaCl2+H2O+CO2↑
100
44
x
6.6g
,x=15g,
样品中CaCO3的质量分数=×100%=60%
(3)设反应结束后产生的MgCl2为y,
样品中Mg(OH)2的质量为25g-15g-4.2g=5.8g
Mg(OH)2+2HClMgCl2+2H2O
58
95
5.8g
y
,y=9.5g
最后溶液的质量:25g-4.2g+150g-6.6g=164.2g
样品中MgCl2的质量分数=×100%=5.8%
1.
如图所示,下列实验操作正确的是(
)
2.
下列有关氢氧化钠的说法,错误的是(
)
A.
氢氧化钠俗称烧碱
B.
氢氧化钠有强烈的腐蚀性
C.
氢氧化钠固体可用于干燥二氧化碳气体
D.
氢氧化钠可用于制肥皂、洗涤剂、造纸、纺织工业等
3.
如图是物质经一步反应实现转化的两种途径,相关说法正确的是(
)
A.
氧化物为SO2
B.
X只能是硫酸
C.
①②属于复分解反应
D.
②可能有沉淀生成
4.
为区别稀盐酸和稀硫酸,小强同学设计如图所示的实验方案:在每组的两支试管中分别盛放稀盐酸和稀硫酸,向同组的两支试管各滴加同种试剂。其中能达到实验目的的是(
)
5.
如图,两圆相交部分是五种物质中两两之间相互反应的示意图。下列对反应现象的说法中,错误的是
(
)
A.
a处形成浅绿色溶液
B.
b处形成大量气泡
C.
c处反应放热
D.
d处溶液呈红色
6.
下列是分析久置于空气中的NaOH固体的相关实验,其中合理的是(
)
选项
实验目的
实验方案
A.
证明变质
取少量固体加水溶解,滴加足量氯化镁
B.
确定成分
取少量固体,加入石灰水,过滤后向滤液中滴加酚酞
C.
测定纯度
取ag样品与足量氯化钡溶液反应,得到mg沉淀
D.
除去杂质
取固体加水溶解,滴加氯化钙溶液至恰好完全反应
7.
下列曲线示意图正确的是(
)
A.
向pH=2的盐酸中滴加过量的氢氧化钠溶液
B.
将等质量的镁和铝分别与等体积、等质量分数的足量盐酸反应
C.
等质量CaCO3分别与等体积、等质量分数的足量稀盐酸反应
D.
向BaCl2和NaOH的混合溶液中加入过量的稀硫酸溶液
8.
(杭州中考)某兴趣小组做了如下实验:
①在止水夹K1、K2处于关闭状态时,将针筒A中溶液挤入试管B中,接着打开止水夹K1,发现D中的部分溶液被吸入试管B中。充分反应后,试管B留下的溶液也显红色;
②再打开止水夹K2,风哨振动鸣叫,C中的部分溶液被吸入B和D中,反应后B、D中溶液都变为无色。
(1)步骤①中,充分反应后,试管B里的CO2最终转化为
(填化学式)和水。
(2)解释步骤②中“风哨振动鸣叫”的原因:
。
(3)实验开始时C、D中两种溶液中溶质质量分数大小关系为:a%
b%(填“>”“=”或“<”)。
9.
如图是甲、乙两位同学一起在实验室进行的氢氧化钠与盐酸中和反应的实验。
(说明:图中A1、A2、A3、B1、B2、B3均为溶液编号)
根据图中实验,请你与甲、乙同学一起完成下列探究:
探究环节
甲同学的探究
乙同学的探究
提出问题
A3溶液为什么不变红?
B3溶液中溶质成分是什么?(酚酞不计)
作出猜想
实验过程中,酚酞变质了
猜想一:NaCl
猜想二:NaCl、HCl
实验验证
(1)取少量A3溶液于另一试管中,向其中滴加NaOH溶液,溶液变红,说明甲同学的猜想
(填“成立”或“不成立”)。(2)你认为,在常温下A2溶液测出的pH应
(填“>”“=”或“<”)7。
取少量B3溶液加入盛有少量铁粉的试管中,观察到有无色气泡产生,固体逐渐减少,溶液由无色变
,据此,你认为乙同学的猜想
(填“一”或“二”)成立。
交流反思
(1)甲、乙同学的实验中,反应均涉及到的化学方程式是
。(2)A3溶液未变红,你认为原因是A2溶液中
较多,加入的NaOH溶液未将其完全中和或恰好完全中和。(3)甲、乙同学经过实验对比探究,一致认为做化学实验时应注意药品用量的控制。
10.
(嘉兴、舟山中考)用久的热水瓶内胆有一层水垢[主要成分是CaCO3和Mg(OH)2],兴趣小组为了解具体成分进行了实验。他们取样品25g放入质量为100g的锥形瓶中,置于电子天平上,往瓶内加入150g稀盐酸时,恰好完全反应(样品中的杂质不与稀盐酸反应),此时天平示数如图。对所得混合物进行过滤、洗涤、干燥、称量,得到固体4.2g。请回答下列问题:
(1)恰好完全反应时,溶液中的溶质为
(填化学式)。
(2)样品中CaCO3的质量分数是多少?
(3)反应结束时溶液中MgCl2的质量分数是多少?(精确到0.1%)
参考答案
本章复习
1.
.
A
2.
C
3.
D
4.
D
5.
D
6.
C
7.
C
8.
(1)Na2CO3
(2)B中CO2气体跟氢氧化钠溶液反应使装置内气压下降,小于外部气压,气流从风哨进入
(3)>
9.
实验验证:甲:(1)不成立
(2)<
乙:浅绿色
二
交流反思:(1)NaOH+HClNaCl+H2O
(2)盐酸
10.
(1)CaCl2、MgCl2
(2)设样品中CaCO3的质量为x,
CO2的质量:25g+100g+150g-268.4g=6.6g
CaCO3+2HClCaCl2+H2O+CO2↑
100
44
x
6.6g
,x=15g,
样品中CaCO3的质量分数=×100%=60%
(3)设反应结束后产生的MgCl2为y,
样品中Mg(OH)2的质量为25g-15g-4.2g=5.8g
Mg(OH)2+2HClMgCl2+2H2O
58
95
5.8g
y
,y=9.5g
最后溶液的质量:25g-4.2g+150g-6.6g=164.2g
样品中MgCl2的质量分数=×100%=5.8%
