1.1化学方程式书写、配平及计算同步练习(无答案)
文档属性
| 名称 | 1.1化学方程式书写、配平及计算同步练习(无答案) |
|
|
| 格式 | zip | ||
| 文件大小 | 675.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-10-04 23:23:36 | ||
图片预览



文档简介
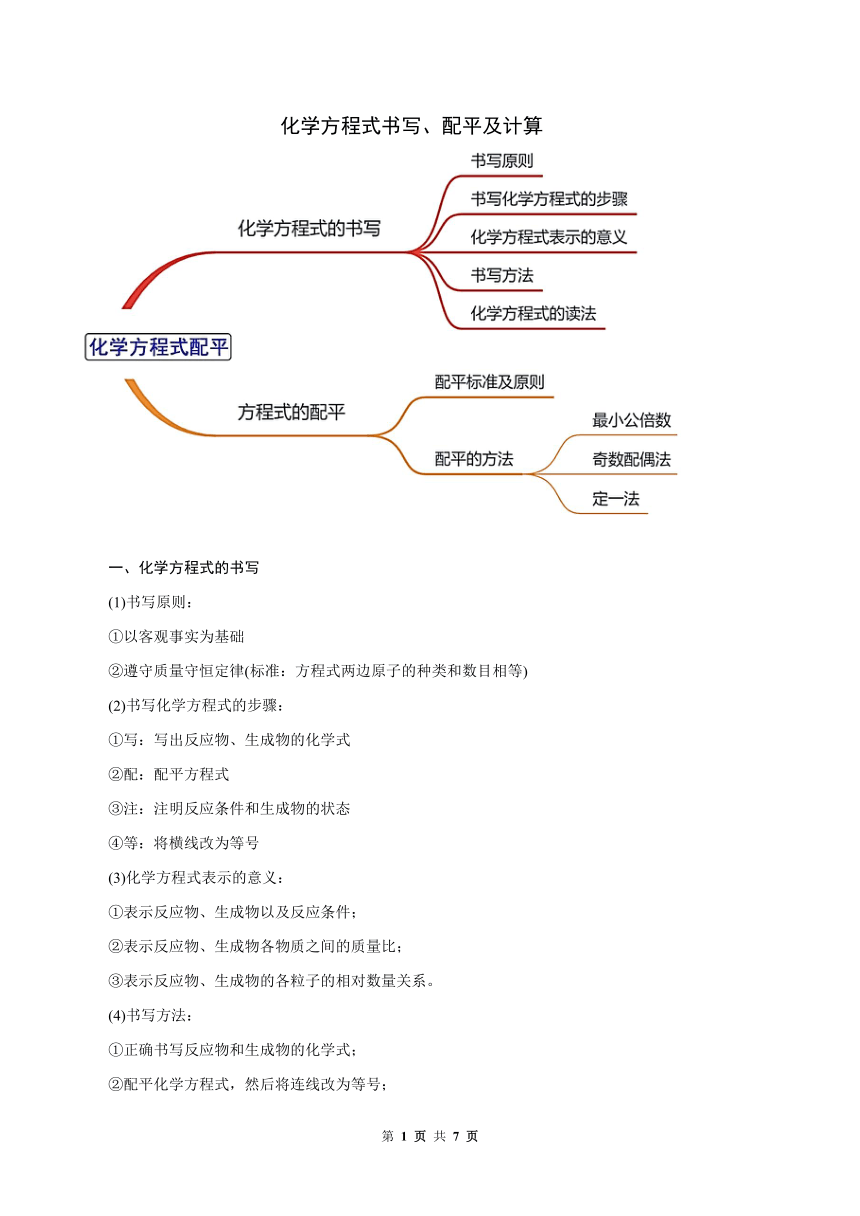
化学方程式书写、配平及计算
一、化学方程式的书写
(1)书写原则:
①以客观事实为基础
②遵守质量守恒定律(标准:方程式两边原子的种类和数目相等)
(2)书写化学方程式的步骤:
①写:写出反应物、生成物的化学式
②配:配平方程式
③注:注明反应条件和生成物的状态
④等:将横线改为等号
(3)化学方程式表示的意义:
①表示反应物、生成物以及反应条件;
②表示反应物、生成物各物质之间的质量比;
③表示反应物、生成物的各粒子的相对数量关系。
(4)书写方法:
①正确书写反应物和生成物的化学式;
②配平化学方程式,然后将连线改为等号;
③注明化学反应的条件及生成物的状态等。
(5)化学方程式的读法:
从左到右,先读反应物,后读生成物,反应物中“+”号读成“跟”、“与”或“和”。生成物中“+”读“和”。“==”读成“生成”。条件读“在……条件下反应”.
二、方程式的配平
(1)配平标准及原则
标准:方程式两边原子种类和数目相等即配平了
配平的原则:在化学式前面加上适当的系数来保.证方程式两边原子种类和数目相等。
(2)配平的方法
[最小公倍数]
Fe3O4+Al
Fe+
Al2O3
配平详解:①找最小公倍数最大的元素:铁原子的最小公倍数是3,氧原子的最小公倍数是12,铝原子的最小公倍数是2。所以从氧元素开始配。
②)计算系数:Fe3O4的系数=12/4=3,Al2O3的系数=12/3=4。
3Fe3O4+Al
Fe+
4Al2O3
③瞪眼观察:
根据Fe3O4和Al2O3的系数来确定Al和Fe的系数。
3Fe3O4+8Al===
(高温)Fe+
4Al2O3
[奇数配偶法]
FeS2+O2Fe2O3+
SO2
配平详解:①找箭头两端出现次数最多的元素:Fe两次、S两次、O三次,所以从氧元素开始配。
②找一奇一偶:确认配平起始点为O2和Fe2O3,并在该氧元素原子数是奇数的化学式前先配上2。
FeS2+O22Fe2O3+
SO2
③瞪眼观察:根据Fe2O3的系数来确定FeS2、SO2和O2的系数。
4FeS2+11O2===
(高温)2Fe2O3+8SO2
[定一法]
KClO3KCl+O2↑
配平详解:①找箭头两端元素种类最多、角标最大的物质,系数定为“1”。
1KClO3KCl+O2↑
②瞪眼观察由已知求未知,(为使两边所选定的元素原子个数相等,可能出现分数系数。处理办法就是等全部配平了,再去分母,把分数变成整数。)
1KClO3KCl+O2↑
③通分整理。
2KClO3===
(加热)2KCl+3O2↑
三、化学方程式基础计算
1.计算的依据:
化学反应中各物质的质量比为定值,且等于化学方程式中的相对分子质量与化学计量数乘积之比。
2.计算的步骤:
(1)设未知量。
注意:未知量不能带单位,且要指明未知量所代表的物理量。
(2)写出化学方程式。
注意:只能是该题所涉及的化学方程式。
(3)列出相关物质的相对分子质量和已知量、未知量。
注意:①找准已知量、未知量对应的化学式。
②已知量必须带单位未知量不能带单位;
③相对分子质量写在上,质量写在下。
(4)列比例式,求解
注意:①列比例式既可以横比,也可以纵比。
②列式和求解过程中已知量都要带单位;
③按要求保留小数位数,未指明时,一般保留至小数点后一位。
(5)简明地写出答
小技巧:①反应物或生成物不纯时,必须乘以纯度,才能代入化学方程式进行计算。②若反应物无气体,而生成物中有气体时,反应前后混合物的质量差就是气体质量,再用气体质量作为已知量来求未知量。
【专题1方程式的配平】
【例1】二氧化氮是大气的污染物之一.煤燃烧会产生一部分二氧化氮气体,它会与空气中的氧气、水蒸气发生反应形成酸雨,
NO2+O2+H2O===HNO3,
配平后各物质的化学计量数分别是(
)
A.1,1,1,2
B.2,1,1,2
C.4,1,2,4
D.6,2,3,6
【点评】本题难度不大,配平时化学计量数必须加在化学式的前面,配平过程中不能改变化学式中的下标;配平后化学计量数必须为整数,配平过程中若出现分数,必须把分数去分母转化为整数.
【专题2
方程式的计算】
【例2】有X,Y两元素,使12gX2与XY3反应生成24gC,化学方程式为:X2+XY3=3C,则X,Y两元素的相对原子质量之比(
)
A.1:1
B.1:2
C.3:1
D.3:4
【点评】本题主要考查了学生用宏观知识解决微观问题的能力,解题关键是根据两种反应物的质量比确定两种反应物的相对分子质量之比。
1.在反应□SO2+□H2S=□H2O+□S中,方框中各物质的化学计量数应该对应的是(
)
A.1,3,3,2
B.1,2,2,3
C.1,2,3,2
D.1,3,2,3
2.在反应□X2+□Y2===□XY3中,各化学式(代号)前的化学计量数分别是(
)
A.2,3,4
B.1,3,2
C.3,2,1
D.1,1,1
3.现有化学反应:xC2H6+yO2zCO2+wH2O,化学计量数之间关系正确的是(
)
A.2z=x
B.3x=2w
C.2x=z
D.y=2z+w
4.在化学方程式aC2H6+bO2mCO2+nH2O中,
各化学计量数之间的关系正确的是(
)
A.2m=a
B.3a=n
C.3m=4n
D.2b=mn
5.北京奥运会使用的“祥云”火炬燃料燃烧后不会对环境造成污染,体现了“绿色奥运”点燃的理念.该反应的化学方程式为:CxH8+5O23CO2+4H2O,则x是(
)
A.1
B.2
C.3
D.4
6.神舟六号载人航天飞行圆满成功,标志着我们在探索太空的伟大征程中取得了重大进展,发射时所用“长征”二号F系列火箭的发动机使用的燃料是联胺,助燃剂是液态四氧点燃化二氮.反应化学方程式是:xN2H4+yN2O4zN2+ωH2O,则x、y、z、ω分别为(
)
A.1、1、2、2
B.2、1、3、4
C.4、2、6、8
D.1、、、2
10.配平下列应的化学方程式(系数是1的也要填入)。
11.在A+3B===2C+2D的反应中,7gA和24gB恰好完全反应生成C和D,若B和D的相对分子质量之比为16:9,则生成C的质量为(
)
A.16g
B.22g
C.44g
D.88g
12.在反应:X+2Y=R+2M中,已知R和M的相对分子质量之比为22:9,当1.6克X与一定量Y完全反应,生成4.4克R,则在此反应中Y与M的质量比为(
)
A.16:9
B.9:16
C.23:9
D.9:23
13.镁在空气中燃烧时,发生如下两个反应:2Mg+O2===
(点燃)2MgO,3Mg+N2===
(点燃)Mg3N2.
已知12g镁在纯氧中燃烧可得到20g产物,则镁在空气中完全燃烧所得产物的质量是(
)
A.等于20g
B.小于20g
C.大于20g
D.无法确定
14.实验室用15.8克高锰酸钾制取氧气、反应一段时间后,称得剩余固体的质量是14.2克,则剩余物是(
)
A.K2MnO4
B.MnO2和K2MnO4
C.KMnO4和K2MnO4
D.MnO2和K2MnO4、KMnO4
15.相同质量的下列四种物质,完全分解后制得氧气质量最多的是(
)
A.H2O
B.KClO3
C.KMnO4
D.H2O2
16.密闭容器内有甲、乙、丙、丁四种物质,在一定条件下充分反应,反应前后各物质质量如表,则下列说法正确的是(
)
物质
甲
乙
丙
丁
反应前质量(g)
4
1
42
10
反应后质量(g)
X
20
6
31
A.乙、丁的相对分子质量比一定为19:21
B.该反应的表达式为:甲+乙→丙+丁
C.X的数值为0
D.参加反应的甲、丙质量比为4:9
17.金属单质A和非金属单质B可生成化合物A2B,反应的化学方程式为2A+B===
(点燃)A2B,某校甲、乙、丙三位同学分别在实验室内做该实验,充分反应时,所用A和B的质量a和b各不相同,但总质量相等,都是10.0g。有关实验数据记录如下:
A的用量
B的用量
A2B的用量
甲
9.0g
1.0g
5.0g
乙
4.0g
6.0g
5.0g
丙
ag
bg
6.0g
下列说法正确的是(
)
A.
A与B的相对分子质量之比是4:1
B.丙同学实验中a:b的值可能是22:3
C.该反应一定不是氧化反应
D.A2B可能是水
18.在潜水艇中常用过氧化钠(Na2O2)来吸收官兵呼出的二氧化碳气体,并产生氧气,供给人呼吸,同时会生成碳酸钠。现有780g过氧化钠与足量的二氧化碳反应,可生成多少克氧气
19.为测定某石灰石矿中碳酸钙(杂质不溶于水,也不参与反应)的质量分数,兴趣小组同学称取12.5克石灰石矿样品粉末放入锥形瓶中,将80克稀盐酸分四次加入,充分反应后用电子天平称量,
测得实验数据如表所示,
(已知:CaCO3+2HCl=CaCl+H2O+CO2↑)
(1)该石灰石矿中碳酸钙的质量分数为多少 (写出计算过程)
(2)下列情况可能会导致碳酸钙质量分数测量值偏大的是
A.实验开始时锥形瓶内含有少量空气
B.锥形瓶内部分水蒸气随二氧化碳逸出
C.反应结束后,锥形瓶内的二氧化碳残留
20.化学兴趣小组用一瓶久置的过氧化氢溶液制取氧气并测量溶液中过氧化氢的浓度。称量50g过氧化氢溶液和1g二氧化锰进行实验,反应前后质量随时间变化关系如图。分析计算:
(1)完全反应后,经过滤烘干,得到固体的质量为
(2)求50g过氧化氢溶液中过氧化氢的质量。(写计算过程)
第
1
页
共
8
页
一、化学方程式的书写
(1)书写原则:
①以客观事实为基础
②遵守质量守恒定律(标准:方程式两边原子的种类和数目相等)
(2)书写化学方程式的步骤:
①写:写出反应物、生成物的化学式
②配:配平方程式
③注:注明反应条件和生成物的状态
④等:将横线改为等号
(3)化学方程式表示的意义:
①表示反应物、生成物以及反应条件;
②表示反应物、生成物各物质之间的质量比;
③表示反应物、生成物的各粒子的相对数量关系。
(4)书写方法:
①正确书写反应物和生成物的化学式;
②配平化学方程式,然后将连线改为等号;
③注明化学反应的条件及生成物的状态等。
(5)化学方程式的读法:
从左到右,先读反应物,后读生成物,反应物中“+”号读成“跟”、“与”或“和”。生成物中“+”读“和”。“==”读成“生成”。条件读“在……条件下反应”.
二、方程式的配平
(1)配平标准及原则
标准:方程式两边原子种类和数目相等即配平了
配平的原则:在化学式前面加上适当的系数来保.证方程式两边原子种类和数目相等。
(2)配平的方法
[最小公倍数]
Fe3O4+Al
Fe+
Al2O3
配平详解:①找最小公倍数最大的元素:铁原子的最小公倍数是3,氧原子的最小公倍数是12,铝原子的最小公倍数是2。所以从氧元素开始配。
②)计算系数:Fe3O4的系数=12/4=3,Al2O3的系数=12/3=4。
3Fe3O4+Al
Fe+
4Al2O3
③瞪眼观察:
根据Fe3O4和Al2O3的系数来确定Al和Fe的系数。
3Fe3O4+8Al===
(高温)Fe+
4Al2O3
[奇数配偶法]
FeS2+O2Fe2O3+
SO2
配平详解:①找箭头两端出现次数最多的元素:Fe两次、S两次、O三次,所以从氧元素开始配。
②找一奇一偶:确认配平起始点为O2和Fe2O3,并在该氧元素原子数是奇数的化学式前先配上2。
FeS2+O22Fe2O3+
SO2
③瞪眼观察:根据Fe2O3的系数来确定FeS2、SO2和O2的系数。
4FeS2+11O2===
(高温)2Fe2O3+8SO2
[定一法]
KClO3KCl+O2↑
配平详解:①找箭头两端元素种类最多、角标最大的物质,系数定为“1”。
1KClO3KCl+O2↑
②瞪眼观察由已知求未知,(为使两边所选定的元素原子个数相等,可能出现分数系数。处理办法就是等全部配平了,再去分母,把分数变成整数。)
1KClO3KCl+O2↑
③通分整理。
2KClO3===
(加热)2KCl+3O2↑
三、化学方程式基础计算
1.计算的依据:
化学反应中各物质的质量比为定值,且等于化学方程式中的相对分子质量与化学计量数乘积之比。
2.计算的步骤:
(1)设未知量。
注意:未知量不能带单位,且要指明未知量所代表的物理量。
(2)写出化学方程式。
注意:只能是该题所涉及的化学方程式。
(3)列出相关物质的相对分子质量和已知量、未知量。
注意:①找准已知量、未知量对应的化学式。
②已知量必须带单位未知量不能带单位;
③相对分子质量写在上,质量写在下。
(4)列比例式,求解
注意:①列比例式既可以横比,也可以纵比。
②列式和求解过程中已知量都要带单位;
③按要求保留小数位数,未指明时,一般保留至小数点后一位。
(5)简明地写出答
小技巧:①反应物或生成物不纯时,必须乘以纯度,才能代入化学方程式进行计算。②若反应物无气体,而生成物中有气体时,反应前后混合物的质量差就是气体质量,再用气体质量作为已知量来求未知量。
【专题1方程式的配平】
【例1】二氧化氮是大气的污染物之一.煤燃烧会产生一部分二氧化氮气体,它会与空气中的氧气、水蒸气发生反应形成酸雨,
NO2+O2+H2O===HNO3,
配平后各物质的化学计量数分别是(
)
A.1,1,1,2
B.2,1,1,2
C.4,1,2,4
D.6,2,3,6
【点评】本题难度不大,配平时化学计量数必须加在化学式的前面,配平过程中不能改变化学式中的下标;配平后化学计量数必须为整数,配平过程中若出现分数,必须把分数去分母转化为整数.
【专题2
方程式的计算】
【例2】有X,Y两元素,使12gX2与XY3反应生成24gC,化学方程式为:X2+XY3=3C,则X,Y两元素的相对原子质量之比(
)
A.1:1
B.1:2
C.3:1
D.3:4
【点评】本题主要考查了学生用宏观知识解决微观问题的能力,解题关键是根据两种反应物的质量比确定两种反应物的相对分子质量之比。
1.在反应□SO2+□H2S=□H2O+□S中,方框中各物质的化学计量数应该对应的是(
)
A.1,3,3,2
B.1,2,2,3
C.1,2,3,2
D.1,3,2,3
2.在反应□X2+□Y2===□XY3中,各化学式(代号)前的化学计量数分别是(
)
A.2,3,4
B.1,3,2
C.3,2,1
D.1,1,1
3.现有化学反应:xC2H6+yO2zCO2+wH2O,化学计量数之间关系正确的是(
)
A.2z=x
B.3x=2w
C.2x=z
D.y=2z+w
4.在化学方程式aC2H6+bO2mCO2+nH2O中,
各化学计量数之间的关系正确的是(
)
A.2m=a
B.3a=n
C.3m=4n
D.2b=mn
5.北京奥运会使用的“祥云”火炬燃料燃烧后不会对环境造成污染,体现了“绿色奥运”点燃的理念.该反应的化学方程式为:CxH8+5O23CO2+4H2O,则x是(
)
A.1
B.2
C.3
D.4
6.神舟六号载人航天飞行圆满成功,标志着我们在探索太空的伟大征程中取得了重大进展,发射时所用“长征”二号F系列火箭的发动机使用的燃料是联胺,助燃剂是液态四氧点燃化二氮.反应化学方程式是:xN2H4+yN2O4zN2+ωH2O,则x、y、z、ω分别为(
)
A.1、1、2、2
B.2、1、3、4
C.4、2、6、8
D.1、、、2
10.配平下列应的化学方程式(系数是1的也要填入)。
11.在A+3B===2C+2D的反应中,7gA和24gB恰好完全反应生成C和D,若B和D的相对分子质量之比为16:9,则生成C的质量为(
)
A.16g
B.22g
C.44g
D.88g
12.在反应:X+2Y=R+2M中,已知R和M的相对分子质量之比为22:9,当1.6克X与一定量Y完全反应,生成4.4克R,则在此反应中Y与M的质量比为(
)
A.16:9
B.9:16
C.23:9
D.9:23
13.镁在空气中燃烧时,发生如下两个反应:2Mg+O2===
(点燃)2MgO,3Mg+N2===
(点燃)Mg3N2.
已知12g镁在纯氧中燃烧可得到20g产物,则镁在空气中完全燃烧所得产物的质量是(
)
A.等于20g
B.小于20g
C.大于20g
D.无法确定
14.实验室用15.8克高锰酸钾制取氧气、反应一段时间后,称得剩余固体的质量是14.2克,则剩余物是(
)
A.K2MnO4
B.MnO2和K2MnO4
C.KMnO4和K2MnO4
D.MnO2和K2MnO4、KMnO4
15.相同质量的下列四种物质,完全分解后制得氧气质量最多的是(
)
A.H2O
B.KClO3
C.KMnO4
D.H2O2
16.密闭容器内有甲、乙、丙、丁四种物质,在一定条件下充分反应,反应前后各物质质量如表,则下列说法正确的是(
)
物质
甲
乙
丙
丁
反应前质量(g)
4
1
42
10
反应后质量(g)
X
20
6
31
A.乙、丁的相对分子质量比一定为19:21
B.该反应的表达式为:甲+乙→丙+丁
C.X的数值为0
D.参加反应的甲、丙质量比为4:9
17.金属单质A和非金属单质B可生成化合物A2B,反应的化学方程式为2A+B===
(点燃)A2B,某校甲、乙、丙三位同学分别在实验室内做该实验,充分反应时,所用A和B的质量a和b各不相同,但总质量相等,都是10.0g。有关实验数据记录如下:
A的用量
B的用量
A2B的用量
甲
9.0g
1.0g
5.0g
乙
4.0g
6.0g
5.0g
丙
ag
bg
6.0g
下列说法正确的是(
)
A.
A与B的相对分子质量之比是4:1
B.丙同学实验中a:b的值可能是22:3
C.该反应一定不是氧化反应
D.A2B可能是水
18.在潜水艇中常用过氧化钠(Na2O2)来吸收官兵呼出的二氧化碳气体,并产生氧气,供给人呼吸,同时会生成碳酸钠。现有780g过氧化钠与足量的二氧化碳反应,可生成多少克氧气
19.为测定某石灰石矿中碳酸钙(杂质不溶于水,也不参与反应)的质量分数,兴趣小组同学称取12.5克石灰石矿样品粉末放入锥形瓶中,将80克稀盐酸分四次加入,充分反应后用电子天平称量,
测得实验数据如表所示,
(已知:CaCO3+2HCl=CaCl+H2O+CO2↑)
(1)该石灰石矿中碳酸钙的质量分数为多少 (写出计算过程)
(2)下列情况可能会导致碳酸钙质量分数测量值偏大的是
A.实验开始时锥形瓶内含有少量空气
B.锥形瓶内部分水蒸气随二氧化碳逸出
C.反应结束后,锥形瓶内的二氧化碳残留
20.化学兴趣小组用一瓶久置的过氧化氢溶液制取氧气并测量溶液中过氧化氢的浓度。称量50g过氧化氢溶液和1g二氧化锰进行实验,反应前后质量随时间变化关系如图。分析计算:
(1)完全反应后,经过滤烘干,得到固体的质量为
(2)求50g过氧化氢溶液中过氧化氢的质量。(写计算过程)
第
1
页
共
8
页
