2021-2022学年高一上学期化学鲁科版(2019)必修第一册第一章 微项目 探秘膨松剂 课件(34张ppt)
文档属性
| 名称 | 2021-2022学年高一上学期化学鲁科版(2019)必修第一册第一章 微项目 探秘膨松剂 课件(34张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 5.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-06 10:11:38 | ||
图片预览











文档简介
(共34张PPT)
微项目
探秘膨松剂
——体会研究物质性质的方法和程序的实用价值
1.对碳酸氢钠用作膨松剂的作用原理进行实验探究,体会研究物质的方法和程序的实用价值。
2.学习如何在真实情景中探究陌生物质的性质,分析和解决实际问题。
学习目标
生活中深受大家喜爱的食品
什么是膨松剂?
膨松剂是在食品加工过程中加入的,能使面胚发起形成多孔组织,从而使食品具有柔软或酥脆特点的一类物质。
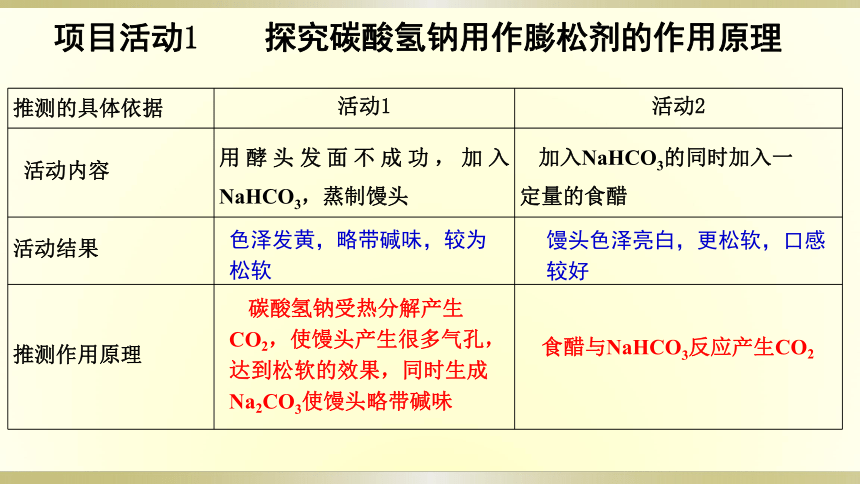
项目活动1
探究碳酸氢钠用作膨松剂的作用原理
推测的具体依据
活动1
活动2
活动内容
用酵头发面不成功,加入NaHCO3,蒸制馒头
加入NaHCO3的同时加入一定量的食醋
活动结果
推测作用原理
碳酸氢钠受热分解产生CO2,使馒头产生很多气孔,达到松软的效果,同时生成Na2CO3使馒头略带碱味
色泽发黄,略带碱味,较为松软
馒头色泽亮白,更松软,口感较好
食醋与NaHCO3反应产生CO2
化学膨松剂中基本都含有碳酸氢钠,那么碳酸氢钠为什么能有这个作用,作用原理可能是什么?
项目活动一、探究碳酸氢钠的蓬松作用原理
推测的具体依据
推测的碳酸氢钠的作用原理
碳酸氢钠受热分解产生CO2气体
加入食醋后蓬松效果更好
碳酸氢钠与酸反应生成CO2气体
思考质疑
碳酸氢钠可单独作为蒸馒头膨松剂
方案1
验证碳酸氢钠受热分解
实验用品:
(1)主要试剂:碳酸氢钠固体、澄清石灰水
(2)其他用品:大试管,酒精灯,铁架台(带铁夹),带导管的橡胶塞,烧杯,药匙
实验方案
实验现象
结论或反应方程式
反应原理:2NaHCO3===Na2CO3+H2O+CO2↑
方案设计与实施
连接装置后加热碳酸氢钠固体,将产生通入澄清石灰水中
试管内壁有水珠产生,有气泡出现,澄清石灰水变浑浊
加热碳酸氢钠有CO2
生成
方案2
验证碳酸氢钠与酸反应
实验方案
实验现象
结论或反应方程式
实验用品:
(1)主要试剂:碳酸氢钠固体、稀盐酸、澄清石灰水
(2)其他用品:大试管,铁架台(带铁夹),带导管的橡胶塞,烧杯
反应原理:NaHCO3+HCl
=
NaCl+H2O+CO2↑
圆底烧瓶中加碳酸氢钠,然后连接装有
稀盐酸的分液漏斗,将导管伸入澄清石灰水
有大量气泡产生
,澄清石灰水变浑浊
碳酸氢钠能与酸反应生成CO2
实验结论:
NaHCO3可以做膨松剂,且在酸性条件下,作用效果更好。
制作馒头的过程及现象
依据碳酸氢钠的性质,解释制作馒头过程中发生的现象。
碳酸氢钠会与面粉中糖类部分氧化产生的有机酸反应产生二氧化碳,既除去了面的酸味又使馒头中有很多气孔,此外碳酸氢钠本身受热分解就会产生二氧化碳使馒头膨大。
思考:
2、结合讨论和实验探究,总结你获得碳酸氢钠化学性质的方法。
实验法,观察法
3、能不能在面团里直接加入纯碱做膨松剂?为什么?
不能,纯碱热稳定性比较强,使用过后会使成品面团残有碱味
知识积累:
Na2CO3与NaHCO3的性质比较
外观
白色粉末
细小白色晶体
苏打、纯碱
小苏打
Na2CO3
NaHCO3
俗称:
水溶性
Na2CO3
NaHCO3
20℃时的溶解度
21.5g
7.8g
结论:
常温下,Na2CO3易溶于水、
NaHCO3
可溶于水
溶解性:
Na2CO3
>
NaHCO3
Na2CO3
NaHCO3
发酵粉,灭火剂,治疗胃酸过多
用于玻璃,肥皂,造纸,洗涤剂
主要用途
酸碱性
结论:
Na2CO3与NaHCO3的水溶液都显碱性
相同浓度时,
Na2CO3溶液的碱性>
NaHCO3溶液
Na2CO3溶液
NaHCO3溶液
Na2CO3溶液
稀盐酸
NaHCO3溶液
稀盐酸
现象:反应较慢,刚开始无气泡,后来才有气泡
现象:反应剧烈,马上有气泡
开始:Na2CO3+HCl(少)
=
NaHCO3+NaCl
后来:NaHCO3+HCl
=
NaCl
+
H2O+CO2
↑
NaHCO3+HCl=NaCl
+
H2O+CO2
↑
因而可利用这样的现象来检验Na2CO3(aq)和NaHCO3
(aq)
与盐酸反应
【思考】
为什么NaHCO3与盐酸反应产生CO2的速率比
Na2CO3与盐酸反应的速率更快
因为HCl与Na2CO3反应是二步反应:
第一步:Na2CO3+HCl=
NaHCO3+NaCl
第二步:
NaHCO3+HCl=
NaCl+H2O+CO2
HCl与NaHCO3反应是一步反应:
NaHCO3+HCl=
NaCl+H2O+CO2
思考题:
把稀HCl逐滴滴加到Na2CO3(aq)和把Na2CO3(aq)逐滴滴加到稀HCl现象一样吗 如不一样,有什么差别
Na2CO3溶液
稀盐酸
Na2CO3溶液
稀盐酸
现象:刚开始无气泡,后来才有气泡
现象:马上有气泡
开始:Na2CO3+HCl(少)
=
NaHCO3+NaCl
后来:NaHCO3+HCl
=
NaCl
+
H2O+CO2
↑
Na2CO3+2HCl(多)
=
2NaCl
+
H2O+CO2
↑
与碱反应
Na2CO3溶液
NaOH溶液
NaHCO3溶液
NaOH溶液
不反应
NaHCO3+NaOH
=
Na2CO3
+H2O
与碱反应
Na2CO3溶液
Ca(OH)2溶液
NaHCO3溶液
Ca(OH)2溶液
现象:溶液变浑浊
Na2CO3+
Ca(OH)2
=
CaCO3
↓+2NaOH
现象:溶液变浑浊
NaHCO3(多)+
Ca(OH)2
→
NaHCO3(少)+
Ca(OH)2
→
与可溶性钙盐、钡盐反应
Na2CO3溶液
CaCl2稀溶液
NaHCO3溶液
CaCl2稀溶液
现象:溶液变浑浊
Na2CO3+
CaCl2
=
CaCO3
↓
+2NaCl
无明显现象
不反应
现象:
1、加热碳酸钠,澄清石灰水无明显变化
2、加热碳酸氢钠,澄清石灰水变浑浊,沾有无水硫酸铜的棉花球变蓝
热稳定性
热稳定性:碳酸钠
>
碳酸氢钠
相互转化
Na2CO3
NaHCO3
①通CO2:Na2CO3+CO2+H2O
=
2NaHCO3
②加少量盐酸:Na2CO3+HCl
=
NaHCO3+NaCl
NaHCO3
Na2CO3
②加适量NaOH溶液:
NaHCO3+NaOH
=
Na2CO3
+H2O
①直接加热:2NaHCO3
=
Na2CO3+
CO2↑
△
现象:溶液变浑浊,产生白色沉淀
饱和Na2CO3溶液
石灰石
稀盐酸
↓
【预测】
往饱和的Na2CO3溶液中通足量的CO2会有什么现象
Na2CO3+CO2+H2O
=
2NaHCO3
饱和
过饱和
1、如何除去Na2CO3中少量的NaHCO3?
2、如何除去NaHCO3中少量的Na2CO3?
加适量NaOH溶液或加热
通入足量CO2
【思考】
小结:Na2CO3与NaHCO3的化学性质比较
物质
Na2CO3
NaHCO3
俗名
纯碱、苏打
小苏打
颜色、状态
白色粉末
白色粉末
水溶性
易溶于水
能溶于水
溶解度大小比较:
Na2CO3
>
NaHCO3
溶液与酚酞
相同浓度下,溶液碱性:Na2CO3
NaHCO3
与盐酸反应
盐酸少量:
盐酸过量:
反应速率:
NaHCO3
Na2CO3
与氯化钙溶液
与澄清石灰水
与氢氧化钠溶液
热稳定性
稳定
不稳定
化学方程式:
相互
转化
鉴别
项目活动2、设计并运用复合膨松剂
通过项目活动1
碳酸氢钠作膨松剂原理探究,你觉得如何选择合适的物质来制成复合膨松剂呢?
加入酸性物质可以解决一些问题
思考质疑
用碳酸氢钠蒸的馒头呈淡黄色,碳酸氢钠作为单一膨松剂,可能造成食品口味不纯,颜色加深等问题。
如何才能使馒头变得又白又松软,甚至口味更佳
实践活动
家庭自制:请同学们利用大休时间自制膨松剂,并制作
使用说明书。利用自制的复合膨松剂制作色、香、味等俱全
的面点
。以照片或视频形式记录并展示。
30
31
32
33
复合膨松剂的组成
用量
作用
碳酸盐类
如碳酸氢钠通常用量30%~50%
与酸性物质反应产生二氧化碳
酸性物质
如柠檬酸通常用量30%~40%
与碳酸盐反应,控制反应速率和提升膨松剂的作用效果,降低食品的碱性
助剂
指的是淀粉、脂肪酸等,通常用量10%~30%
防止膨松剂吸潮结块而失效,调节气体产生速率或使气体均匀产生
复合膨松剂的组成
预测
性质
设计
实验
分析现象
得到结论
研究物质性质的一般步骤
课堂小结
微项目
探秘膨松剂
——体会研究物质性质的方法和程序的实用价值
1.对碳酸氢钠用作膨松剂的作用原理进行实验探究,体会研究物质的方法和程序的实用价值。
2.学习如何在真实情景中探究陌生物质的性质,分析和解决实际问题。
学习目标
生活中深受大家喜爱的食品
什么是膨松剂?
膨松剂是在食品加工过程中加入的,能使面胚发起形成多孔组织,从而使食品具有柔软或酥脆特点的一类物质。
项目活动1
探究碳酸氢钠用作膨松剂的作用原理
推测的具体依据
活动1
活动2
活动内容
用酵头发面不成功,加入NaHCO3,蒸制馒头
加入NaHCO3的同时加入一定量的食醋
活动结果
推测作用原理
碳酸氢钠受热分解产生CO2,使馒头产生很多气孔,达到松软的效果,同时生成Na2CO3使馒头略带碱味
色泽发黄,略带碱味,较为松软
馒头色泽亮白,更松软,口感较好
食醋与NaHCO3反应产生CO2
化学膨松剂中基本都含有碳酸氢钠,那么碳酸氢钠为什么能有这个作用,作用原理可能是什么?
项目活动一、探究碳酸氢钠的蓬松作用原理
推测的具体依据
推测的碳酸氢钠的作用原理
碳酸氢钠受热分解产生CO2气体
加入食醋后蓬松效果更好
碳酸氢钠与酸反应生成CO2气体
思考质疑
碳酸氢钠可单独作为蒸馒头膨松剂
方案1
验证碳酸氢钠受热分解
实验用品:
(1)主要试剂:碳酸氢钠固体、澄清石灰水
(2)其他用品:大试管,酒精灯,铁架台(带铁夹),带导管的橡胶塞,烧杯,药匙
实验方案
实验现象
结论或反应方程式
反应原理:2NaHCO3===Na2CO3+H2O+CO2↑
方案设计与实施
连接装置后加热碳酸氢钠固体,将产生通入澄清石灰水中
试管内壁有水珠产生,有气泡出现,澄清石灰水变浑浊
加热碳酸氢钠有CO2
生成
方案2
验证碳酸氢钠与酸反应
实验方案
实验现象
结论或反应方程式
实验用品:
(1)主要试剂:碳酸氢钠固体、稀盐酸、澄清石灰水
(2)其他用品:大试管,铁架台(带铁夹),带导管的橡胶塞,烧杯
反应原理:NaHCO3+HCl
=
NaCl+H2O+CO2↑
圆底烧瓶中加碳酸氢钠,然后连接装有
稀盐酸的分液漏斗,将导管伸入澄清石灰水
有大量气泡产生
,澄清石灰水变浑浊
碳酸氢钠能与酸反应生成CO2
实验结论:
NaHCO3可以做膨松剂,且在酸性条件下,作用效果更好。
制作馒头的过程及现象
依据碳酸氢钠的性质,解释制作馒头过程中发生的现象。
碳酸氢钠会与面粉中糖类部分氧化产生的有机酸反应产生二氧化碳,既除去了面的酸味又使馒头中有很多气孔,此外碳酸氢钠本身受热分解就会产生二氧化碳使馒头膨大。
思考:
2、结合讨论和实验探究,总结你获得碳酸氢钠化学性质的方法。
实验法,观察法
3、能不能在面团里直接加入纯碱做膨松剂?为什么?
不能,纯碱热稳定性比较强,使用过后会使成品面团残有碱味
知识积累:
Na2CO3与NaHCO3的性质比较
外观
白色粉末
细小白色晶体
苏打、纯碱
小苏打
Na2CO3
NaHCO3
俗称:
水溶性
Na2CO3
NaHCO3
20℃时的溶解度
21.5g
7.8g
结论:
常温下,Na2CO3易溶于水、
NaHCO3
可溶于水
溶解性:
Na2CO3
>
NaHCO3
Na2CO3
NaHCO3
发酵粉,灭火剂,治疗胃酸过多
用于玻璃,肥皂,造纸,洗涤剂
主要用途
酸碱性
结论:
Na2CO3与NaHCO3的水溶液都显碱性
相同浓度时,
Na2CO3溶液的碱性>
NaHCO3溶液
Na2CO3溶液
NaHCO3溶液
Na2CO3溶液
稀盐酸
NaHCO3溶液
稀盐酸
现象:反应较慢,刚开始无气泡,后来才有气泡
现象:反应剧烈,马上有气泡
开始:Na2CO3+HCl(少)
=
NaHCO3+NaCl
后来:NaHCO3+HCl
=
NaCl
+
H2O+CO2
↑
NaHCO3+HCl=NaCl
+
H2O+CO2
↑
因而可利用这样的现象来检验Na2CO3(aq)和NaHCO3
(aq)
与盐酸反应
【思考】
为什么NaHCO3与盐酸反应产生CO2的速率比
Na2CO3与盐酸反应的速率更快
因为HCl与Na2CO3反应是二步反应:
第一步:Na2CO3+HCl=
NaHCO3+NaCl
第二步:
NaHCO3+HCl=
NaCl+H2O+CO2
HCl与NaHCO3反应是一步反应:
NaHCO3+HCl=
NaCl+H2O+CO2
思考题:
把稀HCl逐滴滴加到Na2CO3(aq)和把Na2CO3(aq)逐滴滴加到稀HCl现象一样吗 如不一样,有什么差别
Na2CO3溶液
稀盐酸
Na2CO3溶液
稀盐酸
现象:刚开始无气泡,后来才有气泡
现象:马上有气泡
开始:Na2CO3+HCl(少)
=
NaHCO3+NaCl
后来:NaHCO3+HCl
=
NaCl
+
H2O+CO2
↑
Na2CO3+2HCl(多)
=
2NaCl
+
H2O+CO2
↑
与碱反应
Na2CO3溶液
NaOH溶液
NaHCO3溶液
NaOH溶液
不反应
NaHCO3+NaOH
=
Na2CO3
+H2O
与碱反应
Na2CO3溶液
Ca(OH)2溶液
NaHCO3溶液
Ca(OH)2溶液
现象:溶液变浑浊
Na2CO3+
Ca(OH)2
=
CaCO3
↓+2NaOH
现象:溶液变浑浊
NaHCO3(多)+
Ca(OH)2
→
NaHCO3(少)+
Ca(OH)2
→
与可溶性钙盐、钡盐反应
Na2CO3溶液
CaCl2稀溶液
NaHCO3溶液
CaCl2稀溶液
现象:溶液变浑浊
Na2CO3+
CaCl2
=
CaCO3
↓
+2NaCl
无明显现象
不反应
现象:
1、加热碳酸钠,澄清石灰水无明显变化
2、加热碳酸氢钠,澄清石灰水变浑浊,沾有无水硫酸铜的棉花球变蓝
热稳定性
热稳定性:碳酸钠
>
碳酸氢钠
相互转化
Na2CO3
NaHCO3
①通CO2:Na2CO3+CO2+H2O
=
2NaHCO3
②加少量盐酸:Na2CO3+HCl
=
NaHCO3+NaCl
NaHCO3
Na2CO3
②加适量NaOH溶液:
NaHCO3+NaOH
=
Na2CO3
+H2O
①直接加热:2NaHCO3
=
Na2CO3+
CO2↑
△
现象:溶液变浑浊,产生白色沉淀
饱和Na2CO3溶液
石灰石
稀盐酸
↓
【预测】
往饱和的Na2CO3溶液中通足量的CO2会有什么现象
Na2CO3+CO2+H2O
=
2NaHCO3
饱和
过饱和
1、如何除去Na2CO3中少量的NaHCO3?
2、如何除去NaHCO3中少量的Na2CO3?
加适量NaOH溶液或加热
通入足量CO2
【思考】
小结:Na2CO3与NaHCO3的化学性质比较
物质
Na2CO3
NaHCO3
俗名
纯碱、苏打
小苏打
颜色、状态
白色粉末
白色粉末
水溶性
易溶于水
能溶于水
溶解度大小比较:
Na2CO3
>
NaHCO3
溶液与酚酞
相同浓度下,溶液碱性:Na2CO3
NaHCO3
与盐酸反应
盐酸少量:
盐酸过量:
反应速率:
NaHCO3
Na2CO3
与氯化钙溶液
与澄清石灰水
与氢氧化钠溶液
热稳定性
稳定
不稳定
化学方程式:
相互
转化
鉴别
项目活动2、设计并运用复合膨松剂
通过项目活动1
碳酸氢钠作膨松剂原理探究,你觉得如何选择合适的物质来制成复合膨松剂呢?
加入酸性物质可以解决一些问题
思考质疑
用碳酸氢钠蒸的馒头呈淡黄色,碳酸氢钠作为单一膨松剂,可能造成食品口味不纯,颜色加深等问题。
如何才能使馒头变得又白又松软,甚至口味更佳
实践活动
家庭自制:请同学们利用大休时间自制膨松剂,并制作
使用说明书。利用自制的复合膨松剂制作色、香、味等俱全
的面点
。以照片或视频形式记录并展示。
30
31
32
33
复合膨松剂的组成
用量
作用
碳酸盐类
如碳酸氢钠通常用量30%~50%
与酸性物质反应产生二氧化碳
酸性物质
如柠檬酸通常用量30%~40%
与碳酸盐反应,控制反应速率和提升膨松剂的作用效果,降低食品的碱性
助剂
指的是淀粉、脂肪酸等,通常用量10%~30%
防止膨松剂吸潮结块而失效,调节气体产生速率或使气体均匀产生
复合膨松剂的组成
预测
性质
设计
实验
分析现象
得到结论
研究物质性质的一般步骤
课堂小结
