2021-2022学年高一上学期化学鲁科版(2019)必修第一册3.2 硫的转化 课件 (68张ppt)
文档属性
| 名称 | 2021-2022学年高一上学期化学鲁科版(2019)必修第一册3.2 硫的转化 课件 (68张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 7.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-06 10:18:28 | ||
图片预览







文档简介
(共68张PPT)
鲁科版必修第一册
第3章
物质的性质与转化
第二节
硫的转化
3.2.1
自然界中的硫
二氧化硫
情景展示
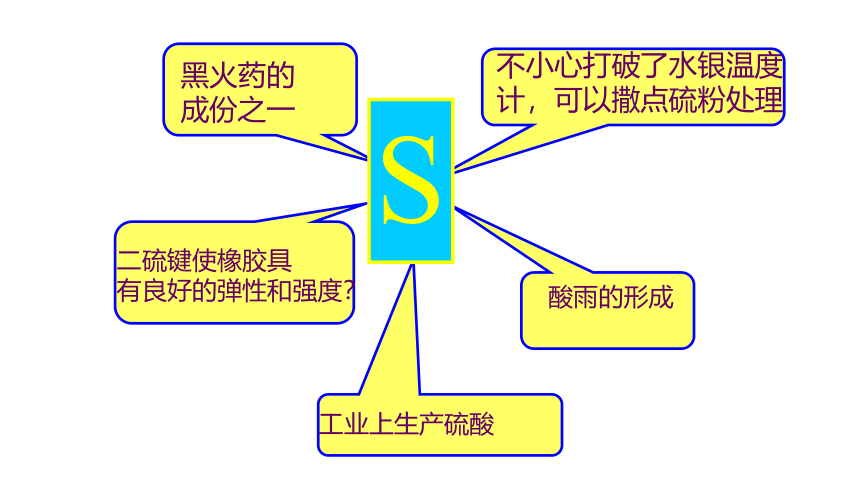
硫是重要的非金属元素,也是人类最早认识的化学元素之一,在硫原子核外电子排布中,最外层电子数是6,易得到2个电子形成8电子相对稳定结构,化学性质比较活泼。而淡黄色的硫单质及含硫化合物常常被炼丹家所使用,硫单质也是黑火药的主要成分。硫及其化合物在现代生产和生活中仍发挥着重要的作用,你知道吗?硫及化合物之间转化你能说出吗?
不小心打破了水银温度计,可以撒点硫粉处理
工业上生产硫酸
二硫键使橡胶具
有良好的弹性和强度?
酸雨的形成
黑火药的成份之一
S
一、自然界中的硫
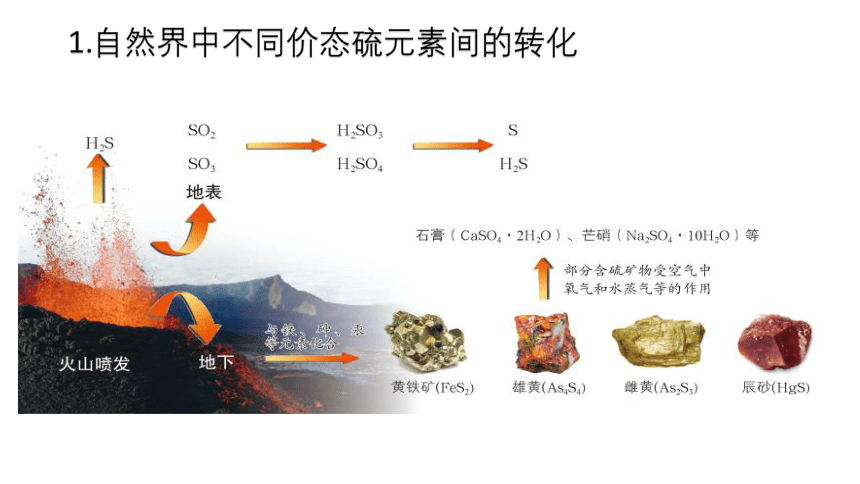
火山爆发
火山喷发时熔岩喷涌、浓烟滚滚,不仅释放出巨大能量,而且产生了许多含有硫元素的气体,在火山口还有硫单质出现。
思考
1.火山喷发时,产生的许多含有硫元素的气体是什么?
2.自然界中还有哪些含硫化合物?他们在自然界中是怎样产生和以什么形态存在?
3.在使用硫单质及含硫化合物的过程中,人们遇到了哪些问题?如何解决的?
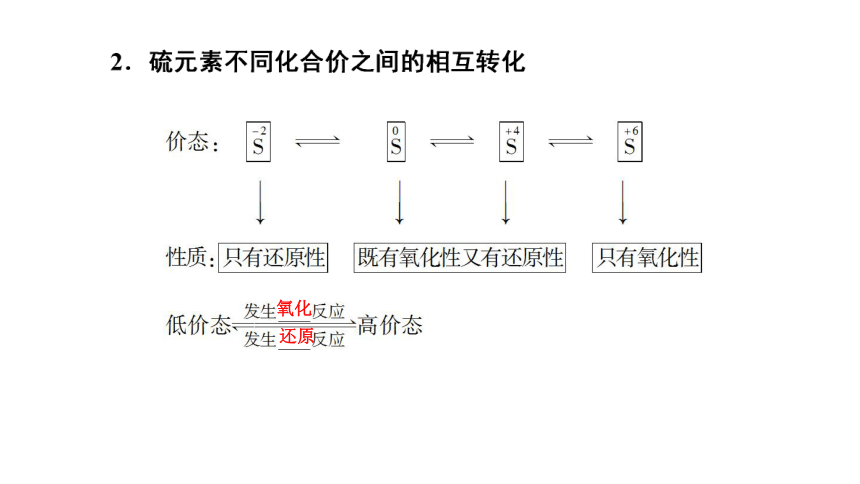
1.自然界中不同价态硫元素间的转化
从化合价角度分析
氧化
还原
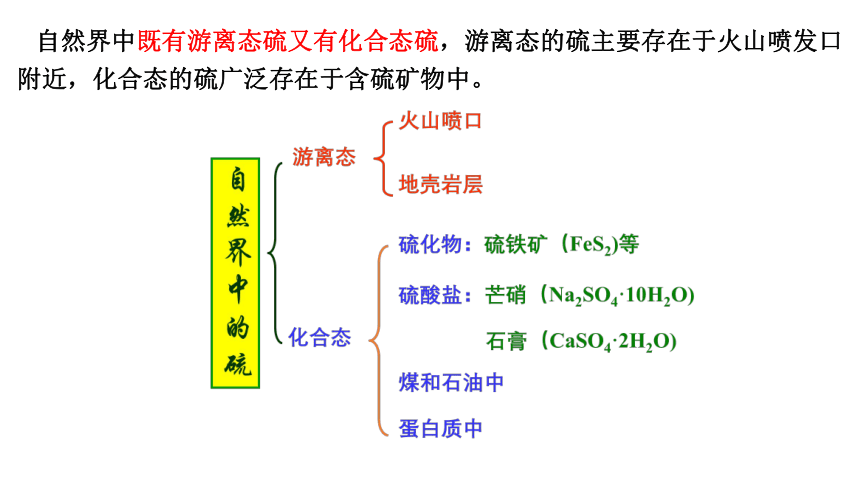
自然界中既有游离态硫又有化合态硫,游离态的硫主要存在于火山喷发口附近,化合态的硫广泛存在于含硫矿物中。
2、认识硫单质
二、
硫单质的化学性质
1、与金属反应
2、与非金属反应
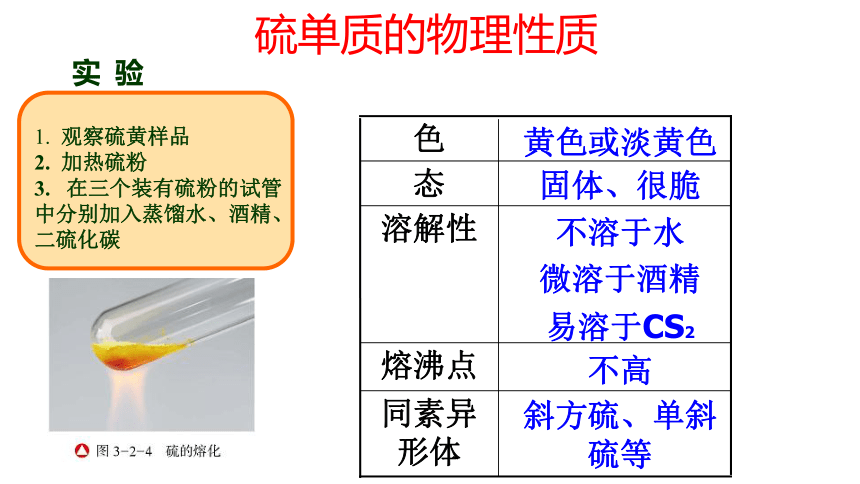
一、硫单质的物理性质
实
验
1.
观察硫黄样品
2.
加热硫粉
在三个装有硫粉的试管
中分别加入蒸馏水、酒精、
二硫化碳
硫单质的物理性质
不高
斜方硫、单斜硫等
不溶于水
微溶于酒精
易溶于CS2
固体、很脆
黄色或淡黄色
熔沸点
同素异形体
溶解性
态
色
常温时硫以斜方硫形式存在,外观菱形,超过95.6℃则渐渐转化为另一种同素异形体,外观为针状叫正交硫。
斜方硫
正交硫
硫的同素异形体
由同一种元素组成的性质不同的几种单质叫做该元素的同素异形体。
同素异形体之间的性质差异主要表现在物理性质上。
氧气(O2)与臭氧(O3)
金刚石与石墨
预测
硫单质的化学性质
1、硫元素有哪些价态?
2、单质硫具有怎样的化学性质?
-2、0、+4、+6
既有氧化性又有还原性
硫单质化学性质
当硫与强还原剂(金属、氢气、碳等)反应时,表现氧化性。(硫元素化合价降低)
当硫与氧气等强氧化剂反应时,表现还原性。(硫元素化合价升高)
思考:硫是一种活泼的非金属单质吗?
把研细的硫粉和铁粉按照一定比例混合均匀,放在石棉网上堆成条状或如图所示形状。用灼热的玻璃棒触及一端,当混合物呈红热状态时移开玻璃棒,观察发生现象。
现象:剧烈燃烧,发光发热,生成黑色固体。
Fe
+
S
=
FeS
△
硫单质具有氧化性
1、已知:Fe、Cu与硫黄和氯气的反应如下:
2Cu+S
=
Cu2S
Cu+Cl2
=
CuCl2
点燃
硫的氧化性弱于氯气。
Fe+S
=
FeS
2Fe+3Cl2
=
2
FeCl3
点燃
结论:硫与变价金属反应生成低价态硫化物,
氯气与变价金属反应生成高价态氯化物。
取少量硫粉放入燃烧匙中,将燃烧匙放在酒精灯上加热至硫粉熔化并燃烧后,迅速伸入盛满氧气的集气瓶中(瓶底装有少量水),观察现象。
发出蓝紫色火焰,放出热量,生成一种刺激性气味气体。
集气瓶中装少量水目的:吸收二氧化硫,防止污染空气。
S
+
O2
=
SO2
点燃
硫作为还原剂具还原性
硫与非金属的反应
S
+
O2
=
SO2
点燃
0
+4
硫作为还原剂,具还原性
0
-2
-2
0
硫作为氧化剂,具氧化性。
H2
+
S
=
H2S
△
C
+
2S
=
CS2
高温
划火柴时常闻到的一股呛鼻的气味,就是火柴头成份中的硫燃烧后产生的二氧化硫。
某同学取了一只试管准备做实验,发现里面沾了一些硫黄,便利用如下的反应原理进行清洗:
3S+6NaOH
=
2Na2S+Na2SO3+3H2O
那么洗涤硫的过程中硫表现了什么性质?
既表现氧化性又表现还原性
即学即用
根据所学知识如何清洗沾有硫黄的试管
△
【思考】在黑火药爆炸的反应中,硫的化合价降低,表现氧化性,化学方程式为:S+2KNO3+3CK2S+3CO2↑+N2↑。
(氧化剂
;还原剂
。)
单质
硫(S)性质小结
物理性质
[
颜色
溶解性]
S
弱还原性
较强氧化性
O2
SO2
H2
H2S
Cu
Cu2S
Al
Al2S3
Fe
FeS
与变价金属反应
生成低价的硫化物
长白山温泉
广东从化温泉
1、“硫磺”温泉可以医治皮肤病
畅所欲言
你能说出硫在生产、生活中的应用吗
2、制造火药,烟花爆竹
S
+
2KNO3
+
3C
==
K2S
+
3CO2↑+
N2↑
点燃
3.轮胎、胶管等橡胶制品
硫的用途
制造硫酸
制造化肥
制造火柴
杀虫剂
1.下列物质中,能在自然界中长期存在的是(
)
A.
S
B.
Na
C.
FeS2
D.
Cl2
AC
2.下列物质中,能通过单质间的化合反应直接得到的是(
)
A.
CuS
B.
FeCl2
C.
FeS
D.
Cu2S
CD
知识巩固:
易溶于水
无色
刺激性
27
3、认识二氧化硫
①、具有酸性氧化物的通性:
水、碱性氧化物、氢氧化钠溶液
②、氧化性:(H2S溶液)
硫化氢、硫化钠
③、还原性(Na2SO3溶液)
O2、酸性高猛酸钾、氯水(溴水、碘水)
④、漂白性:
能使品红溶液退色(用于检验SO2)
2、化学性质:
1、酸性氧化物的性质
⑴与H2O反应:
SO2+H2O=H2SO3【亚硫酸—还原性不稳定中强酸2H2SO3+O2==2H2SO4】
⑵与碱性氧化物反应:SO2+CaO=CaSO3
(与Na2O2的反应:SO2+Na2O2=Na2SO4)
⑶与碱反应:SO2(少量)+2NaOH=Na2SO3+H2O
;
SO2(过量)+NaOH=NaHSO3
(尾气处理)
(SO2与澄清石灰水反应,有与CO2类似的现象)
⑷与盐反应:SO2+H2O+Na2CO3
=
Na2SO3+CO2↑+H2O
SO2+H2O+Na2SO3
==
2NaHSO3
2、
SO2的还原性:
2SO2+O2
2SO3(还可被Cl2、Br2、I2、
KMnO4、FeCl3等氧化)
SO2+2H2O+Cl2=H2SO4+2HCl(
Br2、I2)
5SO2+2H2O+2KMnO4==2H2SO4+
K2SO4+2
MnSO4
3.SO2氧化性:
SO2
+
2H2S
=
2H2O
+
3S↓
4、SO2漂白性——能使品红褪色
某些有机色素
无色不稳定的物质(可逆)
用途:它可以用来漂白纸浆、毛、丝、草编制品等。
SO2气体检验方法:
将某气体通入到品红试液中,品红褪色,加热又恢复至红色,则证明该气体是SO2气体。
SO32-的检验:
先加入过量的BaCl2,生成白色沉淀,再加入盐酸,生成的无色有刺激性气味的、能使品红溶液褪色的气体。
正反两个方向
相同条件
33
SO2
CO2
物理性质
气味
有刺激性气味
无味
毒性
有毒
无毒
密度
比空气大
比空气大
溶解性
易溶(体积比1∶40)
可溶(体积比1∶1)
化学性质
与水的反应
SO2+H2O H2SO3
CO2+H2O H2CO3
与紫色石蕊试液
试液变红
试液变红
与碱的反应
少量:SO2+2NaOH===Na2SO3+H2O
少量:
CO2+2NaOH=
Na2CO3+H2O
过量:SO2+NaOH===
NaHSO3
过量:
CO2+NaOH==
NaHCO3
与澄清石灰水
SO2+Ca(OH)2===
CaSO3↓+H2O(现象:溶液变浑浊)
CO2+Ca(OH)2===
CaCO3↓+H2O(现象:溶液变浑浊)
与BaCl2溶液
不反应
不反应
与Ba(NO3)2溶液
SO2+Ba(NO3)2+H2O→
BaSO4↓+NO
溶液变浑浊
不反应
SO2和CO2的比较
SO2
CO2
化学性质
弱氧化性
SO2+2H2S===3S↓+2H2O
CO2+C=2CO
还原性
2SO2+O2
2SO3,二氧化硫能被酸性高锰酸钾、氯水、溴水、碘水等氧化剂氧化。
X2+SO2+2H2O===H2SO4+2HX(X=Cl、Br、I)
无还原性
漂白性
有,不稳定
无漂白性
对环境的影响
形成酸雨
引起温室效应
鉴别
①闻气味方法:SO2为无色有刺激性气味的气体,CO2为无色无味的气体。
②利用二氧化硫的还原性,用酸性高锰酸钾溶液或溴水鉴别,看是否退色
③利用二氧化硫的漂白性,用品红溶液鉴别
除杂
CO2中含SO2可用饱和NaHCO3溶液或酸性KMnO4溶液除去SO2
36
D
37
除杂:
CO2中含SO2可用饱和NaHCO3溶液或酸性KMnO4溶液除去SO2
类型
原理
特点
举例
适用对象
氧
化
型
漂白剂本身是强氧化剂,可将有色物质氧化,使有色物质失去原有的颜色
不可逆
HClO、
Ca(ClO)2、
Na2O2、
H2O2等
主要适用于漂白纺织品
加
合
型
漂白剂与有机色质结合生成新的无色物质,使有机色质失去原有的颜色
可逆
SO2或
H2SO3
常用于漂白纸张、纺织品等
吸
附
型
有些固体物质疏松多孔,具有较大的表面积,可以吸附有色物质而使之失去原有的颜色
部分吸附剂可重复使用
活性炭
吸附色素、一些有毒气体或微粒
漂白原理分类比较
随堂练习
1.下列溶液中能用来区分SO2和CO2气体的是( )
①澄清石灰水 ②H2S溶液 ③酸性KMnO4 ④氯水
⑤品红溶液 ⑥紫色石蕊溶液
A.①②③⑤ B.①⑥
C.①
D.②③④⑤
2.判断下列说法是否正确。
(1)SO2具有漂白性,能使溴水退色( )
(2)SO2是酸性氧化物,具有酸性氧化物的通性( )
(3)SO2能使紫色石蕊试液先变红后退色( )
(4)少量SO2通入BaCl2溶液中能生成白色沉淀( )
(5)可用饱和Na2CO3溶液除去CO2中的SO2( )
(6)硫在空气中燃烧生成SO2,在纯氧中燃烧则生成SO3( )
(1)在⑥中发生的化学反应方程式为________________________________________。
(2)①中的实验现象为石蕊试液________,此实验证明SO2是____________气体。
(3)②中的品红溶液________,证明SO2有_________________性。
(4)③中实验现象是______________________,证明SO2有________性。
(5)④中实验现象是______________________,证明SO2有________性。
(6)⑤中反应的离子方程式为_________________________________________________。
变红
酸性
褪色
漂白
有淡黄色沉淀生成
氧化
高锰酸钾溶液褪色
还原
SO2+2OH
=
SO32
+
H2O
浓硫酸
稀硫酸
H2SO4
H2SO4=
2H++SO42-
酸的通性
稀释
自身特性
主要以分子
形式存在
完全电离
(吸水性、脱水性、强氧化性)
稀硫酸的化学性质(二元强酸)
H2SO4
=
2H+
+
SO42-
(1)、能和酸碱指示剂反应:遇到紫色石蕊试液变红
(2)、和活泼金属反应:
如:Fe+
H2SO4=FeSO4+H2↑
(3)、和碱发生中和反应:
如:2NaOH+
H2SO4=Na2SO4+2H2O
(4)、和碱性氧化物反应:
如:CuO+
H2SO4=CuSO4+H2O
(5)、和某些盐反应:
如:BaCl2+H2SO4=BaSO4↓+2HCl
颜
色
:
状
态
:
沸
点
:
挥发性:
溶解性:
密
度
:
无
色
粘稠状液体
高沸点(338 C)
比水大
难挥发
易溶与水,能与水以任意比混合。溶解时放出大量的热。
浓硫酸
(一)物理性质:
稀释浓硫酸时,一定要把浓硫酸沿着器壁慢慢地注入水里,并用玻璃棒不断搅拌,切不可把水倒进浓硫酸中!
如何稀释浓硫酸?
浓硫酸沾在皮肤上:
立即用大量水冲洗,然后涂上3%~
5%的NaHCO3溶液。
浓硫酸溅在眼睛里:
立刻用大量的水冲洗,边洗边眨眼睛,切不可用手揉眼睛
“酸入水,杯壁下流”
(二)浓硫酸的化学性质——三大特性
1.吸水性
浓硫酸吸收物质中水蒸气或结晶水等实际存在的水(现有的水)。
CuSO4.5H2O晶体上滴加浓硫酸有何现象?
用途:可以作干燥剂
浓硫酸不能干燥的气体:
(1)碱性气体:NH3
(2)还原性气体:H2S、HBr、HI等
2.浓硫酸的脱水性
在烧杯中放入蔗糖,加几滴水,搅拌均匀后,加一定量的浓硫酸,迅速搅拌。观察现象。
将有机物中H、O按水的组成比(2:1)脱去。(物质本身不含水)
现象:蔗糖逐渐变黑,体积膨胀,形成疏松多孔的海绵状的炭。
说明:浓硫酸表现出氧化性、脱水性。
炭化现象
C12H22O11
12C+11H2O
浓H2SO4
△
C
+
2H2SO4(浓)==
CO2
↑+
2SO2↑+2H2O
△
现象:蔗糖逐渐变黑,体积膨胀,形成疏松多孔的海绵状的炭。
说明:浓硫酸表现出氧化性、脱水性。
①使Fe、Al钝化:
常温下,Fe、Al遇到浓硫酸会反应生成一层致密的氧化膜,阻止内部金属继续发生反应。(
“钝化”现象)。
加热条件下,Fe、Al会继续与浓硫酸反应。
(1)可以氧化大多数金属:Au、Pt
除外)
3、浓硫酸的强氧化性:
如铁与浓硫酸加热反应:
应用:工业上用铁
(铝)槽车盛放、运输冷的浓硫酸。
②与氢之前的活泼金属反应:
Zn+2H2SO4(浓)===ZnSO4+SO2↑+2H2O。
规律:①浓硫酸既表现氧化性,又表现酸性;
②浓硫酸一旦变稀,就发生:Zn+H2SO4==ZnSO4+H2↑
Δ
③与氢之后的不活泼金属(除Au、Pt外)反应:
Cu+2H2SO4(浓)===CuSO4+SO2↑+2H2O。
规律:①反应需加热,否则不反应;
②氧化产物是硫酸盐,金属显高价,还原产物为SO2;
③浓硫酸既表现氧化性,又表现酸性;
④随反应进行,硫酸浓度变小,一旦变为稀硫酸,反应就会停止。
Δ
Δ
(2)与非金属反应:
C+2H2SO4(浓)===CO2↑+2SO2↑+2H2O。
S
+
2H2SO4(浓)==
3SO2↑+2H2O
(3)与还原性化合物反应
如:H2S
、HI、HBr、Fe2+等
H2SO4(浓)
+
H2S
==
3、硫酸的用途——最重要的化工原料之一
强酸性:
制备硫酸盐、化肥;酸洗等
吸水性:
中性、酸性气体干燥剂
脱水性:
有机反应的脱水剂
难挥发性:
制备易挥发性酸如:HCl
三、硫酸的工业制法——接触法制硫酸
4FeS2
+11
O2
2Fe2O3
+
8SO2
高
温
SO3
+
H2O
H2SO4
2SO2
+
O2
2SO3
催化剂
加
热
第一步:
第二步:
第三步:
(1)主要原料:硫铁矿(又称黄铁矿,主要成分是FeS2)、空气、98.3%
浓硫酸。
(2)
生产原理
微点拨:用98.3%的浓硫酸吸收SO3,可以避免形成酸雾,并能提高吸收效率。
接触法制硫酸
沸腾炉
接触室
吸收塔
4FeS2+11O2====8SO2+2Fe2O3
高温
(用98.3%的浓硫酸吸收SO3,可以避免形成酸雾,并能提高吸收效率。
)
2SO2+O2====2SO3(可逆反应)
V2O5
加热
SO3+H2O===H2SO4
沸腾炉
接触室
吸收塔
S+O2====SO2
高温
两
种
重
要
硫
酸
盐
医疗上作“钡餐”
不溶于水和酸,不易被X射线穿透
白色
重晶石BaSO4
硫酸钡
制粉笔、绷带、塑像、豆腐凝固剂
2(CaSO4·2H2O)===
2CaSO4·H2O+3H2O
白色
石膏CaSO4·2H2O
熟石膏2CaSO4·H2O
硫酸钙
主要用途
主要性质
颜色
俗名和成分
名称
△
1、将浓H2SO4表现的性质填入括号内。
A.强酸性 B.强氧化性 C.脱水性 D.吸水性
(1)用磷矿粉[主要成分Ca3(PO4)2]和硫酸反应制磷酸(
)
(2)热的浓硫酸与铜片反应(
)
(3)浓H2SO4不能干燥NH3、H2S、HI等气体(
)
(4)浓H2SO4能吸收H2或SO2气体中的水分(
)
(5)浓硫酸使湿润的蓝色石蕊试纸先变红后变黑
(
)
2.浓硫酸在实现下列物质的转化过程中,既表现出氧化性,又表现出酸性的是(
)
①Cu
→CuSO4
②C→CO2 ③FeO→Fe2(SO4)3 ④Fe2O3→Fe2(SO4)3
A.①③ B.②④
C.①④
D.②③
三、酸雨及其防治
1、酸雨的形成过程
2、酸雨的形成原因
3、酸雨的危害
4、酸雨的防治
什么是酸雨
当降水的pH低于5.6时,降水即称为酸雨。
1、酸雨的形成过程
1.煤、石油中含有硫元素,故煤和石油燃烧会产生二氧化硫物质。
2.排放到空气中的二氧化硫在氧气和水蒸气的共同作用下形成酸雾,随雨水降落就成酸雨。
途径一:SO2+H2O
H2SO3
2H2SO3+O2=2H2SO4
途径二:2SO2+O2
2SO3
SO3+H2O=H2SO4
催化剂
2、酸雨来源
煤和石油等含硫物质的燃烧;火山爆发、硫酸的制备等
3、酸雨的危害
1.使湖泊的水变质→水生生物死亡
2.浸渍土壤→变得贫瘠
3.腐蚀建筑→建筑变得面目全非
4.渗入地下水→危害人体健康
5.酸雨侵蚀森迷→大面积死亡
4、酸雨防治
积极开发利用煤炭的新技术,推广煤炭的净化技术、转化技术,采取烟气脱硫、脱氮技术等重大措施。
减少硫的氧化物和氮的氧化物的排放量,是防止酸沉降的主要途径。
调整能源结构,发展太阳能、核能、水能、风能、地热能等不产生酸雨污染的能源。
化石燃料的脱硫处理,在煤粉燃烧前加入生石灰:
2CaSO3
+
O2
=
2CaSO4
SO2
+
CaO
==
CaSO3
△
在实验室中含有硫元素物质间的转化
活动·探究
不同价态硫元素之间的转化
实验目的:选取含有硫元素的物质,通过实验探究0、+4、+6这三种价态硫元素之间的相互转化。
实验用品:SO2水溶液、Na2SO3溶液、浓硫酸、
Na2S溶液、稀硫酸、NaOH溶液、酸性KMnO4溶液、氯水、KI溶液、品红溶液、铜片
酒精灯、玻璃管、橡胶塞、导气管、试管夹、试管、胶头滴管、铁架台等
实验方案设计与实施
学生必做实验
方法导引
探究不同价态硫元素之间的相互转化,实际上是探究含有不通过价态硫元素的物质之间的相互转化。
首先,要选择含有不同价态硫元素的物质
其次,实现不同价态硫元素之间的相互转化,依据的是氧化还原理论,需要寻找合适的氧化剂或还原剂。
再次,提供表明相应转化实际发生的证据。
预期
转化
选取试剂
实验
现象
结论及化学方程式
2
→0
+4→0
+4→+6
+6→+4
Na2S溶液、Na2SO3溶液、稀H2SO4
产生淡黄色沉淀
二氧化硫水溶液、酸性高锰酸钾
紫红色退去
浓硫酸、铜片、品红溶液
品红溶液退色
2Na2S+a2SO3
+3H2SO4=3Na2SO4+3S+3H2O
2KMnO4+5SO2+2H2O=
K2SO4+2MnSO4+2H2SO4
Cu+2H2SO4(浓)=CuSO4+SO2+2H2O
H2S
H2S
S
SO2
0
+6
溴水、HNO3、Fe3+
KMnO4(H+)、H2O2、
Cu、C、H2S
Cl2、O2、
KMnO4(H+)
-2
+4
H2SO4
O2
H2
思考
1.根据实验结果,用图示的方法表示不同价态硫元素之间的相互转化关系。
2.谈谈你对元素不同价态之间的转化与相关物质氧化性、还原性的认识。
鲁科版必修第一册
第3章
物质的性质与转化
第二节
硫的转化
3.2.1
自然界中的硫
二氧化硫
情景展示
硫是重要的非金属元素,也是人类最早认识的化学元素之一,在硫原子核外电子排布中,最外层电子数是6,易得到2个电子形成8电子相对稳定结构,化学性质比较活泼。而淡黄色的硫单质及含硫化合物常常被炼丹家所使用,硫单质也是黑火药的主要成分。硫及其化合物在现代生产和生活中仍发挥着重要的作用,你知道吗?硫及化合物之间转化你能说出吗?
不小心打破了水银温度计,可以撒点硫粉处理
工业上生产硫酸
二硫键使橡胶具
有良好的弹性和强度?
酸雨的形成
黑火药的成份之一
S
一、自然界中的硫
火山爆发
火山喷发时熔岩喷涌、浓烟滚滚,不仅释放出巨大能量,而且产生了许多含有硫元素的气体,在火山口还有硫单质出现。
思考
1.火山喷发时,产生的许多含有硫元素的气体是什么?
2.自然界中还有哪些含硫化合物?他们在自然界中是怎样产生和以什么形态存在?
3.在使用硫单质及含硫化合物的过程中,人们遇到了哪些问题?如何解决的?
1.自然界中不同价态硫元素间的转化
从化合价角度分析
氧化
还原
自然界中既有游离态硫又有化合态硫,游离态的硫主要存在于火山喷发口附近,化合态的硫广泛存在于含硫矿物中。
2、认识硫单质
二、
硫单质的化学性质
1、与金属反应
2、与非金属反应
一、硫单质的物理性质
实
验
1.
观察硫黄样品
2.
加热硫粉
在三个装有硫粉的试管
中分别加入蒸馏水、酒精、
二硫化碳
硫单质的物理性质
不高
斜方硫、单斜硫等
不溶于水
微溶于酒精
易溶于CS2
固体、很脆
黄色或淡黄色
熔沸点
同素异形体
溶解性
态
色
常温时硫以斜方硫形式存在,外观菱形,超过95.6℃则渐渐转化为另一种同素异形体,外观为针状叫正交硫。
斜方硫
正交硫
硫的同素异形体
由同一种元素组成的性质不同的几种单质叫做该元素的同素异形体。
同素异形体之间的性质差异主要表现在物理性质上。
氧气(O2)与臭氧(O3)
金刚石与石墨
预测
硫单质的化学性质
1、硫元素有哪些价态?
2、单质硫具有怎样的化学性质?
-2、0、+4、+6
既有氧化性又有还原性
硫单质化学性质
当硫与强还原剂(金属、氢气、碳等)反应时,表现氧化性。(硫元素化合价降低)
当硫与氧气等强氧化剂反应时,表现还原性。(硫元素化合价升高)
思考:硫是一种活泼的非金属单质吗?
把研细的硫粉和铁粉按照一定比例混合均匀,放在石棉网上堆成条状或如图所示形状。用灼热的玻璃棒触及一端,当混合物呈红热状态时移开玻璃棒,观察发生现象。
现象:剧烈燃烧,发光发热,生成黑色固体。
Fe
+
S
=
FeS
△
硫单质具有氧化性
1、已知:Fe、Cu与硫黄和氯气的反应如下:
2Cu+S
=
Cu2S
Cu+Cl2
=
CuCl2
点燃
硫的氧化性弱于氯气。
Fe+S
=
FeS
2Fe+3Cl2
=
2
FeCl3
点燃
结论:硫与变价金属反应生成低价态硫化物,
氯气与变价金属反应生成高价态氯化物。
取少量硫粉放入燃烧匙中,将燃烧匙放在酒精灯上加热至硫粉熔化并燃烧后,迅速伸入盛满氧气的集气瓶中(瓶底装有少量水),观察现象。
发出蓝紫色火焰,放出热量,生成一种刺激性气味气体。
集气瓶中装少量水目的:吸收二氧化硫,防止污染空气。
S
+
O2
=
SO2
点燃
硫作为还原剂具还原性
硫与非金属的反应
S
+
O2
=
SO2
点燃
0
+4
硫作为还原剂,具还原性
0
-2
-2
0
硫作为氧化剂,具氧化性。
H2
+
S
=
H2S
△
C
+
2S
=
CS2
高温
划火柴时常闻到的一股呛鼻的气味,就是火柴头成份中的硫燃烧后产生的二氧化硫。
某同学取了一只试管准备做实验,发现里面沾了一些硫黄,便利用如下的反应原理进行清洗:
3S+6NaOH
=
2Na2S+Na2SO3+3H2O
那么洗涤硫的过程中硫表现了什么性质?
既表现氧化性又表现还原性
即学即用
根据所学知识如何清洗沾有硫黄的试管
△
【思考】在黑火药爆炸的反应中,硫的化合价降低,表现氧化性,化学方程式为:S+2KNO3+3CK2S+3CO2↑+N2↑。
(氧化剂
;还原剂
。)
单质
硫(S)性质小结
物理性质
[
颜色
溶解性]
S
弱还原性
较强氧化性
O2
SO2
H2
H2S
Cu
Cu2S
Al
Al2S3
Fe
FeS
与变价金属反应
生成低价的硫化物
长白山温泉
广东从化温泉
1、“硫磺”温泉可以医治皮肤病
畅所欲言
你能说出硫在生产、生活中的应用吗
2、制造火药,烟花爆竹
S
+
2KNO3
+
3C
==
K2S
+
3CO2↑+
N2↑
点燃
3.轮胎、胶管等橡胶制品
硫的用途
制造硫酸
制造化肥
制造火柴
杀虫剂
1.下列物质中,能在自然界中长期存在的是(
)
A.
S
B.
Na
C.
FeS2
D.
Cl2
AC
2.下列物质中,能通过单质间的化合反应直接得到的是(
)
A.
CuS
B.
FeCl2
C.
FeS
D.
Cu2S
CD
知识巩固:
易溶于水
无色
刺激性
27
3、认识二氧化硫
①、具有酸性氧化物的通性:
水、碱性氧化物、氢氧化钠溶液
②、氧化性:(H2S溶液)
硫化氢、硫化钠
③、还原性(Na2SO3溶液)
O2、酸性高猛酸钾、氯水(溴水、碘水)
④、漂白性:
能使品红溶液退色(用于检验SO2)
2、化学性质:
1、酸性氧化物的性质
⑴与H2O反应:
SO2+H2O=H2SO3【亚硫酸—还原性不稳定中强酸2H2SO3+O2==2H2SO4】
⑵与碱性氧化物反应:SO2+CaO=CaSO3
(与Na2O2的反应:SO2+Na2O2=Na2SO4)
⑶与碱反应:SO2(少量)+2NaOH=Na2SO3+H2O
;
SO2(过量)+NaOH=NaHSO3
(尾气处理)
(SO2与澄清石灰水反应,有与CO2类似的现象)
⑷与盐反应:SO2+H2O+Na2CO3
=
Na2SO3+CO2↑+H2O
SO2+H2O+Na2SO3
==
2NaHSO3
2、
SO2的还原性:
2SO2+O2
2SO3(还可被Cl2、Br2、I2、
KMnO4、FeCl3等氧化)
SO2+2H2O+Cl2=H2SO4+2HCl(
Br2、I2)
5SO2+2H2O+2KMnO4==2H2SO4+
K2SO4+2
MnSO4
3.SO2氧化性:
SO2
+
2H2S
=
2H2O
+
3S↓
4、SO2漂白性——能使品红褪色
某些有机色素
无色不稳定的物质(可逆)
用途:它可以用来漂白纸浆、毛、丝、草编制品等。
SO2气体检验方法:
将某气体通入到品红试液中,品红褪色,加热又恢复至红色,则证明该气体是SO2气体。
SO32-的检验:
先加入过量的BaCl2,生成白色沉淀,再加入盐酸,生成的无色有刺激性气味的、能使品红溶液褪色的气体。
正反两个方向
相同条件
33
SO2
CO2
物理性质
气味
有刺激性气味
无味
毒性
有毒
无毒
密度
比空气大
比空气大
溶解性
易溶(体积比1∶40)
可溶(体积比1∶1)
化学性质
与水的反应
SO2+H2O H2SO3
CO2+H2O H2CO3
与紫色石蕊试液
试液变红
试液变红
与碱的反应
少量:SO2+2NaOH===Na2SO3+H2O
少量:
CO2+2NaOH=
Na2CO3+H2O
过量:SO2+NaOH===
NaHSO3
过量:
CO2+NaOH==
NaHCO3
与澄清石灰水
SO2+Ca(OH)2===
CaSO3↓+H2O(现象:溶液变浑浊)
CO2+Ca(OH)2===
CaCO3↓+H2O(现象:溶液变浑浊)
与BaCl2溶液
不反应
不反应
与Ba(NO3)2溶液
SO2+Ba(NO3)2+H2O→
BaSO4↓+NO
溶液变浑浊
不反应
SO2和CO2的比较
SO2
CO2
化学性质
弱氧化性
SO2+2H2S===3S↓+2H2O
CO2+C=2CO
还原性
2SO2+O2
2SO3,二氧化硫能被酸性高锰酸钾、氯水、溴水、碘水等氧化剂氧化。
X2+SO2+2H2O===H2SO4+2HX(X=Cl、Br、I)
无还原性
漂白性
有,不稳定
无漂白性
对环境的影响
形成酸雨
引起温室效应
鉴别
①闻气味方法:SO2为无色有刺激性气味的气体,CO2为无色无味的气体。
②利用二氧化硫的还原性,用酸性高锰酸钾溶液或溴水鉴别,看是否退色
③利用二氧化硫的漂白性,用品红溶液鉴别
除杂
CO2中含SO2可用饱和NaHCO3溶液或酸性KMnO4溶液除去SO2
36
D
37
除杂:
CO2中含SO2可用饱和NaHCO3溶液或酸性KMnO4溶液除去SO2
类型
原理
特点
举例
适用对象
氧
化
型
漂白剂本身是强氧化剂,可将有色物质氧化,使有色物质失去原有的颜色
不可逆
HClO、
Ca(ClO)2、
Na2O2、
H2O2等
主要适用于漂白纺织品
加
合
型
漂白剂与有机色质结合生成新的无色物质,使有机色质失去原有的颜色
可逆
SO2或
H2SO3
常用于漂白纸张、纺织品等
吸
附
型
有些固体物质疏松多孔,具有较大的表面积,可以吸附有色物质而使之失去原有的颜色
部分吸附剂可重复使用
活性炭
吸附色素、一些有毒气体或微粒
漂白原理分类比较
随堂练习
1.下列溶液中能用来区分SO2和CO2气体的是( )
①澄清石灰水 ②H2S溶液 ③酸性KMnO4 ④氯水
⑤品红溶液 ⑥紫色石蕊溶液
A.①②③⑤ B.①⑥
C.①
D.②③④⑤
2.判断下列说法是否正确。
(1)SO2具有漂白性,能使溴水退色( )
(2)SO2是酸性氧化物,具有酸性氧化物的通性( )
(3)SO2能使紫色石蕊试液先变红后退色( )
(4)少量SO2通入BaCl2溶液中能生成白色沉淀( )
(5)可用饱和Na2CO3溶液除去CO2中的SO2( )
(6)硫在空气中燃烧生成SO2,在纯氧中燃烧则生成SO3( )
(1)在⑥中发生的化学反应方程式为________________________________________。
(2)①中的实验现象为石蕊试液________,此实验证明SO2是____________气体。
(3)②中的品红溶液________,证明SO2有_________________性。
(4)③中实验现象是______________________,证明SO2有________性。
(5)④中实验现象是______________________,证明SO2有________性。
(6)⑤中反应的离子方程式为_________________________________________________。
变红
酸性
褪色
漂白
有淡黄色沉淀生成
氧化
高锰酸钾溶液褪色
还原
SO2+2OH
=
SO32
+
H2O
浓硫酸
稀硫酸
H2SO4
H2SO4=
2H++SO42-
酸的通性
稀释
自身特性
主要以分子
形式存在
完全电离
(吸水性、脱水性、强氧化性)
稀硫酸的化学性质(二元强酸)
H2SO4
=
2H+
+
SO42-
(1)、能和酸碱指示剂反应:遇到紫色石蕊试液变红
(2)、和活泼金属反应:
如:Fe+
H2SO4=FeSO4+H2↑
(3)、和碱发生中和反应:
如:2NaOH+
H2SO4=Na2SO4+2H2O
(4)、和碱性氧化物反应:
如:CuO+
H2SO4=CuSO4+H2O
(5)、和某些盐反应:
如:BaCl2+H2SO4=BaSO4↓+2HCl
颜
色
:
状
态
:
沸
点
:
挥发性:
溶解性:
密
度
:
无
色
粘稠状液体
高沸点(338 C)
比水大
难挥发
易溶与水,能与水以任意比混合。溶解时放出大量的热。
浓硫酸
(一)物理性质:
稀释浓硫酸时,一定要把浓硫酸沿着器壁慢慢地注入水里,并用玻璃棒不断搅拌,切不可把水倒进浓硫酸中!
如何稀释浓硫酸?
浓硫酸沾在皮肤上:
立即用大量水冲洗,然后涂上3%~
5%的NaHCO3溶液。
浓硫酸溅在眼睛里:
立刻用大量的水冲洗,边洗边眨眼睛,切不可用手揉眼睛
“酸入水,杯壁下流”
(二)浓硫酸的化学性质——三大特性
1.吸水性
浓硫酸吸收物质中水蒸气或结晶水等实际存在的水(现有的水)。
CuSO4.5H2O晶体上滴加浓硫酸有何现象?
用途:可以作干燥剂
浓硫酸不能干燥的气体:
(1)碱性气体:NH3
(2)还原性气体:H2S、HBr、HI等
2.浓硫酸的脱水性
在烧杯中放入蔗糖,加几滴水,搅拌均匀后,加一定量的浓硫酸,迅速搅拌。观察现象。
将有机物中H、O按水的组成比(2:1)脱去。(物质本身不含水)
现象:蔗糖逐渐变黑,体积膨胀,形成疏松多孔的海绵状的炭。
说明:浓硫酸表现出氧化性、脱水性。
炭化现象
C12H22O11
12C+11H2O
浓H2SO4
△
C
+
2H2SO4(浓)==
CO2
↑+
2SO2↑+2H2O
△
现象:蔗糖逐渐变黑,体积膨胀,形成疏松多孔的海绵状的炭。
说明:浓硫酸表现出氧化性、脱水性。
①使Fe、Al钝化:
常温下,Fe、Al遇到浓硫酸会反应生成一层致密的氧化膜,阻止内部金属继续发生反应。(
“钝化”现象)。
加热条件下,Fe、Al会继续与浓硫酸反应。
(1)可以氧化大多数金属:Au、Pt
除外)
3、浓硫酸的强氧化性:
如铁与浓硫酸加热反应:
应用:工业上用铁
(铝)槽车盛放、运输冷的浓硫酸。
②与氢之前的活泼金属反应:
Zn+2H2SO4(浓)===ZnSO4+SO2↑+2H2O。
规律:①浓硫酸既表现氧化性,又表现酸性;
②浓硫酸一旦变稀,就发生:Zn+H2SO4==ZnSO4+H2↑
Δ
③与氢之后的不活泼金属(除Au、Pt外)反应:
Cu+2H2SO4(浓)===CuSO4+SO2↑+2H2O。
规律:①反应需加热,否则不反应;
②氧化产物是硫酸盐,金属显高价,还原产物为SO2;
③浓硫酸既表现氧化性,又表现酸性;
④随反应进行,硫酸浓度变小,一旦变为稀硫酸,反应就会停止。
Δ
Δ
(2)与非金属反应:
C+2H2SO4(浓)===CO2↑+2SO2↑+2H2O。
S
+
2H2SO4(浓)==
3SO2↑+2H2O
(3)与还原性化合物反应
如:H2S
、HI、HBr、Fe2+等
H2SO4(浓)
+
H2S
==
3、硫酸的用途——最重要的化工原料之一
强酸性:
制备硫酸盐、化肥;酸洗等
吸水性:
中性、酸性气体干燥剂
脱水性:
有机反应的脱水剂
难挥发性:
制备易挥发性酸如:HCl
三、硫酸的工业制法——接触法制硫酸
4FeS2
+11
O2
2Fe2O3
+
8SO2
高
温
SO3
+
H2O
H2SO4
2SO2
+
O2
2SO3
催化剂
加
热
第一步:
第二步:
第三步:
(1)主要原料:硫铁矿(又称黄铁矿,主要成分是FeS2)、空气、98.3%
浓硫酸。
(2)
生产原理
微点拨:用98.3%的浓硫酸吸收SO3,可以避免形成酸雾,并能提高吸收效率。
接触法制硫酸
沸腾炉
接触室
吸收塔
4FeS2+11O2====8SO2+2Fe2O3
高温
(用98.3%的浓硫酸吸收SO3,可以避免形成酸雾,并能提高吸收效率。
)
2SO2+O2====2SO3(可逆反应)
V2O5
加热
SO3+H2O===H2SO4
沸腾炉
接触室
吸收塔
S+O2====SO2
高温
两
种
重
要
硫
酸
盐
医疗上作“钡餐”
不溶于水和酸,不易被X射线穿透
白色
重晶石BaSO4
硫酸钡
制粉笔、绷带、塑像、豆腐凝固剂
2(CaSO4·2H2O)===
2CaSO4·H2O+3H2O
白色
石膏CaSO4·2H2O
熟石膏2CaSO4·H2O
硫酸钙
主要用途
主要性质
颜色
俗名和成分
名称
△
1、将浓H2SO4表现的性质填入括号内。
A.强酸性 B.强氧化性 C.脱水性 D.吸水性
(1)用磷矿粉[主要成分Ca3(PO4)2]和硫酸反应制磷酸(
)
(2)热的浓硫酸与铜片反应(
)
(3)浓H2SO4不能干燥NH3、H2S、HI等气体(
)
(4)浓H2SO4能吸收H2或SO2气体中的水分(
)
(5)浓硫酸使湿润的蓝色石蕊试纸先变红后变黑
(
)
2.浓硫酸在实现下列物质的转化过程中,既表现出氧化性,又表现出酸性的是(
)
①Cu
→CuSO4
②C→CO2 ③FeO→Fe2(SO4)3 ④Fe2O3→Fe2(SO4)3
A.①③ B.②④
C.①④
D.②③
三、酸雨及其防治
1、酸雨的形成过程
2、酸雨的形成原因
3、酸雨的危害
4、酸雨的防治
什么是酸雨
当降水的pH低于5.6时,降水即称为酸雨。
1、酸雨的形成过程
1.煤、石油中含有硫元素,故煤和石油燃烧会产生二氧化硫物质。
2.排放到空气中的二氧化硫在氧气和水蒸气的共同作用下形成酸雾,随雨水降落就成酸雨。
途径一:SO2+H2O
H2SO3
2H2SO3+O2=2H2SO4
途径二:2SO2+O2
2SO3
SO3+H2O=H2SO4
催化剂
2、酸雨来源
煤和石油等含硫物质的燃烧;火山爆发、硫酸的制备等
3、酸雨的危害
1.使湖泊的水变质→水生生物死亡
2.浸渍土壤→变得贫瘠
3.腐蚀建筑→建筑变得面目全非
4.渗入地下水→危害人体健康
5.酸雨侵蚀森迷→大面积死亡
4、酸雨防治
积极开发利用煤炭的新技术,推广煤炭的净化技术、转化技术,采取烟气脱硫、脱氮技术等重大措施。
减少硫的氧化物和氮的氧化物的排放量,是防止酸沉降的主要途径。
调整能源结构,发展太阳能、核能、水能、风能、地热能等不产生酸雨污染的能源。
化石燃料的脱硫处理,在煤粉燃烧前加入生石灰:
2CaSO3
+
O2
=
2CaSO4
SO2
+
CaO
==
CaSO3
△
在实验室中含有硫元素物质间的转化
活动·探究
不同价态硫元素之间的转化
实验目的:选取含有硫元素的物质,通过实验探究0、+4、+6这三种价态硫元素之间的相互转化。
实验用品:SO2水溶液、Na2SO3溶液、浓硫酸、
Na2S溶液、稀硫酸、NaOH溶液、酸性KMnO4溶液、氯水、KI溶液、品红溶液、铜片
酒精灯、玻璃管、橡胶塞、导气管、试管夹、试管、胶头滴管、铁架台等
实验方案设计与实施
学生必做实验
方法导引
探究不同价态硫元素之间的相互转化,实际上是探究含有不通过价态硫元素的物质之间的相互转化。
首先,要选择含有不同价态硫元素的物质
其次,实现不同价态硫元素之间的相互转化,依据的是氧化还原理论,需要寻找合适的氧化剂或还原剂。
再次,提供表明相应转化实际发生的证据。
预期
转化
选取试剂
实验
现象
结论及化学方程式
2
→0
+4→0
+4→+6
+6→+4
Na2S溶液、Na2SO3溶液、稀H2SO4
产生淡黄色沉淀
二氧化硫水溶液、酸性高锰酸钾
紫红色退去
浓硫酸、铜片、品红溶液
品红溶液退色
2Na2S+a2SO3
+3H2SO4=3Na2SO4+3S+3H2O
2KMnO4+5SO2+2H2O=
K2SO4+2MnSO4+2H2SO4
Cu+2H2SO4(浓)=CuSO4+SO2+2H2O
H2S
H2S
S
SO2
0
+6
溴水、HNO3、Fe3+
KMnO4(H+)、H2O2、
Cu、C、H2S
Cl2、O2、
KMnO4(H+)
-2
+4
H2SO4
O2
H2
思考
1.根据实验结果,用图示的方法表示不同价态硫元素之间的相互转化关系。
2.谈谈你对元素不同价态之间的转化与相关物质氧化性、还原性的认识。
