高中化学人教版(2019)必修一第一章 第一节 物质的分类 及转化1 课件(24张ppt)
文档属性
| 名称 | 高中化学人教版(2019)必修一第一章 第一节 物质的分类 及转化1 课件(24张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-06 11:27:36 | ||
图片预览

文档简介
(共24张PPT)
第一章
物质及其变化
第一节
物质的分类及其转化
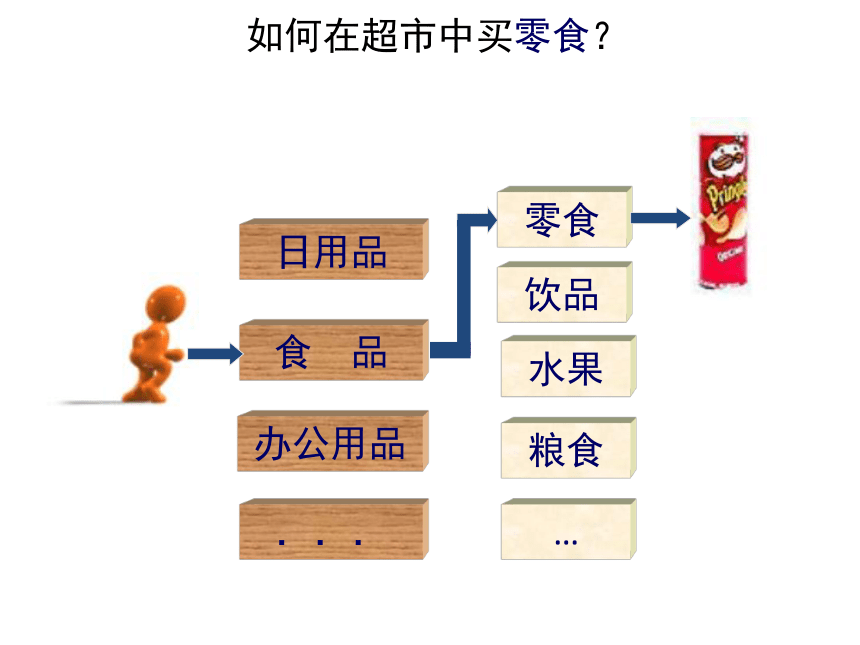
如何在超市中买零食?
食 品
日用品
办公用品
...
水果
零食
饮品
粮食
…
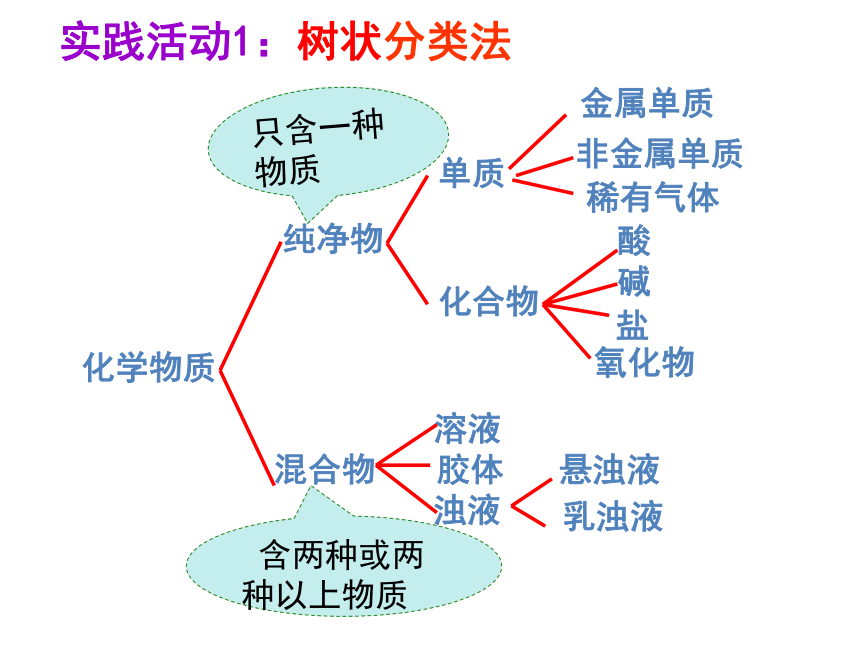
化学物质
纯净物
混合物
单质
化合物
金属单质
非金属单质
酸
碱
氧化物
盐
溶液
胶体
浊液
悬浊液
乳浊液
实践活动1:树状分类法
含两种或两种以上物质
只含一种物质
稀有气体
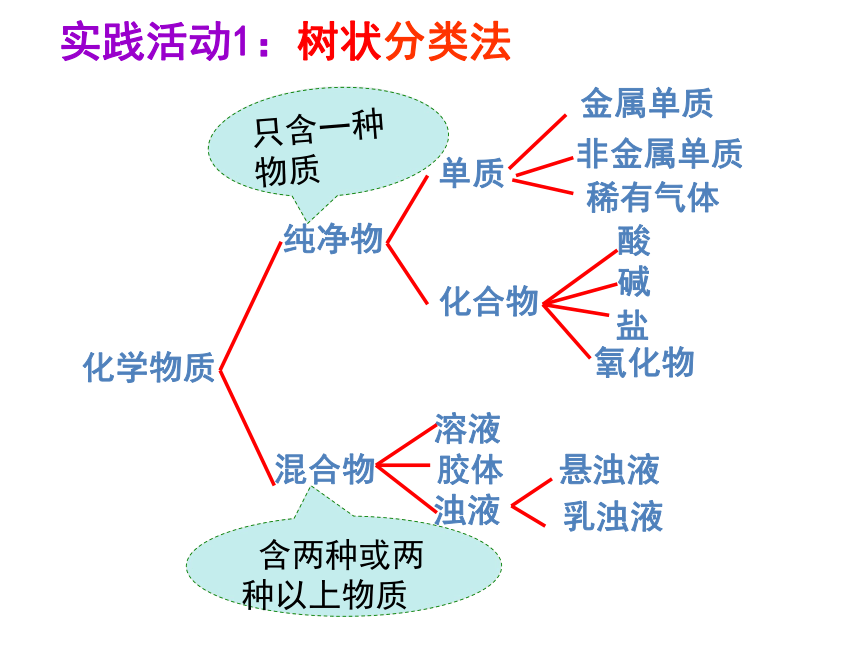
化学物质
纯净物
混合物
单质
化合物
金属单质
非金属单质
酸
碱
氧化物
盐
溶液
胶体
浊液
悬浊液
乳浊液
实践活动1:树状分类法
含两种或两种以上物质
只含一种物质
稀有气体
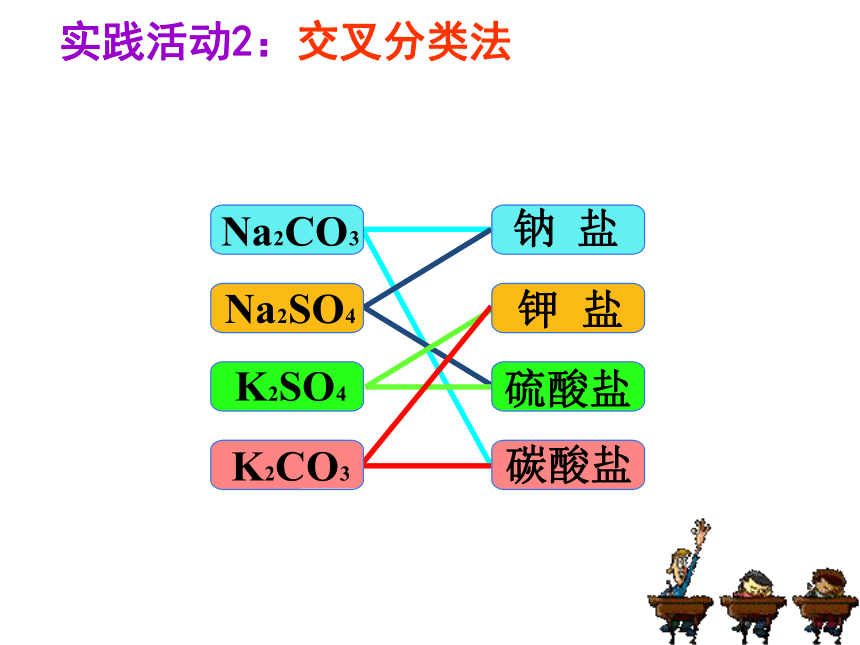
实践活动2:交叉分类法
非金属
酸性氧化物
碱
金属
碱性氧化物
酸
盐
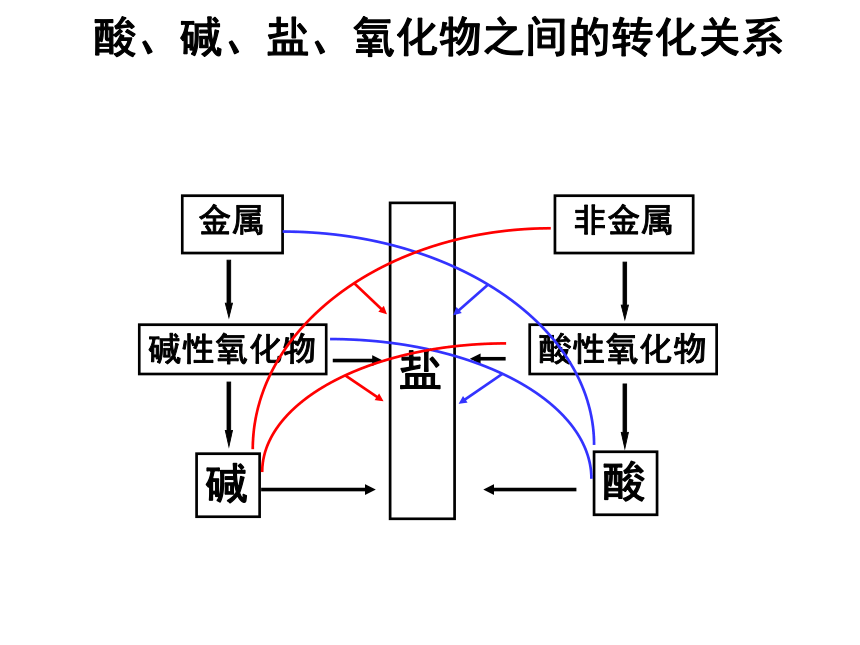
酸、碱、盐、氧化物之间的转化关系
概念
举例说明
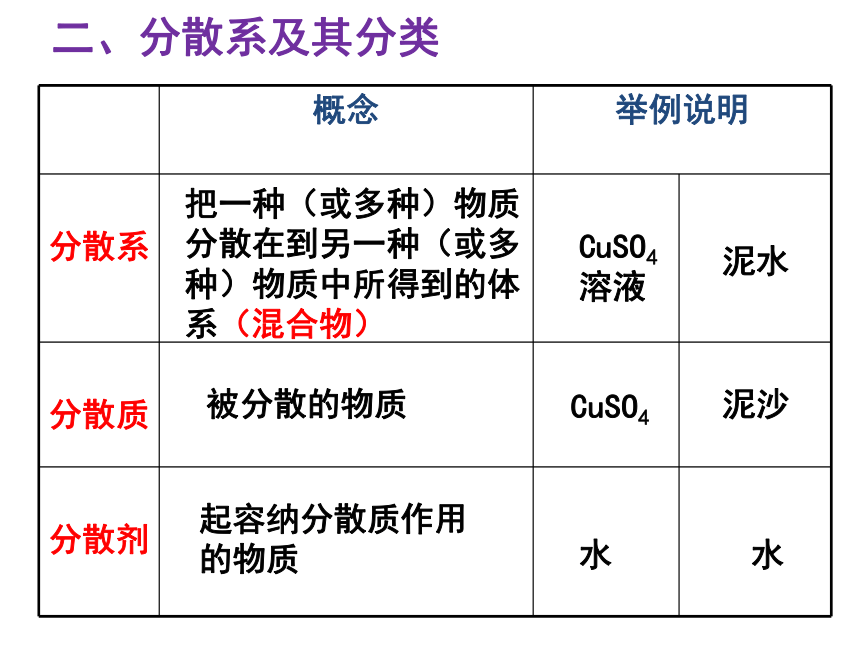
分散系
分散质
分散剂
把一种(或多种)物质分散在到另一种(或多种)物质中所得到的体系(混合物)
被分散的物质
起容纳分散质作用的物质
CuSO4
溶液
泥水
CuSO4
泥沙
水
水
二、分散系及其分类
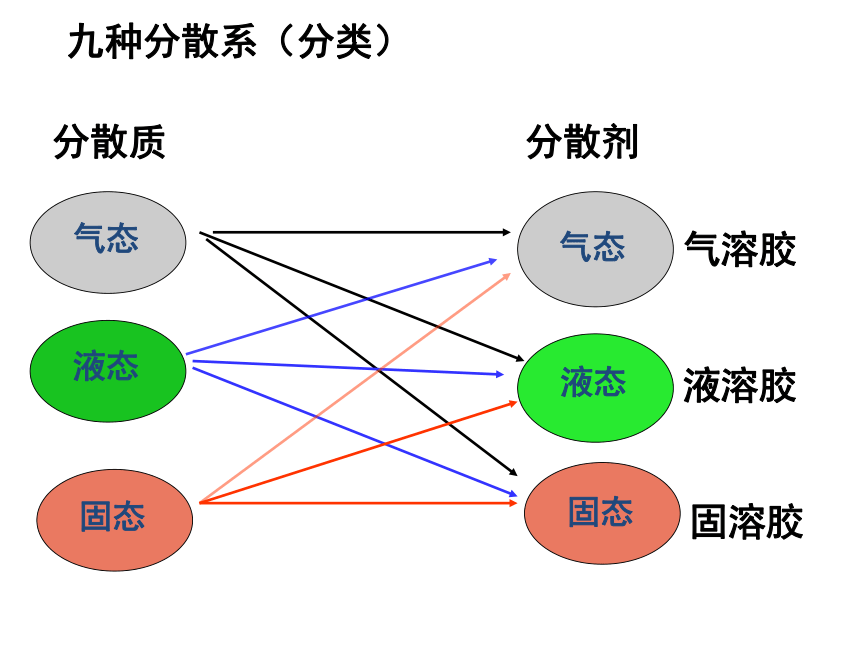
九种分散系(分类)
气态
液态
固态
固态
液态
气态
分散质
分散剂
气溶胶
液溶胶
固溶胶
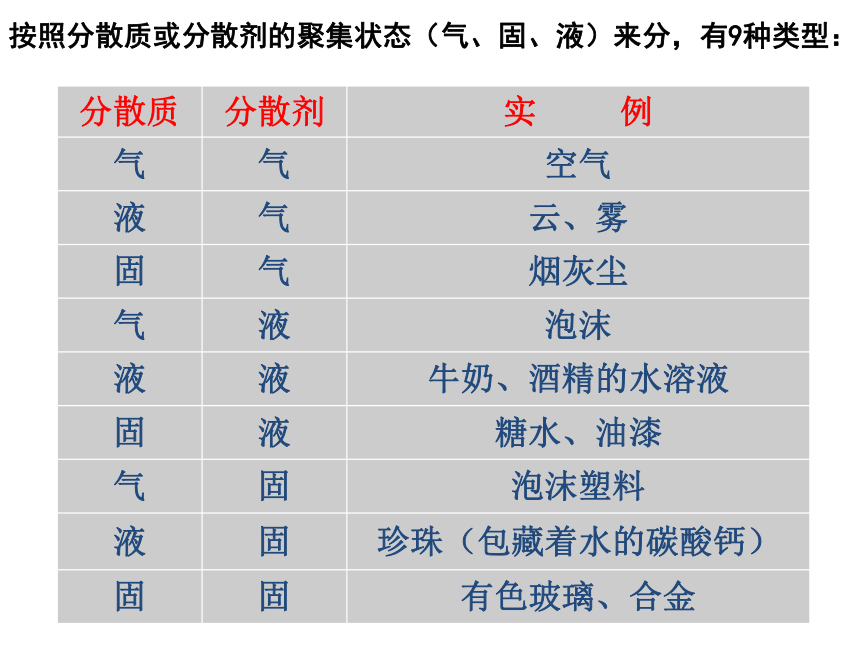
按照分散质或分散剂的聚集状态(气、固、液)来分,有9种类型:
分散质
分散剂
实
例
气
气
空气
液
气
云、雾
固
气
烟灰尘
气
液
泡沫
液
液
牛奶、酒精的水溶液
固
液
糖水、油漆
气
固
泡沫塑料
液
固
珍珠(包藏着水的碳酸钙)
固
固
有色玻璃、合金
彩色玻璃
分散质:氧化亚铜(固)
分散剂:玻璃(固)
气溶胶
分散质粒子直径
分散质粒子
1nm
100nm
溶
液
大于100nm
浊
液
胶体
小于1nm
当分散剂是水或其他液体时,根据分散质粒子的直径大小(本质区别)分三类:
(二)胶体
胶体
(1)定义:分散质粒子的直径在1nm~100nm之间的分散系叫胶体。
(2)举例:Fe(OH)3胶体、豆浆、牛奶、云雾等。
(3)溶液、胶体、浊液三种分散系的区别:
阅读教材P26
常见的胶体,烟、云、雾,河、湖、池塘中的水,血液、牛奶、豆浆、果冻、米粥、汤、蛋清、墨水、肥皂水、有色玻璃、变色玻璃、土壤胶体、淀粉溶液
科学探究1
胶体的制备
1.取一个小烧杯,加入25ml
蒸馏水,并加热至沸腾,向沸水中逐滴加入5~
6
滴
FeCl3饱和溶液。继续煮沸至溶液呈红褐色,停止加热。请将制得的Fe(OH)3胶体与CuSO4溶液和泥水比较。
2.将Fe(OH)3胶体和泥水分别进行过滤,观察并记录实验现象。
4
性质:性质(1):丁达尔效应
CuSO4溶液
Fe(OH)3胶体
丁达尔效应
结论:利用丁达尔效应是区分胶体与溶液的常用物理方法。
生活中的丁达尔现象:
(4)性质:性质2:胶粒带电性
原因:胶粒带电是由于胶粒吸附电荷所致;
胶粒带电使胶体有一些特殊性质
①介稳性
启发:要让胶体粒子相互凝聚沉淀,破坏其带电性是一种可行的选择。
胶体粒子带电,但整个胶体不带电!
②胶体的聚沉
能使胶体聚沉的常见方法有:
a.加入电解质;
b.加热;
c.加入带相反电荷胶粒的胶体。
实例:做豆腐、三角洲的形成。
思考:为什么含有泥沙胶体颗粒的河水,跟海水相遇,容易沉积而形成沙洲(三角洲)?
③电泳现象(P28)
a.Fe(OH)3胶粒带正电;
b.说明胶体粒子具有带电性:
c.应用静电除尘就是利用了胶体粒子的带电性
(3)胶体中胶粒能够透过滤纸,不能透过半透膜
(半透膜)
(滤纸)
淀粉和
NaCl溶液
应用
提纯:渗析实验
(6)胶体的用途
(1)石膏点豆腐;
(2)肥皂的制取和分离;
(3)明矾净水(明矾溶于水生成的Al(OH)3胶体具有吸附作用);
(4)FeCl3溶液用于伤口止血;
(5)冶金厂大量烟尘用静电除尘;
(6)土壤胶体中离子吸附和交换过程,保肥作用;
(7)……
小
结
1、分散系的分类:
2、胶体的性质:
(1)丁达尔现象(区分溶液和胶体);
(2)电泳现象;
(3)胶体的带电性(胶粒带电,而非胶体带电);
(4)胶体的聚沉。
3、胶体的提纯和净制:渗析
1nm
100nm
溶液
浊液
胶体
分散质粒子直径
(3)浊液、溶液、胶体三种分散系的区别:
分散系
分散质粒子大小
主要特征
举例
溶液
胶体
浊液
>100
nm
<1
nm
1nm~100
nm
不均一
不稳定
均一
稳定
均一
较稳定
CuSO4溶液
胶体
Fe(OH)3胶体
泥浆水
第一章
物质及其变化
第一节
物质的分类及其转化
如何在超市中买零食?
食 品
日用品
办公用品
...
水果
零食
饮品
粮食
…
化学物质
纯净物
混合物
单质
化合物
金属单质
非金属单质
酸
碱
氧化物
盐
溶液
胶体
浊液
悬浊液
乳浊液
实践活动1:树状分类法
含两种或两种以上物质
只含一种物质
稀有气体
化学物质
纯净物
混合物
单质
化合物
金属单质
非金属单质
酸
碱
氧化物
盐
溶液
胶体
浊液
悬浊液
乳浊液
实践活动1:树状分类法
含两种或两种以上物质
只含一种物质
稀有气体
实践活动2:交叉分类法
非金属
酸性氧化物
碱
金属
碱性氧化物
酸
盐
酸、碱、盐、氧化物之间的转化关系
概念
举例说明
分散系
分散质
分散剂
把一种(或多种)物质分散在到另一种(或多种)物质中所得到的体系(混合物)
被分散的物质
起容纳分散质作用的物质
CuSO4
溶液
泥水
CuSO4
泥沙
水
水
二、分散系及其分类
九种分散系(分类)
气态
液态
固态
固态
液态
气态
分散质
分散剂
气溶胶
液溶胶
固溶胶
按照分散质或分散剂的聚集状态(气、固、液)来分,有9种类型:
分散质
分散剂
实
例
气
气
空气
液
气
云、雾
固
气
烟灰尘
气
液
泡沫
液
液
牛奶、酒精的水溶液
固
液
糖水、油漆
气
固
泡沫塑料
液
固
珍珠(包藏着水的碳酸钙)
固
固
有色玻璃、合金
彩色玻璃
分散质:氧化亚铜(固)
分散剂:玻璃(固)
气溶胶
分散质粒子直径
分散质粒子
1nm
100nm
溶
液
大于100nm
浊
液
胶体
小于1nm
当分散剂是水或其他液体时,根据分散质粒子的直径大小(本质区别)分三类:
(二)胶体
胶体
(1)定义:分散质粒子的直径在1nm~100nm之间的分散系叫胶体。
(2)举例:Fe(OH)3胶体、豆浆、牛奶、云雾等。
(3)溶液、胶体、浊液三种分散系的区别:
阅读教材P26
常见的胶体,烟、云、雾,河、湖、池塘中的水,血液、牛奶、豆浆、果冻、米粥、汤、蛋清、墨水、肥皂水、有色玻璃、变色玻璃、土壤胶体、淀粉溶液
科学探究1
胶体的制备
1.取一个小烧杯,加入25ml
蒸馏水,并加热至沸腾,向沸水中逐滴加入5~
6
滴
FeCl3饱和溶液。继续煮沸至溶液呈红褐色,停止加热。请将制得的Fe(OH)3胶体与CuSO4溶液和泥水比较。
2.将Fe(OH)3胶体和泥水分别进行过滤,观察并记录实验现象。
4
性质:性质(1):丁达尔效应
CuSO4溶液
Fe(OH)3胶体
丁达尔效应
结论:利用丁达尔效应是区分胶体与溶液的常用物理方法。
生活中的丁达尔现象:
(4)性质:性质2:胶粒带电性
原因:胶粒带电是由于胶粒吸附电荷所致;
胶粒带电使胶体有一些特殊性质
①介稳性
启发:要让胶体粒子相互凝聚沉淀,破坏其带电性是一种可行的选择。
胶体粒子带电,但整个胶体不带电!
②胶体的聚沉
能使胶体聚沉的常见方法有:
a.加入电解质;
b.加热;
c.加入带相反电荷胶粒的胶体。
实例:做豆腐、三角洲的形成。
思考:为什么含有泥沙胶体颗粒的河水,跟海水相遇,容易沉积而形成沙洲(三角洲)?
③电泳现象(P28)
a.Fe(OH)3胶粒带正电;
b.说明胶体粒子具有带电性:
c.应用静电除尘就是利用了胶体粒子的带电性
(3)胶体中胶粒能够透过滤纸,不能透过半透膜
(半透膜)
(滤纸)
淀粉和
NaCl溶液
应用
提纯:渗析实验
(6)胶体的用途
(1)石膏点豆腐;
(2)肥皂的制取和分离;
(3)明矾净水(明矾溶于水生成的Al(OH)3胶体具有吸附作用);
(4)FeCl3溶液用于伤口止血;
(5)冶金厂大量烟尘用静电除尘;
(6)土壤胶体中离子吸附和交换过程,保肥作用;
(7)……
小
结
1、分散系的分类:
2、胶体的性质:
(1)丁达尔现象(区分溶液和胶体);
(2)电泳现象;
(3)胶体的带电性(胶粒带电,而非胶体带电);
(4)胶体的聚沉。
3、胶体的提纯和净制:渗析
1nm
100nm
溶液
浊液
胶体
分散质粒子直径
(3)浊液、溶液、胶体三种分散系的区别:
分散系
分散质粒子大小
主要特征
举例
溶液
胶体
浊液
>100
nm
<1
nm
1nm~100
nm
不均一
不稳定
均一
稳定
均一
较稳定
CuSO4溶液
胶体
Fe(OH)3胶体
泥浆水
