高二化学选修3第2章第2节分子的立体结构课件(共3课时)
文档属性
| 名称 | 高二化学选修3第2章第2节分子的立体结构课件(共3课时) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-08-01 00:00:00 | ||
图片预览





文档简介
(共72张PPT)
高二化学选修3物质结构与性质
第二章 分子结构与性质
第二节分子的立体结构
(第一课时)
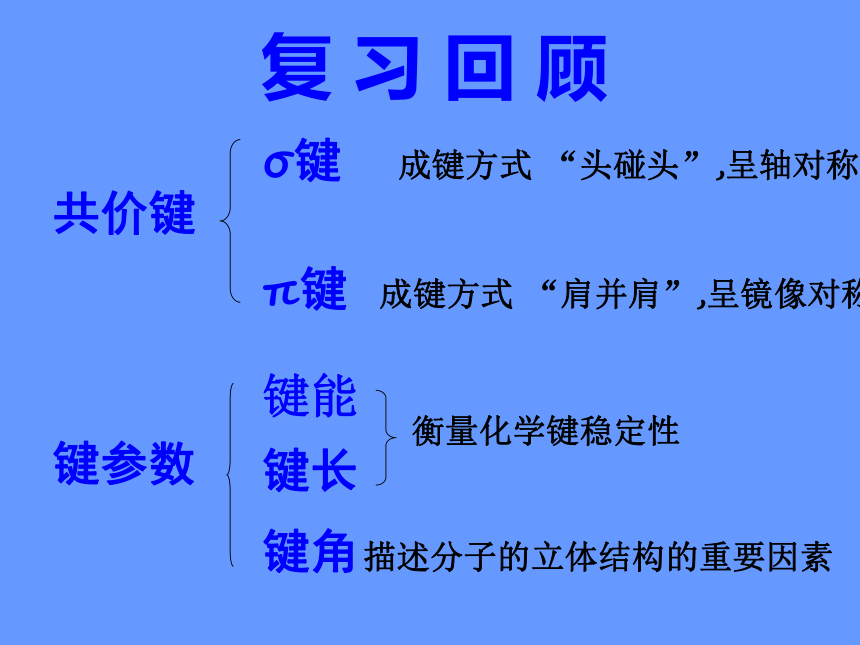
复 习 回 顾
共价键
σ键
π键
键参数
键能
键长
键角
衡量化学键稳定性
描述分子的立体结构的重要因素
成键方式 “头碰头”,呈轴对称
成键方式 “肩并肩”,呈镜像对称
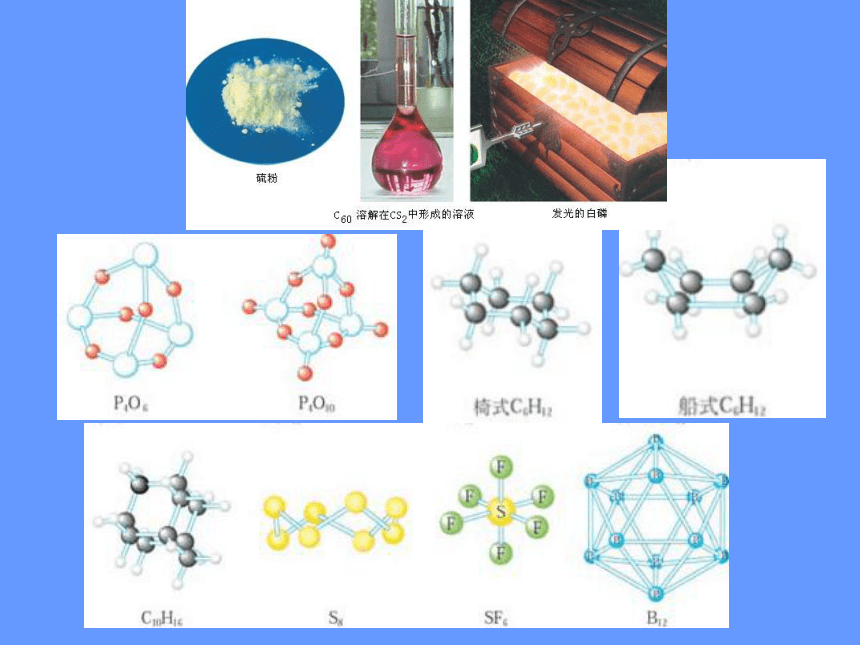
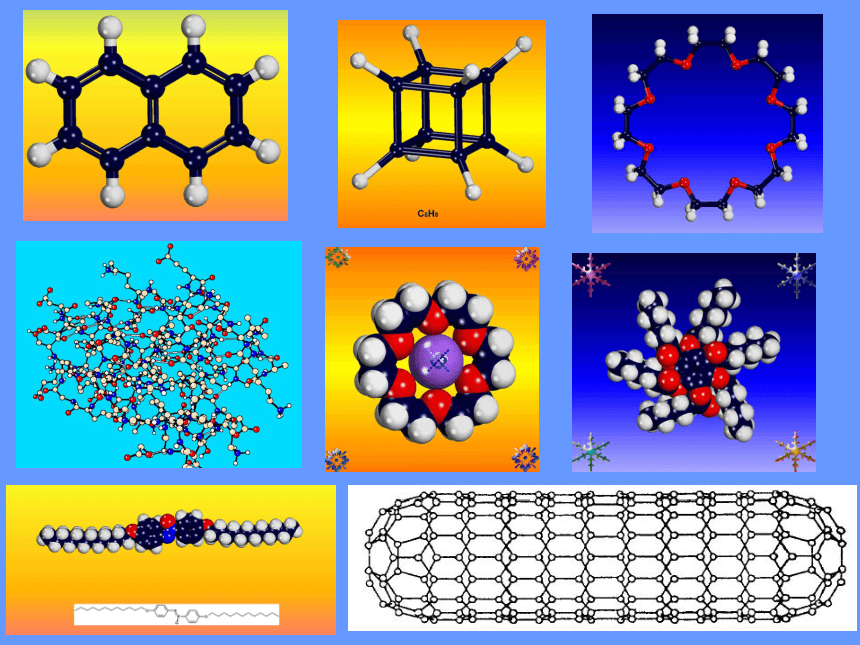
一、形形色色的分子
O2
HCl
H2O
CO2
1、双原子分子(直线型)
2、三原子分子立体结构(有直线形和V形)
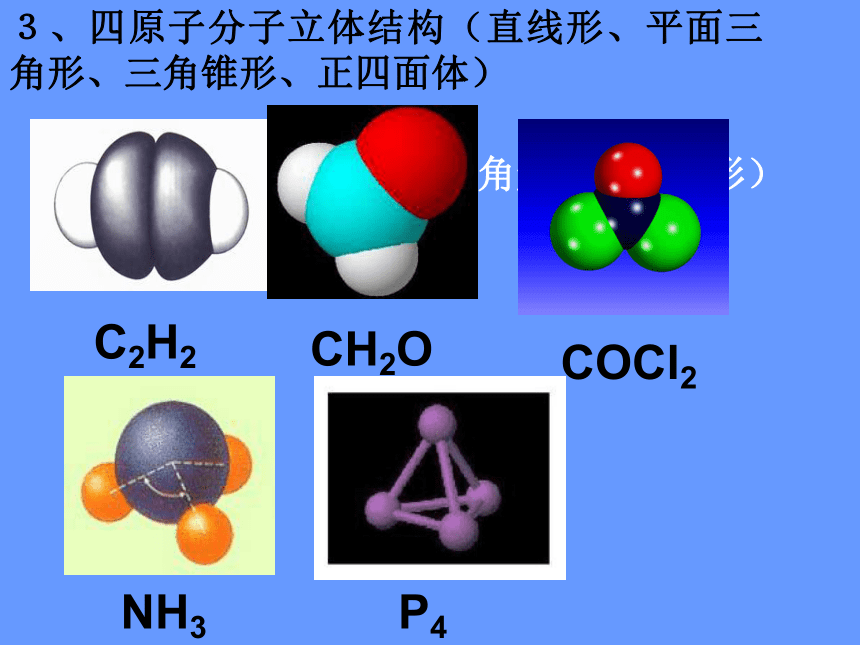
3、四原子分子立体结构(直线形、平面三角形、三角锥形、正四面体)
(平面三角形,三角锥形)
C2H2
CH2O
COCl2
NH3
P4
4、五原子分子立体结构
最常见的是正四面体
CH4
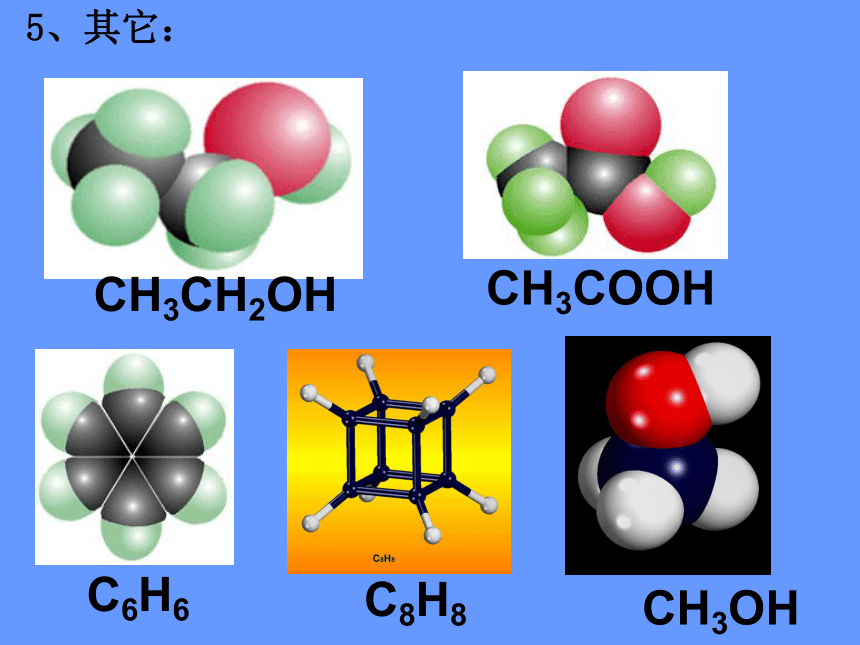
CH3CH2OH
CH3COOH
C6H6
C8H8
CH3OH
5、其它:
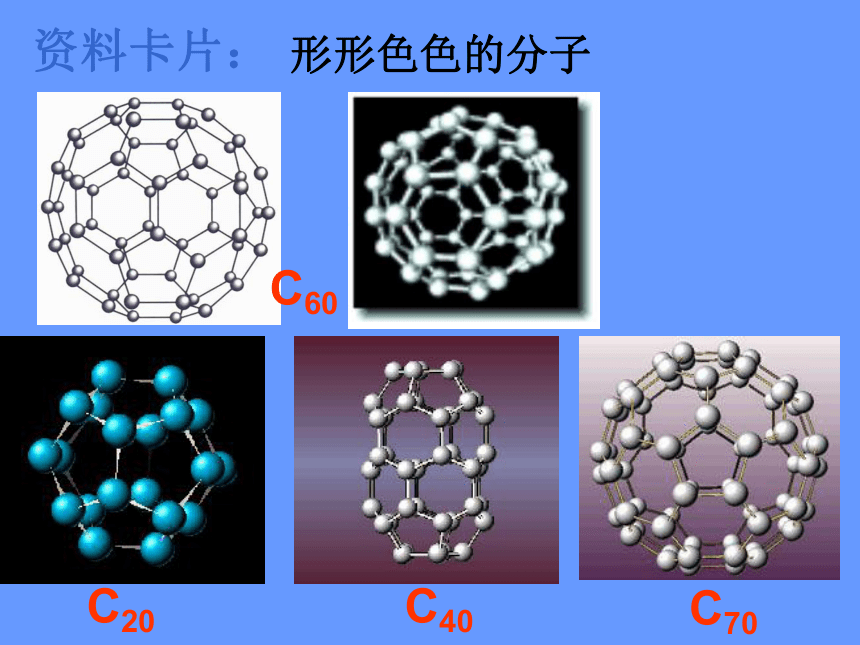
C60
C20
C40
C70
资料卡片:
形形色色的分子
分子世界如此形形色色,异彩纷呈,美不胜收,常使人流连忘返。
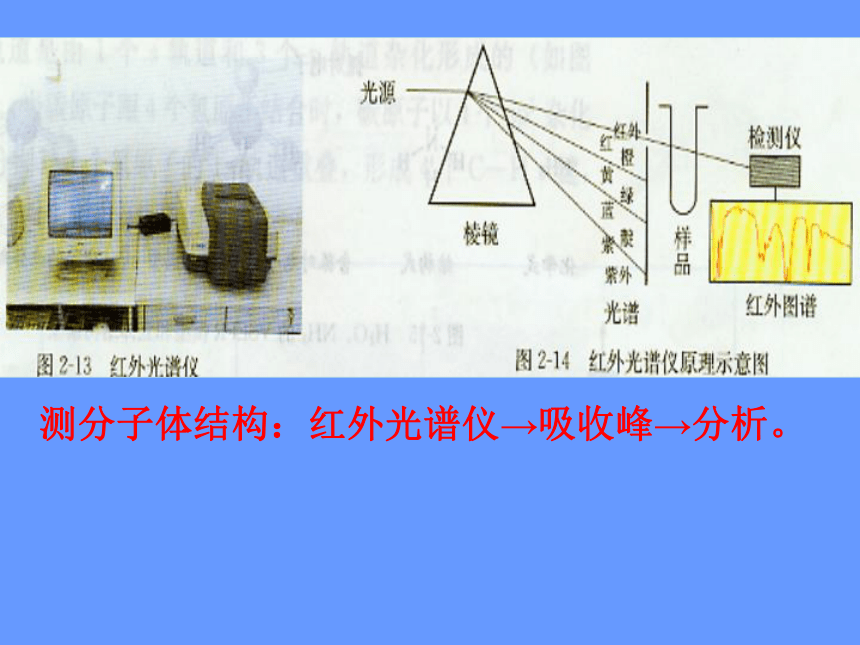
那么分子结构又是怎么测定的呢
早年的科学家主要靠对物质的宏观性质进行系统总结得出规律后进行推测,如今,科学家已经创造了许许多多测定分子结构的现代仪器,红外光谱就是其中的一种。
分子中的原子不是固定不动的,而是不断地振动着的。所谓分子立体结构其实只是分子中的原子处于平衡位置时的模型。当一束红外线透过分子时,分子会吸收跟它的某些化学键的振动频率相同的红外线,再记录到图谱上呈现吸收峰。通过计算机模拟,可以得知各吸收峰是由哪一个化学键、哪种振动方式引起的,综合这些信息,可分析出分子的立体结构。
科学视野—分子的立体结构是怎样测定的?
(指导阅读P39)
测分子体结构:红外光谱仪→吸收峰→分析。
同为三原子分子,CO2 和 H2O 分子的空间结构却不同,什么原因?
直线形
V形
同为四原子分子,CH2O与 NH3 分子的的空间结构也不同,什么原因?
三角锥形
平面三角形
二、价层电子对互斥模型
1、一类是中心原子上的价电子都用于形成共价键,如CO2、CH2O、CH4等分子中的碳原子,它们的立体结构可用中心原子周围的原子数n来预测,概括如下:
ABn 立体结构 范例
n=2 直线形 CO2、 CS2
n=3 平面三角形 CH2O、BF3
n=4 正四面体形 CH4、 CCl4
n=5 三角双锥形 PCl5
n=6 正八面体形 SCl6
分子 CO2 CH2O CH4
电子式
结构式
中心原子
有无孤对电子
空间结构
O C O
::
::
:
:
:
:
:
:
:
H C H
:
H
H
O=C=O
H-C-H
=
O
H-C-H
-
-
H
H
无
无
无
直线形
平面
三角形
正
四面体
:
:
H C H
:
O:
:
:
2、另一类是中心原子上有孤对电子(未用于形成共价键的电子对)的分子。
ABn 立体结构 范例
n=2 V形 H2O
n=3 三角锥形 NH3
原因:
中心原子上的孤对电子也要占据中心原子周围的空间,并参与互相排斥。例如,H2O和NH3的中心原子分别有2对和l对孤对电子,跟中心原子周围的σ键加起来都是4,它们相互排斥,形成四面体,因而H2O分子呈V形,NH3分子呈三角锥形。
中心原子 代表物 中心原子
结合的原子数 分子类型 空间构型
无孤对电子 CO2 2 AB2
CH2O 3 AB3
CH4 4 AB4
有孤对电子 H2O 2 AB2
NH3 3 AB3
直线形
平面三角形
正四面体
V 形
三角锥形
小结:
价层电子对互斥模型
应用反馈:
化学式 中心原子
孤对电子数 中心原子结合的原子数 空间构型
HCN
SO2
NH2-
BF3
H3O+
SiCl4
CHCl3
NH4+
0
1
2
0
1
0
0
0
2
2
2
3
3
4
4
4
直线形
V 形
V形
平面三角形
三角锥形
四面体
正四面体
正四面体
课堂练习
1.下列物质中,分子的立体结构与水分子相似的是 ( )
A.CO2 B.H2S C.PCl3 D.SiCl4
2.下列分子的立体结构,其中属于直线型分子的是 ( )
A.H2O B.CO2 C.C2H2 D.P4
B
BC
3.若ABn型分子的中心原子A上没有未用于形成共价键的孤对电子,运用价层电子对互斥模型,下列说法正确的( )
A.若n=2,则分子的立体构型为V形
B.若n=3,则分子的立体构型为三角锥形
C.若n=4,则分子的立体构型为正四面体形
D.以上说法都不正确
课堂练习
C
美国著名化学家鲍林(L.Pauling, 1901—1994)教授具有独特的化学想象力:只要给他物质的分子式,他就能通过“毛估”法,大体上想象出这种物质的分子结构模型。请你根据价层电子对互斥理论,“毛估”出下列分子的空间构型。
PCl5
PCl3
SO3
SiCl4
课堂练习
三角双锥形
三角锥形
平面三角形
正四面体
【选修3《物质结构与性质》】
第 二 章《分子结构与性质》
第二节 分子的立体结构
课时2
值得注意的是价层电子对互斥模型只能解释化合物分子的空间构形,却无法解释许多深层次的问题,如无法解释甲烷中四个 C---H的键长、键能相同及H—C —H的键角为109 28′。因为按照我们已经学过的价键理论,甲烷的4个C — H单键都应该是σ键,然而,碳原子的4个价层原子轨道是3个相互垂直的2p轨道和1个球形的2s轨道,用它们跟4个氢原子的1s原子轨道重叠,不可能得到四面体构型的甲烷分子。
碳原子:
为了解决这一矛盾,鲍林提出了杂化轨道理论,
杂化轨道理论
杂化:原子内部能量相近的原子轨道,在外界条件影响下重新组合的过程叫原子轨道的杂化
杂化轨道:原子轨道组合杂化后形成的一组新轨道
杂化轨道类型:sp、sp2、sp3、sp3d2
杂化结果:重新分配能量和空间方向,组成数目相等成键能力更强的原子轨道
杂化轨道用于容纳σ键和孤对电子
学习价层电子互斥理论知道: NH3和H2O的模型和甲烷分子一样,也是正四面体的,因此它们的中心原子也是sp3杂化的.不同的是NH3和H2O的中心原子的4个杂化轨道分别用于σ键和孤对电子对,这样的4个杂化轨道显然有差别
sp 杂化
同一原子中 ns-np 杂化成新轨道;一个 s 轨道和一个 p 轨道杂化组合成两个新的 sp 杂化轨道。
例:
BeCl2分子形成
激发
2s
2p
Be基态
2s
2p
激发态
杂化
键合
直线形
sp杂化态
直线形
化合态
Cl Be Cl
180
除sp3杂化轨道外,还有sp杂化轨道和sp2杂化轨道。sp杂化轨道由1个s轨道和1个p轨道杂化而得;sp2杂化轨道由1个s轨道和2个p轨道杂化而得,
碳的sp杂化轨道
sp杂化:夹角为180°的直线形杂化轨道。
乙炔的成键
sp2 杂化
sp2 杂化轨道间的夹角是120度,分子的几何构型为平面正三角形
2s
2p
B的基态
2s
2p
激发态
正三角形
sp2 杂化态
例:
BF3分子形成
B
F
F
F
Cl
B
Cl
1200
Cl
碳的sp2杂化轨道
sp2杂化:三个夹角为120°的平面三角形杂化轨道。
思考题:根据以下事实总结:如何判断一个
化合物的中心原子的杂化类型?
已知:杂化轨道只用于形成σ键或者用来容纳孤对电子
★杂化轨道数
0+2=2
SP
直线形
0+3=3
SP2
平面三角形
0+4=4
SP3
正四面体形
1+2=3
SP2
V形
1+3=4
SP3
三角锥形
2+2=4
SP3
V形
代表物
杂化轨道数
杂化轨道类型
分子结构
CO2
CH2O
CH4
SO2
NH3
H2O
结合上述信息完成下表:
中心原子孤对电子对数+中心原子结合的原子数
练习:在学习价层电子对互斥模型和杂化轨道理论的基础上描述化合物中每个化学键是怎样形成的?
C原子发生SP杂化生成了两个SP轨道分别与两个O原子的一个P轨道形成两个σ键; C原子剩余的两个P轨道分别与两个O原子剩余的1个P轨道形成两个π键。
2 .H2O
O原子发生SP3杂化生成了四个SP3杂化轨道,其中的两个分别与两个H原子的S轨道形成两个σ键; O原子剩余的两个SP3杂化轨道分别被两对孤对电子占据。
1.CO2
O: 1S22S 2P
O C O
σ
σ
π
π
提示:C:1S22S 2P
激发
C:1S22S 2P
SP杂化
探究练习
1、写出HCN分子和CH20分子的路易斯结构式。
2.用VSEPR模型对HCN分子和CH2O分子的立体结构进行预测(用立体结构模型表示)
3.写出HCN分子和CH20分子的中心原子的杂化类型。
4.分析HCN分子和CH2O分子中的π键。
例题三:对SO2与CO2说法正确的是( )
A.都是直线形结构
B.中心原子都采取sp杂化轨道
C. S原子和C原子上都没有孤对电子
D. SO2为V形结构, CO2为直线形结构
D
例题五:写出下列分子的路易斯结构式(是用短线表示键合电子,小黑点表示未键合的价电子的结构式)并指出中心原子可能采用的杂化轨道类型,并预测分子的几何构型。 (1)PCI3 (2)BCl3 (3)CS2 (4) C12O
(1) PCI3: SP3 三角锥形
. .
P
CI
CI
解析:
. .
. .
. .
..
..
..
CI
. .
. .
..
CI
. .
..
(2)BCl3 : SP2 平面三角形
B
CI
. .
. .
..
..
Cl
. .
. .
..
(3)CS2 : SP 直线形
C
=
S
=
S
. .
. .
. .
. .
(4) C12O: SP3 V形
O
. .
. .
Cl
. .
. .
..
CI
. .
. .
..
乙炔的成键
C2H4(sp2杂化)
大π 键 C6H6
C6H6的大π键(离域键)
作业:1、整理学案。
2 、完成课后习题
第三课时
第二节 分子的立体结构
例题一:下列分子中的中心原子杂化轨道的类型相同的是 ( )
A.CO2与SO2 B.CH4与NH3
C.BeCl2与BF3 D.C2H2与C2H4
例题二:对SO2与CO2说法正确的是( )
A.都是直线形结构
B.中心原子都采取sp杂化轨道
C. S原子和C原子上都没有孤对电子
D. SO2为V形结构, CO2为直线形结构
D
例题三:写出下列分子的路易斯结构式(是用短线表示键合电子,小黑点表示未键合的价电子的结构式)并指出中心原子可能采用的杂化轨道类型,并预测分子的几何构型。 (1)PCl3 (2)BCl3 (3)CS2 (4) C12O
(1) PCl3: SP3 三角锥形
. .
P
CI
CI
解析:
. .
. .
. .
..
..
..
CI
. .
. .
..
CI
. .
..
(2)BCl3 : SP2 平面三角形
B
CI
. .
. .
..
..
Cl
. .
. .
..
(3)CS2 : SP 直线形
C
=
S
=
S
. .
. .
. .
. .
(4) C12O: SP3 V形
O
. .
. .
Cl
. .
. .
..
CI
. .
. .
..
天蓝色
天蓝色
天蓝色
无色
无色
无色
配合物理论简介:
实验2-1
固体颜色
溶液颜色
CuSO4
CuCl2.2H2O
CuBr2
NaCl
K2SO4
KBr
白色
绿色
深褐色
白色
白色
白色
思考:前三种溶液呈天蓝色大概与什么物质有关?依据是什么?
Cu
OH2
H2O
H2O
H2O
2+
★配位化合物,简称配合物,通常是由中心离子(或原子) 与配位体(某些分子或阴离子) 以配位键的形式结合而成的复杂离子或分子。
2+
Cu
NH3
H3N
NH3
NH3
实验2-2 已知氢氧化铜与足量氨水反应后溶解是因为生成[Cu(NH3)4]2+ ,其结构简式为:
试写出实验中发生的两个反应的离子方程式?
Cu 2+ +2NH3 .H2O Cu(OH)2 +2 NH4 +
Cu(OH)2 + 4NH3 . H2O [Cu(NH3) 4]2+ +2OH—+4H2O
蓝色沉淀
深蓝色溶液
实验2-3
Fe 3+ +SCN— [Fe (SCN) ]2+
硫氰酸根
血红色
由于该离子的颜色极似血液,常被用于电影特技和魔术表演。
练习书写:
向硝酸银溶液中逐渐滴加氨水的离子方程式
配合物理论简介
一、配合物的组成
1. 中心离子或原子(也称形成体) 有空轨道
主要是一些过渡金属,如铁、钴、镍、铜、银、金、铂等金 属元素的离子;
或是具有高氧化数的非金属元素,硼,硅、磷等,如Na[BF4] 中的B(Ⅲ)、K2[SiF6]中的Si(Ⅳ)和NH4[PF6]中的P(Ⅴ);
或是不带电荷的中性原子,如[Ni(CO)4], [Fe(CO)5]中的Ni, Fe都是中性原子,
碱金属、碱土金属等可作为螯合物的形成体。
[Cu(NH3)4]SO4中,NH3是配位体,N为配位原子。
2. 配位体和配位原子 有孤对电子
a. 单齿配位体(一个配位体中只有一个配位原子)
含氮配位体 NH3 , NCS - ;含硫配位体 SCN- ;
含卤素配位体 F- , Cl- , Br- , I- ; 含碳配位体 CN- , CO
含氧配位体 H2O, OH- ,羧酸,醇,醚等
b. 多齿配位体(有两个或两个以上的配位原子)
乙二胺 NH2一CH2一CH2一NH2 简写为en,
乙二胺四乙酸根(EDTA)等。
3.配位数
与中心离子直接以配位键结合的配位原子个数。
例:[AlF6]3- 配位数6 、 [Cu(NH3)4]SO4 配位数4 、
[Co(NH3)2(en)2](NO3)3 配位数6
*中心离子的电荷高,对配位体的吸引力较强,有利于形成配位数较高的配合物。
常见的配位数与中心离子的电荷数有如下的关系:
中心离子的电荷:+1 +2 +3 +4
常见的配位数: 2 4(或6) 6(或4) 6(或8)
*中心离子半径越大,其周围可容纳配体就越多,
配位数越大。
[AlF6]3- [AlCl4]- [BF4]- [AgI2]- [AgI4]2-
从这些配离子你看出配位数有什么规律?
4. 配离子的电荷
配离子的电荷等于中心离子电荷与配位体总电荷的代数和。 如 K2[PtCl4]
8.1.2 配位化合物的命名
配位数—配位体名称—合—中心离子(用罗马数字表示氧化数),
用二、三、四等数字表示配位体数。不同配位名称之间用圆点“·”分开。 阴离子次序为:简单离子——复杂离子——有机酸根离子。
中性分子次序为:NH3—H2O—有机分子。
1.配位阴离子配合物--配位阴离子“酸”外界
2.配位阳离子配合物—— “某化某”或“某酸某”
3.中性配合物
K2[SiF6] 六氟合硅(Ⅳ)酸钾
K[PtCl5(NH3)] 五氯·一氨合铂(Ⅳ)酸钾
[Co(NH3)6]Br3 三溴化六氨合钴(Ⅲ)
[Co(NH3)2(en)2](NO3)3 硝酸二氨·二(乙二胺)合钴(Ⅲ)
[PtCl2(NH3)2] 二氯·二氨合铂(Ⅱ)
[Ni(CO)4] 四羰基合镍(0)
配合物的盐与复盐的比较
复盐, 能电离出两种或两种以上阳离子的盐如明矾 KAl(SO4)2·12H2O、光卤石 KCl · MgCl2· 6H2O等,仅在固态时稳定存在,一旦溶于水,几乎全部解离成各组分离子:
KAl(SO4)2·12H2O (溶于水) → K+ +Al3++ 2SO42- +12 H2O
KCl · MgCl2 · 6H2O (溶于水) → K+ +Mg2+ + 3Cl- + 6H2O
配合物盐,是在配合物的溶液或晶体中,十分明确地存在着 含有配位键的、能独立存在的复杂组成的离子:
[Cu(NH3)4]SO4·H2O → [Cu(NH3)4]2+ + SO42- + H2O
形成配合物时性质的改变
1、颜色的改变
Fe3+ + nNCS- == [Fe(NCS)n](n-3)-
2、溶解度的改变:
AgCl + HCl =[AgCl2]- + H+
AgCl + 2NH3 == [Ag(NH3)2]+ + Cl-
Au + HNO3 + 4HCl == H[AuCl4] + NO + 2H2O
3Pt + 4HNO3 + 18HCl = 3H2[PtCl6] + 4NO + 8H2O
例题一:下列分子或离子中都存在着配位键的是 ( )
A.NH3、H2O B.NH4 + 、H3O+
C.N2、HClO D. [Cu(NH3) 4]2+ 、PCI3
B
例题二:下列各种说法中错误的是( )
A、形成配位键的条件是一方有空轨道一方有孤对电子。
B、配位键是一种特殊的共价键。
C、配位化合物中的配体可以是分子也可以是阴离子。
D、共价键的形成条件是成键原子必须有未成对电子。
D
高二化学选修3物质结构与性质
第二章 分子结构与性质
第二节分子的立体结构
(第一课时)
复 习 回 顾
共价键
σ键
π键
键参数
键能
键长
键角
衡量化学键稳定性
描述分子的立体结构的重要因素
成键方式 “头碰头”,呈轴对称
成键方式 “肩并肩”,呈镜像对称
一、形形色色的分子
O2
HCl
H2O
CO2
1、双原子分子(直线型)
2、三原子分子立体结构(有直线形和V形)
3、四原子分子立体结构(直线形、平面三角形、三角锥形、正四面体)
(平面三角形,三角锥形)
C2H2
CH2O
COCl2
NH3
P4
4、五原子分子立体结构
最常见的是正四面体
CH4
CH3CH2OH
CH3COOH
C6H6
C8H8
CH3OH
5、其它:
C60
C20
C40
C70
资料卡片:
形形色色的分子
分子世界如此形形色色,异彩纷呈,美不胜收,常使人流连忘返。
那么分子结构又是怎么测定的呢
早年的科学家主要靠对物质的宏观性质进行系统总结得出规律后进行推测,如今,科学家已经创造了许许多多测定分子结构的现代仪器,红外光谱就是其中的一种。
分子中的原子不是固定不动的,而是不断地振动着的。所谓分子立体结构其实只是分子中的原子处于平衡位置时的模型。当一束红外线透过分子时,分子会吸收跟它的某些化学键的振动频率相同的红外线,再记录到图谱上呈现吸收峰。通过计算机模拟,可以得知各吸收峰是由哪一个化学键、哪种振动方式引起的,综合这些信息,可分析出分子的立体结构。
科学视野—分子的立体结构是怎样测定的?
(指导阅读P39)
测分子体结构:红外光谱仪→吸收峰→分析。
同为三原子分子,CO2 和 H2O 分子的空间结构却不同,什么原因?
直线形
V形
同为四原子分子,CH2O与 NH3 分子的的空间结构也不同,什么原因?
三角锥形
平面三角形
二、价层电子对互斥模型
1、一类是中心原子上的价电子都用于形成共价键,如CO2、CH2O、CH4等分子中的碳原子,它们的立体结构可用中心原子周围的原子数n来预测,概括如下:
ABn 立体结构 范例
n=2 直线形 CO2、 CS2
n=3 平面三角形 CH2O、BF3
n=4 正四面体形 CH4、 CCl4
n=5 三角双锥形 PCl5
n=6 正八面体形 SCl6
分子 CO2 CH2O CH4
电子式
结构式
中心原子
有无孤对电子
空间结构
O C O
::
::
:
:
:
:
:
:
:
H C H
:
H
H
O=C=O
H-C-H
=
O
H-C-H
-
-
H
H
无
无
无
直线形
平面
三角形
正
四面体
:
:
H C H
:
O:
:
:
2、另一类是中心原子上有孤对电子(未用于形成共价键的电子对)的分子。
ABn 立体结构 范例
n=2 V形 H2O
n=3 三角锥形 NH3
原因:
中心原子上的孤对电子也要占据中心原子周围的空间,并参与互相排斥。例如,H2O和NH3的中心原子分别有2对和l对孤对电子,跟中心原子周围的σ键加起来都是4,它们相互排斥,形成四面体,因而H2O分子呈V形,NH3分子呈三角锥形。
中心原子 代表物 中心原子
结合的原子数 分子类型 空间构型
无孤对电子 CO2 2 AB2
CH2O 3 AB3
CH4 4 AB4
有孤对电子 H2O 2 AB2
NH3 3 AB3
直线形
平面三角形
正四面体
V 形
三角锥形
小结:
价层电子对互斥模型
应用反馈:
化学式 中心原子
孤对电子数 中心原子结合的原子数 空间构型
HCN
SO2
NH2-
BF3
H3O+
SiCl4
CHCl3
NH4+
0
1
2
0
1
0
0
0
2
2
2
3
3
4
4
4
直线形
V 形
V形
平面三角形
三角锥形
四面体
正四面体
正四面体
课堂练习
1.下列物质中,分子的立体结构与水分子相似的是 ( )
A.CO2 B.H2S C.PCl3 D.SiCl4
2.下列分子的立体结构,其中属于直线型分子的是 ( )
A.H2O B.CO2 C.C2H2 D.P4
B
BC
3.若ABn型分子的中心原子A上没有未用于形成共价键的孤对电子,运用价层电子对互斥模型,下列说法正确的( )
A.若n=2,则分子的立体构型为V形
B.若n=3,则分子的立体构型为三角锥形
C.若n=4,则分子的立体构型为正四面体形
D.以上说法都不正确
课堂练习
C
美国著名化学家鲍林(L.Pauling, 1901—1994)教授具有独特的化学想象力:只要给他物质的分子式,他就能通过“毛估”法,大体上想象出这种物质的分子结构模型。请你根据价层电子对互斥理论,“毛估”出下列分子的空间构型。
PCl5
PCl3
SO3
SiCl4
课堂练习
三角双锥形
三角锥形
平面三角形
正四面体
【选修3《物质结构与性质》】
第 二 章《分子结构与性质》
第二节 分子的立体结构
课时2
值得注意的是价层电子对互斥模型只能解释化合物分子的空间构形,却无法解释许多深层次的问题,如无法解释甲烷中四个 C---H的键长、键能相同及H—C —H的键角为109 28′。因为按照我们已经学过的价键理论,甲烷的4个C — H单键都应该是σ键,然而,碳原子的4个价层原子轨道是3个相互垂直的2p轨道和1个球形的2s轨道,用它们跟4个氢原子的1s原子轨道重叠,不可能得到四面体构型的甲烷分子。
碳原子:
为了解决这一矛盾,鲍林提出了杂化轨道理论,
杂化轨道理论
杂化:原子内部能量相近的原子轨道,在外界条件影响下重新组合的过程叫原子轨道的杂化
杂化轨道:原子轨道组合杂化后形成的一组新轨道
杂化轨道类型:sp、sp2、sp3、sp3d2
杂化结果:重新分配能量和空间方向,组成数目相等成键能力更强的原子轨道
杂化轨道用于容纳σ键和孤对电子
学习价层电子互斥理论知道: NH3和H2O的模型和甲烷分子一样,也是正四面体的,因此它们的中心原子也是sp3杂化的.不同的是NH3和H2O的中心原子的4个杂化轨道分别用于σ键和孤对电子对,这样的4个杂化轨道显然有差别
sp 杂化
同一原子中 ns-np 杂化成新轨道;一个 s 轨道和一个 p 轨道杂化组合成两个新的 sp 杂化轨道。
例:
BeCl2分子形成
激发
2s
2p
Be基态
2s
2p
激发态
杂化
键合
直线形
sp杂化态
直线形
化合态
Cl Be Cl
180
除sp3杂化轨道外,还有sp杂化轨道和sp2杂化轨道。sp杂化轨道由1个s轨道和1个p轨道杂化而得;sp2杂化轨道由1个s轨道和2个p轨道杂化而得,
碳的sp杂化轨道
sp杂化:夹角为180°的直线形杂化轨道。
乙炔的成键
sp2 杂化
sp2 杂化轨道间的夹角是120度,分子的几何构型为平面正三角形
2s
2p
B的基态
2s
2p
激发态
正三角形
sp2 杂化态
例:
BF3分子形成
B
F
F
F
Cl
B
Cl
1200
Cl
碳的sp2杂化轨道
sp2杂化:三个夹角为120°的平面三角形杂化轨道。
思考题:根据以下事实总结:如何判断一个
化合物的中心原子的杂化类型?
已知:杂化轨道只用于形成σ键或者用来容纳孤对电子
★杂化轨道数
0+2=2
SP
直线形
0+3=3
SP2
平面三角形
0+4=4
SP3
正四面体形
1+2=3
SP2
V形
1+3=4
SP3
三角锥形
2+2=4
SP3
V形
代表物
杂化轨道数
杂化轨道类型
分子结构
CO2
CH2O
CH4
SO2
NH3
H2O
结合上述信息完成下表:
中心原子孤对电子对数+中心原子结合的原子数
练习:在学习价层电子对互斥模型和杂化轨道理论的基础上描述化合物中每个化学键是怎样形成的?
C原子发生SP杂化生成了两个SP轨道分别与两个O原子的一个P轨道形成两个σ键; C原子剩余的两个P轨道分别与两个O原子剩余的1个P轨道形成两个π键。
2 .H2O
O原子发生SP3杂化生成了四个SP3杂化轨道,其中的两个分别与两个H原子的S轨道形成两个σ键; O原子剩余的两个SP3杂化轨道分别被两对孤对电子占据。
1.CO2
O: 1S22S 2P
O C O
σ
σ
π
π
提示:C:1S22S 2P
激发
C:1S22S 2P
SP杂化
探究练习
1、写出HCN分子和CH20分子的路易斯结构式。
2.用VSEPR模型对HCN分子和CH2O分子的立体结构进行预测(用立体结构模型表示)
3.写出HCN分子和CH20分子的中心原子的杂化类型。
4.分析HCN分子和CH2O分子中的π键。
例题三:对SO2与CO2说法正确的是( )
A.都是直线形结构
B.中心原子都采取sp杂化轨道
C. S原子和C原子上都没有孤对电子
D. SO2为V形结构, CO2为直线形结构
D
例题五:写出下列分子的路易斯结构式(是用短线表示键合电子,小黑点表示未键合的价电子的结构式)并指出中心原子可能采用的杂化轨道类型,并预测分子的几何构型。 (1)PCI3 (2)BCl3 (3)CS2 (4) C12O
(1) PCI3: SP3 三角锥形
. .
P
CI
CI
解析:
. .
. .
. .
..
..
..
CI
. .
. .
..
CI
. .
..
(2)BCl3 : SP2 平面三角形
B
CI
. .
. .
..
..
Cl
. .
. .
..
(3)CS2 : SP 直线形
C
=
S
=
S
. .
. .
. .
. .
(4) C12O: SP3 V形
O
. .
. .
Cl
. .
. .
..
CI
. .
. .
..
乙炔的成键
C2H4(sp2杂化)
大π 键 C6H6
C6H6的大π键(离域键)
作业:1、整理学案。
2 、完成课后习题
第三课时
第二节 分子的立体结构
例题一:下列分子中的中心原子杂化轨道的类型相同的是 ( )
A.CO2与SO2 B.CH4与NH3
C.BeCl2与BF3 D.C2H2与C2H4
例题二:对SO2与CO2说法正确的是( )
A.都是直线形结构
B.中心原子都采取sp杂化轨道
C. S原子和C原子上都没有孤对电子
D. SO2为V形结构, CO2为直线形结构
D
例题三:写出下列分子的路易斯结构式(是用短线表示键合电子,小黑点表示未键合的价电子的结构式)并指出中心原子可能采用的杂化轨道类型,并预测分子的几何构型。 (1)PCl3 (2)BCl3 (3)CS2 (4) C12O
(1) PCl3: SP3 三角锥形
. .
P
CI
CI
解析:
. .
. .
. .
..
..
..
CI
. .
. .
..
CI
. .
..
(2)BCl3 : SP2 平面三角形
B
CI
. .
. .
..
..
Cl
. .
. .
..
(3)CS2 : SP 直线形
C
=
S
=
S
. .
. .
. .
. .
(4) C12O: SP3 V形
O
. .
. .
Cl
. .
. .
..
CI
. .
. .
..
天蓝色
天蓝色
天蓝色
无色
无色
无色
配合物理论简介:
实验2-1
固体颜色
溶液颜色
CuSO4
CuCl2.2H2O
CuBr2
NaCl
K2SO4
KBr
白色
绿色
深褐色
白色
白色
白色
思考:前三种溶液呈天蓝色大概与什么物质有关?依据是什么?
Cu
OH2
H2O
H2O
H2O
2+
★配位化合物,简称配合物,通常是由中心离子(或原子) 与配位体(某些分子或阴离子) 以配位键的形式结合而成的复杂离子或分子。
2+
Cu
NH3
H3N
NH3
NH3
实验2-2 已知氢氧化铜与足量氨水反应后溶解是因为生成[Cu(NH3)4]2+ ,其结构简式为:
试写出实验中发生的两个反应的离子方程式?
Cu 2+ +2NH3 .H2O Cu(OH)2 +2 NH4 +
Cu(OH)2 + 4NH3 . H2O [Cu(NH3) 4]2+ +2OH—+4H2O
蓝色沉淀
深蓝色溶液
实验2-3
Fe 3+ +SCN— [Fe (SCN) ]2+
硫氰酸根
血红色
由于该离子的颜色极似血液,常被用于电影特技和魔术表演。
练习书写:
向硝酸银溶液中逐渐滴加氨水的离子方程式
配合物理论简介
一、配合物的组成
1. 中心离子或原子(也称形成体) 有空轨道
主要是一些过渡金属,如铁、钴、镍、铜、银、金、铂等金 属元素的离子;
或是具有高氧化数的非金属元素,硼,硅、磷等,如Na[BF4] 中的B(Ⅲ)、K2[SiF6]中的Si(Ⅳ)和NH4[PF6]中的P(Ⅴ);
或是不带电荷的中性原子,如[Ni(CO)4], [Fe(CO)5]中的Ni, Fe都是中性原子,
碱金属、碱土金属等可作为螯合物的形成体。
[Cu(NH3)4]SO4中,NH3是配位体,N为配位原子。
2. 配位体和配位原子 有孤对电子
a. 单齿配位体(一个配位体中只有一个配位原子)
含氮配位体 NH3 , NCS - ;含硫配位体 SCN- ;
含卤素配位体 F- , Cl- , Br- , I- ; 含碳配位体 CN- , CO
含氧配位体 H2O, OH- ,羧酸,醇,醚等
b. 多齿配位体(有两个或两个以上的配位原子)
乙二胺 NH2一CH2一CH2一NH2 简写为en,
乙二胺四乙酸根(EDTA)等。
3.配位数
与中心离子直接以配位键结合的配位原子个数。
例:[AlF6]3- 配位数6 、 [Cu(NH3)4]SO4 配位数4 、
[Co(NH3)2(en)2](NO3)3 配位数6
*中心离子的电荷高,对配位体的吸引力较强,有利于形成配位数较高的配合物。
常见的配位数与中心离子的电荷数有如下的关系:
中心离子的电荷:+1 +2 +3 +4
常见的配位数: 2 4(或6) 6(或4) 6(或8)
*中心离子半径越大,其周围可容纳配体就越多,
配位数越大。
[AlF6]3- [AlCl4]- [BF4]- [AgI2]- [AgI4]2-
从这些配离子你看出配位数有什么规律?
4. 配离子的电荷
配离子的电荷等于中心离子电荷与配位体总电荷的代数和。 如 K2[PtCl4]
8.1.2 配位化合物的命名
配位数—配位体名称—合—中心离子(用罗马数字表示氧化数),
用二、三、四等数字表示配位体数。不同配位名称之间用圆点“·”分开。 阴离子次序为:简单离子——复杂离子——有机酸根离子。
中性分子次序为:NH3—H2O—有机分子。
1.配位阴离子配合物--配位阴离子“酸”外界
2.配位阳离子配合物—— “某化某”或“某酸某”
3.中性配合物
K2[SiF6] 六氟合硅(Ⅳ)酸钾
K[PtCl5(NH3)] 五氯·一氨合铂(Ⅳ)酸钾
[Co(NH3)6]Br3 三溴化六氨合钴(Ⅲ)
[Co(NH3)2(en)2](NO3)3 硝酸二氨·二(乙二胺)合钴(Ⅲ)
[PtCl2(NH3)2] 二氯·二氨合铂(Ⅱ)
[Ni(CO)4] 四羰基合镍(0)
配合物的盐与复盐的比较
复盐, 能电离出两种或两种以上阳离子的盐如明矾 KAl(SO4)2·12H2O、光卤石 KCl · MgCl2· 6H2O等,仅在固态时稳定存在,一旦溶于水,几乎全部解离成各组分离子:
KAl(SO4)2·12H2O (溶于水) → K+ +Al3++ 2SO42- +12 H2O
KCl · MgCl2 · 6H2O (溶于水) → K+ +Mg2+ + 3Cl- + 6H2O
配合物盐,是在配合物的溶液或晶体中,十分明确地存在着 含有配位键的、能独立存在的复杂组成的离子:
[Cu(NH3)4]SO4·H2O → [Cu(NH3)4]2+ + SO42- + H2O
形成配合物时性质的改变
1、颜色的改变
Fe3+ + nNCS- == [Fe(NCS)n](n-3)-
2、溶解度的改变:
AgCl + HCl =[AgCl2]- + H+
AgCl + 2NH3 == [Ag(NH3)2]+ + Cl-
Au + HNO3 + 4HCl == H[AuCl4] + NO + 2H2O
3Pt + 4HNO3 + 18HCl = 3H2[PtCl6] + 4NO + 8H2O
例题一:下列分子或离子中都存在着配位键的是 ( )
A.NH3、H2O B.NH4 + 、H3O+
C.N2、HClO D. [Cu(NH3) 4]2+ 、PCI3
B
例题二:下列各种说法中错误的是( )
A、形成配位键的条件是一方有空轨道一方有孤对电子。
B、配位键是一种特殊的共价键。
C、配位化合物中的配体可以是分子也可以是阴离子。
D、共价键的形成条件是成键原子必须有未成对电子。
D
