3.1 氧气的性质和用途课件--2021-2022学年九年级化学科粤版(2012)上册(共24张PPT)
文档属性
| 名称 | 3.1 氧气的性质和用途课件--2021-2022学年九年级化学科粤版(2012)上册(共24张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-07 00:00:00 | ||
图片预览








文档简介
(共24张PPT)
2016.09.22
【教学目标】:
【教学重点】:
【教学难点】:
1、认识氧气的主要物理性质、化学性质。
2、了解氧气的主要用途,氧气与人类的关系密切。
3、认识氧化反应、化合反应。
认识氧气主要的化学性质。
通过实验探究归纳出氧气的化学性质。
复习:
物理性质一般有哪些?
一般指颜色、状态、气味、熔点、沸点、硬度和密度、是否溶于水等。
一、物理性质(快速阅读P68的内容)
(1)无色无味气体(标准状况下)
(2)密度:略大于空气
(3)水溶性:不易溶于水
摘要:
氧气的三态变化:
氧气
(常温下是无色)
101.3Kpa
-183℃
(淡蓝色的液体)
101.3Kpa
-218℃
储存
蓝色钢瓶
淡蓝色、雪花状的固体
1.
助燃性
(1)氧气可使带火星的木条复燃。(即氧气能支持燃烧
)
氧气检验的方法:
将带有火星的木条伸入集气瓶内,如木条复燃,则证明瓶内装的是氧气。
讨论:现桌上有三瓶无色气体,分别是氧气、空气、二氧化碳,如何区别?
将燃着的木条分别伸入集气瓶中,如果燃烧得更加旺盛,原来的气体就是氧气;无明显变化的是空气;木条熄灭的是二氧化碳。
【演示实验】
1、发红光
2、放热
1、发白光
2、放热
碳、
氧气
文字表达式:
碳
+
氧气
二氧化碳
点燃
C
+
O2
CO2
点燃
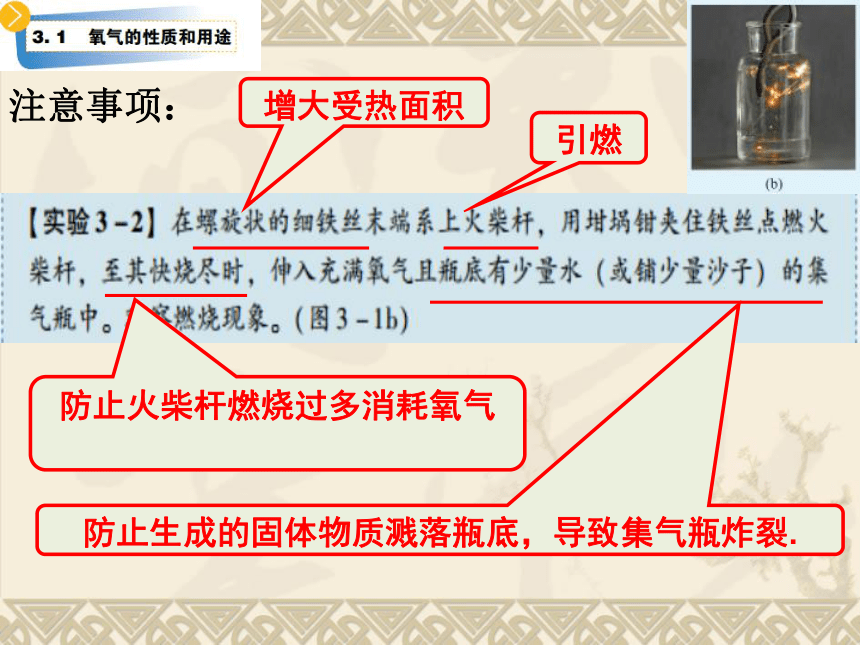
增大受热面积
引燃
防止火柴杆燃烧过多消耗氧气
防止生成的固体物质溅落瓶底,导致集气瓶炸裂.
注意事项:
【演示实验】
受热发红,未见燃烧
剧烈燃烧,火星四射,放出大量
的热,生成黑色固体
铁、氧气
文字表达式:
铁
+
氧气
四氧化三铁
点燃
Fe
+
O2
Fe3O4
点燃
【演示实验】
文字表达式:
蜡烛
+
氧气
二氧化碳
+
水
点燃
1、发黄光
2、放热
剧烈燃烧,发出白光,放热
蜡烛、氧气
硫的燃烧:
燃烧时出现的现象
反应前的物质
反应后生成的新物质
在空气中
在氧气中
硫
氧气
二氧化硫
(SO2)
1、发出淡蓝色的火焰
2、放热
3、生成有刺激性气味的气体
1、发出蓝紫色的火焰
2、放热
3、生成有刺激性气味的气体
文字表达式:
硫
+
氧气
二氧化硫
点燃
S
+
O2
SO2
点燃
氧化反应
剧烈氧化
燃烧、火
药爆炸等
缓慢氧化
动植物的呼吸、
金属生锈等
氧化反应:物质跟氧发生的反应。
缓慢氧化:进行得很慢,不容易被察觉的氧化叫缓慢氧化。
特点:发光、发热
特点:不发光、发热
化合反应:由两种或两种以上的物质生成一种物质的反应。
特点:多变一
表示
:A
+
B
AB
碳
+
氧气
二氧化碳
点燃
铁
+
氧气
四氧化三铁
点燃
【思考】上述两个变化中,有什么共同的特征?P70
讨论与交流3
1、都有氧气参加反应
2、反应条件都是点燃
3、都是氧化反应
4、都是化合反应
判断下列反应是否为化合反应、还是氧化反应?
硫
+
氧气
二氧化硫
点燃
锌
+
盐酸
氯化锌+氢气
石蜡
+
氧气
二氧化碳+水
点燃
镁
+
氧气
氧化镁
点燃
讨论:在什么情况下,一个反应既是化合反应又是氧化反应?
性质
用途
决定
体现
1、氧气的物理性质
2、氧气的化学性质比较活泼,能支持燃烧。
3、由两种或两种发上的物质生成另一种物质的反应,叫做化合反应。物质与氧发生的反应叫做氧化反应。
学完本课题你应该知道:
1、联欢会上,化学老师出了一条谜语:说是宝,真是宝,动物植物离不了;看不见。摸不着.越往高处越稀少——打一物质名称。这条谜语的谜底是(
)
A、氮气
B、氧气
C、稀有气体
D、二氧化碳
2、下列物质在氧气中燃烧时,能看到浓厚白烟的是(
)
A.氢气
B.硫粉
C.红磷
D.木炭
B
c
3.
观察右图中的有关操作和现象,判断下列叙述正确的是(
)
A.
集气瓶中的气体可能是CO2
B.
集气瓶的气体可能是空气
C.
集气瓶中的气体一定是O2
D.
集气瓶中的气体一定是N2
A
B
4.下列有关实验现象的描述错误的是(
)
A.木炭在氧气中燃烧比在空气中更剧烈
B.木炭在氧气中燃烧生成二氧化碳气体
C.硫在氧气中燃烧火焰为蓝紫色,生成一种有刺激性气味的气体
D.木炭燃烧后,立即向瓶内倒入澄清的石灰水,振荡后变浑浊
C
C
D
3
2
1、2、3
2
防止生成物溅落,造成瓶底破裂。
铁
+
氧气
四氧化三铁
点燃
磷
+
氧气
五氧化二磷
点燃
铝
+
氧气
氧化铝
点燃
镁
+
氧气
氧化镁
点燃
3968254
198
2016.09.22
【教学目标】:
【教学重点】:
【教学难点】:
1、认识氧气的主要物理性质、化学性质。
2、了解氧气的主要用途,氧气与人类的关系密切。
3、认识氧化反应、化合反应。
认识氧气主要的化学性质。
通过实验探究归纳出氧气的化学性质。
复习:
物理性质一般有哪些?
一般指颜色、状态、气味、熔点、沸点、硬度和密度、是否溶于水等。
一、物理性质(快速阅读P68的内容)
(1)无色无味气体(标准状况下)
(2)密度:略大于空气
(3)水溶性:不易溶于水
摘要:
氧气的三态变化:
氧气
(常温下是无色)
101.3Kpa
-183℃
(淡蓝色的液体)
101.3Kpa
-218℃
储存
蓝色钢瓶
淡蓝色、雪花状的固体
1.
助燃性
(1)氧气可使带火星的木条复燃。(即氧气能支持燃烧
)
氧气检验的方法:
将带有火星的木条伸入集气瓶内,如木条复燃,则证明瓶内装的是氧气。
讨论:现桌上有三瓶无色气体,分别是氧气、空气、二氧化碳,如何区别?
将燃着的木条分别伸入集气瓶中,如果燃烧得更加旺盛,原来的气体就是氧气;无明显变化的是空气;木条熄灭的是二氧化碳。
【演示实验】
1、发红光
2、放热
1、发白光
2、放热
碳、
氧气
文字表达式:
碳
+
氧气
二氧化碳
点燃
C
+
O2
CO2
点燃
增大受热面积
引燃
防止火柴杆燃烧过多消耗氧气
防止生成的固体物质溅落瓶底,导致集气瓶炸裂.
注意事项:
【演示实验】
受热发红,未见燃烧
剧烈燃烧,火星四射,放出大量
的热,生成黑色固体
铁、氧气
文字表达式:
铁
+
氧气
四氧化三铁
点燃
Fe
+
O2
Fe3O4
点燃
【演示实验】
文字表达式:
蜡烛
+
氧气
二氧化碳
+
水
点燃
1、发黄光
2、放热
剧烈燃烧,发出白光,放热
蜡烛、氧气
硫的燃烧:
燃烧时出现的现象
反应前的物质
反应后生成的新物质
在空气中
在氧气中
硫
氧气
二氧化硫
(SO2)
1、发出淡蓝色的火焰
2、放热
3、生成有刺激性气味的气体
1、发出蓝紫色的火焰
2、放热
3、生成有刺激性气味的气体
文字表达式:
硫
+
氧气
二氧化硫
点燃
S
+
O2
SO2
点燃
氧化反应
剧烈氧化
燃烧、火
药爆炸等
缓慢氧化
动植物的呼吸、
金属生锈等
氧化反应:物质跟氧发生的反应。
缓慢氧化:进行得很慢,不容易被察觉的氧化叫缓慢氧化。
特点:发光、发热
特点:不发光、发热
化合反应:由两种或两种以上的物质生成一种物质的反应。
特点:多变一
表示
:A
+
B
AB
碳
+
氧气
二氧化碳
点燃
铁
+
氧气
四氧化三铁
点燃
【思考】上述两个变化中,有什么共同的特征?P70
讨论与交流3
1、都有氧气参加反应
2、反应条件都是点燃
3、都是氧化反应
4、都是化合反应
判断下列反应是否为化合反应、还是氧化反应?
硫
+
氧气
二氧化硫
点燃
锌
+
盐酸
氯化锌+氢气
石蜡
+
氧气
二氧化碳+水
点燃
镁
+
氧气
氧化镁
点燃
讨论:在什么情况下,一个反应既是化合反应又是氧化反应?
性质
用途
决定
体现
1、氧气的物理性质
2、氧气的化学性质比较活泼,能支持燃烧。
3、由两种或两种发上的物质生成另一种物质的反应,叫做化合反应。物质与氧发生的反应叫做氧化反应。
学完本课题你应该知道:
1、联欢会上,化学老师出了一条谜语:说是宝,真是宝,动物植物离不了;看不见。摸不着.越往高处越稀少——打一物质名称。这条谜语的谜底是(
)
A、氮气
B、氧气
C、稀有气体
D、二氧化碳
2、下列物质在氧气中燃烧时,能看到浓厚白烟的是(
)
A.氢气
B.硫粉
C.红磷
D.木炭
B
c
3.
观察右图中的有关操作和现象,判断下列叙述正确的是(
)
A.
集气瓶中的气体可能是CO2
B.
集气瓶的气体可能是空气
C.
集气瓶中的气体一定是O2
D.
集气瓶中的气体一定是N2
A
B
4.下列有关实验现象的描述错误的是(
)
A.木炭在氧气中燃烧比在空气中更剧烈
B.木炭在氧气中燃烧生成二氧化碳气体
C.硫在氧气中燃烧火焰为蓝紫色,生成一种有刺激性气味的气体
D.木炭燃烧后,立即向瓶内倒入澄清的石灰水,振荡后变浑浊
C
C
D
3
2
1、2、3
2
防止生成物溅落,造成瓶底破裂。
铁
+
氧气
四氧化三铁
点燃
磷
+
氧气
五氧化二磷
点燃
铝
+
氧气
氧化铝
点燃
镁
+
氧气
氧化镁
点燃
3968254
198
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
