第1章化学反应质量评估卷单元测试(有答案)
文档属性
| 名称 | 第1章化学反应质量评估卷单元测试(有答案) |
|
|
| 格式 | zip | ||
| 文件大小 | 190.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-10-07 20:20:01 | ||
图片预览

文档简介
第一单元
质量评估卷
考试时间:60分钟
满分:100分
题号
一
二
三
总分
评分
一、单选题
1.
(
2分
)
蜡烛在空气中完全燃烧生成二氧化碳和水蒸气,关于蜡烛中元素组成说法正确的是(
)
A.一定没有氧元素
B.一定含有碳、氢两种元素
C.只含有碳、氢两种元素
D.一定含有碳、氢、氧三种元素
2.
(
2分
)
1774年,法国化学家拉瓦锡在加热氧化汞时,制得并命名了氧气。加热氧化汞发生的化学反应为2HgO=2Hg+O2↑。该反应属于(
)
A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应
3.
(
2分
)
小科加热氯酸钾和二氧化锰的混合物来制取氧气。在加热过程中,该固体混合物中氧元素质量随时间变化关系正确的是(
)
A. B. C. D.
4.
(
2分
)
电子工业中常用氯化铁(FeCl3)溶液腐蚀铜板上不需要的铜,制作印刷电路板,反应化学方程式为Cu+2FeCl3=CuCl2+2FeCl2。关于该反应判断正确的是(
)
A. 属于化合反应 B. 参加应的Cu、FeCl3质量之和等于生成的CuCl2、FeCl2质量之和
C. 反应前后氯原子的数目增加
D. 反应后铜元素的化合价降低
5.
(
2分
)
如图所示是磷与氧气反应前后的微观模型图(●表示磷原子,○表示氧原子),根据质量守恒定律,则虚线框中的微观模型应该是(
)
A. B. C. D.
题5图
题6图
6.
(
2分
)
某化学反应的微观示意图如下图所示(不同小球代表不同的原子),下列说法中不正确的是(
)
A.在此图示变化中共有四种物质
B.该图示变化中的分子没有变化
C.原子是化学反应中的最小粒子
D.反应前后物质的质量总和不变
7.
(
2分
)
根据下列实验方案进行实验,能达到相应实验目的是
(
)
A. 甲:收集氧气并验满 B. 乙:检验土壤中存在有机物
C. 丙:测定空气中氧气的体积分数 D. 丁:探究可燃物燃烧的条件
8.
(
2分
)
2021年6月3日凌晨在西昌卫星发射中心用长征运载火箭成功发射风云四号卫星,发射该卫星的火箭用联氨(N2H4)做燃料,用四氧化二氮(N2O4)助燃,生成物不会对大气造成污染,该反应的化学方程式是2N2H4+N2O4=3X+4H2O。请你写出X的化学式(
)
A.
NO B. N2
C. NH3
D. O2
9.
(
2分
)
逻辑推理是一种重要的科学思维方法,以下推理合理的是(
)
A. 因为离子是带电的粒子,所以带电的粒子就是离子
B. 因为单质中只含一种元素,所以只含一种元素的物质就是单质
C. 因为化合物含有多种元素,所以含多种元素的物质一定都是化合物
D. 因水电解只得到氢气和氧气,所以水一定由氢、氧两种元素组成
10.
(
2分
)
一定条件下,在一密闭容器内发生某化学反应,并测得反应前后各物质的质量如图所示。下列说法正确的是(
)
A. x的值为9 B. 该反应中氧气与水的质量变化之比为6:5
C. W由碳、氢两种元素组成 D. W中碳、氢元素质量比为3:1
题10图
题11图
11.
(
2分
)
如图所示,某矿石含六种元素。则该矿石中不可能存在的物质是(
)
A. Al2O3 B. CaCO3 C. SiO2 D. Cu2(OH)2CO3
12.
(
2分
)
镁、锌、铁的混合物50克与足量的稀硫酸反应得到混合溶液,蒸发后得到218克固体(已换算成无水硫酸盐)。则反应产生氢气的质量是(
)
A. 2克 B. 3克 C. 3.5克 D. 4.5克
13.
(
2分
)
某只含铁、氧两种元素的样品A,高温时与足量的CO充分反应,生成的气体被足量澄清石灰水吸收,测得沉淀的质量与原样品A质量相等,如果A中只含两种物质,则A中一定含有(
)
A. FeO B. Fe2O3
C. Fe D. Fe3O4
14.
(
2分
)
在一个密闭容器中放入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表。
物质.
甲
乙
丙
丁
反应前质量(克)
18
1
2
32
反应后质量(克)
x
(未知)
26
2
12
下列说法中,不正确的是(
)
A.反应后物质甲的质量为13克
B.乙是反应物
C.反应中乙、丁的质量比为5:
4
D.物质丙可能是该反应的催化剂
15.
(
2分
)
工业上可以用甲烷制合成气,如图所示是反应的微观示意图。下列说法不正确的是(
)
A. 图中甲为甲烷,化学式为CH4 B. 乙和内都属于氧化物
C. 参加反应的甲和乙的质量比是5:3 D. 生成的丙和丁的分子个数比为1:3
16.
(
2分
)
我国科学家创造性地构建了“单中心铁催化剂”,在甲烷高效转化研究中获得重大突破,其成果在最近的美国《科学》杂志发表。该转化的微观示意图如图所示,有关转化的说法正确的是(
)
A.催化剂只能是加快反应速率 B. 保持氢气化学性质的最小粒子是H
C. 该反应的化学方程式是:2CH4═C2H4+2H2
D. 反应前后分子的种类发生了改变,是分解反应
17.
(
2分
)
ClO2是安全消毒剂,可由如下反应制取:2NaClO2+Cl2═2ClO2+xNaCl。则下列说法正确的是(
)
A. ClO2的化学名称为一氯化二氧 B. ClO2中氯元素的化合价为+2价
C. 制取ClO2的反应属于化合反应 D. 制取ClO2的反应中,x=2
18.
(
2分
)
某同学学习了氧气制取和性质后,记录了部分实验操作或现象,其中符合事实的是(
)
A. 实验室制取氧气时,加入药品后再检查装置的气密性
B. 铜片在氧气中加热时,不会发生任何变化
C. 红磷在氧气中燃烧时,生成刺激性气味的气体
D. 铁丝在氧气中燃烧时,火星四射,生成黑色固体
19.
(
2分
)
下列证明水电解实验中两极产生什么气体的方法,正确的是(
)。
A.用燃着的木条接近液面下降较多的玻璃管尖嘴处的气体,气体燃烧,出现淡蓝色火焰,证明是氢气
B.用带火星的木条接近液面下降较多的玻璃管尖嘴处的气体,木条立即复燃,证明是氧气
C.用带火星的木条接近液面下降较少的玻璃管尖嘴处的气体,气体燃烧,证明是氧气
D.用燃着的木条接近液面下降较少的玻璃管尖嘴处的气体,气体燃烧,出现淡蓝色火焰,证明是氢气
20.
(
2分
)
实验室制取氢气的原理是:Zn+H2SO4=ZnSO4+H2↑。下列气体的实验室制法中,与制取氢气所用的实验器材相同且所选试剂正确的是(
)
A.高锰酸钾加热分解制取氧气
B.石灰石和稀硫酸反应制取二氧化碳
C.双氧水与二氧化锰混合制取氧气
D.氯酸钾与二氧化锰混合加热制取氧气
二、填空题
21.
(
2分
)
.神秘的三星堆遗址挖掘出了许多青铜面具,这些面具表面都有一层绿色的铜锈,其主要成分为碱式碳酸铜[Cu2(OH)2CO3]。碱式碳酸铜是铜与空气中的氧气、二氧化碳等物质反应生成的,其反应的化学方程式为:2Cu+O2+X+CO2=Cu2(OH)2CO3。
(1).请写出X的化学式为
。
(2).该反应的基本类型是
。
22.
(
4分
)
某化学研究小组利用CO2催化氢化制甲烷的办法,实现了将CO2转化为有机物,实验过程如图。对反应后的物质进行检测,结果如下:
在气体中检测到甲烷(CH4)、氢气;在液体中检测到甲酸(HCOOH);在固体中检测到镍粉、四氧化三铁。请分析以上变化关系和检测结果,回答以下问题:
(1)以上反应过程中,有一种物质起到了催化作用,你认为该物质很可能是_____ (填名称)。
(2)在高温条件下,铁粉能够与水蒸气发生反应3X+4H2O(气)
Fe3O4+4H2
,
则X的化学式为________。
23.
(
6分
)
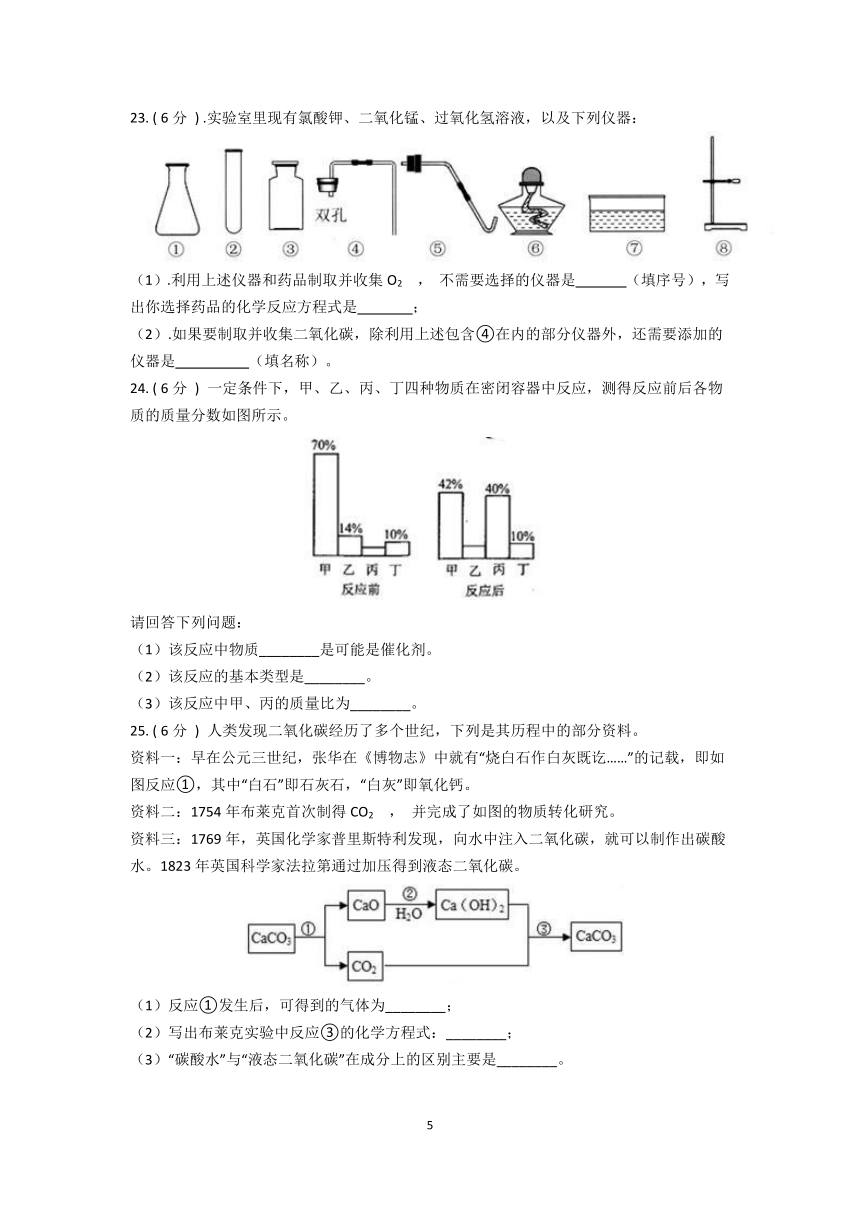
.实验室里现有氯酸钾、二氧化锰、过氧化氢溶液,以及下列仪器:
(1).利用上述仪器和药品制取并收集O2
,
不需要选择的仪器是
(填序号),写出你选择药品的化学反应方程式是
;
(2).如果要制取并收集二氧化碳,除利用上述包含④在内的部分仪器外,还需要添加的仪器是
(填名称)。
24.
(
6分
)
一定条件下,甲、乙、丙、丁四种物质在密闭容器中反应,测得反应前后各物质的质量分数如图所示。
请回答下列问题:
(1)该反应中物质________是可能是催化剂。
(2)该反应的基本类型是________。
(3)该反应中甲、丙的质量比为________。
25.
(
6分
)
人类发现二氧化碳经历了多个世纪,下列是其历程中的部分资料。
资料一:早在公元三世纪,张华在《博物志》中就有“烧白石作白灰既讫……”的记载,即如图反应①,其中“白石”即石灰石,“白灰”即氧化钙。
资料二:1754年布莱克首次制得CO2
,
并完成了如图的物质转化研究。
资料三:1769年,英国化学家普里斯特利发现,向水中注入二氧化碳,就可以制作出碳酸水。1823年英国科学家法拉第通过加压得到液态二氧化碳。
(1)反应①发生后,可得到的气体为________;
(2)写出布莱克实验中反应③的化学方程式:________;
(3)“碳酸水”与“液态二氧化碳”在成分上的区别主要是________。
26.
(
4分
)
在一个密闭容器中,有a、b、c、d四种物质,反应前各物质的质量关系如图刻度纸所示(例如:a的质量为5g,d的质量为2g)。在一定条件下发生反应,反应结束后,再次测得各物质的质量变化,并通过刻度的移动来表示,且记录在同一张刻度纸上:刻度线Ⅰ向右移动9格;刻度线Ⅱ向左移动8格;刻度线Ⅲ向左移动8格。
(1)该反应的类型是________。
(2)a、b变化的质量比为________。
三、实验探究题
27.
(
6分
)
质量守恒是所有化学反应都必须遵守的定律。某兴趣小组利用如图装置验证质量守恒定律,步骤如下:①按如图方式将椎形瓶置于天平托盘上,调节天平平衡;②取下锥形瓶,然后使稀盐酸和大理石粉末充分接触;③充分反应后,将锥形瓶放回左盘,观察天平是否平衡。
(1)步骤②中使稀盐酸和大理石粉末充分接触,其操作是________;
(2)步骤③中发现天平不平衡,导致出现该现象的原因可能是________;
(3)关于上述实验的说法正确的是
(填字母)。
A.使用气球的目的,是防止生成物从密封系统中逸出
B.若大理石粉末质量不足,则不能验证质量守恒定律
C.天平不平衡,是因反应前后原子的种类和数目发生改变
题27图
题28图
28.
(
6分
)
.小安进行如图所示的实验:在一根用细铜丝吊着的长玻璃棒两端,分别绕上粗铜丝,并使玻璃保持水平。然后,用酒精灯给a端铜丝加热数分钟。
(1).停止加热后冷却,可以观察到的现象是:铜丝表面变黑色, ;
(2).小安根据实验现象得出:在化学反应中,生成物的总质量与反
应物的总质量不相等,请你从原子的角度分析,他的结论是否正确: 。
(3).启示:若利用 的反应验证质量守恒定律时,必须在密闭的容器内进行。
29.
(
6分
)
小嘉用H2O2溶液制取氧气时,在烧瓶中加入50毫升水及0.5克MnO2
,
再往分液漏斗中加入30毫升15%的H2O2溶液。为什么要加入50毫升水呢?查阅资料发现:在不加入水时,若注入H2O2溶液速度过快,反应会过于剧烈而引发事故。
[提出问题]水是如何减缓该反应速度的呢?
[建立假设]水可以降低H2O2溶液浓度,从而减缓反应速度
[实验方案]他利用如图装置,在相同条件下,分别用30毫升的1%、3%和7%的H2O2溶液进行实验,观察并比较。
[实验结论]加水降低了H2O2溶液的浓度,使反应速度变慢。
[交流反思]
(1)为了更好地比较反应的快慢,在三次实验中滴加等量H2O2溶液时,需控制________相同。
(2)判断产生氧气的速度时,可以通过观察产生气泡的快慢,还可以比较________。
(3)为了探究H2O2溶液分解快慢还与哪些因素有关,他又利用如图装置,用3%的H2O2溶液分别在0°C、20℃和60℃的条件下进行实验。进行该实验所基于的假设是________。
四、解答题
30.
(
8分
)
绍兴盛产一种四角菱,称“驮背白”。其菱肉富含淀粉等多种营养物质,此外菱角的茎和根富含纤维素(C6H10O5)n,也是一-种很不错的食物和药材。
(1)菱肉中的钙、磷、铁等元素是以________(填“单质”或“化合物”)的形态存在;
(2)该纤维素中C、H、O元素的质量比________(最简比)
;
(3)查阅资料获悉菱肉制成的菱粉质细爽滑,为淀粉中之佳品。求菱叶产生3.6千克淀粉[有机物(CH2O)n]的同时,光合作用产生氧气多少千克?
(已知光合作用的化学方程式为:nCO2+nH2O=(CH2O)n+nO2:条件忽略)
31.
(
6分
)
石头纸是一种介于纸张和塑料之间的环保新型材料,主要成分为碳酸钙。为测定其中碳酸钙的含量,课外活动小组的同学进行了实验,实验数据见下表(假设纸张其他成分既不溶于水,也不与水反应):
烧杯①
烧杯②
烧杯③
烧杯④
烧杯⑤
加入样品的质量/g
10
10
10
10
10
加入稀盐酸的质量/g
10
20
30
40
50
充分反应后生成气体的质量/g
0.88
1.76
2.64
3.08
3.08
(1)根据表中的实验数据可知,烧杯④样品中的碳酸钙全部参加了反应,则10克样品完全反应生成二氧化碳的质量为________克。
(2)求样品中碳酸钙的质量分数。(需写出计算过程)
答案部分
一、单选题
1.
B
2.
B
3.
B
4.
B
5.
D
6.
B
7.
D
8.
B
9.
D
10.
D
11.
D
12.
C
13.
C
14.
B
15.
C
16.
D
17.
D
18.
D
19.
A
20.
C
二、填空题
21.
(1)H2O(2)化合反应
22.
(1)镍粉(2)Fe
23.
(1)①和④;2KClO3
2KCl+
3O2↑(2)长颈漏斗(分液漏斗)
24.
(1)丁
(2)化合反应
(3)14:
17
25.
(1)CO2
(2)CO2+Ca(OH)2=CaCO3↓+H2O
(3)碳酸水中含有水分子、二氧化碳分子、碳酸分子、氢离子和碳酸根离子,而液态二氧化碳中只含有二氧化碳分子。
26.
(1)分解反应
(2)9:17
三、实验探究题
27.
(1)将气球中的大理石物末倒入锥形瓶中
(2)气球受到浮力(或装置漏气)
(3)A
28.
(1)左端(a端)下沉
(2)化学反应前后,原子的种类和数目都不会改变
(3)有气体反应或者生成
29.
(1)速度(或时间)
(2)相同时间内收集的氧气体积(或收集相同体积氧气所需的时间或量筒内液面下降的快慢)
[继续探究]
(3)H2O2溶液分解快慢可能与温度有关。
四、解答题
30.
(1)化合物
(2)36:5:40
(3)解:设光合作用产生氧气质量为x。
nCO2+nH2O=
(CH2O)n+
nO2
30n
32n
3.6kg
x
x=3.84Kg
答:光合作用产生氧气3.84千克.
31.
(1)3.08
(2)解:设10克样品中碳酸钙的质量为x,则
CaCO3+2HCl=CaCl2+H2O+
CO2↑
100
44
x
3.08克
得:x=7克
CaCO3%=
答:样品中碳酸钙的质量分数为70%。
解析部分
一、单选题
1.
B
【解析】蜡烛在空气中完全燃烧生成二氧化碳和水蒸气,由反应前后元素种类不变可知,蜡烛中一定含碳元素和氢元素,可能含氧元素;
2.
B
【解析】根据
2HgO=2Hg+O2↑
可知,反应物只有一种,而生成物有两种,应该为分解反应,故B正确,而A、C、D错误。
3.
B
【解析】随着氯酸钾的分解,生成的氧气越来越多,而混合物中的氧元素越来越少。当氯酸钾完全分解后,因为二氧化锰的质量不变,所以混合物中氧元素的质量不再发生改变,故B正确,而A、C、D错误。
4.
B
【解析】A.该反应的生成物有两种,肯定不属于化合反应,故A错误;
B.根据质量守恒定律可知,参加应的Cu、FeCl3质量之和等于生成的CuCl2、FeCl2质量之和,故B正确;
C.反应前后氯原子的数目都是6个,故C错误;
D.反应前,铜单质中铜元素的化合价为0价,而反应后CuCl2中铜元素的化合价为+2价,故D错误。
5.
D
【解析】设方框内围观模型为x,根据微观模型图得到:x+10=10+4,
解得:x=4,
故D正确,而A、B、C错误。
6.
B
【解析】A.根据图片可知,图中有四种不同的分子,则共有四种物质,故A正确不合题意;
B.根据和可知,图示变化中分子发生了变化,故B错误符合题意;
CD.反应前后,原子的种类都是三种,且每种原子的个数保持不变,故C、D正确不合题意。
7.
D
【解析】A.甲:氧气的密度大于空气,因此导气管口应该伸到集气瓶底部,故A错误;
B.乙:通过给土壤加热的方式无法判断是否存在有机物,故B错误;
C.丙:木炭燃烧生成二氧化碳气体,集气瓶内气压变化不大,烧杯内的水几乎不能流入集气瓶内,无法完成氧气的测量,故C错误;
D.铜片上的白磷和红磷比较,可以得到燃烧的条件之一为达到着火点;铜片上的白磷和水里的白磷比较,可以得到燃烧的条件之一为与氧气接触,故D正确。
8.
B
【解析】根据方程式
2N2H4+N2O4=3X+4H2O
得到:6N+8H+4O=3X+8H+4O,解得:3X=6N,即X=N2
,
故B正确,而A、C、D错误。
9.
D
【解析】A.带电的离子可能是质子、电子和离子,故A错误;
B.臭氧和氧气都是由氧元素组成的单质,二者混合为混合物,而不是单质,故B错误;
C.铁单质和铜单质混合在一起时,就含有多种元素,但它们组成的是混合物而不是化合物,故C错误;
D.根据质量守恒定律可知,因水电解只得到氢气和氧气,所以水一定由氢、氧两种元素组成,故D正确。
10.
D
【解析】A.根据反应前后元素质量守恒得到:x=(1g+20g+8g)-(8g+11g)=10g,故A错误;
B.该反应中,氧气的质量减少:20g-8g=12g,水的质量增加了:10g-1g=9g,则氧气与水的质量变化之比为:12g:9g=4:3,故B错误;
C、11gCO2中含有碳元素的质量为:
,
9g水中含有氢元素的质量为:
,
、
所含碳、氢元素的质量和:3g+1g=4g<8g,
该物质中含氧元素的质量为:8g-4g=4g,
则该物质中一定含有碳、氢、氧三种元素,故C错误;
D.W中碳、氢元素质量比为3g:1g=3:1,故D正确。
11.
D
【解析】根据图片可知,该矿石中不含有H元素,而Cu2(OH)2CO3中含有H元素,违反了元素守恒定律,故D符合题意,而A、B、C不合题意。
12.
C
【解析】设生成氢气的质量为x,根据关系式A→ASO4→SO4→H2↑得到:
则
解得:x=3.5g;
13.
C
【解析】设含铁、氧两种元素的样品中A的化学式为FexOy
,
高温时与足量的CO充分反应,即FexOy+yCOxFe+yCO2
,
生成的气体被足量澄清石灰水吸收,即CO2+Ca(OH)2=CaCO3↓+H2O,
设原样品的质量为mg,则沉淀的质量为mg,
由上方的方程式得到:FexOy~yCaCO3
56x+16y
100y
mg
mg
;
解得:
,
由于铁与氧的原子个数比是3:2,
在FeO、Fe2O3和Fe3O4中,铁和氧原子的个数之比都小于3:2,
说明了A中一定含有铁。
14.
B
【解析】A.根据质量守恒定律得到:18g+1g+2g+32g=x+26g+2g+12g,解得:x=13g,故A正确不合题意;
DB.比较可知,甲和丁的质量减小,为反应物;而乙的质量增大,为生成物,丙的质量不变,可能为催化剂,故B错误符合题意,D正确不合题意;
C.反应中乙和丁的质量之比为:(26g-1g):(32g-12g)=5:4,故C正确不合题意。
15.
C
【解析】A.根据可知,甲由一个碳原子和四个氢原子构成,化学式为CH4
,
名称为甲烷,故A正确不合题意;
B.根据和可知,乙和丙都由两种元素组成,其中一种为氧元素,则它们都是氧化物,故B正确不合题意;
C.参加反应的甲和乙的质量比为:(12+1×4):(12+16×2)=16:44=4:11,故C错误符合题意;
D.生成的丙和丁的分子个数之比为1:3,故D正确不合题意。
16.
D
【解析】A.催化剂可能加快反应速率,也可能减慢反应速率,故A错误;
B.保持氢气化学性质的最小粒子是H2
,
故B错误;
C.该反应的化学方程式是:
2CH4C2H4+2H2
,故C错误;
D.反应前后分子的种类发生了改变,由于反应物有一种,而生成物有两种,因此为分解反应,故D正确。
17.
D
【解析】A.ClO2的化学名称为二氧化氯,故A错误;
B.
根据ClO2
,
利用正负化合价代数和为零得到:x+(-2)×2=0,解得:x=+4价,故B错误;
C.
该反应的反应物和生成物都是两种,肯定不是化合反应,故C错误;
D.
根据方程式
2NaClO2+Cl2═2ClO2+xNaCl
得到:2Na+4Cl+4O=2Cl+4O+xNaCl,解得:xNaCl=2Na+2Cl,即x=2,故D正确。
18.
D
【解析】A.实验室制取氧气时,先检查装置的气密性再装入药品,故A错误;
B.铜片在氧气中加热时,会变成黑色,即生成氧化铜,故B错误;
C.红磷在氧气中燃烧时,生成白烟,即生成五氧化二磷固体,故C错误;
D.铁丝在氧气中燃烧时,火星四射,生成黑色固体,故D正确。
19.
A
【解析】A、电解水时产生氢气体积大于氧气体积,用燃着的木条接近液面下降较多的玻璃管尖嘴处的气体,气体燃烧,出现淡蓝色火焰,证明是氢气
,符合题意;
B、
电解水时产生氢气体积大于氧气体积,用带火星的木条接近液面下降较少的玻璃管尖嘴处的气体,木条立即复燃,证明是氧气
,不符合题意;
C、
用带火星的木条接近液面下降较少的玻璃管尖嘴处的气体,木条复燃,证明是氧气
,不符合题意;
D、
用燃着的木条接近液面下降较多的玻璃管尖嘴处的气体,气体燃烧,出现淡蓝色火焰,证明是氢气
,不符合题意;
20.
C
【解析】A、高锰酸钾加热分解制取氧气需要加热,而氢气不用
,不符合题意;
B、制取二氧化碳不能用稀硫酸,应选择稀盐酸,不符合题意;
C、
双氧水与二氧化锰混合制取氧气反应物为固液,反应条件为常温,可与氢气所用实验器材相同
,符合题意;
D、
氯酸钾与二氧化锰混合加热制取氧气需要加热,氢气不需要,不符合题意;
二、填空题
21.
(1)H2O
(2)化合反应
【解析】(1)根据方程式
2Cu+O2+X+CO2=Cu2(OH)2CO3
得到:2Cu+4O+1C+X=2Cu+5O+1C+2H,解得:X=2H+1O=H2O。
(2)根据方程式可知,反应物有4种,而生成物只有1种,则该反应为化合反应。
22.
(1)镍粉
(2)Fe
【解析】(1)根据题目描述可知,铁却反应生成了四氧化三铁;在反应物中有镍粉,在生成物中仍然有镍粉存在,因此镍粉质量和性质都没有改变,可能为催化剂。
(2)根据化学方程式
3X+4H2O(气) Fe3O4+4H2
和元素守恒得到:3X+8H+4O=3Fe+4O+8H,解得:3X=3Fe,即X=Fe。
23.
(1)①和④;2KClO3
2KCl+
3O2↑
(2)长颈漏斗(分液漏斗)
【解析】(1)氯酸钾分解制取氧气的实验装置如下图,那么不需要的仪器是锥形瓶和带有双孔胶塞的导管,故选①和④。
氯酸钾在二氧化锰的催化作用下受热分解,生成氯化钾和氧气,
反应的方程式为:
2KClO3 2KCl+
3O2↑
;
(2)在实验室内,通常用石灰石和稀盐酸反应制取二氧化碳,装置图如下:
如果要制取并收集二氧化碳,除利用上述包含④在内的部分仪器外,还需要添加的仪器是长颈漏斗(分液漏斗)。
24.
(1)丁
(2)化合反应
(3)14:
17
【解析】(1)根据图片可知,物质丁的质量在反应前后保持不变,可能是催化剂。
(2)反应前,丙的质量分数:1-70%-14%-10%=6%;
反应后,乙的质量分数为:1-42%-40%-10%=8%;
甲和乙的质量减小,为反应物,只有丙的质量增加,为生成物。因为只有一种生成物,所以该反应为化合反应。
(3)该反应中甲、丙的质量之比为:(70%-42%):(40%-6%)=14:17。
25.
(1)CO2
(2)CO2+Ca(OH)2=CaCO3↓+H2O
(3)碳酸水中含有水分子、二氧化碳分子、碳酸分子、氢离子和碳酸根离子,而液态二氧化碳中只含有二氧化碳分子。
【解析】(1)反应①发生后,可得到的气体为CO2;
(2)布莱克实验中反应③,即氢氧化钙与二氧化碳反应,生成碳酸钙和水,它化学方程式:CO2+Ca(OH)2=CaCO3↓+H2O。
(3)“碳酸水”与“液态二氧化碳”在成分上的区别主要是:碳酸水中含有水分子、二氧化碳分子、碳酸分子、氢离子和碳酸根离子,而液态二氧化碳中只含有二氧化碳分子。
26.
(1)分解反应
(2)9:17
【解析】(1)由图示可知,每一格的质量为1g;反应前a的质量为5g,b的质量为22g-5g=17g;c的质量为28g-22g=6g;d的质量为30g-28g=2g。
反应后,刻度线Ⅰ右移9格,a物质质量增加9g;刻度线Ⅱ左移8格,同时刻度线Ⅰ右移9格,则b物质质量减少了:8g+9g=17g;刻度线Ⅲ左移8格,同时刻度线Ⅱ左移8格,则c物质质量不变;刻度线Ⅲ左移8格,d物质的质量增加了8g,则该反应可表示为b→a+d。
那么该反应类型为分解反应。
(2)a、b的质量变化之比为:9g:17g=9:17。
三、实验探究题
27.
(1)将气球中的大理石物末倒入锥形瓶中
(2)气球受到浮力(或装置漏气)
(3)A
【解析】(1)步骤②中使稀盐酸和大理石粉末充分接触,其操作是:将气球中的大理石物末倒入锥形瓶中。
(2)步骤③中发现天平不平衡,导致出现该现象的原因可能是:气球受到浮力(或装置漏气)。
(3)A.使用气球的目的,是防止生成物从密封系统中逸出,故A正确;
B.若大理石粉末质量不足,则生成的二氧化碳的质量偏小,但是物质的总质量并没有发生改变,因此则能验证质量守恒定律,故B错误;
C.天平不平衡,是因反应前后气球受到的浮力大小不同,或者装置可能漏气,而原子的种类和数目保持不变,故C错误。
28.
(1)左端(a端)下沉
(2)化学反应前后,原子的种类和数目都不会改变
(3)有气体反应或者生成
【解析】(1)停止加热后冷却,可以观察到的现象是:铜丝表面变黑色,左端(a端)下沉;
(2)从原子的角度分析,他的结论是错误,理由是:化学反应前后,原子的种类和数目都不会改变。
(3)启示:若利用有气体反应或者生成的反应验证质量守恒定律时,必须在密闭的容器内进行。
29.
(1)速度(或时间)
(2)相同时间内收集的氧气体积(或收集相同体积氧气所需的时间或量筒内液面下降的快慢)
[继续探究]
(3)H2O2溶液分解快慢可能与温度有关。
【解析】(1)为了更好地比较反应的快慢,在三次实验中滴加等量H2O2溶液时,需控制速度(或时间)相同。
(2)判断产生氧气的速度时,可以通过观察产生气泡的快慢,还可以比较相同时间内收集的氧气体积(或收集相同体积氧气所需的时间或量筒内液面下降的快慢)。
(3)为了探究H2O2溶液分解快慢还与哪些因素有关,他又利用如图装置,用3%的H2O2溶液分别在0°C、20℃和60℃的条件下进行实验。进行该实验所基于的假设是:H2O2溶液分解快慢可能与温度有关。
四、解答题
30.
(1)化合物
(2)36:5:40
(3)解:设光合作用产生氧气质量为x。
nCO2+nH2O=
(CH2O)n+
nO2
30n
32n
3.6kg
x
x=3.84Kg
答:光合作用产生氧气3.84千克.
【解析】(1)菱肉同时含有钙、磷、铁等元素,应该是以化合物的形式存在;
(2)根据化学式
(C6H10O5)n
可知,该纤维素中C、H、O元素的质量比:(12×6):(1×10):(16×5)=36:5:40。
31.
(1)3.08
(2)解:设10克样品中碳酸钙的质量为x,则
CaCO3+2HCl=CaCl2+H2O+
CO2↑
100
44
x
3.08克
得:x=7克
CaCO3%=
答:样品中碳酸钙的质量分数为70%。
【解析】(1)根据表格数据确定最终生成二氧化碳的质量;
(2)写出碳酸钙与稀盐酸反应的化学方程式,利用二氧化碳的质量,根据质量之间的比例关系计算出参加反应的碳酸钙的质量,最后根据计算即可。
质量评估卷
考试时间:60分钟
满分:100分
题号
一
二
三
总分
评分
一、单选题
1.
(
2分
)
蜡烛在空气中完全燃烧生成二氧化碳和水蒸气,关于蜡烛中元素组成说法正确的是(
)
A.一定没有氧元素
B.一定含有碳、氢两种元素
C.只含有碳、氢两种元素
D.一定含有碳、氢、氧三种元素
2.
(
2分
)
1774年,法国化学家拉瓦锡在加热氧化汞时,制得并命名了氧气。加热氧化汞发生的化学反应为2HgO=2Hg+O2↑。该反应属于(
)
A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应
3.
(
2分
)
小科加热氯酸钾和二氧化锰的混合物来制取氧气。在加热过程中,该固体混合物中氧元素质量随时间变化关系正确的是(
)
A. B. C. D.
4.
(
2分
)
电子工业中常用氯化铁(FeCl3)溶液腐蚀铜板上不需要的铜,制作印刷电路板,反应化学方程式为Cu+2FeCl3=CuCl2+2FeCl2。关于该反应判断正确的是(
)
A. 属于化合反应 B. 参加应的Cu、FeCl3质量之和等于生成的CuCl2、FeCl2质量之和
C. 反应前后氯原子的数目增加
D. 反应后铜元素的化合价降低
5.
(
2分
)
如图所示是磷与氧气反应前后的微观模型图(●表示磷原子,○表示氧原子),根据质量守恒定律,则虚线框中的微观模型应该是(
)
A. B. C. D.
题5图
题6图
6.
(
2分
)
某化学反应的微观示意图如下图所示(不同小球代表不同的原子),下列说法中不正确的是(
)
A.在此图示变化中共有四种物质
B.该图示变化中的分子没有变化
C.原子是化学反应中的最小粒子
D.反应前后物质的质量总和不变
7.
(
2分
)
根据下列实验方案进行实验,能达到相应实验目的是
(
)
A. 甲:收集氧气并验满 B. 乙:检验土壤中存在有机物
C. 丙:测定空气中氧气的体积分数 D. 丁:探究可燃物燃烧的条件
8.
(
2分
)
2021年6月3日凌晨在西昌卫星发射中心用长征运载火箭成功发射风云四号卫星,发射该卫星的火箭用联氨(N2H4)做燃料,用四氧化二氮(N2O4)助燃,生成物不会对大气造成污染,该反应的化学方程式是2N2H4+N2O4=3X+4H2O。请你写出X的化学式(
)
A.
NO B. N2
C. NH3
D. O2
9.
(
2分
)
逻辑推理是一种重要的科学思维方法,以下推理合理的是(
)
A. 因为离子是带电的粒子,所以带电的粒子就是离子
B. 因为单质中只含一种元素,所以只含一种元素的物质就是单质
C. 因为化合物含有多种元素,所以含多种元素的物质一定都是化合物
D. 因水电解只得到氢气和氧气,所以水一定由氢、氧两种元素组成
10.
(
2分
)
一定条件下,在一密闭容器内发生某化学反应,并测得反应前后各物质的质量如图所示。下列说法正确的是(
)
A. x的值为9 B. 该反应中氧气与水的质量变化之比为6:5
C. W由碳、氢两种元素组成 D. W中碳、氢元素质量比为3:1
题10图
题11图
11.
(
2分
)
如图所示,某矿石含六种元素。则该矿石中不可能存在的物质是(
)
A. Al2O3 B. CaCO3 C. SiO2 D. Cu2(OH)2CO3
12.
(
2分
)
镁、锌、铁的混合物50克与足量的稀硫酸反应得到混合溶液,蒸发后得到218克固体(已换算成无水硫酸盐)。则反应产生氢气的质量是(
)
A. 2克 B. 3克 C. 3.5克 D. 4.5克
13.
(
2分
)
某只含铁、氧两种元素的样品A,高温时与足量的CO充分反应,生成的气体被足量澄清石灰水吸收,测得沉淀的质量与原样品A质量相等,如果A中只含两种物质,则A中一定含有(
)
A. FeO B. Fe2O3
C. Fe D. Fe3O4
14.
(
2分
)
在一个密闭容器中放入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表。
物质.
甲
乙
丙
丁
反应前质量(克)
18
1
2
32
反应后质量(克)
x
(未知)
26
2
12
下列说法中,不正确的是(
)
A.反应后物质甲的质量为13克
B.乙是反应物
C.反应中乙、丁的质量比为5:
4
D.物质丙可能是该反应的催化剂
15.
(
2分
)
工业上可以用甲烷制合成气,如图所示是反应的微观示意图。下列说法不正确的是(
)
A. 图中甲为甲烷,化学式为CH4 B. 乙和内都属于氧化物
C. 参加反应的甲和乙的质量比是5:3 D. 生成的丙和丁的分子个数比为1:3
16.
(
2分
)
我国科学家创造性地构建了“单中心铁催化剂”,在甲烷高效转化研究中获得重大突破,其成果在最近的美国《科学》杂志发表。该转化的微观示意图如图所示,有关转化的说法正确的是(
)
A.催化剂只能是加快反应速率 B. 保持氢气化学性质的最小粒子是H
C. 该反应的化学方程式是:2CH4═C2H4+2H2
D. 反应前后分子的种类发生了改变,是分解反应
17.
(
2分
)
ClO2是安全消毒剂,可由如下反应制取:2NaClO2+Cl2═2ClO2+xNaCl。则下列说法正确的是(
)
A. ClO2的化学名称为一氯化二氧 B. ClO2中氯元素的化合价为+2价
C. 制取ClO2的反应属于化合反应 D. 制取ClO2的反应中,x=2
18.
(
2分
)
某同学学习了氧气制取和性质后,记录了部分实验操作或现象,其中符合事实的是(
)
A. 实验室制取氧气时,加入药品后再检查装置的气密性
B. 铜片在氧气中加热时,不会发生任何变化
C. 红磷在氧气中燃烧时,生成刺激性气味的气体
D. 铁丝在氧气中燃烧时,火星四射,生成黑色固体
19.
(
2分
)
下列证明水电解实验中两极产生什么气体的方法,正确的是(
)。
A.用燃着的木条接近液面下降较多的玻璃管尖嘴处的气体,气体燃烧,出现淡蓝色火焰,证明是氢气
B.用带火星的木条接近液面下降较多的玻璃管尖嘴处的气体,木条立即复燃,证明是氧气
C.用带火星的木条接近液面下降较少的玻璃管尖嘴处的气体,气体燃烧,证明是氧气
D.用燃着的木条接近液面下降较少的玻璃管尖嘴处的气体,气体燃烧,出现淡蓝色火焰,证明是氢气
20.
(
2分
)
实验室制取氢气的原理是:Zn+H2SO4=ZnSO4+H2↑。下列气体的实验室制法中,与制取氢气所用的实验器材相同且所选试剂正确的是(
)
A.高锰酸钾加热分解制取氧气
B.石灰石和稀硫酸反应制取二氧化碳
C.双氧水与二氧化锰混合制取氧气
D.氯酸钾与二氧化锰混合加热制取氧气
二、填空题
21.
(
2分
)
.神秘的三星堆遗址挖掘出了许多青铜面具,这些面具表面都有一层绿色的铜锈,其主要成分为碱式碳酸铜[Cu2(OH)2CO3]。碱式碳酸铜是铜与空气中的氧气、二氧化碳等物质反应生成的,其反应的化学方程式为:2Cu+O2+X+CO2=Cu2(OH)2CO3。
(1).请写出X的化学式为
。
(2).该反应的基本类型是
。
22.
(
4分
)
某化学研究小组利用CO2催化氢化制甲烷的办法,实现了将CO2转化为有机物,实验过程如图。对反应后的物质进行检测,结果如下:
在气体中检测到甲烷(CH4)、氢气;在液体中检测到甲酸(HCOOH);在固体中检测到镍粉、四氧化三铁。请分析以上变化关系和检测结果,回答以下问题:
(1)以上反应过程中,有一种物质起到了催化作用,你认为该物质很可能是_____ (填名称)。
(2)在高温条件下,铁粉能够与水蒸气发生反应3X+4H2O(气)
Fe3O4+4H2
,
则X的化学式为________。
23.
(
6分
)
.实验室里现有氯酸钾、二氧化锰、过氧化氢溶液,以及下列仪器:
(1).利用上述仪器和药品制取并收集O2
,
不需要选择的仪器是
(填序号),写出你选择药品的化学反应方程式是
;
(2).如果要制取并收集二氧化碳,除利用上述包含④在内的部分仪器外,还需要添加的仪器是
(填名称)。
24.
(
6分
)
一定条件下,甲、乙、丙、丁四种物质在密闭容器中反应,测得反应前后各物质的质量分数如图所示。
请回答下列问题:
(1)该反应中物质________是可能是催化剂。
(2)该反应的基本类型是________。
(3)该反应中甲、丙的质量比为________。
25.
(
6分
)
人类发现二氧化碳经历了多个世纪,下列是其历程中的部分资料。
资料一:早在公元三世纪,张华在《博物志》中就有“烧白石作白灰既讫……”的记载,即如图反应①,其中“白石”即石灰石,“白灰”即氧化钙。
资料二:1754年布莱克首次制得CO2
,
并完成了如图的物质转化研究。
资料三:1769年,英国化学家普里斯特利发现,向水中注入二氧化碳,就可以制作出碳酸水。1823年英国科学家法拉第通过加压得到液态二氧化碳。
(1)反应①发生后,可得到的气体为________;
(2)写出布莱克实验中反应③的化学方程式:________;
(3)“碳酸水”与“液态二氧化碳”在成分上的区别主要是________。
26.
(
4分
)
在一个密闭容器中,有a、b、c、d四种物质,反应前各物质的质量关系如图刻度纸所示(例如:a的质量为5g,d的质量为2g)。在一定条件下发生反应,反应结束后,再次测得各物质的质量变化,并通过刻度的移动来表示,且记录在同一张刻度纸上:刻度线Ⅰ向右移动9格;刻度线Ⅱ向左移动8格;刻度线Ⅲ向左移动8格。
(1)该反应的类型是________。
(2)a、b变化的质量比为________。
三、实验探究题
27.
(
6分
)
质量守恒是所有化学反应都必须遵守的定律。某兴趣小组利用如图装置验证质量守恒定律,步骤如下:①按如图方式将椎形瓶置于天平托盘上,调节天平平衡;②取下锥形瓶,然后使稀盐酸和大理石粉末充分接触;③充分反应后,将锥形瓶放回左盘,观察天平是否平衡。
(1)步骤②中使稀盐酸和大理石粉末充分接触,其操作是________;
(2)步骤③中发现天平不平衡,导致出现该现象的原因可能是________;
(3)关于上述实验的说法正确的是
(填字母)。
A.使用气球的目的,是防止生成物从密封系统中逸出
B.若大理石粉末质量不足,则不能验证质量守恒定律
C.天平不平衡,是因反应前后原子的种类和数目发生改变
题27图
题28图
28.
(
6分
)
.小安进行如图所示的实验:在一根用细铜丝吊着的长玻璃棒两端,分别绕上粗铜丝,并使玻璃保持水平。然后,用酒精灯给a端铜丝加热数分钟。
(1).停止加热后冷却,可以观察到的现象是:铜丝表面变黑色, ;
(2).小安根据实验现象得出:在化学反应中,生成物的总质量与反
应物的总质量不相等,请你从原子的角度分析,他的结论是否正确: 。
(3).启示:若利用 的反应验证质量守恒定律时,必须在密闭的容器内进行。
29.
(
6分
)
小嘉用H2O2溶液制取氧气时,在烧瓶中加入50毫升水及0.5克MnO2
,
再往分液漏斗中加入30毫升15%的H2O2溶液。为什么要加入50毫升水呢?查阅资料发现:在不加入水时,若注入H2O2溶液速度过快,反应会过于剧烈而引发事故。
[提出问题]水是如何减缓该反应速度的呢?
[建立假设]水可以降低H2O2溶液浓度,从而减缓反应速度
[实验方案]他利用如图装置,在相同条件下,分别用30毫升的1%、3%和7%的H2O2溶液进行实验,观察并比较。
[实验结论]加水降低了H2O2溶液的浓度,使反应速度变慢。
[交流反思]
(1)为了更好地比较反应的快慢,在三次实验中滴加等量H2O2溶液时,需控制________相同。
(2)判断产生氧气的速度时,可以通过观察产生气泡的快慢,还可以比较________。
(3)为了探究H2O2溶液分解快慢还与哪些因素有关,他又利用如图装置,用3%的H2O2溶液分别在0°C、20℃和60℃的条件下进行实验。进行该实验所基于的假设是________。
四、解答题
30.
(
8分
)
绍兴盛产一种四角菱,称“驮背白”。其菱肉富含淀粉等多种营养物质,此外菱角的茎和根富含纤维素(C6H10O5)n,也是一-种很不错的食物和药材。
(1)菱肉中的钙、磷、铁等元素是以________(填“单质”或“化合物”)的形态存在;
(2)该纤维素中C、H、O元素的质量比________(最简比)
;
(3)查阅资料获悉菱肉制成的菱粉质细爽滑,为淀粉中之佳品。求菱叶产生3.6千克淀粉[有机物(CH2O)n]的同时,光合作用产生氧气多少千克?
(已知光合作用的化学方程式为:nCO2+nH2O=(CH2O)n+nO2:条件忽略)
31.
(
6分
)
石头纸是一种介于纸张和塑料之间的环保新型材料,主要成分为碳酸钙。为测定其中碳酸钙的含量,课外活动小组的同学进行了实验,实验数据见下表(假设纸张其他成分既不溶于水,也不与水反应):
烧杯①
烧杯②
烧杯③
烧杯④
烧杯⑤
加入样品的质量/g
10
10
10
10
10
加入稀盐酸的质量/g
10
20
30
40
50
充分反应后生成气体的质量/g
0.88
1.76
2.64
3.08
3.08
(1)根据表中的实验数据可知,烧杯④样品中的碳酸钙全部参加了反应,则10克样品完全反应生成二氧化碳的质量为________克。
(2)求样品中碳酸钙的质量分数。(需写出计算过程)
答案部分
一、单选题
1.
B
2.
B
3.
B
4.
B
5.
D
6.
B
7.
D
8.
B
9.
D
10.
D
11.
D
12.
C
13.
C
14.
B
15.
C
16.
D
17.
D
18.
D
19.
A
20.
C
二、填空题
21.
(1)H2O(2)化合反应
22.
(1)镍粉(2)Fe
23.
(1)①和④;2KClO3
2KCl+
3O2↑(2)长颈漏斗(分液漏斗)
24.
(1)丁
(2)化合反应
(3)14:
17
25.
(1)CO2
(2)CO2+Ca(OH)2=CaCO3↓+H2O
(3)碳酸水中含有水分子、二氧化碳分子、碳酸分子、氢离子和碳酸根离子,而液态二氧化碳中只含有二氧化碳分子。
26.
(1)分解反应
(2)9:17
三、实验探究题
27.
(1)将气球中的大理石物末倒入锥形瓶中
(2)气球受到浮力(或装置漏气)
(3)A
28.
(1)左端(a端)下沉
(2)化学反应前后,原子的种类和数目都不会改变
(3)有气体反应或者生成
29.
(1)速度(或时间)
(2)相同时间内收集的氧气体积(或收集相同体积氧气所需的时间或量筒内液面下降的快慢)
[继续探究]
(3)H2O2溶液分解快慢可能与温度有关。
四、解答题
30.
(1)化合物
(2)36:5:40
(3)解:设光合作用产生氧气质量为x。
nCO2+nH2O=
(CH2O)n+
nO2
30n
32n
3.6kg
x
x=3.84Kg
答:光合作用产生氧气3.84千克.
31.
(1)3.08
(2)解:设10克样品中碳酸钙的质量为x,则
CaCO3+2HCl=CaCl2+H2O+
CO2↑
100
44
x
3.08克
得:x=7克
CaCO3%=
答:样品中碳酸钙的质量分数为70%。
解析部分
一、单选题
1.
B
【解析】蜡烛在空气中完全燃烧生成二氧化碳和水蒸气,由反应前后元素种类不变可知,蜡烛中一定含碳元素和氢元素,可能含氧元素;
2.
B
【解析】根据
2HgO=2Hg+O2↑
可知,反应物只有一种,而生成物有两种,应该为分解反应,故B正确,而A、C、D错误。
3.
B
【解析】随着氯酸钾的分解,生成的氧气越来越多,而混合物中的氧元素越来越少。当氯酸钾完全分解后,因为二氧化锰的质量不变,所以混合物中氧元素的质量不再发生改变,故B正确,而A、C、D错误。
4.
B
【解析】A.该反应的生成物有两种,肯定不属于化合反应,故A错误;
B.根据质量守恒定律可知,参加应的Cu、FeCl3质量之和等于生成的CuCl2、FeCl2质量之和,故B正确;
C.反应前后氯原子的数目都是6个,故C错误;
D.反应前,铜单质中铜元素的化合价为0价,而反应后CuCl2中铜元素的化合价为+2价,故D错误。
5.
D
【解析】设方框内围观模型为x,根据微观模型图得到:x+10=10+4,
解得:x=4,
故D正确,而A、B、C错误。
6.
B
【解析】A.根据图片可知,图中有四种不同的分子,则共有四种物质,故A正确不合题意;
B.根据和可知,图示变化中分子发生了变化,故B错误符合题意;
CD.反应前后,原子的种类都是三种,且每种原子的个数保持不变,故C、D正确不合题意。
7.
D
【解析】A.甲:氧气的密度大于空气,因此导气管口应该伸到集气瓶底部,故A错误;
B.乙:通过给土壤加热的方式无法判断是否存在有机物,故B错误;
C.丙:木炭燃烧生成二氧化碳气体,集气瓶内气压变化不大,烧杯内的水几乎不能流入集气瓶内,无法完成氧气的测量,故C错误;
D.铜片上的白磷和红磷比较,可以得到燃烧的条件之一为达到着火点;铜片上的白磷和水里的白磷比较,可以得到燃烧的条件之一为与氧气接触,故D正确。
8.
B
【解析】根据方程式
2N2H4+N2O4=3X+4H2O
得到:6N+8H+4O=3X+8H+4O,解得:3X=6N,即X=N2
,
故B正确,而A、C、D错误。
9.
D
【解析】A.带电的离子可能是质子、电子和离子,故A错误;
B.臭氧和氧气都是由氧元素组成的单质,二者混合为混合物,而不是单质,故B错误;
C.铁单质和铜单质混合在一起时,就含有多种元素,但它们组成的是混合物而不是化合物,故C错误;
D.根据质量守恒定律可知,因水电解只得到氢气和氧气,所以水一定由氢、氧两种元素组成,故D正确。
10.
D
【解析】A.根据反应前后元素质量守恒得到:x=(1g+20g+8g)-(8g+11g)=10g,故A错误;
B.该反应中,氧气的质量减少:20g-8g=12g,水的质量增加了:10g-1g=9g,则氧气与水的质量变化之比为:12g:9g=4:3,故B错误;
C、11gCO2中含有碳元素的质量为:
,
9g水中含有氢元素的质量为:
,
、
所含碳、氢元素的质量和:3g+1g=4g<8g,
该物质中含氧元素的质量为:8g-4g=4g,
则该物质中一定含有碳、氢、氧三种元素,故C错误;
D.W中碳、氢元素质量比为3g:1g=3:1,故D正确。
11.
D
【解析】根据图片可知,该矿石中不含有H元素,而Cu2(OH)2CO3中含有H元素,违反了元素守恒定律,故D符合题意,而A、B、C不合题意。
12.
C
【解析】设生成氢气的质量为x,根据关系式A→ASO4→SO4→H2↑得到:
则
解得:x=3.5g;
13.
C
【解析】设含铁、氧两种元素的样品中A的化学式为FexOy
,
高温时与足量的CO充分反应,即FexOy+yCOxFe+yCO2
,
生成的气体被足量澄清石灰水吸收,即CO2+Ca(OH)2=CaCO3↓+H2O,
设原样品的质量为mg,则沉淀的质量为mg,
由上方的方程式得到:FexOy~yCaCO3
56x+16y
100y
mg
mg
;
解得:
,
由于铁与氧的原子个数比是3:2,
在FeO、Fe2O3和Fe3O4中,铁和氧原子的个数之比都小于3:2,
说明了A中一定含有铁。
14.
B
【解析】A.根据质量守恒定律得到:18g+1g+2g+32g=x+26g+2g+12g,解得:x=13g,故A正确不合题意;
DB.比较可知,甲和丁的质量减小,为反应物;而乙的质量增大,为生成物,丙的质量不变,可能为催化剂,故B错误符合题意,D正确不合题意;
C.反应中乙和丁的质量之比为:(26g-1g):(32g-12g)=5:4,故C正确不合题意。
15.
C
【解析】A.根据可知,甲由一个碳原子和四个氢原子构成,化学式为CH4
,
名称为甲烷,故A正确不合题意;
B.根据和可知,乙和丙都由两种元素组成,其中一种为氧元素,则它们都是氧化物,故B正确不合题意;
C.参加反应的甲和乙的质量比为:(12+1×4):(12+16×2)=16:44=4:11,故C错误符合题意;
D.生成的丙和丁的分子个数之比为1:3,故D正确不合题意。
16.
D
【解析】A.催化剂可能加快反应速率,也可能减慢反应速率,故A错误;
B.保持氢气化学性质的最小粒子是H2
,
故B错误;
C.该反应的化学方程式是:
2CH4C2H4+2H2
,故C错误;
D.反应前后分子的种类发生了改变,由于反应物有一种,而生成物有两种,因此为分解反应,故D正确。
17.
D
【解析】A.ClO2的化学名称为二氧化氯,故A错误;
B.
根据ClO2
,
利用正负化合价代数和为零得到:x+(-2)×2=0,解得:x=+4价,故B错误;
C.
该反应的反应物和生成物都是两种,肯定不是化合反应,故C错误;
D.
根据方程式
2NaClO2+Cl2═2ClO2+xNaCl
得到:2Na+4Cl+4O=2Cl+4O+xNaCl,解得:xNaCl=2Na+2Cl,即x=2,故D正确。
18.
D
【解析】A.实验室制取氧气时,先检查装置的气密性再装入药品,故A错误;
B.铜片在氧气中加热时,会变成黑色,即生成氧化铜,故B错误;
C.红磷在氧气中燃烧时,生成白烟,即生成五氧化二磷固体,故C错误;
D.铁丝在氧气中燃烧时,火星四射,生成黑色固体,故D正确。
19.
A
【解析】A、电解水时产生氢气体积大于氧气体积,用燃着的木条接近液面下降较多的玻璃管尖嘴处的气体,气体燃烧,出现淡蓝色火焰,证明是氢气
,符合题意;
B、
电解水时产生氢气体积大于氧气体积,用带火星的木条接近液面下降较少的玻璃管尖嘴处的气体,木条立即复燃,证明是氧气
,不符合题意;
C、
用带火星的木条接近液面下降较少的玻璃管尖嘴处的气体,木条复燃,证明是氧气
,不符合题意;
D、
用燃着的木条接近液面下降较多的玻璃管尖嘴处的气体,气体燃烧,出现淡蓝色火焰,证明是氢气
,不符合题意;
20.
C
【解析】A、高锰酸钾加热分解制取氧气需要加热,而氢气不用
,不符合题意;
B、制取二氧化碳不能用稀硫酸,应选择稀盐酸,不符合题意;
C、
双氧水与二氧化锰混合制取氧气反应物为固液,反应条件为常温,可与氢气所用实验器材相同
,符合题意;
D、
氯酸钾与二氧化锰混合加热制取氧气需要加热,氢气不需要,不符合题意;
二、填空题
21.
(1)H2O
(2)化合反应
【解析】(1)根据方程式
2Cu+O2+X+CO2=Cu2(OH)2CO3
得到:2Cu+4O+1C+X=2Cu+5O+1C+2H,解得:X=2H+1O=H2O。
(2)根据方程式可知,反应物有4种,而生成物只有1种,则该反应为化合反应。
22.
(1)镍粉
(2)Fe
【解析】(1)根据题目描述可知,铁却反应生成了四氧化三铁;在反应物中有镍粉,在生成物中仍然有镍粉存在,因此镍粉质量和性质都没有改变,可能为催化剂。
(2)根据化学方程式
3X+4H2O(气) Fe3O4+4H2
和元素守恒得到:3X+8H+4O=3Fe+4O+8H,解得:3X=3Fe,即X=Fe。
23.
(1)①和④;2KClO3
2KCl+
3O2↑
(2)长颈漏斗(分液漏斗)
【解析】(1)氯酸钾分解制取氧气的实验装置如下图,那么不需要的仪器是锥形瓶和带有双孔胶塞的导管,故选①和④。
氯酸钾在二氧化锰的催化作用下受热分解,生成氯化钾和氧气,
反应的方程式为:
2KClO3 2KCl+
3O2↑
;
(2)在实验室内,通常用石灰石和稀盐酸反应制取二氧化碳,装置图如下:
如果要制取并收集二氧化碳,除利用上述包含④在内的部分仪器外,还需要添加的仪器是长颈漏斗(分液漏斗)。
24.
(1)丁
(2)化合反应
(3)14:
17
【解析】(1)根据图片可知,物质丁的质量在反应前后保持不变,可能是催化剂。
(2)反应前,丙的质量分数:1-70%-14%-10%=6%;
反应后,乙的质量分数为:1-42%-40%-10%=8%;
甲和乙的质量减小,为反应物,只有丙的质量增加,为生成物。因为只有一种生成物,所以该反应为化合反应。
(3)该反应中甲、丙的质量之比为:(70%-42%):(40%-6%)=14:17。
25.
(1)CO2
(2)CO2+Ca(OH)2=CaCO3↓+H2O
(3)碳酸水中含有水分子、二氧化碳分子、碳酸分子、氢离子和碳酸根离子,而液态二氧化碳中只含有二氧化碳分子。
【解析】(1)反应①发生后,可得到的气体为CO2;
(2)布莱克实验中反应③,即氢氧化钙与二氧化碳反应,生成碳酸钙和水,它化学方程式:CO2+Ca(OH)2=CaCO3↓+H2O。
(3)“碳酸水”与“液态二氧化碳”在成分上的区别主要是:碳酸水中含有水分子、二氧化碳分子、碳酸分子、氢离子和碳酸根离子,而液态二氧化碳中只含有二氧化碳分子。
26.
(1)分解反应
(2)9:17
【解析】(1)由图示可知,每一格的质量为1g;反应前a的质量为5g,b的质量为22g-5g=17g;c的质量为28g-22g=6g;d的质量为30g-28g=2g。
反应后,刻度线Ⅰ右移9格,a物质质量增加9g;刻度线Ⅱ左移8格,同时刻度线Ⅰ右移9格,则b物质质量减少了:8g+9g=17g;刻度线Ⅲ左移8格,同时刻度线Ⅱ左移8格,则c物质质量不变;刻度线Ⅲ左移8格,d物质的质量增加了8g,则该反应可表示为b→a+d。
那么该反应类型为分解反应。
(2)a、b的质量变化之比为:9g:17g=9:17。
三、实验探究题
27.
(1)将气球中的大理石物末倒入锥形瓶中
(2)气球受到浮力(或装置漏气)
(3)A
【解析】(1)步骤②中使稀盐酸和大理石粉末充分接触,其操作是:将气球中的大理石物末倒入锥形瓶中。
(2)步骤③中发现天平不平衡,导致出现该现象的原因可能是:气球受到浮力(或装置漏气)。
(3)A.使用气球的目的,是防止生成物从密封系统中逸出,故A正确;
B.若大理石粉末质量不足,则生成的二氧化碳的质量偏小,但是物质的总质量并没有发生改变,因此则能验证质量守恒定律,故B错误;
C.天平不平衡,是因反应前后气球受到的浮力大小不同,或者装置可能漏气,而原子的种类和数目保持不变,故C错误。
28.
(1)左端(a端)下沉
(2)化学反应前后,原子的种类和数目都不会改变
(3)有气体反应或者生成
【解析】(1)停止加热后冷却,可以观察到的现象是:铜丝表面变黑色,左端(a端)下沉;
(2)从原子的角度分析,他的结论是错误,理由是:化学反应前后,原子的种类和数目都不会改变。
(3)启示:若利用有气体反应或者生成的反应验证质量守恒定律时,必须在密闭的容器内进行。
29.
(1)速度(或时间)
(2)相同时间内收集的氧气体积(或收集相同体积氧气所需的时间或量筒内液面下降的快慢)
[继续探究]
(3)H2O2溶液分解快慢可能与温度有关。
【解析】(1)为了更好地比较反应的快慢,在三次实验中滴加等量H2O2溶液时,需控制速度(或时间)相同。
(2)判断产生氧气的速度时,可以通过观察产生气泡的快慢,还可以比较相同时间内收集的氧气体积(或收集相同体积氧气所需的时间或量筒内液面下降的快慢)。
(3)为了探究H2O2溶液分解快慢还与哪些因素有关,他又利用如图装置,用3%的H2O2溶液分别在0°C、20℃和60℃的条件下进行实验。进行该实验所基于的假设是:H2O2溶液分解快慢可能与温度有关。
四、解答题
30.
(1)化合物
(2)36:5:40
(3)解:设光合作用产生氧气质量为x。
nCO2+nH2O=
(CH2O)n+
nO2
30n
32n
3.6kg
x
x=3.84Kg
答:光合作用产生氧气3.84千克.
【解析】(1)菱肉同时含有钙、磷、铁等元素,应该是以化合物的形式存在;
(2)根据化学式
(C6H10O5)n
可知,该纤维素中C、H、O元素的质量比:(12×6):(1×10):(16×5)=36:5:40。
31.
(1)3.08
(2)解:设10克样品中碳酸钙的质量为x,则
CaCO3+2HCl=CaCl2+H2O+
CO2↑
100
44
x
3.08克
得:x=7克
CaCO3%=
答:样品中碳酸钙的质量分数为70%。
【解析】(1)根据表格数据确定最终生成二氧化碳的质量;
(2)写出碳酸钙与稀盐酸反应的化学方程式,利用二氧化碳的质量,根据质量之间的比例关系计算出参加反应的碳酸钙的质量,最后根据计算即可。
