1.6几种重要的盐 同步练习(含解析)
文档属性
| 名称 | 1.6几种重要的盐 同步练习(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 68.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-10-08 20:12:00 | ||
图片预览


文档简介
几种重要的盐
一、单选题
1.盐在日常生活中是用途非常广泛的一类物质。下列说法中不正确的是(
)
A. 添加大量的亚硝酸钠来保鲜食品 B. 用小苏打制作糕点
C. 农业上常用硫酸铜配制波尔多液 D. 用纯碱除去面粉发酵生成的酸
2.以下各类盐中,除钾盐、钠盐、铵盐能溶于水外,其余大部分不溶于水的盐是(
)
①盐酸盐 ②硫酸盐 ③硝酸盐 ④碳酸盐 ⑤磷酸盐
A. ①⑤ B. ②④ C. ③④ D. ④⑤
3.2015年1月15日,海珠陈女士一家六口人饭后出现亚硝酸盐中毒,并被送往医院紧急治疗.亚硝酸钠外观酷似食盐,有咸味,加热会分解,放出有臭味的气体.请结合下表信息判断,下列区别亚硝酸钠和氯化钠方法错误的是(
)
亚硝酸钠(NaNO2)
氯化钠(NaCl)
跟稀盐酸作用
放出红棕色的气体
无反应
跟硝酸银溶液作用
生成浅黄色沉淀
生成白色沉淀
A. 滴加稀盐酸 B. 加热 C. 滴加硝酸银溶液 D. 加水溶解
4.盐在人体的新陈代谢中十分重要,它可以维持血液中适当的酸碱度,并通过人体复杂的作用,产生消化液,帮助消化.这里的盐是指(
)
A. 氯化钠 B. 硫化钠 C. 氯化钙 D. 氯化镁
5.一包白色粉末,可能含有CuSO4、CaCO3、BaCl2、Na2SO4、NaOH中的一种或几种。为探究其组成进行如下实验:
①取少量白色粉末,向其中加入足量的水,充分搅拌后过滤,得到白色沉淀和无色滤液;
②取实验①滤出的白色沉淀,向其中加入足量的盐酸,沉淀全部溶解,并产生无色气体;
③取实验①得到的滤液,向其中通人CO2
,
产生白色沉淀。
根据以上实验现象,判断白色粉末。下列结论不正确的是(
)
A. 白色粉末中一定不含CuSO4、Na2SO4, B. 白色粉末中一定含有CaCO3、BaCl2
C. 白色粉末中一定含有CaCO3、BaCl2、NaOH D. 白色粉末中可能含有
NaOH
6.中国丝绸具有几千年的历史传承,古代染坊常用一种盐来处理丝绸,可使丝绸颜色洁白,质感柔软。这种盐是下列物质中的(
)
A. 碳酸钾 B. 烧碱 C. 乙醇 D. 熟石灰
7.下列各组物质相互反应后,不能生成氯化铁的是(
)
①氧化铁和盐酸;②氢氧化铁和盐酸;③铁粉和盐酸;④硫酸铁和氯化钡;⑤氯化钾和氢氧化铁;⑥硝酸铁和氯化铜;⑦氢氧化铁和氯化镁。
A. ①②④⑤ B. ③⑤⑥⑦ C. ③⑤⑥ D. ②③⑤⑦
8.“一带一路”赋予古丝绸之路崭新的时代内涵。古代染坊常用下列物质中的盐类物质来处理丝绸,这种盐是(
)
A. 熟石灰 B. 酒精 C. 碳酸钾 D. 烧碱
9.英国医生塞达尼·任格在对离体蛙心进行的实验中发现,用不含钙和钾的生理盐水灌注蛙心,收缩不能维持,用含有少量钙和钾的生理盐水灌注时,蛙心可持续跳动数小时。实验说明钙盐和钾盐(
)
A. 是细胞中某些复杂化合物的重要组成成分 B. 对维持生物体的生命活动有重要作用
C. 对维持细胞的形态有重要作用 D. 为蛙心的持续跳动提供能量
10.小明同学在往氢氧化钠溶液中滴加稀盐酸研究中和反应时,忘记了滴加酸碱指示剂。为了确认滴加的盐酸是否已经过量,从烧杯中取少量反应后的溶液于试管中,用某种试剂进行检验。下表是小明同学设计的实验方案,其中不正确的是(
)
实验方案
使用的试剂
判断的方法
A.
铁粉
如果有气泡产生,表明盐酸已经过量
B.
pH
试纸
如果
pH<7,表明盐酸已经过量
C.
硝酸银溶液
如果有白色沉淀产生,表明盐酸已经过量
D.
紫色石蕊试剂
如果溶液变成红色,表明盐酸已经过量
A. A B. B C. C D. D
11.现有
4
种试剂:①紫色石蕊试液;②稀硫酸;③氢氧化钡溶液;④氯化钡溶液。能用来一次性鉴别稀盐酸、氢氧化钡溶液、碳酸钠溶液的试剂有(不可组内互相反应)(
)
A. ② B. ②③ C. ①②③ D. ②③④
12.不用其他试剂,可以鉴别石蕊、盐酸、氢氧化钙、氢氧化钠、碳酸钠五种溶液,第二个被鉴别出来的物质是:
(
)
A. 盐酸 B. 氢氧化钙 C. 氢氧化钠 D. 碳酸钠
二、填空题
13.厨房里有两瓶白色固体,分别为食盐(NaCl)
和纯碱(Na2CO3)。
(1)可用于腌制肉类和蔬菜,使食物不易腐败的是________。
(2)为鉴别这两种物质,某同学取少量白色固体,进行如下实验。
方案一:分别滴加少量食醋,有气泡产生的是________。
方案二:加水溶解,分别滴加________溶液,有沉淀产生的是纯碱。
14.盐是________离子和________离子(或________离子)组成的化合物。硫酸铜、石膏都可以归为________盐。
三、解答题
15.人体的汗液有咸味.某同学猜测汗液中可能含有氯化钠,为此她准备做探究实验。她想到两种提取汗液的方法,方法一:用胶头滴管直接吸取足量汗液转移到烧杯中
,再加入适量蒸馏水稀释;方法二:用出汗的手在盛有自来水的容器中清洗,再将清洗后的自来水部分转移到老师指定处,她用正确的方法提取汗液,进行以下实验:
(1)用试管取适量提取液,滴入硝酸钡溶液,没有出现白色沉淀,说明汗液中________(选填:“存在”或“不存在”)硫酸和硫酸盐
。
(2)用试管取适量提取液,滴入硝酸银溶液,发现出现白色沉淀,加入稀硝酸后沉淀不溶解。由此可推测该白
色沉淀的化学式是________。
(3)将适量的提取液倒入蒸发皿中加热蒸发,出现类似食盐的小颗粒。你认为她能否仅凭上述三步实验得出“这些小颗粒就是氯化钠” 请说出理由________。
四、实验探究题
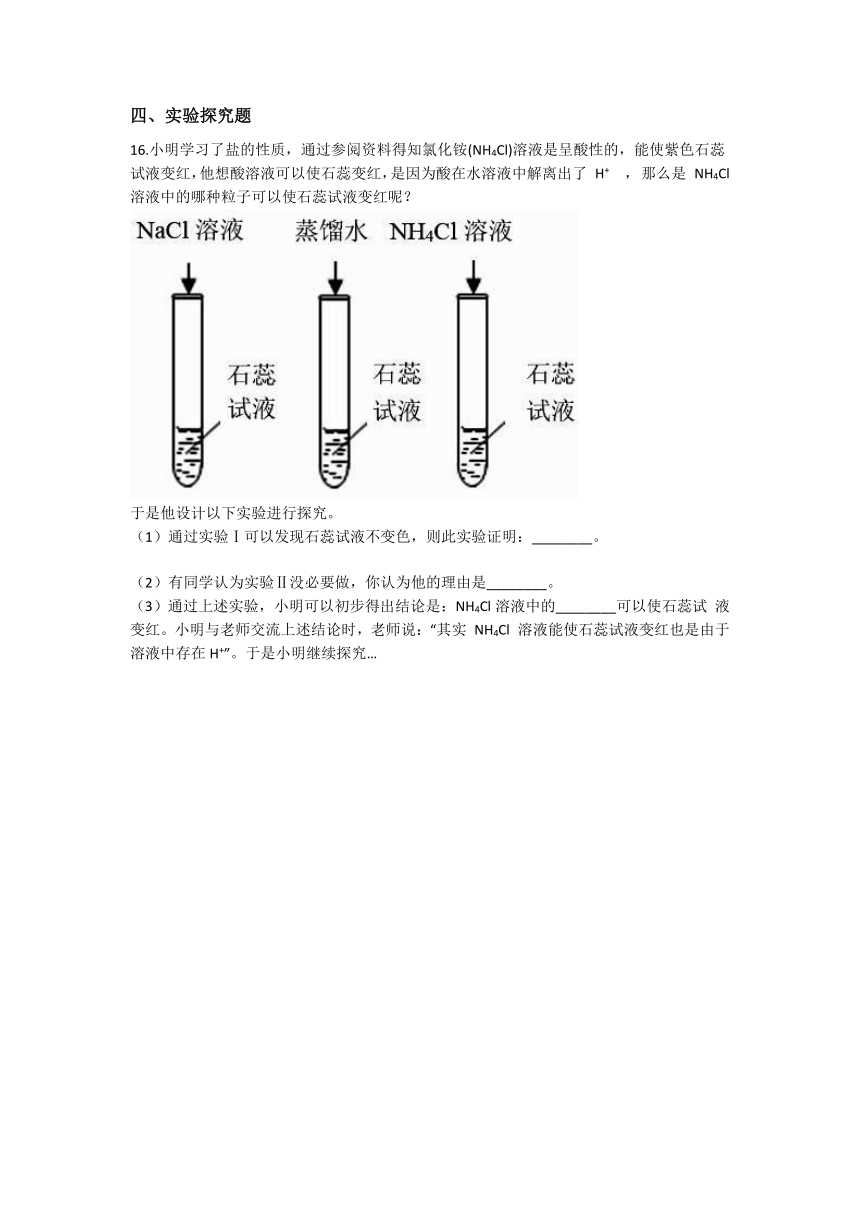
16.小明学习了盐的性质,通过参阅资料得知氯化铵(NH4Cl)溶液是呈酸性的,能使紫色石蕊试液变红,他想酸溶液可以使石蕊变红,是因为酸在水溶液中解离出了
H+
,
那么是
NH4Cl
溶液中的哪种粒子可以使石蕊试液变红呢?
于是他设计以下实验进行探究。
(1)通过实验Ⅰ可以发现石蕊试液不变色,则此实验证明:________。
(2)有同学认为实验Ⅱ没必要做,你认为他的理由是________。
(3)通过上述实验,小明可以初步得出结论是:NH4Cl溶液中的________可以使石蕊试
液变红。小明与老师交流上述结论时,老师说:“其实
NH4Cl
溶液能使石蕊试液变红也是由于溶液中存在H+”。于是小明继续探究…
答案解析部分
一、单选题
1.【答案】
A
【解析】【分析】A、根据亚硝酸钠有毒分析;
B、根据碳酸氢钠的性质分析;
C、根据波尔多液的成分分析;
D、根据碳酸钠的性质分析。
【解答】A、亚硝酸钠有毒,不能用于加工食品,符合题意;
B、小苏打受热或与面中的酸反应都会产生二氧化碳气体,使面食松软可口,可用于制作糕点,不符合题意;
C、农业上可用硫酸铜和氢氧化钙配制波尔多液,不符合题意;
D、纯碱为碳酸钠,与酸能发生反应,可用纯碱除去面粉发酵生成的酸,不符合题意;
故答案为:A。
2.【答案】
D
【解析】【分析】盐的溶解性规律:钾盐钠盐铵盐硝酸盐都可溶;盐酸盐中不溶氯化银;硫酸盐中不溶硫酸钡;碳酸盐只溶钾盐、钠盐、铵盐。
【解答】根据盐的溶解性规律可知:
①盐酸盐中不溶氯化银;
②硫酸盐中不溶硫酸钡;
③硝酸盐全部溶于水;
④碳酸盐中只溶钾盐、钠盐、铵盐;
⑤磷酸盐中只溶钾盐、钠盐、铵盐等。
因此大部分不溶于水的盐是碳酸盐和磷酸盐,即④⑤。
故选D。
3.【答案】
D
【解析】【分析】根据表格分析亚硝酸钠和氯化钠的不同点.根据这些不同点可以区分它们。
【解答】A.滴加稀盐酸,亚硝酸钠放出红棕色气体,而氯化钠不反应,故A正确不合题意;
B.加热时,亚硝酸加热会分解,放出有臭味的气体,而氯化钠受热不会反应,故B正确不合题意;
C.滴加硝酸银溶液,和亚硝酸钠反应生成浅黄色沉淀,而和氯化钠反应生成白色沉淀,故C正确不合题意;
D.加水溶解,二者都易溶于水,没有明显现象,没法进行区别,故D错误符合题意。
故选D。
4.【答案】
A
【解析】【分析】根据氯化钠对人体的作用分析即可。
【解答】氯化钠俗称食盐,是一种常用的调味品,可以维持血液中适当的酸碱度,并通过人体复杂的作用,产生消化液,帮助消化,故A正确,而B、C、D错误。
故选A。
5.【答案】
D
【解析】【分析】根据题干叙述结合物质的性质进行分析解答,硫酸铜溶液呈蓝色,硫酸钡沉淀不溶于酸,碳酸盐遇酸生成二氧化碳气体,据此分析即可。
【解答】①溶于水得到白色沉淀和无色滤液,而硫酸铜溶液呈蓝色,故一定不含有硫酸铜;
②
加入足量的盐酸,沉淀全部溶解,因为硫酸钡沉淀不溶于酸,因此一定不含有硫酸钡,并产生无色气体
,说明该沉淀是碳酸钙。
③
取实验①得到的滤液,向其中通人CO2
,
产生白色沉淀,若只含有氯化钡,二氧化碳不与氯化钡反应,若只含有氢氧化钠,氢氧化钠与二氧化碳生成碳酸钠不是沉淀,故氯化钡和氢氧化钠同时存在。
综上所诉,白色粉末中一定含有碳酸钙、氯化钡、氢氧化钠,一定不含有硫酸铜、硫酸钠。
A、白色粉末中一定不含CuSO4、Na2SO4, 正确,不符合题意。
B.
白色粉末中一定含有CaCO3、BaCl2
,正确,不符合题意。
C.白色粉末中一定含有CaCO3、BaCl2
、NaOH,正确,不符合题意。
D.白色粉末中一定含有NaOH,而不是可能,D不正确,符合题意。
故答案为:D
6.【答案】
A
【解析】【分析】盐是指一类金属离子或铵根离子(NH4+)与酸根离子或非金属离子结合的化合物。
【解答】A、K2CO3,是由金属离子和碳酸根离子构成,是盐;故A符合;
B、烧碱是NaOH,是由金属离子和氢氧根离子构成,是碱;故B不符合题意;
C、乙醇是酒精,属于有机物;故C不符合题意;
D、熟石灰是Ca(OH)2
,
是金属离子和氢氧根离子构成,是碱;故D不符合题意;
故答案为:A。
7.【答案】
B
【解析】【分析】(1)复分解反应发生的条件:有气体、沉淀或水生成;
(2)单质铁与酸只能生成二价铁离子,据此解答。
【解答】①氧化铁和盐酸生成氯化铁和水,所以可以得到氯化铁,故①不合题意;
②氢氧化铁和盐酸生成氯化铁和水,所以可以得到氯化铁,故②不合题意;
③铁粉和盐酸生成氯化亚铁和氢气,不能生成氯化铁,故③符合题意;
④硫酸铁和氯化钡生成硫酸钡和氯化铁,能够生成氯化铁,故④不合题意;
⑤金属铁和氯化银,由于氯化银不溶于水,所以两者不反应,故⑤符合题意;
⑥硝酸铁和氯化铜,两者相互交换成分没有沉淀、气体或者水,所以不反应,故⑥符合题意;
⑦氢氧化铁和氯化镁,由于氢氧化铁不溶于水,所以两者不反应,故⑦符合题意。
不能生成氯化铁的是③⑤⑥⑦。
故选B。
8.【答案】
C
【解析】【分析】盐是由金属阳离子或铵根离子和酸根离子构成的化合物。
【解答】A、熟石灰由金属阳离子和氢氧根离子构成的化合物,属于碱;故A错误;
B、酒精属于有机物,而盐属于无机物;故B错误;
C、碳酸钾是由金属阳离子和酸根离子构成的化合物,属于盐;故C正确;
D、烧碱是由金属阳离子和氢氧根离子构成的化合物,属于碱;故D错误;
故答案为:C。
9.【答案】
B
【解析】【分析】无机盐主要是以离子形式存在的,在生命中有着重要的作用,在人的血液中含有Fe2+
,
Ca元素能够调节肌肉收缩和血液的凝固等。
【解答】用不含钙和钾的生理盐水灌注蛙心,不能维持收缩,用含少量钙和钾的生理盐水灌注时,能够持续跳动数小时,说明钙盐和钾盐对维持生物体的生命活动有重要的作用;
故选B。
10.【答案】
C
【解析】【分析】根据酸的化学性质进行判断即可。
【解答】A.铁会与盐酸反应生成氢气,只要有气泡产生,说明酸过量了,故A正确不合题意;
B.pH试纸测出的pH值小于7,说明溶液显酸性,盐酸就过量了,故B正确不合题意;
C.盐酸即使不过量,中和反应生成的氯离子也会与硝酸银生成沉淀,故C错误符合题意;
D.紫色石蕊变红色,说明溶液中存在氢离子,也就可以证明盐酸过量,故D正确不合题意。
故选C。
11.【答案】
A
【解析】【分析】如果要将两种物质鉴别出来,就必须有明显的、可以区别的现象,;根据酸、碱、盐的化学性质和物理性质进行鉴别即可。
【解答】①稀盐酸能使紫色石蕊试液变成红色,氢氧化钡溶液、碳酸钠溶液都显碱性,都能使紫色石蕊试液变成蓝色,因此无法鉴别;
②稀硫酸与稀盐酸不反应;稀硫酸能与氢氧化钡反应生成了白色沉淀;稀硫酸能与碳酸钠反应生成了二氧化碳气体,因此能用来一次性鉴别出三种物质;
③氢氧化钡溶液能与稀盐酸反应生成氯化钡和水,但现象不明显,它与氢氧化钡不反应,因此不能将稀盐酸和氢氧化钡鉴别出来;
④氯化钡溶液与稀盐酸、氢氧化钡溶液不反应,不能一次性鉴别稀盐酸、氢氧化钡溶液。
因此能用来一次性鉴别三种物质的是②。
故选A。
12.【答案】
A
【解析】【分析】不用其他试剂进行物质的鉴别,是根据物质间的相互反应进行,首先观察颜色,然后把鉴别出来的物质依次加入其他试剂中进行鉴别。
【解答】①因为石蕊试液是紫色的,所以首先鉴别出石蕊;
②然后将石蕊试液滴入其它液体,显红色的就是盐酸,而剩下的氢氧化钙、氢氧化钠、碳酸钠三种溶液为碱性,都变成变蓝色无法鉴别;
③将盐酸分别滴入剩余的液体,有气泡生成的就是碳酸钠溶液;
④将碳酸钠溶液滴入剩余的两种液体,能够生成白色沉淀的就是氢氧化钙,最后剩下的就是氢氧化钠溶液。
那么第二个被鉴别出来的物质是盐酸。
故选A。
二、填空题
13.【答案】
(1)食盐(NaCl)
(2)纯碱(Na2CO3);CaCl2
(Ba2+、Ca2+的可溶性盐或碱均可)
【解析】【分析】(1)食盐是厨房内非常重要的调味品,因为其有咸味,所以可以腌制酱菜。由于它可以使细胞脱水,因此可以消毒杀菌,使食物不易变质。
(2)方案一:碳酸钠和稀盐酸反应,生成二氧化碳气体,而氯化钠和稀盐酸不反应;
方案二:碳酸钠和氯化钙反应,生成碳酸钙沉淀,而氯化钠和氯化钡不反应。
【解答】(1)可用于腌制肉类和蔬菜,使食物不易腐败的是食盐(NaCl)。
(2)为鉴别这两种物质,某同学取少量白色固体,进行如下实验。
方案一:分别滴加少量食醋,有气泡产生的是纯碱(Na2CO3);
方案二:加水溶解,分别滴加CaCl2
(Ba2+、Ca2+的可溶性盐或碱)溶液,有沉淀产生的是纯碱。
14.【答案】
酸根;金属;铵根;硫酸
【解析】【分析】根据盐的定义及命名分析。
【解答】盐是酸根离子和金属离子或铵根离子形成的化合物,
硫酸铜、石膏都含硫酸根离子,可归为硫酸盐;
故答案为:酸根、金属、铵根、硫酸。
三、解答题
15.【答案】
(1)不存在
(2)AgCl
(3)不能,可能是其他含有氯离子的无机盐
【解析】【分析】硫酸、硫酸盐溶液能与硝酸钡溶液反应生成硫酸钡白色沉淀;硫酸钡、氯化银白色沉淀不溶于稀硝酸;汗水中也含有其他的矿物质和无机盐。
【解答】(1)硫酸、硫酸盐溶液能与硝酸钡溶液反应生成硫酸钡白色沉淀,
滴入硝酸钡溶液,没有出现白色沉淀,说明汗液中
不存在
硫酸和硫酸盐
;
(2)由于硫酸钡、氯化银白色沉淀不溶于稀硝酸,说明白色沉淀只能是氯化银
AgCl
;
(3)由于凭上述三步实验只能得出汗液中含有氯离子,而不能证明其含有钠离子,汗水中除了氯化钠外也可能含有其它的无机盐,蒸发后也会出现小颗粒。
故答案为:(1)不存在;(2)
AgCl
;(3)
不能,可能是其他含有氯离子的无机盐
。
四、实验探究题
16.【答案】
(1)不是
NH4Cl
中的
Cl-使石蕊试液变红
(2)石蕊试液或
NaCl
溶液中已经含有水
(3)
【解析】【分析】根据验证某粒子的性质可通过加入含该粒子的其他物质直接证明,还可以通过排除其他粒子间接得出性质与该粒子有关。
【解答】(1)氯化钠中含有氯离子,但石蕊试液不变色,所以可以证明不是
NH4Cl
中的
Cl-使石蕊试液变红;(2)石蕊试液或
NaCl
溶液中已经含有水,所以实验II没有必要做;(3)因氯化铵溶液中含有铵根离子和氯离子,实验I排除了氯离子使石蕊变红的可能,所以使石蕊试液变红的是铵根离子。
一、单选题
1.盐在日常生活中是用途非常广泛的一类物质。下列说法中不正确的是(
)
A. 添加大量的亚硝酸钠来保鲜食品 B. 用小苏打制作糕点
C. 农业上常用硫酸铜配制波尔多液 D. 用纯碱除去面粉发酵生成的酸
2.以下各类盐中,除钾盐、钠盐、铵盐能溶于水外,其余大部分不溶于水的盐是(
)
①盐酸盐 ②硫酸盐 ③硝酸盐 ④碳酸盐 ⑤磷酸盐
A. ①⑤ B. ②④ C. ③④ D. ④⑤
3.2015年1月15日,海珠陈女士一家六口人饭后出现亚硝酸盐中毒,并被送往医院紧急治疗.亚硝酸钠外观酷似食盐,有咸味,加热会分解,放出有臭味的气体.请结合下表信息判断,下列区别亚硝酸钠和氯化钠方法错误的是(
)
亚硝酸钠(NaNO2)
氯化钠(NaCl)
跟稀盐酸作用
放出红棕色的气体
无反应
跟硝酸银溶液作用
生成浅黄色沉淀
生成白色沉淀
A. 滴加稀盐酸 B. 加热 C. 滴加硝酸银溶液 D. 加水溶解
4.盐在人体的新陈代谢中十分重要,它可以维持血液中适当的酸碱度,并通过人体复杂的作用,产生消化液,帮助消化.这里的盐是指(
)
A. 氯化钠 B. 硫化钠 C. 氯化钙 D. 氯化镁
5.一包白色粉末,可能含有CuSO4、CaCO3、BaCl2、Na2SO4、NaOH中的一种或几种。为探究其组成进行如下实验:
①取少量白色粉末,向其中加入足量的水,充分搅拌后过滤,得到白色沉淀和无色滤液;
②取实验①滤出的白色沉淀,向其中加入足量的盐酸,沉淀全部溶解,并产生无色气体;
③取实验①得到的滤液,向其中通人CO2
,
产生白色沉淀。
根据以上实验现象,判断白色粉末。下列结论不正确的是(
)
A. 白色粉末中一定不含CuSO4、Na2SO4, B. 白色粉末中一定含有CaCO3、BaCl2
C. 白色粉末中一定含有CaCO3、BaCl2、NaOH D. 白色粉末中可能含有
NaOH
6.中国丝绸具有几千年的历史传承,古代染坊常用一种盐来处理丝绸,可使丝绸颜色洁白,质感柔软。这种盐是下列物质中的(
)
A. 碳酸钾 B. 烧碱 C. 乙醇 D. 熟石灰
7.下列各组物质相互反应后,不能生成氯化铁的是(
)
①氧化铁和盐酸;②氢氧化铁和盐酸;③铁粉和盐酸;④硫酸铁和氯化钡;⑤氯化钾和氢氧化铁;⑥硝酸铁和氯化铜;⑦氢氧化铁和氯化镁。
A. ①②④⑤ B. ③⑤⑥⑦ C. ③⑤⑥ D. ②③⑤⑦
8.“一带一路”赋予古丝绸之路崭新的时代内涵。古代染坊常用下列物质中的盐类物质来处理丝绸,这种盐是(
)
A. 熟石灰 B. 酒精 C. 碳酸钾 D. 烧碱
9.英国医生塞达尼·任格在对离体蛙心进行的实验中发现,用不含钙和钾的生理盐水灌注蛙心,收缩不能维持,用含有少量钙和钾的生理盐水灌注时,蛙心可持续跳动数小时。实验说明钙盐和钾盐(
)
A. 是细胞中某些复杂化合物的重要组成成分 B. 对维持生物体的生命活动有重要作用
C. 对维持细胞的形态有重要作用 D. 为蛙心的持续跳动提供能量
10.小明同学在往氢氧化钠溶液中滴加稀盐酸研究中和反应时,忘记了滴加酸碱指示剂。为了确认滴加的盐酸是否已经过量,从烧杯中取少量反应后的溶液于试管中,用某种试剂进行检验。下表是小明同学设计的实验方案,其中不正确的是(
)
实验方案
使用的试剂
判断的方法
A.
铁粉
如果有气泡产生,表明盐酸已经过量
B.
pH
试纸
如果
pH<7,表明盐酸已经过量
C.
硝酸银溶液
如果有白色沉淀产生,表明盐酸已经过量
D.
紫色石蕊试剂
如果溶液变成红色,表明盐酸已经过量
A. A B. B C. C D. D
11.现有
4
种试剂:①紫色石蕊试液;②稀硫酸;③氢氧化钡溶液;④氯化钡溶液。能用来一次性鉴别稀盐酸、氢氧化钡溶液、碳酸钠溶液的试剂有(不可组内互相反应)(
)
A. ② B. ②③ C. ①②③ D. ②③④
12.不用其他试剂,可以鉴别石蕊、盐酸、氢氧化钙、氢氧化钠、碳酸钠五种溶液,第二个被鉴别出来的物质是:
(
)
A. 盐酸 B. 氢氧化钙 C. 氢氧化钠 D. 碳酸钠
二、填空题
13.厨房里有两瓶白色固体,分别为食盐(NaCl)
和纯碱(Na2CO3)。
(1)可用于腌制肉类和蔬菜,使食物不易腐败的是________。
(2)为鉴别这两种物质,某同学取少量白色固体,进行如下实验。
方案一:分别滴加少量食醋,有气泡产生的是________。
方案二:加水溶解,分别滴加________溶液,有沉淀产生的是纯碱。
14.盐是________离子和________离子(或________离子)组成的化合物。硫酸铜、石膏都可以归为________盐。
三、解答题
15.人体的汗液有咸味.某同学猜测汗液中可能含有氯化钠,为此她准备做探究实验。她想到两种提取汗液的方法,方法一:用胶头滴管直接吸取足量汗液转移到烧杯中
,再加入适量蒸馏水稀释;方法二:用出汗的手在盛有自来水的容器中清洗,再将清洗后的自来水部分转移到老师指定处,她用正确的方法提取汗液,进行以下实验:
(1)用试管取适量提取液,滴入硝酸钡溶液,没有出现白色沉淀,说明汗液中________(选填:“存在”或“不存在”)硫酸和硫酸盐
。
(2)用试管取适量提取液,滴入硝酸银溶液,发现出现白色沉淀,加入稀硝酸后沉淀不溶解。由此可推测该白
色沉淀的化学式是________。
(3)将适量的提取液倒入蒸发皿中加热蒸发,出现类似食盐的小颗粒。你认为她能否仅凭上述三步实验得出“这些小颗粒就是氯化钠” 请说出理由________。
四、实验探究题
16.小明学习了盐的性质,通过参阅资料得知氯化铵(NH4Cl)溶液是呈酸性的,能使紫色石蕊试液变红,他想酸溶液可以使石蕊变红,是因为酸在水溶液中解离出了
H+
,
那么是
NH4Cl
溶液中的哪种粒子可以使石蕊试液变红呢?
于是他设计以下实验进行探究。
(1)通过实验Ⅰ可以发现石蕊试液不变色,则此实验证明:________。
(2)有同学认为实验Ⅱ没必要做,你认为他的理由是________。
(3)通过上述实验,小明可以初步得出结论是:NH4Cl溶液中的________可以使石蕊试
液变红。小明与老师交流上述结论时,老师说:“其实
NH4Cl
溶液能使石蕊试液变红也是由于溶液中存在H+”。于是小明继续探究…
答案解析部分
一、单选题
1.【答案】
A
【解析】【分析】A、根据亚硝酸钠有毒分析;
B、根据碳酸氢钠的性质分析;
C、根据波尔多液的成分分析;
D、根据碳酸钠的性质分析。
【解答】A、亚硝酸钠有毒,不能用于加工食品,符合题意;
B、小苏打受热或与面中的酸反应都会产生二氧化碳气体,使面食松软可口,可用于制作糕点,不符合题意;
C、农业上可用硫酸铜和氢氧化钙配制波尔多液,不符合题意;
D、纯碱为碳酸钠,与酸能发生反应,可用纯碱除去面粉发酵生成的酸,不符合题意;
故答案为:A。
2.【答案】
D
【解析】【分析】盐的溶解性规律:钾盐钠盐铵盐硝酸盐都可溶;盐酸盐中不溶氯化银;硫酸盐中不溶硫酸钡;碳酸盐只溶钾盐、钠盐、铵盐。
【解答】根据盐的溶解性规律可知:
①盐酸盐中不溶氯化银;
②硫酸盐中不溶硫酸钡;
③硝酸盐全部溶于水;
④碳酸盐中只溶钾盐、钠盐、铵盐;
⑤磷酸盐中只溶钾盐、钠盐、铵盐等。
因此大部分不溶于水的盐是碳酸盐和磷酸盐,即④⑤。
故选D。
3.【答案】
D
【解析】【分析】根据表格分析亚硝酸钠和氯化钠的不同点.根据这些不同点可以区分它们。
【解答】A.滴加稀盐酸,亚硝酸钠放出红棕色气体,而氯化钠不反应,故A正确不合题意;
B.加热时,亚硝酸加热会分解,放出有臭味的气体,而氯化钠受热不会反应,故B正确不合题意;
C.滴加硝酸银溶液,和亚硝酸钠反应生成浅黄色沉淀,而和氯化钠反应生成白色沉淀,故C正确不合题意;
D.加水溶解,二者都易溶于水,没有明显现象,没法进行区别,故D错误符合题意。
故选D。
4.【答案】
A
【解析】【分析】根据氯化钠对人体的作用分析即可。
【解答】氯化钠俗称食盐,是一种常用的调味品,可以维持血液中适当的酸碱度,并通过人体复杂的作用,产生消化液,帮助消化,故A正确,而B、C、D错误。
故选A。
5.【答案】
D
【解析】【分析】根据题干叙述结合物质的性质进行分析解答,硫酸铜溶液呈蓝色,硫酸钡沉淀不溶于酸,碳酸盐遇酸生成二氧化碳气体,据此分析即可。
【解答】①溶于水得到白色沉淀和无色滤液,而硫酸铜溶液呈蓝色,故一定不含有硫酸铜;
②
加入足量的盐酸,沉淀全部溶解,因为硫酸钡沉淀不溶于酸,因此一定不含有硫酸钡,并产生无色气体
,说明该沉淀是碳酸钙。
③
取实验①得到的滤液,向其中通人CO2
,
产生白色沉淀,若只含有氯化钡,二氧化碳不与氯化钡反应,若只含有氢氧化钠,氢氧化钠与二氧化碳生成碳酸钠不是沉淀,故氯化钡和氢氧化钠同时存在。
综上所诉,白色粉末中一定含有碳酸钙、氯化钡、氢氧化钠,一定不含有硫酸铜、硫酸钠。
A、白色粉末中一定不含CuSO4、Na2SO4, 正确,不符合题意。
B.
白色粉末中一定含有CaCO3、BaCl2
,正确,不符合题意。
C.白色粉末中一定含有CaCO3、BaCl2
、NaOH,正确,不符合题意。
D.白色粉末中一定含有NaOH,而不是可能,D不正确,符合题意。
故答案为:D
6.【答案】
A
【解析】【分析】盐是指一类金属离子或铵根离子(NH4+)与酸根离子或非金属离子结合的化合物。
【解答】A、K2CO3,是由金属离子和碳酸根离子构成,是盐;故A符合;
B、烧碱是NaOH,是由金属离子和氢氧根离子构成,是碱;故B不符合题意;
C、乙醇是酒精,属于有机物;故C不符合题意;
D、熟石灰是Ca(OH)2
,
是金属离子和氢氧根离子构成,是碱;故D不符合题意;
故答案为:A。
7.【答案】
B
【解析】【分析】(1)复分解反应发生的条件:有气体、沉淀或水生成;
(2)单质铁与酸只能生成二价铁离子,据此解答。
【解答】①氧化铁和盐酸生成氯化铁和水,所以可以得到氯化铁,故①不合题意;
②氢氧化铁和盐酸生成氯化铁和水,所以可以得到氯化铁,故②不合题意;
③铁粉和盐酸生成氯化亚铁和氢气,不能生成氯化铁,故③符合题意;
④硫酸铁和氯化钡生成硫酸钡和氯化铁,能够生成氯化铁,故④不合题意;
⑤金属铁和氯化银,由于氯化银不溶于水,所以两者不反应,故⑤符合题意;
⑥硝酸铁和氯化铜,两者相互交换成分没有沉淀、气体或者水,所以不反应,故⑥符合题意;
⑦氢氧化铁和氯化镁,由于氢氧化铁不溶于水,所以两者不反应,故⑦符合题意。
不能生成氯化铁的是③⑤⑥⑦。
故选B。
8.【答案】
C
【解析】【分析】盐是由金属阳离子或铵根离子和酸根离子构成的化合物。
【解答】A、熟石灰由金属阳离子和氢氧根离子构成的化合物,属于碱;故A错误;
B、酒精属于有机物,而盐属于无机物;故B错误;
C、碳酸钾是由金属阳离子和酸根离子构成的化合物,属于盐;故C正确;
D、烧碱是由金属阳离子和氢氧根离子构成的化合物,属于碱;故D错误;
故答案为:C。
9.【答案】
B
【解析】【分析】无机盐主要是以离子形式存在的,在生命中有着重要的作用,在人的血液中含有Fe2+
,
Ca元素能够调节肌肉收缩和血液的凝固等。
【解答】用不含钙和钾的生理盐水灌注蛙心,不能维持收缩,用含少量钙和钾的生理盐水灌注时,能够持续跳动数小时,说明钙盐和钾盐对维持生物体的生命活动有重要的作用;
故选B。
10.【答案】
C
【解析】【分析】根据酸的化学性质进行判断即可。
【解答】A.铁会与盐酸反应生成氢气,只要有气泡产生,说明酸过量了,故A正确不合题意;
B.pH试纸测出的pH值小于7,说明溶液显酸性,盐酸就过量了,故B正确不合题意;
C.盐酸即使不过量,中和反应生成的氯离子也会与硝酸银生成沉淀,故C错误符合题意;
D.紫色石蕊变红色,说明溶液中存在氢离子,也就可以证明盐酸过量,故D正确不合题意。
故选C。
11.【答案】
A
【解析】【分析】如果要将两种物质鉴别出来,就必须有明显的、可以区别的现象,;根据酸、碱、盐的化学性质和物理性质进行鉴别即可。
【解答】①稀盐酸能使紫色石蕊试液变成红色,氢氧化钡溶液、碳酸钠溶液都显碱性,都能使紫色石蕊试液变成蓝色,因此无法鉴别;
②稀硫酸与稀盐酸不反应;稀硫酸能与氢氧化钡反应生成了白色沉淀;稀硫酸能与碳酸钠反应生成了二氧化碳气体,因此能用来一次性鉴别出三种物质;
③氢氧化钡溶液能与稀盐酸反应生成氯化钡和水,但现象不明显,它与氢氧化钡不反应,因此不能将稀盐酸和氢氧化钡鉴别出来;
④氯化钡溶液与稀盐酸、氢氧化钡溶液不反应,不能一次性鉴别稀盐酸、氢氧化钡溶液。
因此能用来一次性鉴别三种物质的是②。
故选A。
12.【答案】
A
【解析】【分析】不用其他试剂进行物质的鉴别,是根据物质间的相互反应进行,首先观察颜色,然后把鉴别出来的物质依次加入其他试剂中进行鉴别。
【解答】①因为石蕊试液是紫色的,所以首先鉴别出石蕊;
②然后将石蕊试液滴入其它液体,显红色的就是盐酸,而剩下的氢氧化钙、氢氧化钠、碳酸钠三种溶液为碱性,都变成变蓝色无法鉴别;
③将盐酸分别滴入剩余的液体,有气泡生成的就是碳酸钠溶液;
④将碳酸钠溶液滴入剩余的两种液体,能够生成白色沉淀的就是氢氧化钙,最后剩下的就是氢氧化钠溶液。
那么第二个被鉴别出来的物质是盐酸。
故选A。
二、填空题
13.【答案】
(1)食盐(NaCl)
(2)纯碱(Na2CO3);CaCl2
(Ba2+、Ca2+的可溶性盐或碱均可)
【解析】【分析】(1)食盐是厨房内非常重要的调味品,因为其有咸味,所以可以腌制酱菜。由于它可以使细胞脱水,因此可以消毒杀菌,使食物不易变质。
(2)方案一:碳酸钠和稀盐酸反应,生成二氧化碳气体,而氯化钠和稀盐酸不反应;
方案二:碳酸钠和氯化钙反应,生成碳酸钙沉淀,而氯化钠和氯化钡不反应。
【解答】(1)可用于腌制肉类和蔬菜,使食物不易腐败的是食盐(NaCl)。
(2)为鉴别这两种物质,某同学取少量白色固体,进行如下实验。
方案一:分别滴加少量食醋,有气泡产生的是纯碱(Na2CO3);
方案二:加水溶解,分别滴加CaCl2
(Ba2+、Ca2+的可溶性盐或碱)溶液,有沉淀产生的是纯碱。
14.【答案】
酸根;金属;铵根;硫酸
【解析】【分析】根据盐的定义及命名分析。
【解答】盐是酸根离子和金属离子或铵根离子形成的化合物,
硫酸铜、石膏都含硫酸根离子,可归为硫酸盐;
故答案为:酸根、金属、铵根、硫酸。
三、解答题
15.【答案】
(1)不存在
(2)AgCl
(3)不能,可能是其他含有氯离子的无机盐
【解析】【分析】硫酸、硫酸盐溶液能与硝酸钡溶液反应生成硫酸钡白色沉淀;硫酸钡、氯化银白色沉淀不溶于稀硝酸;汗水中也含有其他的矿物质和无机盐。
【解答】(1)硫酸、硫酸盐溶液能与硝酸钡溶液反应生成硫酸钡白色沉淀,
滴入硝酸钡溶液,没有出现白色沉淀,说明汗液中
不存在
硫酸和硫酸盐
;
(2)由于硫酸钡、氯化银白色沉淀不溶于稀硝酸,说明白色沉淀只能是氯化银
AgCl
;
(3)由于凭上述三步实验只能得出汗液中含有氯离子,而不能证明其含有钠离子,汗水中除了氯化钠外也可能含有其它的无机盐,蒸发后也会出现小颗粒。
故答案为:(1)不存在;(2)
AgCl
;(3)
不能,可能是其他含有氯离子的无机盐
。
四、实验探究题
16.【答案】
(1)不是
NH4Cl
中的
Cl-使石蕊试液变红
(2)石蕊试液或
NaCl
溶液中已经含有水
(3)
【解析】【分析】根据验证某粒子的性质可通过加入含该粒子的其他物质直接证明,还可以通过排除其他粒子间接得出性质与该粒子有关。
【解答】(1)氯化钠中含有氯离子,但石蕊试液不变色,所以可以证明不是
NH4Cl
中的
Cl-使石蕊试液变红;(2)石蕊试液或
NaCl
溶液中已经含有水,所以实验II没有必要做;(3)因氯化铵溶液中含有铵根离子和氯离子,实验I排除了氯离子使石蕊变红的可能,所以使石蕊试液变红的是铵根离子。
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
