高中化学人教版(2019)第一章 第三节氧化还原反应 课件(36张ppt)
文档属性
| 名称 | 高中化学人教版(2019)第一章 第三节氧化还原反应 课件(36张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-08 00:00:00 | ||
图片预览





文档简介
(共36张PPT)
第一章
物质及其变化
第三节
氧化还原反应
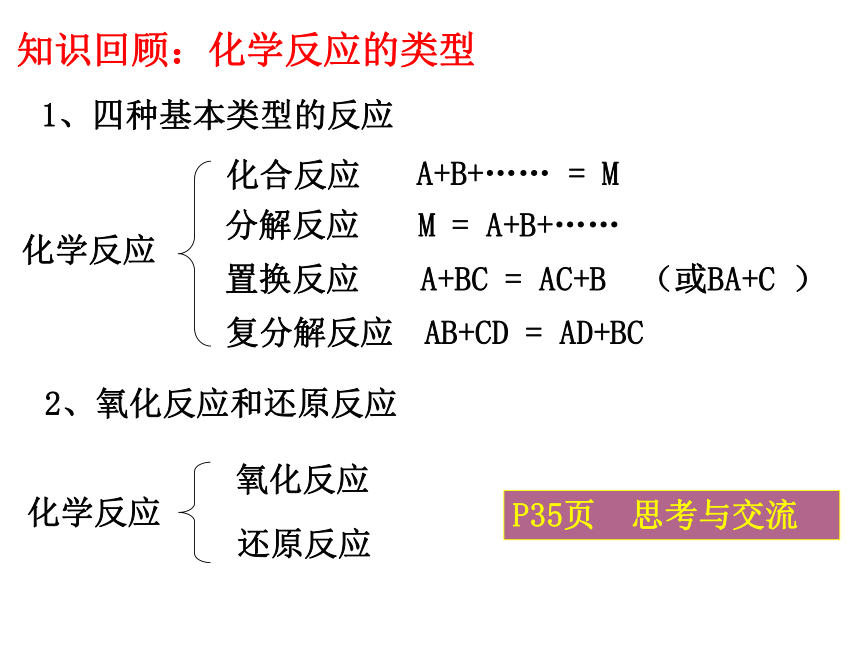
知识回顾:化学反应的类型
1、四种基本类型的反应
化学反应
化合反应
分解反应
置换反应
复分解反应
A+B+……
=
M
M
=
A+B+……
A+BC
=
AC+B
(或BA+C
)
AB+CD
=
AD+BC
2、氧化反应和还原反应
化学反应
氧化反应
还原反应
P35页
思考与交流
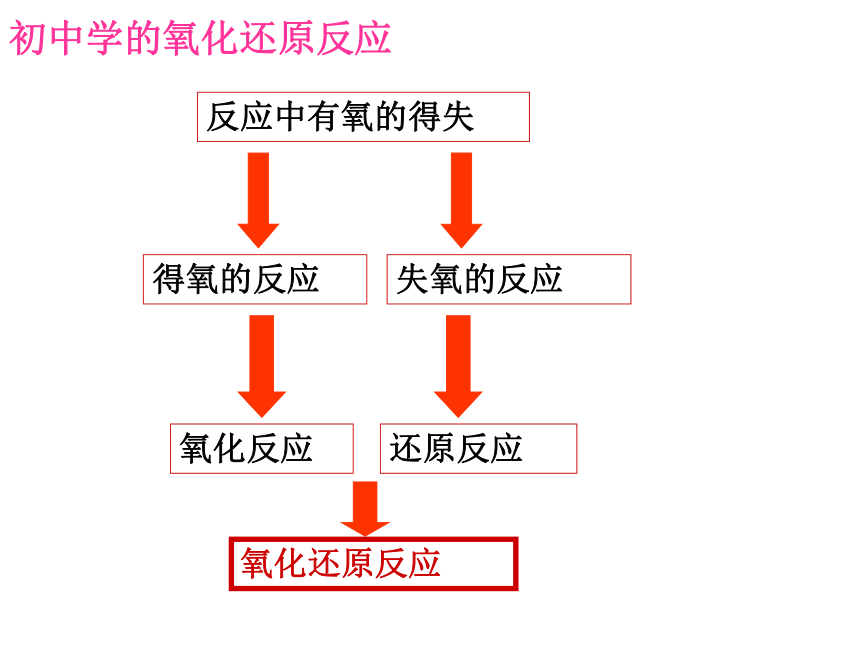
反应中有氧的得失
得氧的反应
氧化反应
初中学的氧化还原反应
失氧的反应
还原反应
氧化还原反应
一、氧化还原反应
1、从得氧、失氧分析
2CuO
+
C
===
2Cu
+
CO2↑
△
得到氧,被氧化,发生氧化反应
失去氧,被还原,发生还原反应
C
+
O2
===
CO2
点燃
对比
氧化还原反应:一种物质被氧化,同时另一种
物质被还原的反应。
(有得氧、失氧的反应)
2、从化合价升降分析
C
+
O2
===
CO2
点燃
2CuO
+
C
===
2Cu
+
CO2
↑
△
+2
0
0
+4
失去氧,化合价降低
得到氧,化合价升高
0
0
+4
-2
失去氧,化合价降低
得到氧,化合价升高
氧化还原反应:有元素化合价升降的化学反应。
2、从化合价升降分析
氧化反应:物质所含元素化合价升高的反应。
还原反应:物质所含元素化合价降低的反应。
H2+
Cl
2===
2HCl
属于氧化还原反应吗?
点燃
思考
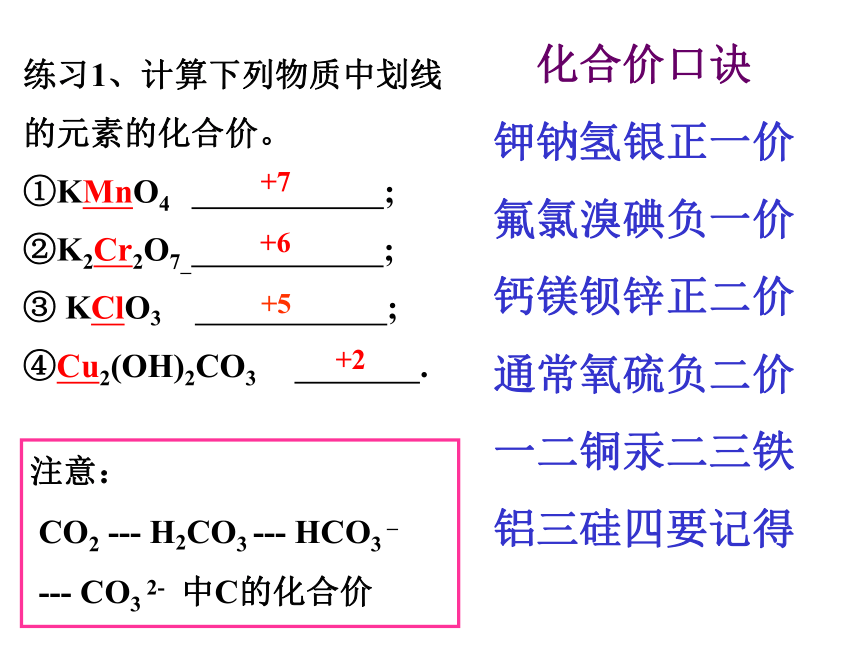
练习1、计算下列物质中划线
的元素的化合价。
①KMnO4
;
②K2Cr2O7
;
③
KClO3
;
④Cu2(OH)2CO3
.
+7
+6
+5
+2
化合价口诀
钾钠氢银正一价
氟氯溴碘负一价
钙镁钡锌正二价
通常氧硫负二价
一二铜汞二三铁
铝三硅四要记得
注意:
CO2
---
H2CO3
---
HCO3
–
---
CO3
2-
中C的化合价
练习2、下列反应属于氧化还原反应的是
A、Fe2O3
+
3CO
===
2Fe
+
3CO2
B、NH4NO3
===
N2O
↑+
2H2O
C、2NaHCO3
===
Na2CO3
+
CO2↑+
H2O
D、3Cl2
+
6KOH
==
5KCl
+
KClO3
+
3H2O
E、Cu2(OH)2CO3
===
2CuO
+
CO2↑+
H2O
F、
H2SO4
+
Ba(OH)2==
BaSO4
+
2H2O
H、Zn
+
2HCl
=
ZnCl2
+
H2
↑
高温
△
△
△
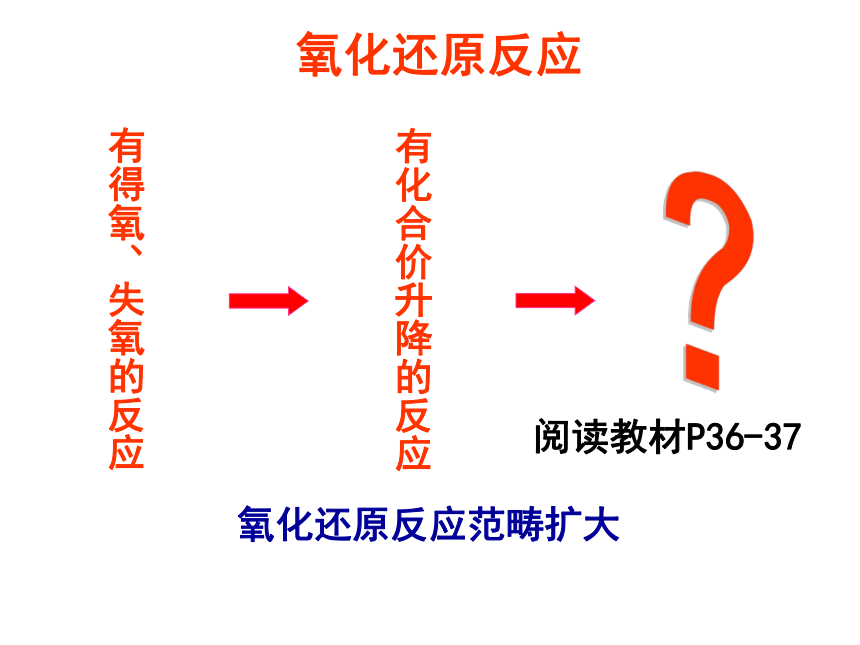
氧化还原反应
有得氧、失氧的反应
有化合价升降的反应
氧化还原反应范畴扩大
阅读教材P36-37
NaCl的形成过程
定滑轮
化合价
失去电子
得到电子
e-
化合价
Na
Cl
失去e-
失去e-后
得到e-后
Na+
[
Cl
]-
Cl-
Na+
升高
降低
元素的化合价升降的实质
化合价升降的实质:电子的转移
2Na
+
Cl2
===
2NaCl
点燃
0
+1
0
-1
失去电子,化合价升高,被氧化
得电子,化合价降低,被还原
H2
+
Cl2
===
2HCl
点燃
0
+1
0
-1
电子对偏离,化合价升高,被氧化
电子对偏向,化合价降低,被还原
电子的转移(得失或偏移)是化合价变化的本质,也是氧化还原反应发生的实质。
3、从电子转移(得失或偏移)分析
氧化还原反应:有电子转移(得失或偏移)的反应。
实质
表观特征
氧化反应:物质失去电子(或电子对偏离)的反应。
还原反应:物质得到电子(或电子对偏向)的反应。
有得氧、失氧的反应
有化合价升降的反应
有电子转移的反应
氧化还原反应的判据:有无化合价的升降(表观特征)。
练习:判断下列反应各属于四种基本反应类型中的哪一种?
其中哪些属于氧化还原反应?
(1)2Mg
+
O2
===2MgO
(2)2KMnO4
==
K2MnO4
+
MnO2
+
O2↑
(3)CO2
+
Na2O
==
Na2CO3
(4)Fe
+
CuSO4
==
FeSO4
+
Cu
(5)CH4
+
2O2
===
CO2
+2H2O
(6)2NaHCO3
===
Na2CO3
+
CO2↑+
H2O
(7)CaCl2
+
Na2CO3
==
CaCO3↓+
2NaCl
点燃
△
点燃
△
化合反应
分解反应
化合反应
置换反应
分解反应
复分解反应
是
是
是
是
否
否
否
氧还反应
非氧还反应
置换
复分解
化合
分
解
氧化还原反应与四种基本类型反应的关系
有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应。
二、氧化剂和还原剂
1、氧化剂和还原剂
CuO
+
H2
===
Cu
+
H2O
△
+2
0
0
+1
化合价降低,得电子,被还原
化合价升高,失电子,被氧化
氧化剂
还原剂
反应物
还原产物
氧化产物
生成物
氧化剂
+
还原剂
==
氧化产物
+
还原产物
化合价降低,得到电子,被还原,发生还原反应
化合价升高,失去电子,被氧化
,发生氧化反应
总结:
升、失、氧(化、还原剂)降、得、还(原、氧化剂)
该物质是还原剂
具有还原性
化合价升高
(表观特征)
失电子
(实质)
被氧化
发生氧化反应
得到氧化产物
练习:指出下列反应的氧化剂、还原剂、氧化产物和还原产物。
MnO2
+
4HCl
===
MnCl2
+
Cl2↑+
2H2O
2H2S
+
SO2
==
3S
↓
+
2H2O
2KClO3
===
2KCl
+
3O2
↑
△
△
氧化剂
还原剂
还原产物
氧化产物
还原剂
氧化剂
氧化产物
还原产物
氧化剂
还原剂
还原产物
氧化产物
2、氧化还原反应的表示方法:
(1)“双线桥”法
(2)“单线桥”法
(1)“双线桥”法
CuO
+
H2
===
Cu
+
H2O
△
+2
0
0
+1
得
2e-
失
2×e-
(2)“单线桥”法
CuO
+
H2
===
Cu
+
H2O
△
2e-
B、写“得”或“失”
描述同种元素的变化过程。箭头连接反应前后
不同价态的同种元素,
且从反应物指向生成物。
A、
C
、电子转移的数目
m
×n
e-
(得失电子总数相等)
A、描述电子的转移方向。
箭头由失电子元素
指向得电子元素
。
B、只标电子转移总
数,不标得失。
n
1个原子转移的电子数目
m
反应中实际有多少个原子发生了电子转移
电子转移的数目
m
×n
e-
若只m
=1,则m
×n
e-
写成
n
e-
若只n
=1,则m
×n
e-
写成
m
×
e-
若m
=
n
=1,则m
×n
e-
写成
e-
练习:用“双线桥”法表示下列氧化还原反应电子转移的方向和数目,并指出氧化剂和还原剂。
(2)2KMnO4
+
16HCl
==
2KCl+2MnCl2
+
5Cl2↑+
8H2O
(3)KClO3
+
6HCl
==
KCl
+
3Cl2
↑+
3H2O
(1)Fe
+
H2SO4
==
FeSO4
+
H2↑
0
+1
+2
0
失
2e-
得2×e-
还原剂
氧化剂
得2×5e-
+7
-1
+2
0
失
10×
e-
氧化剂
还原剂
+5
-1
-1
0
得5e-
失
5×
e-
氧化剂
还原剂
(4)3Cu
+
8HNO3(稀)
3Cu(NO3)2+
2
NO↑+
4H2O
得到2×3e-
失去3×2e-
(5)Cl2
+
2NaOH
==
NaCl
+
NaClO
+
H2O
还原剂
氧化剂
得到e-
失去e-
还原剂
氧化剂
(6)2KMnO4
==
K2MnO4
+
MnO2
+
O2↑
得到(1+3)e-
失去2×2e-
还原剂
氧化剂
3、常见的氧化剂和还原剂
常见的氧化剂:
O2、Cl2、浓硫酸、HNO3、KMnO4、
FeCl3等。
常见的还原剂:
活泼金属单质如Al、Zn、Fe,以及C、H2、CO等。
三、氧化还原反应的一般规律
1、得失电子守恒、化合价升降守恒。
2、元素的化合价与氧化性、还原性的关系
思考:
Na
、Cl-的化合价能否降低?Na+、H+的化合价能否升高?
Cl2、Fe2+的化合价呢?
物质所含元素化合价
可能的变化情况
可能体现的性质
最低价态
可升
还原性
最高价态
可降
氧化性
中间价态
可升也可降
二者皆有
3、氧化性、还原性强弱的初步判断
(1)K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb(H)Cu
Hg
Ag
Pt
Au
单质还原性逐渐减弱,失电子能力逐渐减弱
对应阳离子氧化性逐渐增强,得电子能力逐渐增强
氧化性:得电子的难易
还原性:失电子的难易
K+
Ca2+
Na+
Mg2+
Al3+
Zn2+
Fe2+
Sn2+
Pb2+(H
+)
Cu2+
Hg2+
Ag+
判据
思考:Zn+
CuSO4
===
ZnSO4
+
Cu
还原剂
氧化剂
氧化产物
还原产物
还原性
氧化性
(2)还原性:
氧化性
还原性
还原剂
>
还原产物
氧化性:
氧化剂
>
氧化产物
练习1、下列变化中,必须要加入氧化剂才能实现的是
(
)
A、KMnO4→O2
B、HCl→Cl2
C、HCl→H2
D、SO3→H2SO4
B
2、下列说法中正确的是(
)
A、处于最高价态的元素不一定具有强氧化性
B、元素由游离态转为化合态,说明该元素一定被氧化
C、阳离子只有氧化性,阴离子只有还原性
D、金属元素只有还原性,非金属元素只有氧化性
A
3、下列电子转移方向和数目的表示方法中正确的是(
)
D
4.
根据以下两个方程式
(1)
2FeCl2
+
Cl2
=
2FeCl3
(2)
2FeCl3
+
2HI
=
2FeCl2
+
I2
+
2HCl
回答下列问题:
(1)
判断
Fe3+、
Cl2、
I2
氧化性的强弱
Cl2
>
Fe3+
>
I2
(2)
判断
Fe2+、
Cl-、
I-
还原性的强弱
Cl-
<
Fe2+
<
I-
(3)
判断
I2
+
2NaCl
===
2NaI
+
Cl2
能否发生?
不能。
5、有反应:
问:在上面四个反应中,反应②中MnO2作
,反应③中
MnO2作
,反应①中HCl作
,反应③中HCl
作
,反应②中KClO3作
,反应④中KClO3
作
,反应②中KCl是
,反应④中KCl是
。
(从“氧化剂、还原剂、酸、催化剂、氧化产物、还原产物”等词中选填)
催化剂
氧化剂
氧化剂
还原剂
氧化剂、还原剂
氧化剂
还原产物
还原剂
6、氧化还原反应中,若同一物质中相同价态的同种
元素原子间互相发生氧化与还原,这种反应称为歧化反应。
例:
Cl2+2NaOH=NaCl+NaClO+H2O
即为歧化反应,
下列反应中,
属于歧化反应的是(
)
D
7、某金属硝酸盐在受热分解时生成了金属氧化物、
NO2和O2。其中NO2和O2个数比为4:1。则该金属
元素在反应前后的化合价的变化情况是
。
(填“升高”“降低”或“不变”)
不变
小结
氧化剂:定义:得到电子(或电子对偏向)的物质。
还原剂:定义:失去电子(或电子对偏离)的物质。
1.有关概念
2Al
+
Fe2O3
2Fe
+
A
l2O3
失去2×3e-,化合价升高,被氧化
得到2×3e-,化合价降低,被还原
0
+3
0
+3
表现:在反应时所含元素化合价降低
表现:在反应时所含元素化合价升高
氧化剂
还原剂
还原产物
氧化产物
氧化产物:还原剂被氧化后的生成物。
还原产物:氧化剂被还原后的生成物。
氧化性:
得电子的能力(
氧化剂的性质
)
还原性:
失电子的能力(
还原剂的性质
)
2、氧化还原反应基本概念之间的关系
还原剂
还原性
氧化反应
氧化产物
氧化剂
氧化性
还原反应
还原产物
具有
失电子
价升高
具有
得电子
价降低
①同时存在
②得失电子守恒
“升、失、氧”“降、得、还”
3、氧化还原反应常见题型
1)判断化学反应是否氧化还原反应
2)氧化还原反应概念判断
判断物质氧化性、还原性
判断反应中氧化剂、还原剂及其对应量
判断氧化产物、还原产物及其对应量
3)分析氧化还原反应
双线桥:物质在反应前后电子得失数。
单线桥:氧化剂和还原剂间得失电子总数。
只标明电子转移的总数目(不标明“得、失”
)。
4)分析判断物质氧化性和还原性强弱
氧化性:氧化剂的氧化性大于氧化产物;
还原性:还原剂的还原性大于还原产物。
5)利用电子守恒(化合价升降总数相等)
配平氧化还原方程式
6)利用电子守恒进行计算
第一章
物质及其变化
第三节
氧化还原反应
知识回顾:化学反应的类型
1、四种基本类型的反应
化学反应
化合反应
分解反应
置换反应
复分解反应
A+B+……
=
M
M
=
A+B+……
A+BC
=
AC+B
(或BA+C
)
AB+CD
=
AD+BC
2、氧化反应和还原反应
化学反应
氧化反应
还原反应
P35页
思考与交流
反应中有氧的得失
得氧的反应
氧化反应
初中学的氧化还原反应
失氧的反应
还原反应
氧化还原反应
一、氧化还原反应
1、从得氧、失氧分析
2CuO
+
C
===
2Cu
+
CO2↑
△
得到氧,被氧化,发生氧化反应
失去氧,被还原,发生还原反应
C
+
O2
===
CO2
点燃
对比
氧化还原反应:一种物质被氧化,同时另一种
物质被还原的反应。
(有得氧、失氧的反应)
2、从化合价升降分析
C
+
O2
===
CO2
点燃
2CuO
+
C
===
2Cu
+
CO2
↑
△
+2
0
0
+4
失去氧,化合价降低
得到氧,化合价升高
0
0
+4
-2
失去氧,化合价降低
得到氧,化合价升高
氧化还原反应:有元素化合价升降的化学反应。
2、从化合价升降分析
氧化反应:物质所含元素化合价升高的反应。
还原反应:物质所含元素化合价降低的反应。
H2+
Cl
2===
2HCl
属于氧化还原反应吗?
点燃
思考
练习1、计算下列物质中划线
的元素的化合价。
①KMnO4
;
②K2Cr2O7
;
③
KClO3
;
④Cu2(OH)2CO3
.
+7
+6
+5
+2
化合价口诀
钾钠氢银正一价
氟氯溴碘负一价
钙镁钡锌正二价
通常氧硫负二价
一二铜汞二三铁
铝三硅四要记得
注意:
CO2
---
H2CO3
---
HCO3
–
---
CO3
2-
中C的化合价
练习2、下列反应属于氧化还原反应的是
A、Fe2O3
+
3CO
===
2Fe
+
3CO2
B、NH4NO3
===
N2O
↑+
2H2O
C、2NaHCO3
===
Na2CO3
+
CO2↑+
H2O
D、3Cl2
+
6KOH
==
5KCl
+
KClO3
+
3H2O
E、Cu2(OH)2CO3
===
2CuO
+
CO2↑+
H2O
F、
H2SO4
+
Ba(OH)2==
BaSO4
+
2H2O
H、Zn
+
2HCl
=
ZnCl2
+
H2
↑
高温
△
△
△
氧化还原反应
有得氧、失氧的反应
有化合价升降的反应
氧化还原反应范畴扩大
阅读教材P36-37
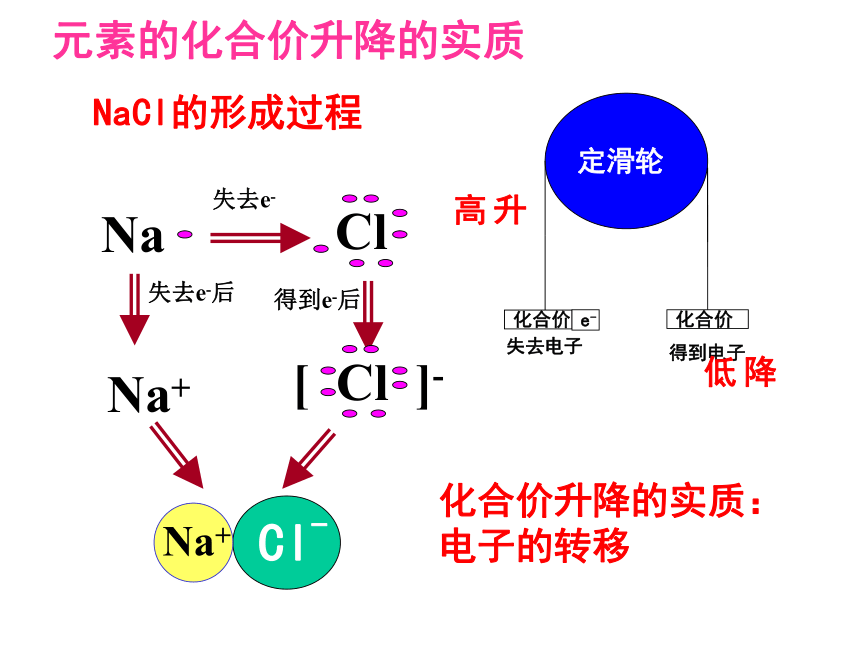
NaCl的形成过程
定滑轮
化合价
失去电子
得到电子
e-
化合价
Na
Cl
失去e-
失去e-后
得到e-后
Na+
[
Cl
]-
Cl-
Na+
升高
降低
元素的化合价升降的实质
化合价升降的实质:电子的转移
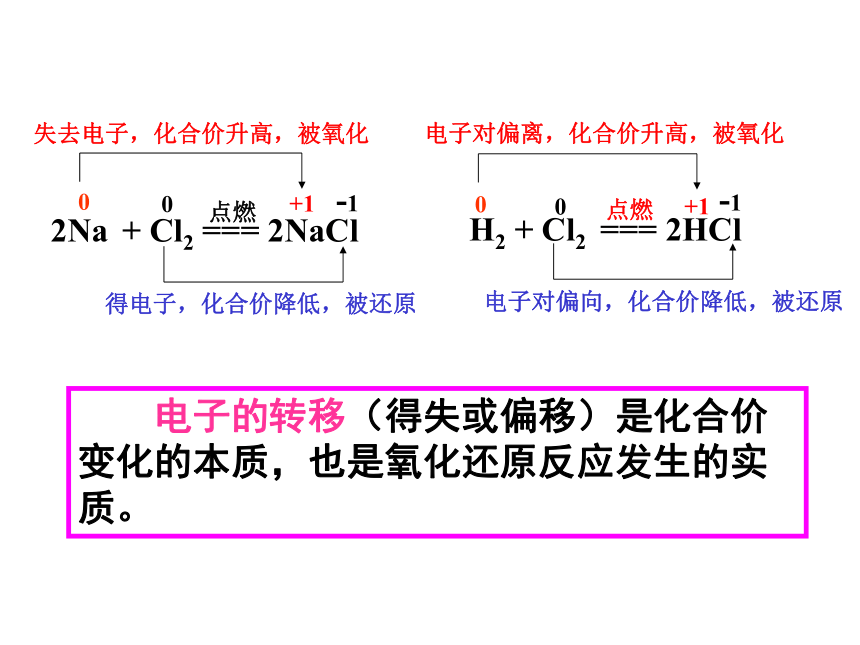
2Na
+
Cl2
===
2NaCl
点燃
0
+1
0
-1
失去电子,化合价升高,被氧化
得电子,化合价降低,被还原
H2
+
Cl2
===
2HCl
点燃
0
+1
0
-1
电子对偏离,化合价升高,被氧化
电子对偏向,化合价降低,被还原
电子的转移(得失或偏移)是化合价变化的本质,也是氧化还原反应发生的实质。
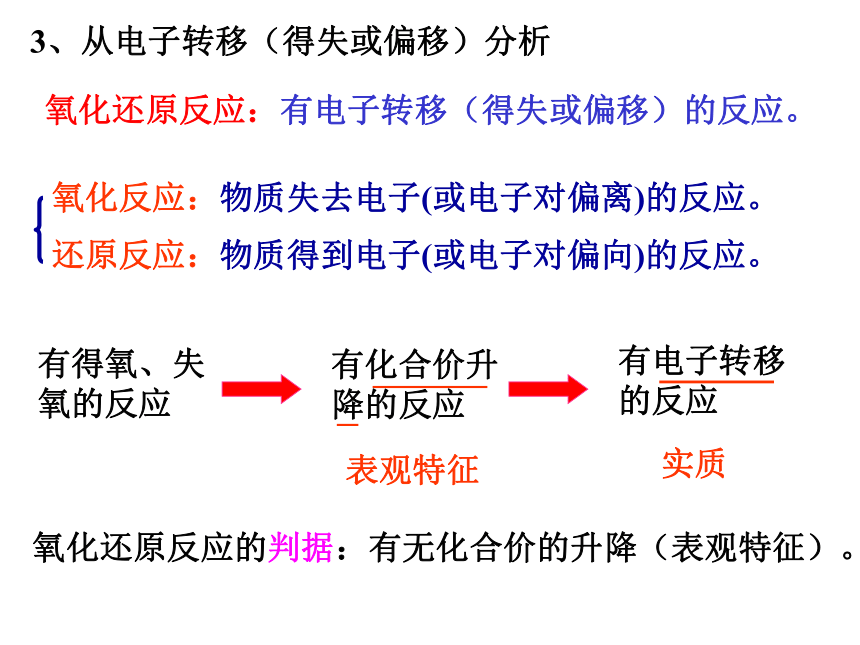
3、从电子转移(得失或偏移)分析
氧化还原反应:有电子转移(得失或偏移)的反应。
实质
表观特征
氧化反应:物质失去电子(或电子对偏离)的反应。
还原反应:物质得到电子(或电子对偏向)的反应。
有得氧、失氧的反应
有化合价升降的反应
有电子转移的反应
氧化还原反应的判据:有无化合价的升降(表观特征)。
练习:判断下列反应各属于四种基本反应类型中的哪一种?
其中哪些属于氧化还原反应?
(1)2Mg
+
O2
===2MgO
(2)2KMnO4
==
K2MnO4
+
MnO2
+
O2↑
(3)CO2
+
Na2O
==
Na2CO3
(4)Fe
+
CuSO4
==
FeSO4
+
Cu
(5)CH4
+
2O2
===
CO2
+2H2O
(6)2NaHCO3
===
Na2CO3
+
CO2↑+
H2O
(7)CaCl2
+
Na2CO3
==
CaCO3↓+
2NaCl
点燃
△
点燃
△
化合反应
分解反应
化合反应
置换反应
分解反应
复分解反应
是
是
是
是
否
否
否
氧还反应
非氧还反应
置换
复分解
化合
分
解
氧化还原反应与四种基本类型反应的关系
有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应。
二、氧化剂和还原剂
1、氧化剂和还原剂
CuO
+
H2
===
Cu
+
H2O
△
+2
0
0
+1
化合价降低,得电子,被还原
化合价升高,失电子,被氧化
氧化剂
还原剂
反应物
还原产物
氧化产物
生成物
氧化剂
+
还原剂
==
氧化产物
+
还原产物
化合价降低,得到电子,被还原,发生还原反应
化合价升高,失去电子,被氧化
,发生氧化反应
总结:
升、失、氧(化、还原剂)降、得、还(原、氧化剂)
该物质是还原剂
具有还原性
化合价升高
(表观特征)
失电子
(实质)
被氧化
发生氧化反应
得到氧化产物
练习:指出下列反应的氧化剂、还原剂、氧化产物和还原产物。
MnO2
+
4HCl
===
MnCl2
+
Cl2↑+
2H2O
2H2S
+
SO2
==
3S
↓
+
2H2O
2KClO3
===
2KCl
+
3O2
↑
△
△
氧化剂
还原剂
还原产物
氧化产物
还原剂
氧化剂
氧化产物
还原产物
氧化剂
还原剂
还原产物
氧化产物
2、氧化还原反应的表示方法:
(1)“双线桥”法
(2)“单线桥”法
(1)“双线桥”法
CuO
+
H2
===
Cu
+
H2O
△
+2
0
0
+1
得
2e-
失
2×e-
(2)“单线桥”法
CuO
+
H2
===
Cu
+
H2O
△
2e-
B、写“得”或“失”
描述同种元素的变化过程。箭头连接反应前后
不同价态的同种元素,
且从反应物指向生成物。
A、
C
、电子转移的数目
m
×n
e-
(得失电子总数相等)
A、描述电子的转移方向。
箭头由失电子元素
指向得电子元素
。
B、只标电子转移总
数,不标得失。
n
1个原子转移的电子数目
m
反应中实际有多少个原子发生了电子转移
电子转移的数目
m
×n
e-
若只m
=1,则m
×n
e-
写成
n
e-
若只n
=1,则m
×n
e-
写成
m
×
e-
若m
=
n
=1,则m
×n
e-
写成
e-
练习:用“双线桥”法表示下列氧化还原反应电子转移的方向和数目,并指出氧化剂和还原剂。
(2)2KMnO4
+
16HCl
==
2KCl+2MnCl2
+
5Cl2↑+
8H2O
(3)KClO3
+
6HCl
==
KCl
+
3Cl2
↑+
3H2O
(1)Fe
+
H2SO4
==
FeSO4
+
H2↑
0
+1
+2
0
失
2e-
得2×e-
还原剂
氧化剂
得2×5e-
+7
-1
+2
0
失
10×
e-
氧化剂
还原剂
+5
-1
-1
0
得5e-
失
5×
e-
氧化剂
还原剂
(4)3Cu
+
8HNO3(稀)
3Cu(NO3)2+
2
NO↑+
4H2O
得到2×3e-
失去3×2e-
(5)Cl2
+
2NaOH
==
NaCl
+
NaClO
+
H2O
还原剂
氧化剂
得到e-
失去e-
还原剂
氧化剂
(6)2KMnO4
==
K2MnO4
+
MnO2
+
O2↑
得到(1+3)e-
失去2×2e-
还原剂
氧化剂
3、常见的氧化剂和还原剂
常见的氧化剂:
O2、Cl2、浓硫酸、HNO3、KMnO4、
FeCl3等。
常见的还原剂:
活泼金属单质如Al、Zn、Fe,以及C、H2、CO等。
三、氧化还原反应的一般规律
1、得失电子守恒、化合价升降守恒。
2、元素的化合价与氧化性、还原性的关系
思考:
Na
、Cl-的化合价能否降低?Na+、H+的化合价能否升高?
Cl2、Fe2+的化合价呢?
物质所含元素化合价
可能的变化情况
可能体现的性质
最低价态
可升
还原性
最高价态
可降
氧化性
中间价态
可升也可降
二者皆有
3、氧化性、还原性强弱的初步判断
(1)K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb(H)Cu
Hg
Ag
Pt
Au
单质还原性逐渐减弱,失电子能力逐渐减弱
对应阳离子氧化性逐渐增强,得电子能力逐渐增强
氧化性:得电子的难易
还原性:失电子的难易
K+
Ca2+
Na+
Mg2+
Al3+
Zn2+
Fe2+
Sn2+
Pb2+(H
+)
Cu2+
Hg2+
Ag+
判据
思考:Zn+
CuSO4
===
ZnSO4
+
Cu
还原剂
氧化剂
氧化产物
还原产物
还原性
氧化性
(2)还原性:
氧化性
还原性
还原剂
>
还原产物
氧化性:
氧化剂
>
氧化产物
练习1、下列变化中,必须要加入氧化剂才能实现的是
(
)
A、KMnO4→O2
B、HCl→Cl2
C、HCl→H2
D、SO3→H2SO4
B
2、下列说法中正确的是(
)
A、处于最高价态的元素不一定具有强氧化性
B、元素由游离态转为化合态,说明该元素一定被氧化
C、阳离子只有氧化性,阴离子只有还原性
D、金属元素只有还原性,非金属元素只有氧化性
A
3、下列电子转移方向和数目的表示方法中正确的是(
)
D
4.
根据以下两个方程式
(1)
2FeCl2
+
Cl2
=
2FeCl3
(2)
2FeCl3
+
2HI
=
2FeCl2
+
I2
+
2HCl
回答下列问题:
(1)
判断
Fe3+、
Cl2、
I2
氧化性的强弱
Cl2
>
Fe3+
>
I2
(2)
判断
Fe2+、
Cl-、
I-
还原性的强弱
Cl-
<
Fe2+
<
I-
(3)
判断
I2
+
2NaCl
===
2NaI
+
Cl2
能否发生?
不能。
5、有反应:
问:在上面四个反应中,反应②中MnO2作
,反应③中
MnO2作
,反应①中HCl作
,反应③中HCl
作
,反应②中KClO3作
,反应④中KClO3
作
,反应②中KCl是
,反应④中KCl是
。
(从“氧化剂、还原剂、酸、催化剂、氧化产物、还原产物”等词中选填)
催化剂
氧化剂
氧化剂
还原剂
氧化剂、还原剂
氧化剂
还原产物
还原剂
6、氧化还原反应中,若同一物质中相同价态的同种
元素原子间互相发生氧化与还原,这种反应称为歧化反应。
例:
Cl2+2NaOH=NaCl+NaClO+H2O
即为歧化反应,
下列反应中,
属于歧化反应的是(
)
D
7、某金属硝酸盐在受热分解时生成了金属氧化物、
NO2和O2。其中NO2和O2个数比为4:1。则该金属
元素在反应前后的化合价的变化情况是
。
(填“升高”“降低”或“不变”)
不变
小结
氧化剂:定义:得到电子(或电子对偏向)的物质。
还原剂:定义:失去电子(或电子对偏离)的物质。
1.有关概念
2Al
+
Fe2O3
2Fe
+
A
l2O3
失去2×3e-,化合价升高,被氧化
得到2×3e-,化合价降低,被还原
0
+3
0
+3
表现:在反应时所含元素化合价降低
表现:在反应时所含元素化合价升高
氧化剂
还原剂
还原产物
氧化产物
氧化产物:还原剂被氧化后的生成物。
还原产物:氧化剂被还原后的生成物。
氧化性:
得电子的能力(
氧化剂的性质
)
还原性:
失电子的能力(
还原剂的性质
)
2、氧化还原反应基本概念之间的关系
还原剂
还原性
氧化反应
氧化产物
氧化剂
氧化性
还原反应
还原产物
具有
失电子
价升高
具有
得电子
价降低
①同时存在
②得失电子守恒
“升、失、氧”“降、得、还”
3、氧化还原反应常见题型
1)判断化学反应是否氧化还原反应
2)氧化还原反应概念判断
判断物质氧化性、还原性
判断反应中氧化剂、还原剂及其对应量
判断氧化产物、还原产物及其对应量
3)分析氧化还原反应
双线桥:物质在反应前后电子得失数。
单线桥:氧化剂和还原剂间得失电子总数。
只标明电子转移的总数目(不标明“得、失”
)。
4)分析判断物质氧化性和还原性强弱
氧化性:氧化剂的氧化性大于氧化产物;
还原性:还原剂的还原性大于还原产物。
5)利用电子守恒(化合价升降总数相等)
配平氧化还原方程式
6)利用电子守恒进行计算
