专题2《研究物质的基本方法》测试题(含答案)2021-2022学年上学期高一化学苏教版(2019)必修第一册
文档属性
| 名称 | 专题2《研究物质的基本方法》测试题(含答案)2021-2022学年上学期高一化学苏教版(2019)必修第一册 |  | |
| 格式 | docx | ||
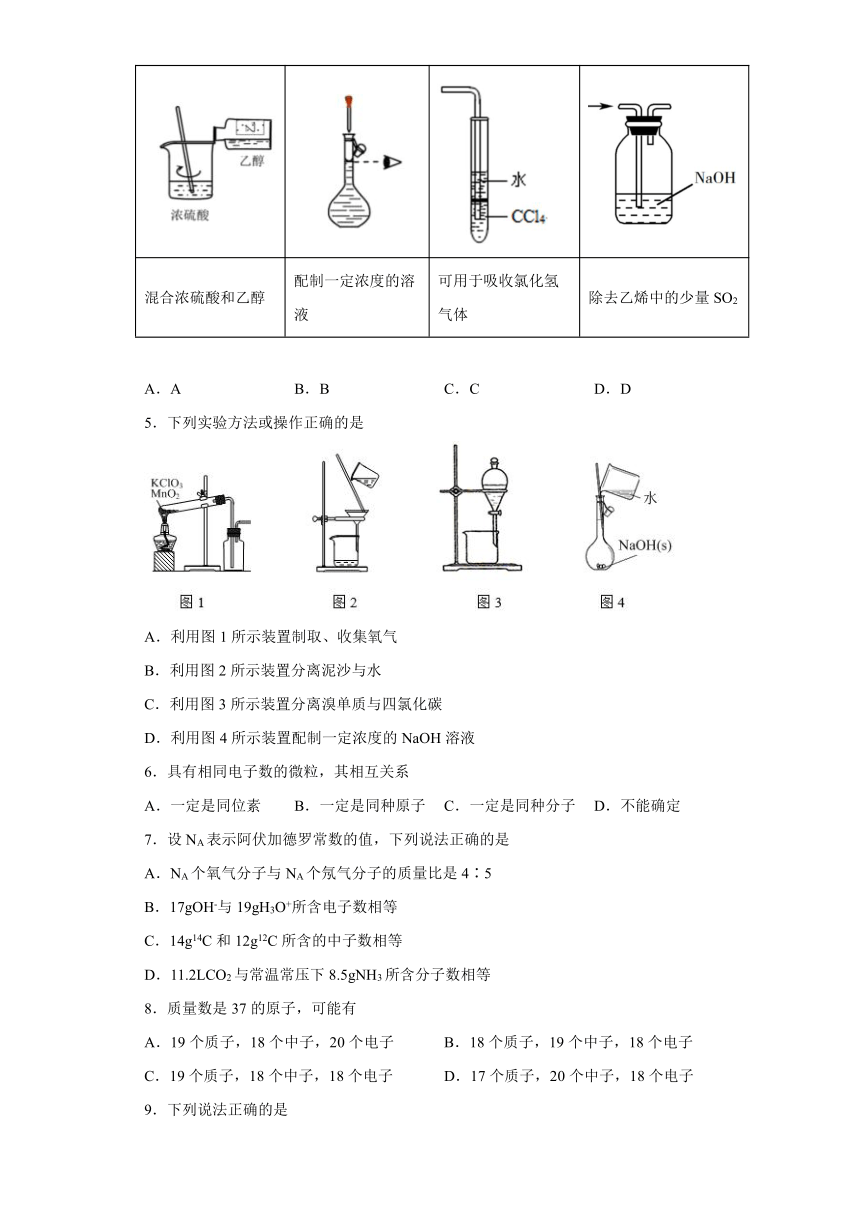
| 文件大小 | 402.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-10 21:02:10 | ||
图片预览



文档简介
专题2《研究物质的基本方法》测试题
一、单选题(共15题)
1.提纯混有泥沙的食盐,主要操作有:溶解、过滤、蒸发。这些操作中都需要使用的仪器是
A.烧杯 B.漏斗 C.玻璃棒 D.酒精灯
2.下列分离和提纯的实验中,所选用的方法或仪器错误的是
选项 A B C D
实验目的 制取蒸馏水 分离水和植物油 分离食盐水与泥沙 从浓食盐水中得到氯化钠晶体
分离方法 蒸馏 分液 萃取 蒸发
选用仪器
A.A B.B C.C D.D
3.某混合物可能含有Al、Cu、Fe2O3、Al2O3,为探究该混合物成分,某兴趣小组设计如图分析方案。下列分析正确的是
A.已知m2<m1,则混合物中一定含有Al2O3和Al
B.蓝绿色溶液中含有的阳离子为Cu2+、Fe3+和H+
C.固体P一定是纯净物
D.向溶液N中滴加足量盐酸有白色沉淀生成
4.下列实验操作或装置不能达到目的的是
A B C D
混合浓硫酸和乙醇 配制一定浓度的溶液 可用于吸收氯化氢气体 除去乙烯中的少量SO2
A.A B.B C.C D.D
5.下列实验方法或操作正确的是
A.利用图1所示装置制取、收集氧气
B.利用图2所示装置分离泥沙与水
C.利用图3所示装置分离溴单质与四氯化碳
D.利用图4所示装置配制一定浓度的NaOH溶液
6.具有相同电子数的微粒,其相互关系
A.一定是同位素 B.一定是同种原子 C.一定是同种分子 D.不能确定
7.设NA表示阿伏加德罗常数的值,下列说法正确的是
A.NA个氧气分子与NA个氖气分子的质量比是4∶5
B.17gOH-与19gH3O+所含电子数相等
C.14g14C和12g12C所含的中子数相等
D.11.2LCO2与常温常压下8.5gNH3所含分子数相等
8.质量数是37的原子,可能有
A.19个质子,18个中子,20个电子 B.18个质子,19个中子,18个电子
C.19个质子,18个中子,18个电子 D.17个质子,20个中子,18个电子
9.下列说法正确的是
A.抽滤时,用倾析法转移沉淀,再转移溶液,然后开大水龙头进行抽滤
B.一些有机溶剂苯、四氯化碳、乙醚等极易被引燃,使用时必须远离明火和热源
C.抽滤得阿司匹林粗产品后,先用冷水洗涤晶体,再用酒精洗涤,加快干燥
D.MnO2催化双氧水分解时,其用量和颗粒直径大小均会影响双氧水分解的速率
10.把碘从碘水里分离出来,有下列基本操作:①静置后分液,②充分振荡,③把碘水倒入分液漏斗,再加入萃取剂四氯化碳,④检验分液漏斗是否漏液。其正确的操作顺序是
A.①②③④ B.③①②④ C.④②③① D.④③②①
11.下列说法不正确的是
A.重结晶时,溶液冷却速度越慢得到的晶体颗粒越大
B.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
C.抽滤装置由布氏漏斗、吸滤瓶、安全瓶、抽气泵等仪器组成,工作的主要原理是抽气泵给吸滤瓶减压,导致装置内部的压强降低,使过滤的速度加快
D.硝酸钾饱和溶液冷却未出现结晶时,可以用玻棒充分磨擦器皿壁,促使晶体析出
12.月球上的每百吨He聚变所释放出的能量相当于目前人类一年消耗的能量,地球上氦元素主要以He的形式存在。已知一个12C原子的质量为a g,一个He原子的质量为b g,NA为阿伏加德罗常数的值。下列说法正确的是
A.He比He多一个中子 B.氦元素的近似相对原子质量为3
C.He的相对原子质量为 D.He的摩尔质量为2bNA
13.下列仪器不能用酒精灯直接加热的是
仪器
名称 小试管 蒸发皿 蒸馏烧瓶 坩埚
选项 A B C D
A.A B.B C.C D.D
14.美国UNC化学教授ThomasJ.Meyer等研发了环境友好、安全型的“绿色”引爆炸药,其中一种可表示为Na2R,它保存在水中可以失去活性,爆炸后不会产生危害性残留物。已知10mLNa2R溶液含Na+的数目为N,该Na2R溶液的物质的量浓度为
A.N×10-2mol·L-1 B.mol·L-1
C.mol·L-1 D.mol·L-1
15.碲(52Te)被誉为“国防与尖端技术的维生素”;锡酸钠(Na2SnO3)可用于制造陶瓷电容器的基体。以锡碲渣(主要含Na2SnO3和Na2TeO3)为原料,回收锡酸钠并制备碲单质的流程图如下,下列说法错误的是
已知:锡酸钠(Na2SnO3)和亚碲酸钠(Na2TeO3)均易溶于碱。
A.在生产过程中,要将锡碲渣粉碎,其目的是增大锡碲渣的碱浸速率和浸出率
B.“氧化”时,反应的离子方程式为
C.“氧化”的温度应该越高越好,因为温度越高化学反应速率越快
D.以石墨为电极电解Na2TeO3溶液可获得Te,电解过程中阴极上的电极反应为:
二、填空题(共8题)
16.选择下列一种方法分离物质,将分离方法的序号填在横线上.
A.萃取分液 B.升华 C.结晶 D.分液 E.蒸馏 F.过滤
(1)从溴水中提取溴______
(2)分离饱和食盐水与沙子的混合物______
(3)分离水和汽油的混合物______
(4)分离酒精(沸点为78.1℃)和甲苯(沸点为110.6℃)两种互溶液体______.
17.四个试剂瓶中分别装有NaNO3、Na2CO3、Na2SO4和NaCl溶液,为鉴别这四种溶液,分别取四种溶液各1 mL 于四支试管中,做下列实验。
(1)在四支试管中分别滴入足量_____,出现_____的是___________,反应的化学方程式是___________。
(2)在剩余三支试管中分别滴入___________,出现___________的是___________,反应的化学方程式是___________。
(3)再取剩余两支试管对应的溶液,分别滴入___________,出现___________,的是___________,反应的化学方程式是___________。
(4)三次实验中都没有明显现象的是___________。
18.现有A、B、C、D四种化合物,透过蓝色钴玻璃观察其焰色反应现象时发现火焰均为紫色,A、B、C和盐酸反应后,均可得到D;将固体C加热可制得A;若在A的溶液中通入一种无色无味气体,又可制得C;B与C的溶液混合可制得A。
(1)推断A是_____________(填化学式,下同),B是____________,C是_________,D是_______。
(2)写出B+C→A的化学方程式:___________。
19.如图所示中学化学中常见物质的实验转化过程,部分物质和反应条件略去。
(1)写出F的化学式______;写出物质A的一种用途______;
(2)写出单质B与强碱溶液反应的离子方程式______,写出沉淀J生成H溶液的离子方程式______;
(3)溶液E中加入氨水时,先生成白色沉淀L,写出生成L的离子方程式______;
(4)溶液I中所含金属离子是______。
20.化合物A(仅含三种元素,摩尔质量为 ),具有高效的消毒作用.为探究A的组成和性质,设计并完成下实验:
已知中和液进行焰色反应透过蓝色钻玻璃可以观察到火焰呈紫色,气体E能使带火星的木条复燃.
(1)化合物A中所含的元素为________;
(2)写出A与水反应的化学方程式________;
(3)检验中和液中的阴离子的实验操作为________.
21.某小组利用如图装置测定常温常压下的气体摩尔体积。取一定量已去除氧化膜的镁条放入烧瓶中,用注射器向烧瓶中注入硫酸溶液,反应后冷却至室温,使量气管与水准管液面相平,再读数.重复实验,数据如下:
序号 镁条质量/ 反应前量气管读数/ 反应后量气管读数/
1 0.0530 0.0 66.8
2 0.0540 0.0 67.0
3 0.0550 0.0 67.2
计算
(1)第1组实验反应后溶液中的物质的量浓度=_______(假设反应后溶液体积不变);
(2)常温常压下的气体摩尔体积=___________(保留三位有效数字) L·mol-1。
22.(1)已知1.204×1023 个 X 气体分子的质量是 6.4 g,则X 气体的摩尔质量是:_______;
(2)同温同压下,同体积的甲烷 CH4气体和CO气体质量之比为_______,质子数之比_______;
(3)相同质量的 SO2、SO3 的氧原子的个数之比为_______;
(4)V L Al2(SO4)3 溶液中含 Al3+ a mol,该 Al2(SO4)3 溶液的物质的量浓度为_____mol/L,取出 0.5V L 再加入水稀释到4V L,则稀释后的溶液中 SO的物质的量浓度为_____mol/L。
23.从铬铜废催化剂(主要含CuO·Cr2O3、少量有机物及水)中回收铬和铜的实验流程如下:
(1)700℃“焙烧”可使Cr2O3不溶于酸,焙烧的另一目的是_______
(2)配制“酸洗”所用100mL6mol·L-1硫酸需要的玻璃仪器有:量筒、烧杯、100mL容量瓶、_______和_______;为使研碎的烧渣中CuO充分溶解,应采取的措施是_______
(3)为确定xNa2SO4·yCr2(SO4)3·zH2O的组成,进行下列实验:
①称取样品1.9320g溶于水,加入足量盐酸酸化的BaCl2溶液,得到1.8640g沉淀。
②另称取样品1.9320g溶于水,经H2O2在碱性条件下氧化、煮沸、酸化得Na2Cr2O7和Na2SO4的混合酸性溶液;加入稍过量的KI溶液(+6I-+14H+ = 2Cr3++3I2+7H2O),暗处静置5min,立刻用0.5000mol·L-1Na2S2O3标准溶液滴定(2Na2S2O3+I2=2NaI+Na2S4O6)至溶液呈浅黄色,再加入1mL淀粉溶液,继续滴定至溶液蓝色刚好消失,消耗Na2S2O3溶液24.00mL。
根据上述实验数据,确定xNa2SO4·yCr2(SO4)3·zH2O的化学式(写出计算过程)___________。
参考答案
1.C 2.C 3.C 4.A 5.B 6.D 7.B 8.B 9.D 10.D 11.B 12.C 13.C 14.B 15.C
16.A F D E
17.稀硝酸 气泡 Na2CO3溶液 Na2CO3+2HNO3=2NaNO3+CO2↑+H2O Ba(NO3)2溶液 白色沉淀 Na2SO4溶液 Na2SO4+Ba(NO3)2=BaSO4↓+2NaNO3 AgNO3溶液 白色沉淀 NaCl溶液 NaCl+AgNO3=NaNO3+AgCl↓ NaNO3溶液
18. KOH KCl
19. 作油漆颜料,炼铁等 、
20.Fe、K、O 4K2FeO4+10H2O=4Fe(OH)3+8KOH+3O2↑ 取中和液少许放入试管中,向试管中滴加盐酸无变化,再加入氯化钡溶液,若产生白色沉淀说明溶液中含有硫酸根离子,否则溶液不含硫酸根离子;
21.5.56 mol/L 25.3
22.32g·mol-1 4:7 5:7 5:6 a/2V 3a/16V
23.将有机物及水除去 玻璃棒 胶头滴管 适当加热并搅拌 n(Na2SO4)+3n[Cr2(SO4)3]==0.0080mol,由发生的反应,可建立如下关系式:Cr2(SO4)3——Na2Cr2O7——3I2——6Na2S2O3,则n[Cr2(SO4)3]=n(Na2S2O3)= ×0.5000mol/L×0.02400L=0.0020mol,n(Na2SO4)= 0.0080mol-3×0.0020mol=0.0020mol,n(H2O)==0.0480mol,从而得出x:y:z=0.0020:0.0020:0.0480=1:1:24,盐的化学式为Na2SO4·Cr2(SO4)3·24H2O
一、单选题(共15题)
1.提纯混有泥沙的食盐,主要操作有:溶解、过滤、蒸发。这些操作中都需要使用的仪器是
A.烧杯 B.漏斗 C.玻璃棒 D.酒精灯
2.下列分离和提纯的实验中,所选用的方法或仪器错误的是
选项 A B C D
实验目的 制取蒸馏水 分离水和植物油 分离食盐水与泥沙 从浓食盐水中得到氯化钠晶体
分离方法 蒸馏 分液 萃取 蒸发
选用仪器
A.A B.B C.C D.D
3.某混合物可能含有Al、Cu、Fe2O3、Al2O3,为探究该混合物成分,某兴趣小组设计如图分析方案。下列分析正确的是
A.已知m2<m1,则混合物中一定含有Al2O3和Al
B.蓝绿色溶液中含有的阳离子为Cu2+、Fe3+和H+
C.固体P一定是纯净物
D.向溶液N中滴加足量盐酸有白色沉淀生成
4.下列实验操作或装置不能达到目的的是
A B C D
混合浓硫酸和乙醇 配制一定浓度的溶液 可用于吸收氯化氢气体 除去乙烯中的少量SO2
A.A B.B C.C D.D
5.下列实验方法或操作正确的是
A.利用图1所示装置制取、收集氧气
B.利用图2所示装置分离泥沙与水
C.利用图3所示装置分离溴单质与四氯化碳
D.利用图4所示装置配制一定浓度的NaOH溶液
6.具有相同电子数的微粒,其相互关系
A.一定是同位素 B.一定是同种原子 C.一定是同种分子 D.不能确定
7.设NA表示阿伏加德罗常数的值,下列说法正确的是
A.NA个氧气分子与NA个氖气分子的质量比是4∶5
B.17gOH-与19gH3O+所含电子数相等
C.14g14C和12g12C所含的中子数相等
D.11.2LCO2与常温常压下8.5gNH3所含分子数相等
8.质量数是37的原子,可能有
A.19个质子,18个中子,20个电子 B.18个质子,19个中子,18个电子
C.19个质子,18个中子,18个电子 D.17个质子,20个中子,18个电子
9.下列说法正确的是
A.抽滤时,用倾析法转移沉淀,再转移溶液,然后开大水龙头进行抽滤
B.一些有机溶剂苯、四氯化碳、乙醚等极易被引燃,使用时必须远离明火和热源
C.抽滤得阿司匹林粗产品后,先用冷水洗涤晶体,再用酒精洗涤,加快干燥
D.MnO2催化双氧水分解时,其用量和颗粒直径大小均会影响双氧水分解的速率
10.把碘从碘水里分离出来,有下列基本操作:①静置后分液,②充分振荡,③把碘水倒入分液漏斗,再加入萃取剂四氯化碳,④检验分液漏斗是否漏液。其正确的操作顺序是
A.①②③④ B.③①②④ C.④②③① D.④③②①
11.下列说法不正确的是
A.重结晶时,溶液冷却速度越慢得到的晶体颗粒越大
B.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
C.抽滤装置由布氏漏斗、吸滤瓶、安全瓶、抽气泵等仪器组成,工作的主要原理是抽气泵给吸滤瓶减压,导致装置内部的压强降低,使过滤的速度加快
D.硝酸钾饱和溶液冷却未出现结晶时,可以用玻棒充分磨擦器皿壁,促使晶体析出
12.月球上的每百吨He聚变所释放出的能量相当于目前人类一年消耗的能量,地球上氦元素主要以He的形式存在。已知一个12C原子的质量为a g,一个He原子的质量为b g,NA为阿伏加德罗常数的值。下列说法正确的是
A.He比He多一个中子 B.氦元素的近似相对原子质量为3
C.He的相对原子质量为 D.He的摩尔质量为2bNA
13.下列仪器不能用酒精灯直接加热的是
仪器
名称 小试管 蒸发皿 蒸馏烧瓶 坩埚
选项 A B C D
A.A B.B C.C D.D
14.美国UNC化学教授ThomasJ.Meyer等研发了环境友好、安全型的“绿色”引爆炸药,其中一种可表示为Na2R,它保存在水中可以失去活性,爆炸后不会产生危害性残留物。已知10mLNa2R溶液含Na+的数目为N,该Na2R溶液的物质的量浓度为
A.N×10-2mol·L-1 B.mol·L-1
C.mol·L-1 D.mol·L-1
15.碲(52Te)被誉为“国防与尖端技术的维生素”;锡酸钠(Na2SnO3)可用于制造陶瓷电容器的基体。以锡碲渣(主要含Na2SnO3和Na2TeO3)为原料,回收锡酸钠并制备碲单质的流程图如下,下列说法错误的是
已知:锡酸钠(Na2SnO3)和亚碲酸钠(Na2TeO3)均易溶于碱。
A.在生产过程中,要将锡碲渣粉碎,其目的是增大锡碲渣的碱浸速率和浸出率
B.“氧化”时,反应的离子方程式为
C.“氧化”的温度应该越高越好,因为温度越高化学反应速率越快
D.以石墨为电极电解Na2TeO3溶液可获得Te,电解过程中阴极上的电极反应为:
二、填空题(共8题)
16.选择下列一种方法分离物质,将分离方法的序号填在横线上.
A.萃取分液 B.升华 C.结晶 D.分液 E.蒸馏 F.过滤
(1)从溴水中提取溴______
(2)分离饱和食盐水与沙子的混合物______
(3)分离水和汽油的混合物______
(4)分离酒精(沸点为78.1℃)和甲苯(沸点为110.6℃)两种互溶液体______.
17.四个试剂瓶中分别装有NaNO3、Na2CO3、Na2SO4和NaCl溶液,为鉴别这四种溶液,分别取四种溶液各1 mL 于四支试管中,做下列实验。
(1)在四支试管中分别滴入足量_____,出现_____的是___________,反应的化学方程式是___________。
(2)在剩余三支试管中分别滴入___________,出现___________的是___________,反应的化学方程式是___________。
(3)再取剩余两支试管对应的溶液,分别滴入___________,出现___________,的是___________,反应的化学方程式是___________。
(4)三次实验中都没有明显现象的是___________。
18.现有A、B、C、D四种化合物,透过蓝色钴玻璃观察其焰色反应现象时发现火焰均为紫色,A、B、C和盐酸反应后,均可得到D;将固体C加热可制得A;若在A的溶液中通入一种无色无味气体,又可制得C;B与C的溶液混合可制得A。
(1)推断A是_____________(填化学式,下同),B是____________,C是_________,D是_______。
(2)写出B+C→A的化学方程式:___________。
19.如图所示中学化学中常见物质的实验转化过程,部分物质和反应条件略去。
(1)写出F的化学式______;写出物质A的一种用途______;
(2)写出单质B与强碱溶液反应的离子方程式______,写出沉淀J生成H溶液的离子方程式______;
(3)溶液E中加入氨水时,先生成白色沉淀L,写出生成L的离子方程式______;
(4)溶液I中所含金属离子是______。
20.化合物A(仅含三种元素,摩尔质量为 ),具有高效的消毒作用.为探究A的组成和性质,设计并完成下实验:
已知中和液进行焰色反应透过蓝色钻玻璃可以观察到火焰呈紫色,气体E能使带火星的木条复燃.
(1)化合物A中所含的元素为________;
(2)写出A与水反应的化学方程式________;
(3)检验中和液中的阴离子的实验操作为________.
21.某小组利用如图装置测定常温常压下的气体摩尔体积。取一定量已去除氧化膜的镁条放入烧瓶中,用注射器向烧瓶中注入硫酸溶液,反应后冷却至室温,使量气管与水准管液面相平,再读数.重复实验,数据如下:
序号 镁条质量/ 反应前量气管读数/ 反应后量气管读数/
1 0.0530 0.0 66.8
2 0.0540 0.0 67.0
3 0.0550 0.0 67.2
计算
(1)第1组实验反应后溶液中的物质的量浓度=_______(假设反应后溶液体积不变);
(2)常温常压下的气体摩尔体积=___________(保留三位有效数字) L·mol-1。
22.(1)已知1.204×1023 个 X 气体分子的质量是 6.4 g,则X 气体的摩尔质量是:_______;
(2)同温同压下,同体积的甲烷 CH4气体和CO气体质量之比为_______,质子数之比_______;
(3)相同质量的 SO2、SO3 的氧原子的个数之比为_______;
(4)V L Al2(SO4)3 溶液中含 Al3+ a mol,该 Al2(SO4)3 溶液的物质的量浓度为_____mol/L,取出 0.5V L 再加入水稀释到4V L,则稀释后的溶液中 SO的物质的量浓度为_____mol/L。
23.从铬铜废催化剂(主要含CuO·Cr2O3、少量有机物及水)中回收铬和铜的实验流程如下:
(1)700℃“焙烧”可使Cr2O3不溶于酸,焙烧的另一目的是_______
(2)配制“酸洗”所用100mL6mol·L-1硫酸需要的玻璃仪器有:量筒、烧杯、100mL容量瓶、_______和_______;为使研碎的烧渣中CuO充分溶解,应采取的措施是_______
(3)为确定xNa2SO4·yCr2(SO4)3·zH2O的组成,进行下列实验:
①称取样品1.9320g溶于水,加入足量盐酸酸化的BaCl2溶液,得到1.8640g沉淀。
②另称取样品1.9320g溶于水,经H2O2在碱性条件下氧化、煮沸、酸化得Na2Cr2O7和Na2SO4的混合酸性溶液;加入稍过量的KI溶液(+6I-+14H+ = 2Cr3++3I2+7H2O),暗处静置5min,立刻用0.5000mol·L-1Na2S2O3标准溶液滴定(2Na2S2O3+I2=2NaI+Na2S4O6)至溶液呈浅黄色,再加入1mL淀粉溶液,继续滴定至溶液蓝色刚好消失,消耗Na2S2O3溶液24.00mL。
根据上述实验数据,确定xNa2SO4·yCr2(SO4)3·zH2O的化学式(写出计算过程)___________。
参考答案
1.C 2.C 3.C 4.A 5.B 6.D 7.B 8.B 9.D 10.D 11.B 12.C 13.C 14.B 15.C
16.A F D E
17.稀硝酸 气泡 Na2CO3溶液 Na2CO3+2HNO3=2NaNO3+CO2↑+H2O Ba(NO3)2溶液 白色沉淀 Na2SO4溶液 Na2SO4+Ba(NO3)2=BaSO4↓+2NaNO3 AgNO3溶液 白色沉淀 NaCl溶液 NaCl+AgNO3=NaNO3+AgCl↓ NaNO3溶液
18. KOH KCl
19. 作油漆颜料,炼铁等 、
20.Fe、K、O 4K2FeO4+10H2O=4Fe(OH)3+8KOH+3O2↑ 取中和液少许放入试管中,向试管中滴加盐酸无变化,再加入氯化钡溶液,若产生白色沉淀说明溶液中含有硫酸根离子,否则溶液不含硫酸根离子;
21.5.56 mol/L 25.3
22.32g·mol-1 4:7 5:7 5:6 a/2V 3a/16V
23.将有机物及水除去 玻璃棒 胶头滴管 适当加热并搅拌 n(Na2SO4)+3n[Cr2(SO4)3]==0.0080mol,由发生的反应,可建立如下关系式:Cr2(SO4)3——Na2Cr2O7——3I2——6Na2S2O3,则n[Cr2(SO4)3]=n(Na2S2O3)= ×0.5000mol/L×0.02400L=0.0020mol,n(Na2SO4)= 0.0080mol-3×0.0020mol=0.0020mol,n(H2O)==0.0480mol,从而得出x:y:z=0.0020:0.0020:0.0480=1:1:24,盐的化学式为Na2SO4·Cr2(SO4)3·24H2O
