2021-2022学年高二化学人教版(2019)选择性必修2第三章《不同聚集状态的物质与性质》检测题(含答案)
文档属性
| 名称 | 2021-2022学年高二化学人教版(2019)选择性必修2第三章《不同聚集状态的物质与性质》检测题(含答案) | 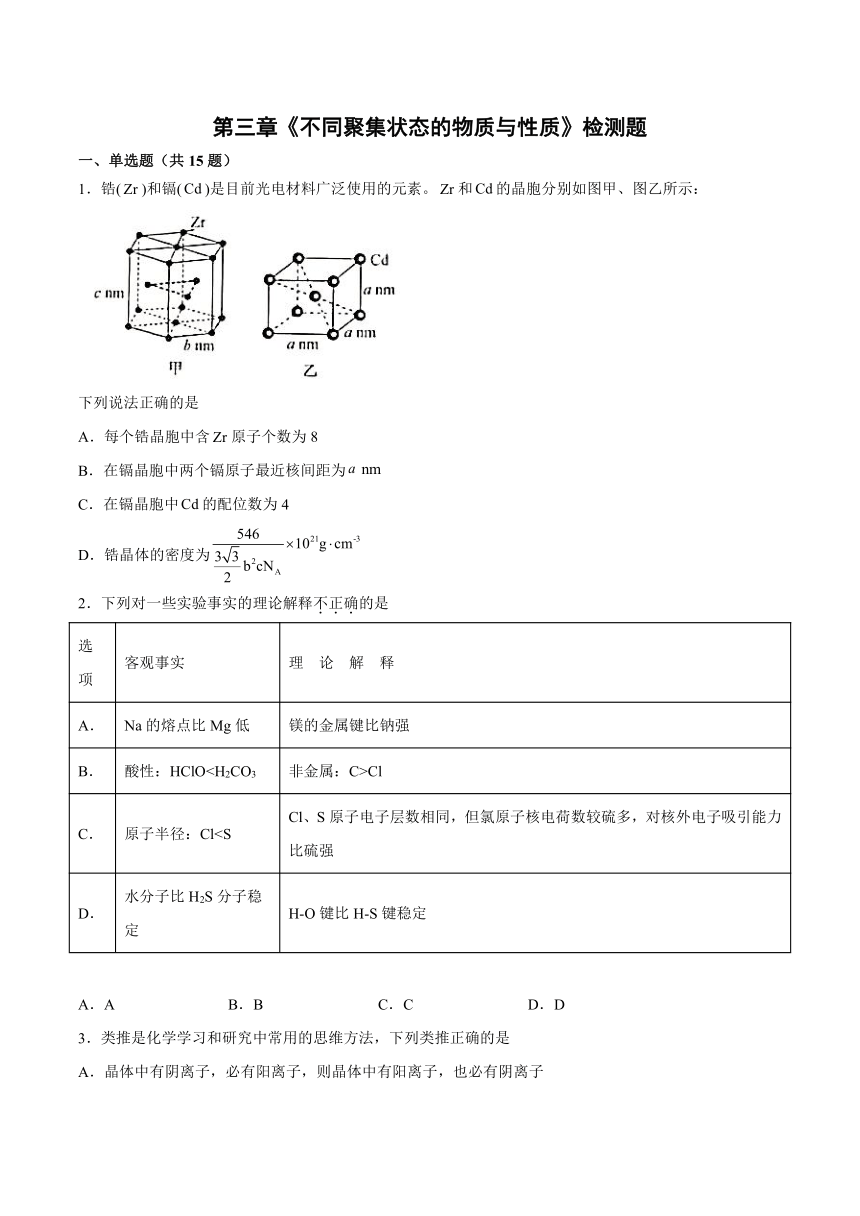 | |
| 格式 | docx | ||
| 文件大小 | 260.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-11 20:47:38 | ||
图片预览




文档简介
第三章《不同聚集状态的物质与性质》检测题
一、单选题(共15题)
1.锆()和镉()是目前光电材料广泛使用的元素。和的晶胞分别如图甲、图乙所示:
下列说法正确的是
A.每个锆晶胞中含原子个数为8
B.在镉晶胞中两个镉原子最近核间距为
C.在镉晶胞中的配位数为4
D.锆晶体的密度为
2.下列对一些实验事实的理论解释不正确的是
选项 客观事实 理 论 解 释
A. Na的熔点比Mg低 镁的金属键比钠强
B. 酸性:HClOCl
C. 原子半径:ClD. 水分子比H2S分子稳定 H-O键比H-S键稳定
A.A B.B C.C D.D
3.类推是化学学习和研究中常用的思维方法,下列类推正确的是
A.晶体中有阴离子,必有阳离子,则晶体中有阳离子,也必有阴离子
B.CuSO4溶液在空气中蒸干得到CuSO4固体,故Fe2(SO4)3溶液在空气中蒸干得到Fe2(SO4)3固体
C.适量CO2通入Ca(ClO)2溶液中可生成CaCO3和HClO,故适量SO2通入Ca(ClO)2溶液中可生成CaSO3和HClO
D.Fe和S反应生成FeS,则Cu和S反应生成CuS
4.碳有多种同分异构体,其中石墨烯与金刚石的晶体结构如图所示,下列说法不正确的是
A.在石墨烯晶体中,每个正六元环拥有的共价键和碳原子数比例为3:2
B.石墨晶体中的碳原子全部是碳碳单键
C.金刚石晶体中,碳原子采用sp3杂化
D.金刚石晶体中最小的碳环上有6个碳原子
5.表中数据是对应物质的熔点:
物质 干冰
熔点() 2073 920 801 1291 190 -107 -57 1723
据此做出的下列判断中正确的是
A.铝的化合物的晶体都是离子晶体
B.表中只有干冰和是分子晶体
C.同族元素的氧化物一定形成相同类型的晶体
D.不同族元素的氧化物可形成相同类型的晶体
6.美国Lawrece Liermore国家实验室成功地在高压下将转化为具有类似结构的原子晶体,下列关于的原子晶体说法,正确的是
A.的原子晶体和分子晶体互为同分异构体
B.在一定条件下,原子晶体转化为分子晶体是物理变化
C.的原子晶体和分子晶体具有相同的物理性质和化学性质
D.在的原子晶体中,每一个C原子结合4个O原子,每一个O原子跟两个C原子相结合
7.短周期主族元素X、Y、Z、W的原子序数依次增大,X和Y的基态原子的2p能级上各有两个未成对电子,Z元素基态原子的最高s能级电子数是其基态原子最低能级电子数的一半,W的原子半径在同周期中最小.下列说法正确的是
A.X、Y、Z、W四种元素组成的常见单质熔沸点依次升高
B.X、Y、Z、W四种元素中的某些元素既可组成含有非极性共价键的离子晶体,也能组成含有极性共价键的离子晶体
C.Z、W元素组成的物质其晶胞结构中Z的配位数为8
D.X元素的单质存在多种同素异形体,且熔点都很高
8.2021年5月15日,我国探测车“祝融号”成功登陆火星。其核心元器件封装用的是超轻的铝硅合金,下列说法错误的是
A.Si的电负性大于Al
B.和都属于分子晶体
C.Al和Si都位于元素周期表的同一个周期,金属和非金属交界处
D.由于硅原子最外层4个电子,相对稳定,在自然界中有单质硅存在
9.“中国芯”的主要原材料是高纯单晶硅,可通过反应SiCl4(g)+2H2(g)Si(s)+4HCl(g)制备高纯硅。下列有关说法正确的是
A.H2分子中含有非极性共价键
B.氯化氢的电子式:
C.单晶硅是传输信号所用光缆的主要成分
D.由图可知硅晶胞中硅原子的配位数为12
10.关于下列晶胞说法错误的是
A.离子晶体NaCl的晶胞结构如图甲所示,晶体中Cl-周围距离最近的Cl-个数为6
B.分子晶体CO2的晶胞结构如图乙所示,该晶胞中含有4个CO2
C.共价晶体金刚石的晶胞结构如图丙所示,该晶胞中含有8个C
D.金属晶体钠的晶胞结构如图丁所示,晶体中Na的配位数为8
11.类推的思维方法在化学学习与研究中可能会产生错误的结论,因此类推出的结论需经过实践的检验才能确定其正确与否。下列几种类推结论正确的是
A.金刚石中C—C键的键长为154.45pm,C60中C—C键的键长为140~145pm,所以C60的熔点高于金刚石
B.CO2晶体是分子晶体,SiO2晶体也是分子晶体
C.从CH4、NH、SO为正面体结构,可推测CC14、PH、PO也为正四面体结构
D.C2H6是碳链为直线形的非极性分子,可推测C3H8也是碳链为直线形的非极性分子
12.金刚石和石墨的物理性质存在着较大差异,原因是
A.他们各自的原子排列方式不同 B.它们是由不同种元素构成的
C.它们具有不同的几何外形 D.石墨能导电而金刚石不能
13.下面的排序错误的是
A.熔点由低到高:CF4碳化硅>晶体硅
C.第一电离能由大到小:A1>Mg>Na D.酸性强弱:HClO3>HClO2>HClO
二、非选择题(共10题)
14.有下列七种物质:
A.干冰 B.氧化镁 C.氯化铵 D.固态碘 E.烧碱 F.冰 G.过氧化钾
(1)熔化时需要破坏共价键和离子键的是___________(填字母,下同)。
(2)熔点最低的是___________。
(3)既有离子键又有共价键的是___________。
(4)只含有极性键的是___________。
(5)含非极性键的是___________。
15.我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO2固溶体。四方ZrO2晶胞如图所示。Zr4+离子在晶胞中的配位数是___________,晶胞参数为a pm、a pm、c pm,该晶体密度为___________g·cm-3(写出表达式)。在ZrO2中掺杂少量ZnO后形成的催化剂,化学式可表示为ZnxZr1-xOy,则y=___________(用x表达)。
16.A、B、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大.A元素可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1817kJ/mol,I3=2745kJ/mol,I4=11575kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为65,中子数为35.请回答下列问题:
(1)AY2是一种常用的溶剂,为_____________分子(填“极性”或“非极性”),分子中存在___________个σ键。
(2)X形成的单质与NaOH溶液反应的离子方程式为______________________________,超高导热绝缘耐高温纳米XB在绝缘材料中应用广泛,其晶体与金刚石类似,属于____晶体。
(3)X、氧、B元素的电负性由大到小的顺序为_______________(用元素符号作答)。
(4)Z的基态原子核外电子排布式为___________________________。
17.D、E、X、Y、Z是周期表中的前20号元素,且原子序数逐渐增大,它们的最简单氢化物分子的空间结构依次是正四面体、三角锥形、正四面体、角形(V形)、直线型,回答下列问题:
(1)Y的最高价氧化物的化学式为______________。
(2)上述5种元素中,能形成酸性最强的含氧酸的元素是____________(填元素符号),写出该元素的任意3种含氧酸的化学式:_______________________。
(3)D和Y形成的化合物,其分子的空间构型为________________。
(4)D和X形成的化合物,其化学键类型属_______________,其晶体类型属________。
(5)金属镁和E的单质在高温下反应得到的产物是__________,此产物与水反应生成两种碱,该反应的化学方程式是___________________________。
(6)试比较D和X的最高价氧化物熔点的高低,并说明理由:________________。
18.A、B、C、W、X、Y、Z是由周期表中短周期元素组成的七种物质,其中A、B、C是三种固体单质,W、X、Y、Z是由两种元素组成的化合物。它们之间的转化关系如图所示(所有反应物和生成物均在框图中):
回答下列问题:
(1)化合物Z的晶体类型属于__________晶体。
(2)写出单质C的一种用途__________________________________。
(3)航天科技测知化合物N是金星大气层的成分之一,组成化合物N的元素与W相同。已知N中两种元素的质量之比为2:1,N的相对原子质量小于80,则N的化学式为_____________。又知该分子中的每个原子都满足最外层8电子的稳定结构,试写出其电子式_________________。
(4)写出下列反应的化学方程式:
①__________________________________;
②__________________________________。
19.随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定的精度也越来越高。现有一种简单可行的测定方法,具体步骤为:
①将NaCl固体研细、干燥后,准确称取mgNaCl固体并转移到定容仪器A中。
②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度,计算出NaCl固体的体积为Vcm3。
(1)步骤①中仪器A最好使用___(填序号)。
A.量筒B.烧杯C.容量瓶D.试管
(2)步骤②中是用酸式滴定管还是用碱式滴定管___,理由是___。
(3)能否用水代替苯___(填“是”或“否”),理由是___。
(4)已知NaCl晶体中,靠得最近的Na+、Cl﹣间的距离为acm(如图),则用上述方法测得的阿伏加德常数NA的表达式为___。
20.青蒿素是烃的含氧衍生物,为无色针状晶体,在乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素60℃以上易分解,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃。从青蒿中提取青蒿素的方法之一是以萃取原理为基础的。
(1)青篙素在超临界CO2中有很强的溶解性,萃取青蒿素________(填”能”或“不能”)用超临界CO2作萃取剂;中医古籍《肘后备急方》中“青蒿一握,以水二升渍,绞取汁,尽服之”______(填“是”或“不是”)为了提取纤维素。现有四氯化碳(沸点76.5℃)和乙醚两种溶剂,应选用__________作为萃取剂;青蒿素组成元素中电负性较大的两种元素第一电离能由大到小排序为__________(填元素符号)。
(2)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与_________(填字母)具有相似的性质。说明青蒿素的结构中含有_______(填官能团名称)。
A.乙醇 B.乙酸乙酯 C.乙酸 D.酰胺 E.葡萄糖
(3)青蒿素的质谱数据中有一个峰值与另一种抗疟药鹰爪素相同,而鹰爪素的该质谱峰对应过氧基团,于是推测青蒿素中含有_____(填粒子的电子式)。青蒿素所属晶体类型为_________。1974年中科院上海有机所和生物物理研究所在研究青蒿素功能基团的过程中,屠呦呦团队发明了双氢青蒿素。从青蒿素到生成双氢青蒿素发生了_____反应。
(4)科学家对H2O2分子结构的认识经历了较为漫长的过程,最初科学家提出了两种观点:甲:、 乙: H—O—O—H,甲式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的分子结构,设计并完成了下列实验:
a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;
b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;
c.将生成的A与H2反应(已知该反应中H2作还原剂)。
①如果H2O2的结构如甲所示,实验c中化学反应方程式为(A写结构简式)________。
②为了进一步确定H2O2的结构,还需要在实验c后添加一步实验d,请设计d的实验方案:_______________________。
21.根据晶胞结构示意图,计算晶胞的体积或密度。
(1)N和Cu元素形成的化合物的晶胞结构如图所示,则该化合物的化学式为____。该化合物的相对分子质量为M,NA为阿伏加德罗常数的值。若该晶胞的边长为a cm,则该晶体的密度是______g·cm-3。
(2)S与Cu形成化合物晶体的晶胞如图所示。已知该晶体的密度为a g·cm-3,则该晶胞中硫原子的个数为______的体积为______cm3(NA表示阿伏加德罗常数的值)。
22.某气态烃A和B按2:3(体积比)混合后,取0.1mol混合烃与一定量氧气混合燃烧,产物为CO、CO2和水蒸气,将燃烧产物依次通过足量的浓硫酸、灼热的CuO及碱石灰,最后碱石灰增重7.04g,求A和B可能的分子式。
23.现有甲、乙、丙三种晶体的晶胞(甲中X处于晶胞的中心,乙中A处于晶胞的中心),可推知:甲晶体中X与Y的个数比是___________,乙中A与B的个数比是___________,丙晶胞中有___________个C离子,有___________个D离子。
甲晶体的化学式是___________(X为阳离子)。丙晶胞中距离C离子等距离且最近的D离子有___________个。
参考答案
1.D 2.B 3.B 4.B 5.D 6.D 7.B 8.D 9.A 10.A 11.C 12.A 13.C
14.C A CEG AF DG 15.8 2-x
16.非极性 2 2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑ 原子 O>N>Al 1s22s22p63s23p63d104s2或[Ar] 3d104s2
17. Cl HClO、HClO2、HClO3 直线型 共价键 原子晶体 Mg3N2 Mg3N2+6H2O3Mg(OH)2↓+2NH3↑ SiO2的熔点CO2比高。因为前者为原子晶体,由共价键结合,而后者为分子晶体,由分子间的作用力结合,共价键之间的作用力远大于分子间的作用力
18.原子 计算机芯片(或硅太阳能电池、半导体材料等) C2O3 2Mg+CO22MgO+C 2C+SiO22CO↑+Si
19.C 酸式滴定管 碱式滴定管的橡胶管会溶于苯而变形 否 水会溶解NaCl,无法准确测出NaCl固体的体积
20.能 不是 乙醚 O>C BD 酯基 过氧基 分子晶体 加成反应(或还原反应) +H2→C2H5OC2H5+H2O 用无水硫酸铜检验c的反应产物中有没有水
21.Cu3N 4
22.A的分子式为CH4,B的分子式可能为C2H6或C2H4或C2H2
23.4∶3 1∶1 4 4 X4Y3 6
一、单选题(共15题)
1.锆()和镉()是目前光电材料广泛使用的元素。和的晶胞分别如图甲、图乙所示:
下列说法正确的是
A.每个锆晶胞中含原子个数为8
B.在镉晶胞中两个镉原子最近核间距为
C.在镉晶胞中的配位数为4
D.锆晶体的密度为
2.下列对一些实验事实的理论解释不正确的是
选项 客观事实 理 论 解 释
A. Na的熔点比Mg低 镁的金属键比钠强
B. 酸性:HClO
C. 原子半径:Cl
A.A B.B C.C D.D
3.类推是化学学习和研究中常用的思维方法,下列类推正确的是
A.晶体中有阴离子,必有阳离子,则晶体中有阳离子,也必有阴离子
B.CuSO4溶液在空气中蒸干得到CuSO4固体,故Fe2(SO4)3溶液在空气中蒸干得到Fe2(SO4)3固体
C.适量CO2通入Ca(ClO)2溶液中可生成CaCO3和HClO,故适量SO2通入Ca(ClO)2溶液中可生成CaSO3和HClO
D.Fe和S反应生成FeS,则Cu和S反应生成CuS
4.碳有多种同分异构体,其中石墨烯与金刚石的晶体结构如图所示,下列说法不正确的是
A.在石墨烯晶体中,每个正六元环拥有的共价键和碳原子数比例为3:2
B.石墨晶体中的碳原子全部是碳碳单键
C.金刚石晶体中,碳原子采用sp3杂化
D.金刚石晶体中最小的碳环上有6个碳原子
5.表中数据是对应物质的熔点:
物质 干冰
熔点() 2073 920 801 1291 190 -107 -57 1723
据此做出的下列判断中正确的是
A.铝的化合物的晶体都是离子晶体
B.表中只有干冰和是分子晶体
C.同族元素的氧化物一定形成相同类型的晶体
D.不同族元素的氧化物可形成相同类型的晶体
6.美国Lawrece Liermore国家实验室成功地在高压下将转化为具有类似结构的原子晶体,下列关于的原子晶体说法,正确的是
A.的原子晶体和分子晶体互为同分异构体
B.在一定条件下,原子晶体转化为分子晶体是物理变化
C.的原子晶体和分子晶体具有相同的物理性质和化学性质
D.在的原子晶体中,每一个C原子结合4个O原子,每一个O原子跟两个C原子相结合
7.短周期主族元素X、Y、Z、W的原子序数依次增大,X和Y的基态原子的2p能级上各有两个未成对电子,Z元素基态原子的最高s能级电子数是其基态原子最低能级电子数的一半,W的原子半径在同周期中最小.下列说法正确的是
A.X、Y、Z、W四种元素组成的常见单质熔沸点依次升高
B.X、Y、Z、W四种元素中的某些元素既可组成含有非极性共价键的离子晶体,也能组成含有极性共价键的离子晶体
C.Z、W元素组成的物质其晶胞结构中Z的配位数为8
D.X元素的单质存在多种同素异形体,且熔点都很高
8.2021年5月15日,我国探测车“祝融号”成功登陆火星。其核心元器件封装用的是超轻的铝硅合金,下列说法错误的是
A.Si的电负性大于Al
B.和都属于分子晶体
C.Al和Si都位于元素周期表的同一个周期,金属和非金属交界处
D.由于硅原子最外层4个电子,相对稳定,在自然界中有单质硅存在
9.“中国芯”的主要原材料是高纯单晶硅,可通过反应SiCl4(g)+2H2(g)Si(s)+4HCl(g)制备高纯硅。下列有关说法正确的是
A.H2分子中含有非极性共价键
B.氯化氢的电子式:
C.单晶硅是传输信号所用光缆的主要成分
D.由图可知硅晶胞中硅原子的配位数为12
10.关于下列晶胞说法错误的是
A.离子晶体NaCl的晶胞结构如图甲所示,晶体中Cl-周围距离最近的Cl-个数为6
B.分子晶体CO2的晶胞结构如图乙所示,该晶胞中含有4个CO2
C.共价晶体金刚石的晶胞结构如图丙所示,该晶胞中含有8个C
D.金属晶体钠的晶胞结构如图丁所示,晶体中Na的配位数为8
11.类推的思维方法在化学学习与研究中可能会产生错误的结论,因此类推出的结论需经过实践的检验才能确定其正确与否。下列几种类推结论正确的是
A.金刚石中C—C键的键长为154.45pm,C60中C—C键的键长为140~145pm,所以C60的熔点高于金刚石
B.CO2晶体是分子晶体,SiO2晶体也是分子晶体
C.从CH4、NH、SO为正面体结构,可推测CC14、PH、PO也为正四面体结构
D.C2H6是碳链为直线形的非极性分子,可推测C3H8也是碳链为直线形的非极性分子
12.金刚石和石墨的物理性质存在着较大差异,原因是
A.他们各自的原子排列方式不同 B.它们是由不同种元素构成的
C.它们具有不同的几何外形 D.石墨能导电而金刚石不能
13.下面的排序错误的是
A.熔点由低到高:CF4
C.第一电离能由大到小:A1>Mg>Na D.酸性强弱:HClO3>HClO2>HClO
二、非选择题(共10题)
14.有下列七种物质:
A.干冰 B.氧化镁 C.氯化铵 D.固态碘 E.烧碱 F.冰 G.过氧化钾
(1)熔化时需要破坏共价键和离子键的是___________(填字母,下同)。
(2)熔点最低的是___________。
(3)既有离子键又有共价键的是___________。
(4)只含有极性键的是___________。
(5)含非极性键的是___________。
15.我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO2固溶体。四方ZrO2晶胞如图所示。Zr4+离子在晶胞中的配位数是___________,晶胞参数为a pm、a pm、c pm,该晶体密度为___________g·cm-3(写出表达式)。在ZrO2中掺杂少量ZnO后形成的催化剂,化学式可表示为ZnxZr1-xOy,则y=___________(用x表达)。
16.A、B、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大.A元素可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1817kJ/mol,I3=2745kJ/mol,I4=11575kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为65,中子数为35.请回答下列问题:
(1)AY2是一种常用的溶剂,为_____________分子(填“极性”或“非极性”),分子中存在___________个σ键。
(2)X形成的单质与NaOH溶液反应的离子方程式为______________________________,超高导热绝缘耐高温纳米XB在绝缘材料中应用广泛,其晶体与金刚石类似,属于____晶体。
(3)X、氧、B元素的电负性由大到小的顺序为_______________(用元素符号作答)。
(4)Z的基态原子核外电子排布式为___________________________。
17.D、E、X、Y、Z是周期表中的前20号元素,且原子序数逐渐增大,它们的最简单氢化物分子的空间结构依次是正四面体、三角锥形、正四面体、角形(V形)、直线型,回答下列问题:
(1)Y的最高价氧化物的化学式为______________。
(2)上述5种元素中,能形成酸性最强的含氧酸的元素是____________(填元素符号),写出该元素的任意3种含氧酸的化学式:_______________________。
(3)D和Y形成的化合物,其分子的空间构型为________________。
(4)D和X形成的化合物,其化学键类型属_______________,其晶体类型属________。
(5)金属镁和E的单质在高温下反应得到的产物是__________,此产物与水反应生成两种碱,该反应的化学方程式是___________________________。
(6)试比较D和X的最高价氧化物熔点的高低,并说明理由:________________。
18.A、B、C、W、X、Y、Z是由周期表中短周期元素组成的七种物质,其中A、B、C是三种固体单质,W、X、Y、Z是由两种元素组成的化合物。它们之间的转化关系如图所示(所有反应物和生成物均在框图中):
回答下列问题:
(1)化合物Z的晶体类型属于__________晶体。
(2)写出单质C的一种用途__________________________________。
(3)航天科技测知化合物N是金星大气层的成分之一,组成化合物N的元素与W相同。已知N中两种元素的质量之比为2:1,N的相对原子质量小于80,则N的化学式为_____________。又知该分子中的每个原子都满足最外层8电子的稳定结构,试写出其电子式_________________。
(4)写出下列反应的化学方程式:
①__________________________________;
②__________________________________。
19.随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定的精度也越来越高。现有一种简单可行的测定方法,具体步骤为:
①将NaCl固体研细、干燥后,准确称取mgNaCl固体并转移到定容仪器A中。
②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度,计算出NaCl固体的体积为Vcm3。
(1)步骤①中仪器A最好使用___(填序号)。
A.量筒B.烧杯C.容量瓶D.试管
(2)步骤②中是用酸式滴定管还是用碱式滴定管___,理由是___。
(3)能否用水代替苯___(填“是”或“否”),理由是___。
(4)已知NaCl晶体中,靠得最近的Na+、Cl﹣间的距离为acm(如图),则用上述方法测得的阿伏加德常数NA的表达式为___。
20.青蒿素是烃的含氧衍生物,为无色针状晶体,在乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素60℃以上易分解,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃。从青蒿中提取青蒿素的方法之一是以萃取原理为基础的。
(1)青篙素在超临界CO2中有很强的溶解性,萃取青蒿素________(填”能”或“不能”)用超临界CO2作萃取剂;中医古籍《肘后备急方》中“青蒿一握,以水二升渍,绞取汁,尽服之”______(填“是”或“不是”)为了提取纤维素。现有四氯化碳(沸点76.5℃)和乙醚两种溶剂,应选用__________作为萃取剂;青蒿素组成元素中电负性较大的两种元素第一电离能由大到小排序为__________(填元素符号)。
(2)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与_________(填字母)具有相似的性质。说明青蒿素的结构中含有_______(填官能团名称)。
A.乙醇 B.乙酸乙酯 C.乙酸 D.酰胺 E.葡萄糖
(3)青蒿素的质谱数据中有一个峰值与另一种抗疟药鹰爪素相同,而鹰爪素的该质谱峰对应过氧基团,于是推测青蒿素中含有_____(填粒子的电子式)。青蒿素所属晶体类型为_________。1974年中科院上海有机所和生物物理研究所在研究青蒿素功能基团的过程中,屠呦呦团队发明了双氢青蒿素。从青蒿素到生成双氢青蒿素发生了_____反应。
(4)科学家对H2O2分子结构的认识经历了较为漫长的过程,最初科学家提出了两种观点:甲:、 乙: H—O—O—H,甲式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的分子结构,设计并完成了下列实验:
a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;
b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;
c.将生成的A与H2反应(已知该反应中H2作还原剂)。
①如果H2O2的结构如甲所示,实验c中化学反应方程式为(A写结构简式)________。
②为了进一步确定H2O2的结构,还需要在实验c后添加一步实验d,请设计d的实验方案:_______________________。
21.根据晶胞结构示意图,计算晶胞的体积或密度。
(1)N和Cu元素形成的化合物的晶胞结构如图所示,则该化合物的化学式为____。该化合物的相对分子质量为M,NA为阿伏加德罗常数的值。若该晶胞的边长为a cm,则该晶体的密度是______g·cm-3。
(2)S与Cu形成化合物晶体的晶胞如图所示。已知该晶体的密度为a g·cm-3,则该晶胞中硫原子的个数为______的体积为______cm3(NA表示阿伏加德罗常数的值)。
22.某气态烃A和B按2:3(体积比)混合后,取0.1mol混合烃与一定量氧气混合燃烧,产物为CO、CO2和水蒸气,将燃烧产物依次通过足量的浓硫酸、灼热的CuO及碱石灰,最后碱石灰增重7.04g,求A和B可能的分子式。
23.现有甲、乙、丙三种晶体的晶胞(甲中X处于晶胞的中心,乙中A处于晶胞的中心),可推知:甲晶体中X与Y的个数比是___________,乙中A与B的个数比是___________,丙晶胞中有___________个C离子,有___________个D离子。
甲晶体的化学式是___________(X为阳离子)。丙晶胞中距离C离子等距离且最近的D离子有___________个。
参考答案
1.D 2.B 3.B 4.B 5.D 6.D 7.B 8.D 9.A 10.A 11.C 12.A 13.C
14.C A CEG AF DG 15.8 2-x
16.非极性 2 2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑ 原子 O>N>Al 1s22s22p63s23p63d104s2或[Ar] 3d104s2
17. Cl HClO、HClO2、HClO3 直线型 共价键 原子晶体 Mg3N2 Mg3N2+6H2O3Mg(OH)2↓+2NH3↑ SiO2的熔点CO2比高。因为前者为原子晶体,由共价键结合,而后者为分子晶体,由分子间的作用力结合,共价键之间的作用力远大于分子间的作用力
18.原子 计算机芯片(或硅太阳能电池、半导体材料等) C2O3 2Mg+CO22MgO+C 2C+SiO22CO↑+Si
19.C 酸式滴定管 碱式滴定管的橡胶管会溶于苯而变形 否 水会溶解NaCl,无法准确测出NaCl固体的体积
20.能 不是 乙醚 O>C BD 酯基 过氧基 分子晶体 加成反应(或还原反应) +H2→C2H5OC2H5+H2O 用无水硫酸铜检验c的反应产物中有没有水
21.Cu3N 4
22.A的分子式为CH4,B的分子式可能为C2H6或C2H4或C2H2
23.4∶3 1∶1 4 4 X4Y3 6
