2021-2022学年鲁科版(2019)高中化学选择性必修2第三章《不同聚集状态的物质与性质》检测题(含答案 )
文档属性
| 名称 | 2021-2022学年鲁科版(2019)高中化学选择性必修2第三章《不同聚集状态的物质与性质》检测题(含答案 ) |  | |
| 格式 | docx | ||
| 文件大小 | 557.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-11 20:47:57 | ||
图片预览


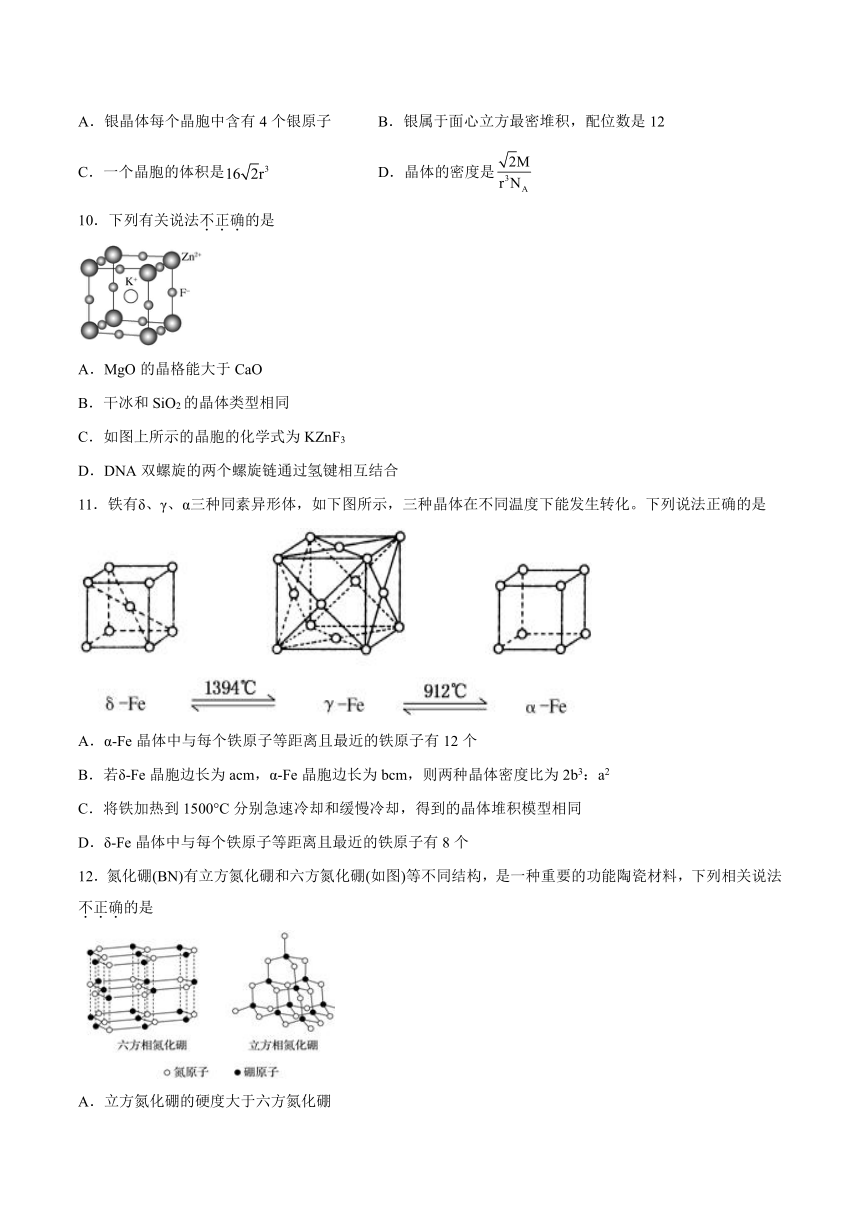

文档简介
第三章《不同聚集状态的物质与性质》检测题
一、单选题(共15题)
1.下列叙述正确的是
A.第二周期主族元素原子半径从左到右依次减小
B.第三周期元素的氯化物所属晶体类型相同
C.短周期第IA族与VIIA族元素构成的物质均含离子键
D.元素周期表中位于金属与非金属分界线附近的元素属于过渡元素
2.下列说法正确的是
A.干冰属于原子晶体
B.CH4分子中含有极性共价键,所以是极性分子
C.所有的金属元素都分布在d区和ds区
D.离子键、氢键、范德华力本质上都是静电作用
3.下列各组物质熔点高低的比较,正确的是
A. B.
C.晶体硅>金刚石>碳化硅 D.
4.碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:下列说法正确的是
A.三种单质的晶体中C60晶体熔点最低
B.假设金刚石晶体中最近碳原子相切,则晶胞的空间利用率为74%
C.均为原子晶体
D.C原子杂化方式均为sp3
5.关于下列晶胞说法错误的是
A.金属晶体钠的晶胞结构如图丁所示,晶体中Na的配位数为8
B.分子晶体CO2的晶胞结构如图乙所示,该晶胞中含有4个CO2
C.共价晶体金刚石的晶胞结构如图丙所示,该晶胞中含有8个C
D.离子晶体NaCl的晶胞结构如图甲所示,晶体中Cl-周围距离最近的Cl-个数为6
6.下列叙述错误的是
A.、的中心原子杂化轨道类型相同
B.与N2结构相似,分子中σ键与π键个数之比为2∶1
C.熔点:
D.晶体中存在离子,离子的空间构型为V形
7.根据如图几种晶体结构,下列说法中错误的是
A.钛酸钙的化学式为
B.在金刚石晶体中,碳原子与碳碳键()数目之比为
C.硒化锌晶体中与一个距离最近且相等的有8个
D.中与距离最近的所形成的键的夹角为
8.下列叙述正确的是
A.正四面体构型的分子中,键与键之间的夹角均是109°28’
B.因为C的相对原子质量小于Si,所以金刚石的熔点小于晶体硅
C.石英晶体中存在的最小环为不共面12元环
D.稀有气体的晶体属于原子晶体,因为其组成微粒为原子
9.银晶体的晶胞如图所示。设银原子的半径为r,用表示阿伏加德罗常数,M表示银的摩尔质量。则下列说法错误的是
A.银晶体每个晶胞中含有4个银原子 B.银属于面心立方最密堆积,配位数是12
C.一个晶胞的体积是 D.晶体的密度是
10.下列有关说法不正确的是
A.MgO的晶格能大于CaO
B.干冰和SiO2的晶体类型相同
C.如图上所示的晶胞的化学式为KZnF3
D.DNA双螺旋的两个螺旋链通过氢键相互结合
11.铁有δ、γ、α三种同素异形体,如下图所示,三种晶体在不同温度下能发生转化。下列说法正确的是
A.α-Fe晶体中与每个铁原子等距离且最近的铁原子有12个
B.若δ-Fe晶胞边长为acm,α-Fe晶胞边长为bcm,则两种晶体密度比为2b3:a2
C.将铁加热到1500°C分别急速冷却和缓慢冷却,得到的晶体堆积模型相同
D.δ-Fe晶体中与每个铁原子等距离且最近的铁原子有8个
12.氮化硼(BN)有立方氮化硼和六方氮化硼(如图)等不同结构,是一种重要的功能陶瓷材料,下列相关说法不正确的是
A.立方氮化硼的硬度大于六方氮化硼
B.在六方氮化硼中,实线、虚线均代表共价键
C.立方氮化硼晶胞中,B原子配位数是4
D.在一定条件下,六方氮化硼可转化为立方氮化硼
13.下列有关物质结构和性质的比较中,不正确的是
A.酸性: B.键角:
C.熔点: D.稳定性:
二、非选择题(共10题)
14.回答以下问题:
(1)金属Cu晶体采取的是以下___________(填序号)面心立方最密堆积方式。
(2)CuSO4晶体类型为___________晶体。的空间构型为___________(填“正四面体”、“直线型”或“平面三角”)。
(3)如图所示,(代表Cu原子,代表O原子),一个Cu2O晶胞中Cu原子的数目为___________。
(4)鉴别晶体与非晶体最科学的实验方法为:___________。
15.选择以下物体填写下列空白
A干冰B氯化铵C烧碱D固体碘
(1)晶体中存在分子的是__________填写序号,下同)
(2)晶体中既有离子键又有共价键的是_________
(3)熔化时不需要破坏共价键的是_________
(4)常况下能升华的_________
16.(1)酸碱质子理论认为:凡是能给出质子(H+)的任何物质都是酸,凡是能接受质子(H+)的任何物质都是碱。则CH3CH3、OH-、HCl、F-中属于碱的是 _______,用一个离子方程式说明它们结合质子能力的相对强弱_______。
(2)化合物A、B、C的熔点如表:
A B C
化学式 CH3CH2Cl CH3CH2CH2Cl CH3NH3Cl
熔点/℃ -139 -123 230
化合物C的熔点明显高于A的原因是 _______。
17.在1到20号元素中,已知五种元素的核电荷数的大小顺序为F>A>B>D>E;A、F具有相同的电子层B、F具有相同的最外层电子数;A与B形成离子化合物A2B,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子分子。
(1)写出D元素形成的单质的结构式______;E、F和B三种元素形成的化合物属于____(填晶体类型);写出B和E形成的化合物的化学式__________。
(2)在标准状况下,1克E的单质在足量的B的单质中完全反应,放出142.9kJ的热量,写出该反应的热化学方程式_______________________。
(3)元素Y的原子质子数比A多9,假如Y形成的强碱式量为M,把质量为mg的该强碱,在一定条件下,完全溶解在水中得到VmL饱和溶液,若此溶液的密度为,则该溶液中OH-离子的物质的量浓度为_______。
18.现有X、Y、Z、T四种短周期元素,原子序数依次增大。请根据下列相关信息,回答问题。
元素 相关信息
X 原子的1s轨道上只有1个电子
Y 原子的L层上s电子数等于p电子数
Z 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的
T 负二价的元素T的氢化物在通常情况下是一种液体,且T的质量分数为88.9%
(1) Z2X4分子中Z原子采取________杂化,写出与之互为等电子体的有机物的结构简式_____________________
(2) Cl2T分子的空间构型___________, Z2T的电子式_________________
(3) 请用价层电子对互斥理论解释ZX和ZX3的键角∠XZX的大小:_____________。
(4) Y晶体的晶胞如图所示,该晶胞含有______个Y原子,若晶胞的密度为d g·cm-3,阿伏加德罗常数的值为NA(mol-1),则晶胞参数为a=_______ pm。(用含d 、NA的式子表示)
19.下列装置中有机物样品在电炉中充分燃烧,通过测定生成的CO2和H2O的质量,来确定有机物分子式。
(1)A装置是提供实验所需的O2,B装置中浓硫酸的作用是______;C中CuO的作用是_______。
(2)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.44 g样品,经充分反应后,D管质量增加0.36g,E管质量增加0.88 g,已知该物质的相对分子质量为44,则该样品的化学式为___。
(3)若该有机物的核磁共振氢谱如下图所示,峰面积之比为1∶3,则其结构简式为_____;该有机物官能团的名称为_________。
(4)若该有机物只有一种类型的氢原子,则结构简式为_____
20.实验室用燃烧法测定某氨基酸(CxHyOzNp)的分子组成,取w g该氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现用如图所示装置进行实验(铁架台、铁夹、酒精灯等未画出),请回答有关问题:
(1)该装置的合理连接顺序是_________________(填序号)。
(2)实验中止水夹a是关闭的,b是开启的。但实验开始时,首先要打开夹a,关闭夹b,通一段时间的纯氧,这样做的目的是_____。
(3)以上装置中需要加热的有___________(填装置代号)。操作时应先点燃__________处的酒精灯。
(4)实验中测得N2的体积为VmL(已换算成标准状况),为确定此氨基酸的分子式,还需要得到的数据有____(填字母)。
A 生成二氧化碳气体的质量 B 生成水的质量
C 通入氧气的体积 D 该氨基酸的相对分子质量
21.根据晶胞结构示意图,计算晶胞的体积或密度。
(1)N和Cu元素形成的化合物的晶胞结构如图所示,则该化合物的化学式为___________。该化合物的相对分子质量为M,NA为阿伏加德罗常数的值。若该晶胞的边长为a pm,则该晶体的密度是___________g·pm-3。
(2)S与Cu形成化合物晶体的晶胞如图所示。已知该晶体的密度为a g·cm-3,则该晶胞的体积为___________cm3(NA表示阿伏加德罗常数的值)。
22.K2S的晶胞结构如图所示。其中K+的配位数为___________,S2-的配位数为___________;若晶胞中距离最近的两个S2-核间距为acm,则K2S晶体的密度为___________g·cm-3(列出计算式,不必计算出结果)。
23.回答下列问题。
(1)新型钙钛矿太阳能电池具备更加清洁、便于应用、制造成本低和效率高等显著优点。一种钙钛矿太阳能电池材料的晶胞如图所示。
该钙钛矿太阳能电池材料的化学式为______;该晶胞中,与I﹣紧邻的I﹣个数为__________。
(2)金属钼晶体中的原子堆积方式如图所示,若晶体钼的密度为ρ g·cm-3,钼原子半径为r pm,NA表示阿伏加德罗常数的值,M表示钼的相对原子质量,则钼晶胞中原子的空间利用率为________(用含有ρ、r、NA、M的代数式表示)。
(3)阿伏加德罗常数的测定有多种方法,X﹣射线衍射法就是其中的一种。通过对碲化锌晶体的X﹣射线衍射图像分析,可以得出其晶胞如图 所示。若晶体中 Te 呈立方面心最密堆积方式排列,Te 的原子半径为 a pm,晶体的密度为 ρ g·cm-3,碲化锌的摩尔质量为193g· mol-1 ,则阿伏加德罗常数 NA= _________mol-1 (列计算式表达)
(4)氮化钛的晶胞如图1所示,图2是氮化钛的晶胞截面图。NA是阿伏加德罗常数的值,氮化钛的摩尔质量为62 g· mol-1,氮化钛晶体密度为d g·cm-3,计算氮化钛晶胞中N原子半径为_________ pm。
参考答案
1.A 2.D 3.B 4.A 5.D 6.C 7.C 8.C 9.D 10.B 11.D 12.B 13.A
14.④ 离子晶体 正四面体 4 X-射线衍射实验
15.AD BC ABCD AD
16.OH-、F- HF+OH-=F-+H2O A是分子晶体,C是离子晶体,离子键比分子间作用力强
17.N≡N 分子晶体 H2O、H2O2 2H2(g)+O2(g)=2H2O(l) =-571.6kJ/mol mol/L
18.sp3 CH3OH或 CH3SH V型 中N原子孤电子对数为2,NH3中N原子孤电子对数为1,孤对电子与成键电子间的斥力大于成键电子与成键电子间的斥力,孤对电子数前者多,排斥作用强,所以前者键角小 8
19.吸收水蒸气,干燥氧气 使有机物充分氧化生成CO2 C2H4O CH3CHO 醛基
20.AEBDC 将装置中的空气排净 A和D D ABD
21.Cu3N
22.4 8
23.PbCH3NH3I3 8 ×100%
一、单选题(共15题)
1.下列叙述正确的是
A.第二周期主族元素原子半径从左到右依次减小
B.第三周期元素的氯化物所属晶体类型相同
C.短周期第IA族与VIIA族元素构成的物质均含离子键
D.元素周期表中位于金属与非金属分界线附近的元素属于过渡元素
2.下列说法正确的是
A.干冰属于原子晶体
B.CH4分子中含有极性共价键,所以是极性分子
C.所有的金属元素都分布在d区和ds区
D.离子键、氢键、范德华力本质上都是静电作用
3.下列各组物质熔点高低的比较,正确的是
A. B.
C.晶体硅>金刚石>碳化硅 D.
4.碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:下列说法正确的是
A.三种单质的晶体中C60晶体熔点最低
B.假设金刚石晶体中最近碳原子相切,则晶胞的空间利用率为74%
C.均为原子晶体
D.C原子杂化方式均为sp3
5.关于下列晶胞说法错误的是
A.金属晶体钠的晶胞结构如图丁所示,晶体中Na的配位数为8
B.分子晶体CO2的晶胞结构如图乙所示,该晶胞中含有4个CO2
C.共价晶体金刚石的晶胞结构如图丙所示,该晶胞中含有8个C
D.离子晶体NaCl的晶胞结构如图甲所示,晶体中Cl-周围距离最近的Cl-个数为6
6.下列叙述错误的是
A.、的中心原子杂化轨道类型相同
B.与N2结构相似,分子中σ键与π键个数之比为2∶1
C.熔点:
D.晶体中存在离子,离子的空间构型为V形
7.根据如图几种晶体结构,下列说法中错误的是
A.钛酸钙的化学式为
B.在金刚石晶体中,碳原子与碳碳键()数目之比为
C.硒化锌晶体中与一个距离最近且相等的有8个
D.中与距离最近的所形成的键的夹角为
8.下列叙述正确的是
A.正四面体构型的分子中,键与键之间的夹角均是109°28’
B.因为C的相对原子质量小于Si,所以金刚石的熔点小于晶体硅
C.石英晶体中存在的最小环为不共面12元环
D.稀有气体的晶体属于原子晶体,因为其组成微粒为原子
9.银晶体的晶胞如图所示。设银原子的半径为r,用表示阿伏加德罗常数,M表示银的摩尔质量。则下列说法错误的是
A.银晶体每个晶胞中含有4个银原子 B.银属于面心立方最密堆积,配位数是12
C.一个晶胞的体积是 D.晶体的密度是
10.下列有关说法不正确的是
A.MgO的晶格能大于CaO
B.干冰和SiO2的晶体类型相同
C.如图上所示的晶胞的化学式为KZnF3
D.DNA双螺旋的两个螺旋链通过氢键相互结合
11.铁有δ、γ、α三种同素异形体,如下图所示,三种晶体在不同温度下能发生转化。下列说法正确的是
A.α-Fe晶体中与每个铁原子等距离且最近的铁原子有12个
B.若δ-Fe晶胞边长为acm,α-Fe晶胞边长为bcm,则两种晶体密度比为2b3:a2
C.将铁加热到1500°C分别急速冷却和缓慢冷却,得到的晶体堆积模型相同
D.δ-Fe晶体中与每个铁原子等距离且最近的铁原子有8个
12.氮化硼(BN)有立方氮化硼和六方氮化硼(如图)等不同结构,是一种重要的功能陶瓷材料,下列相关说法不正确的是
A.立方氮化硼的硬度大于六方氮化硼
B.在六方氮化硼中,实线、虚线均代表共价键
C.立方氮化硼晶胞中,B原子配位数是4
D.在一定条件下,六方氮化硼可转化为立方氮化硼
13.下列有关物质结构和性质的比较中,不正确的是
A.酸性: B.键角:
C.熔点: D.稳定性:
二、非选择题(共10题)
14.回答以下问题:
(1)金属Cu晶体采取的是以下___________(填序号)面心立方最密堆积方式。
(2)CuSO4晶体类型为___________晶体。的空间构型为___________(填“正四面体”、“直线型”或“平面三角”)。
(3)如图所示,(代表Cu原子,代表O原子),一个Cu2O晶胞中Cu原子的数目为___________。
(4)鉴别晶体与非晶体最科学的实验方法为:___________。
15.选择以下物体填写下列空白
A干冰B氯化铵C烧碱D固体碘
(1)晶体中存在分子的是__________填写序号,下同)
(2)晶体中既有离子键又有共价键的是_________
(3)熔化时不需要破坏共价键的是_________
(4)常况下能升华的_________
16.(1)酸碱质子理论认为:凡是能给出质子(H+)的任何物质都是酸,凡是能接受质子(H+)的任何物质都是碱。则CH3CH3、OH-、HCl、F-中属于碱的是 _______,用一个离子方程式说明它们结合质子能力的相对强弱_______。
(2)化合物A、B、C的熔点如表:
A B C
化学式 CH3CH2Cl CH3CH2CH2Cl CH3NH3Cl
熔点/℃ -139 -123 230
化合物C的熔点明显高于A的原因是 _______。
17.在1到20号元素中,已知五种元素的核电荷数的大小顺序为F>A>B>D>E;A、F具有相同的电子层B、F具有相同的最外层电子数;A与B形成离子化合物A2B,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子分子。
(1)写出D元素形成的单质的结构式______;E、F和B三种元素形成的化合物属于____(填晶体类型);写出B和E形成的化合物的化学式__________。
(2)在标准状况下,1克E的单质在足量的B的单质中完全反应,放出142.9kJ的热量,写出该反应的热化学方程式_______________________。
(3)元素Y的原子质子数比A多9,假如Y形成的强碱式量为M,把质量为mg的该强碱,在一定条件下,完全溶解在水中得到VmL饱和溶液,若此溶液的密度为,则该溶液中OH-离子的物质的量浓度为_______。
18.现有X、Y、Z、T四种短周期元素,原子序数依次增大。请根据下列相关信息,回答问题。
元素 相关信息
X 原子的1s轨道上只有1个电子
Y 原子的L层上s电子数等于p电子数
Z 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的
T 负二价的元素T的氢化物在通常情况下是一种液体,且T的质量分数为88.9%
(1) Z2X4分子中Z原子采取________杂化,写出与之互为等电子体的有机物的结构简式_____________________
(2) Cl2T分子的空间构型___________, Z2T的电子式_________________
(3) 请用价层电子对互斥理论解释ZX和ZX3的键角∠XZX的大小:_____________。
(4) Y晶体的晶胞如图所示,该晶胞含有______个Y原子,若晶胞的密度为d g·cm-3,阿伏加德罗常数的值为NA(mol-1),则晶胞参数为a=_______ pm。(用含d 、NA的式子表示)
19.下列装置中有机物样品在电炉中充分燃烧,通过测定生成的CO2和H2O的质量,来确定有机物分子式。
(1)A装置是提供实验所需的O2,B装置中浓硫酸的作用是______;C中CuO的作用是_______。
(2)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.44 g样品,经充分反应后,D管质量增加0.36g,E管质量增加0.88 g,已知该物质的相对分子质量为44,则该样品的化学式为___。
(3)若该有机物的核磁共振氢谱如下图所示,峰面积之比为1∶3,则其结构简式为_____;该有机物官能团的名称为_________。
(4)若该有机物只有一种类型的氢原子,则结构简式为_____
20.实验室用燃烧法测定某氨基酸(CxHyOzNp)的分子组成,取w g该氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现用如图所示装置进行实验(铁架台、铁夹、酒精灯等未画出),请回答有关问题:
(1)该装置的合理连接顺序是_________________(填序号)。
(2)实验中止水夹a是关闭的,b是开启的。但实验开始时,首先要打开夹a,关闭夹b,通一段时间的纯氧,这样做的目的是_____。
(3)以上装置中需要加热的有___________(填装置代号)。操作时应先点燃__________处的酒精灯。
(4)实验中测得N2的体积为VmL(已换算成标准状况),为确定此氨基酸的分子式,还需要得到的数据有____(填字母)。
A 生成二氧化碳气体的质量 B 生成水的质量
C 通入氧气的体积 D 该氨基酸的相对分子质量
21.根据晶胞结构示意图,计算晶胞的体积或密度。
(1)N和Cu元素形成的化合物的晶胞结构如图所示,则该化合物的化学式为___________。该化合物的相对分子质量为M,NA为阿伏加德罗常数的值。若该晶胞的边长为a pm,则该晶体的密度是___________g·pm-3。
(2)S与Cu形成化合物晶体的晶胞如图所示。已知该晶体的密度为a g·cm-3,则该晶胞的体积为___________cm3(NA表示阿伏加德罗常数的值)。
22.K2S的晶胞结构如图所示。其中K+的配位数为___________,S2-的配位数为___________;若晶胞中距离最近的两个S2-核间距为acm,则K2S晶体的密度为___________g·cm-3(列出计算式,不必计算出结果)。
23.回答下列问题。
(1)新型钙钛矿太阳能电池具备更加清洁、便于应用、制造成本低和效率高等显著优点。一种钙钛矿太阳能电池材料的晶胞如图所示。
该钙钛矿太阳能电池材料的化学式为______;该晶胞中,与I﹣紧邻的I﹣个数为__________。
(2)金属钼晶体中的原子堆积方式如图所示,若晶体钼的密度为ρ g·cm-3,钼原子半径为r pm,NA表示阿伏加德罗常数的值,M表示钼的相对原子质量,则钼晶胞中原子的空间利用率为________(用含有ρ、r、NA、M的代数式表示)。
(3)阿伏加德罗常数的测定有多种方法,X﹣射线衍射法就是其中的一种。通过对碲化锌晶体的X﹣射线衍射图像分析,可以得出其晶胞如图 所示。若晶体中 Te 呈立方面心最密堆积方式排列,Te 的原子半径为 a pm,晶体的密度为 ρ g·cm-3,碲化锌的摩尔质量为193g· mol-1 ,则阿伏加德罗常数 NA= _________mol-1 (列计算式表达)
(4)氮化钛的晶胞如图1所示,图2是氮化钛的晶胞截面图。NA是阿伏加德罗常数的值,氮化钛的摩尔质量为62 g· mol-1,氮化钛晶体密度为d g·cm-3,计算氮化钛晶胞中N原子半径为_________ pm。
参考答案
1.A 2.D 3.B 4.A 5.D 6.C 7.C 8.C 9.D 10.B 11.D 12.B 13.A
14.④ 离子晶体 正四面体 4 X-射线衍射实验
15.AD BC ABCD AD
16.OH-、F- HF+OH-=F-+H2O A是分子晶体,C是离子晶体,离子键比分子间作用力强
17.N≡N 分子晶体 H2O、H2O2 2H2(g)+O2(g)=2H2O(l) =-571.6kJ/mol mol/L
18.sp3 CH3OH或 CH3SH V型 中N原子孤电子对数为2,NH3中N原子孤电子对数为1,孤对电子与成键电子间的斥力大于成键电子与成键电子间的斥力,孤对电子数前者多,排斥作用强,所以前者键角小 8
19.吸收水蒸气,干燥氧气 使有机物充分氧化生成CO2 C2H4O CH3CHO 醛基
20.AEBDC 将装置中的空气排净 A和D D ABD
21.Cu3N
22.4 8
23.PbCH3NH3I3 8 ×100%
