2021-2022学年高二上学期化学鲁科版(2019)选择性必修1第三章《物质在水溶液中的行为》测试题(含答案)
文档属性
| 名称 | 2021-2022学年高二上学期化学鲁科版(2019)选择性必修1第三章《物质在水溶液中的行为》测试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 441.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-11 20:48:50 | ||
图片预览




文档简介
第三章《物质在水溶液中的行为》测试题
一、单选题(共15题)
1.下列各组离子在指定环境中能大量共存的是
A.在c()=0.1 mol L 1的溶液中:K+、、Cl-、
B.在常温下由水电离出的c(OH-)=1×10 12 mol L 1的溶液中:Fe2+、ClO-、Na+、
C.在加入苯酚会显紫色的溶液中:、Cl-、Na+、SCN-
D.在能使蓝色石蕊试纸变红的溶液中:、、Na+、K+
2.常温下,往的溶液中通入HCl或加入NaOH固体调节溶液的pH(忽略体积变化),溶液中随pH变化的曲线如图。下列说法正确的是
A.水的电离程度:
B.
C.c点溶液中存在:
D.d点溶液中存在:
3.某溶液中可能含有Na+、SO、SO、Cl-、Br-、CO、HCO中的一种或多种,进行如图所示的实验,每次实验所加试剂均过量。下列说法正确的是
A.一定有SO B.不能确定是否含有HCO
C.可能存在Br- D.肯定存在的离子有Na+、CO、HCO
4.向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中含硫各微粒(H2S、HS-、S2-)的分布分数(平衡时某微粒的浓度占各种微粒浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出)。下列说法正确的是
A.X点对应溶液中:c(Na+)>3[c(H2S)+c(HS—)+c(S2—)]
B.若知Y点处的pH,可计算出Ka2(H2S)
C.已知NaHS溶液呈碱性,若向NaHS溶液中加入CuSO4溶液至恰好完全反应,所得溶液呈强酸性
D.X、Y点对应溶液中水的电离程度大小关系为:X5.下列离子方程式表达正确的是
A.氢氧化铁溶于氢碘酸:
B.小苏打溶液呈碱性的原因:
C.溴化亚铁溶液中通入足量氯气:
D.向硫酸铝铵溶液中滴加少量溶液:
6.某溶液中含有Al3+、Fe2+、Cu2+、Ag+等离子,为了逐一将其沉淀并过滤,可采取:①通入H2S;②通入CO2,③加HCl溶液,④加NaOH溶液这4个步骤,若试剂均过量,其正确的操作顺序是
A.③①④② B.①③④② C.④②①③ D.④②③①
7.下列离子在溶液中一定能大量共存的一组是
A.c(Fe3+)=1.0mol·L-1的溶液中:Na+、K+、、
B.能使甲基橙变红的溶液中:Na+、、、
C.mol·L-1的溶液中:Na+、Ca2+、、Cl-
D.水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、、
8.设NA为阿伏加德罗常数的值,下列叙述正确的是
A.密闭容器中,1molN2和3molH2充分催化反应后分子总数为2NA
B.1L0.1mol·L-1NH4Cl溶液中,NH的数量为0.1NA
C.1molNa与足量O2反应生成Na2O和Na2O2的混合物,转移的电子数为NA
D.25℃时,1LpH=13的Ba(OH)2溶液中,含有的OH-数目为0.2NA
9.试剂可以鉴别乙醇、乙醛、乙酸、甲酸四种无色溶液
A.新制Cu(OH)2悬浊液 B.浓溴水
C.银氨溶液 D.FeCl3溶液
10.把NaCl晶体溶于水充分搅拌后,溶液中仍有晶体存在,下列说法正确的是
A.溶解过程停止 B.此时溶解速率等于结晶速率
C.此时溶质不再溶解 D.溶解过程停止
11.羟胺()是一种还原剂。现用羟胺的酸性溶液与足量硫酸铁溶液反应,生成的用酸性溶液滴定,达到滴定终点,消耗溶液。下列有关叙述正确的是
A.羟胺的氧化产物是
B.还原性:羟胺
C.与酸性溶液反应时,氧化剂与还原剂的物质的量之比为
D.滴定过程中,可用溶液作指示剂
12.向1L含0.01mol AlCl3和0.01mol HCl的溶液中缓慢通入NH3随n(NH3)增大,先后发生两个不同的反应,下列对应关系正确的是
选项 n(NH3) /mol 溶液中离子的物质的量浓度
A 0 c( Al3+ )+c(H+)=c(Cl-)+c(OH-)
B 0.01 c(Cl- )>c( Al3+ )>c( H+ )>c( NH)
C 0.04. c(Cl-)=c(NH3·H2O) +c(NH)
D 0.04 c( NH)>c(Cl- )>c( OH- )>c(H+)
A.A B.B C.C D.D
13.以硼镁泥(主要成分是MgO,还含有Na2B4O7、CaO、Fe2O3、FeO、SiO2等杂质)制取七水硫酸镁的工艺流程如图:
已知:CaSO4和MgSO4的溶解度数据如表,下列说法错误的是
温度 20 40 50 60 80
MgSO4溶解度/g 25.1 30.8 32.9 34.3 34.9
CaSO4溶解度/g 0.231 0.210 0.207 0.201 0.193
A.Na2B4O7中B的化合价为+3
B.“操作A”为蒸发浓缩、冷却结晶、过滤
C.加入MgO的目的是:调节溶液的pH值,使Fe3+转化为Fe(OH)3除去
D.NaClO的作用为将溶液中的Fe2+转化为Fe3+
14.氨基酸分子中含有—NH2和COOH两种官能团,氨基酸分子表面不带电荷时的pH称为等电点,等电点时甘氨酸(H3NCH2COO- )记作HA.已知H2AHAA- ,pK= -1g K。25℃时用NaOH溶液滴定。pH=0的甘氨酸,甘氨酸被滴定的百分数[被滴定的百分数=×100%]与溶液pH的关系如图所示,下列说法错误的是
A.X点时,c(HA) =c(A- )
B.Y点的pH=(pK1+ pK2)/2
C.从Y点到Z点的过程中发生的反应为HA +OH-= A- +H2O
D.—COO- 结合H+的能力比—NH2的弱
15.下列有关说法正确的是
A.298K时,反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的ΔH<0
B.表示硫的燃烧热的热化学方程式:S(s)+O2(g)=SO3(g) ΔH=-315kJ/mol
C.在硫酸钡悬浊液中加入足量饱和Na2CO3溶液处理,向所得沉淀中加入盐酸有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3)
D.常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同
二、填空题(共8题)
16.下列三组物质中,均有一种物质的类别与其他三种不同。
①MgO、Na2O、CO2、CuO ②HCl、H2O、H2SO4、HNO3 ③NaOH、Na2CO3、KOH、Cu(OH)2
(1)三种物质依次是(填化学式): A___________;B___________;C___________。
(2)这三种物质相互作用可生成一种新物质,写出其反应的化学方程式:___________
(3)写出物质 C 与足量稀硫酸反应的离子方程式:___________。
(4)与 H+、OH-在溶液中都不能大量共存,试用离子方程式说明___________、___________。
17.弱电解质的研究是重要课题。
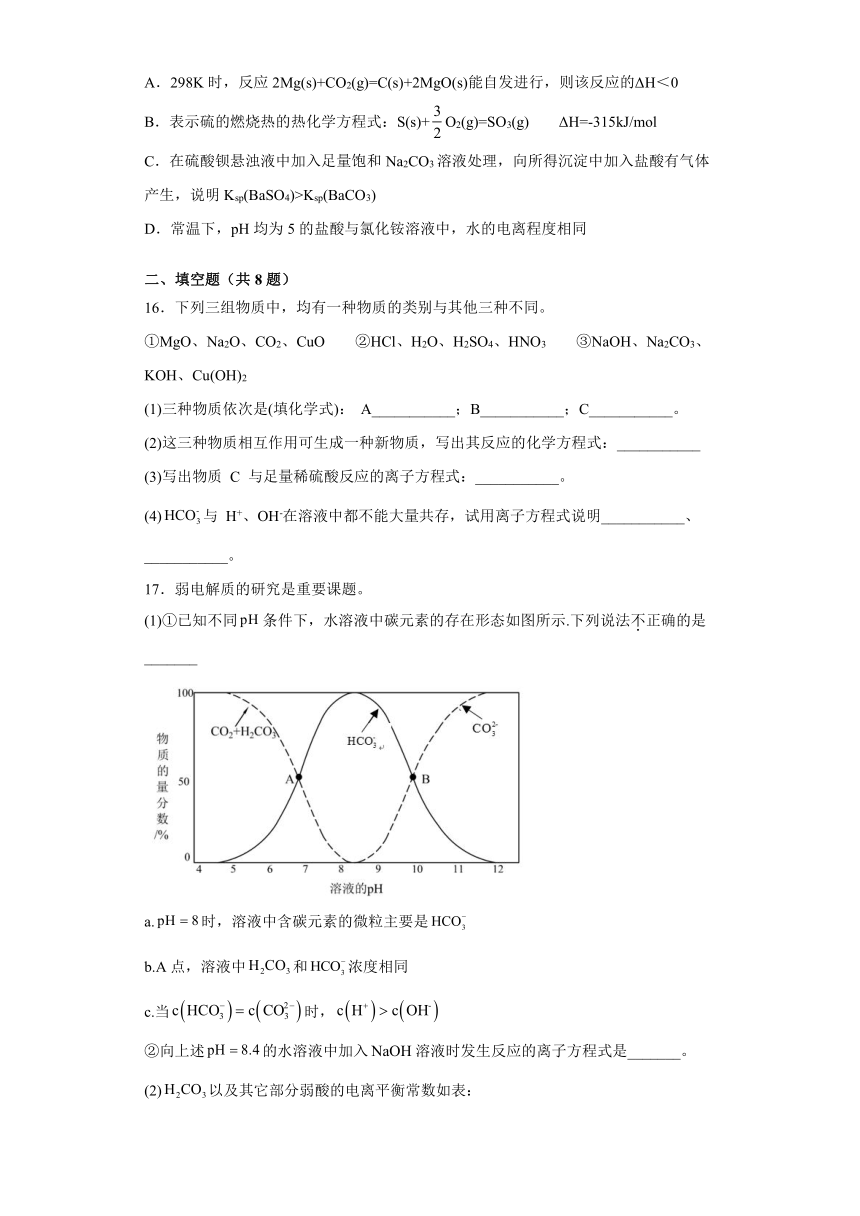
(1)①已知不同条件下,水溶液中碳元素的存在形态如图所示.下列说法不正确的是_______
a.时,溶液中含碳元素的微粒主要是
b.A点,溶液中和浓度相同
c.当时,
②向上述的水溶液中加入溶液时发生反应的离子方程式是_______。
(2)以及其它部分弱酸的电离平衡常数如表:
弱酸
电离平衡常数
按要求回答下列问题:
①的酸性由强到弱的顺序为_______。
②将少量气体通入溶液中,写出该反应的离子方程式:_______。
(3)常温下,已知一元酸溶液中。
①常温下,溶液的_______;
②的与的溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是:_______。
18.某化学课外活动小组欲制取纯Na2CO3溶液并讨论实验过程中的相关问题。可供选择的试剂有:
A.大理石 B.盐酸 C.氢氧化钠溶液 D.澄清石灰水
三名同学设计的制备纯Na2CO3的溶液的实验方案的反应流程分别如下:
甲:NaOH溶液Na2CO3溶液
乙:NaOH溶液NaHCO3溶液Na2CO3固体Na2CO3溶液
丙:NaOH溶液NaHCO3溶液Na2CO3溶液
(1)请指出甲、乙两方案的主要缺点:
甲方案:___________;
乙方案:___________。
(2)若采用丙方案制取纯Na2CO3溶液,其实验的关键是:___________。
(3)假设反应②所得的Na2CO3固体中混有未分解的NaHCO3,乙同学选择澄清石灰水测定其中NaHCO3的质量分数,乙同学___________(填“能”或“不能”)达到实验目的:若能,请说明计算所需的数据;若不能,请简要说明理由;___________。
(4)已知物质的量浓度均为0.10mol/L的NaHCO3、Na2CO3和Na2S溶液pH如下:
溶液 NaHCO3 Na2CO3 Na2S
pH 8.3 11.6 12.5
①Na2CO3水溶液呈碱性的原因是___________(用离子方程式表示)。NaHCO3溶液中滴加酚酞溶液显___________色,原因是___________;微热溶液颜色变深,可能的原因是___________(结合离子方程式说明)。
②从表中数据可知,K2CO3溶液中c(CO)___________K2S溶液中的c(S2-)(填“>”“<”或“=”)。
19.二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的消毒剂,是一种黄绿色的气体,易溶于水,沸点为11℃。
(1)用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如图所示:
①写出电解时发生反应的化学方程式:___。
②ClO2的消毒效率(以转移电子数目的多少为依据)是等物质的量的Cl2的___倍。
(2)产品中ClO2含量的测量:向锥形瓶中加入由适量碘化钾、3mL硫酸组成的混合溶液,将上述反应过程中生成的一部分ClO2气体通入锥形瓶中充分反应。再加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定(I2+2=2I-+S,通入的气体中不存在能与I2、反应的成分),共用去VmL硫代硫酸钠溶液。
①请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式:___。
②滴定终点的现象是___。
③测得通入ClO2的质量m(ClO2)=___(用含c、V的代数式表示)。
20.现有含有少量NaCl、Na2SO4、Na2CO3等杂质的NaNO3溶液,选择适当地试剂除去杂质,得到纯净的NaNO3固体,实验流程如图所示。
(1)沉淀A的主要成分是_______、________(填化学式)。
(2)②中相关的离子方程式为________;③中加入过量的Na2CO3溶液的目的是_______。
(3)溶液3经过处理可以得到NaNO3固体,溶液3中肯定含有的杂质是_______,为了除去杂质,可向溶液3中加入适量的_______溶液。
21.(1)常温下,稀释0.5mol/L的醋酸溶液过程中,溶液中随着加水量的增加,c(OH-)___(填“增大”、“减小”、或“不变”)。
(2)常温下0.01mol·L-1HCl溶液中c(H+)=___,pH=____;常温下0.01mol·L-1NaOH溶液:pH=___。
(3)pH=3的盐酸稀释100倍,pH___5(填“>”、“=”、或“<”)。
(4)pH=13的强碱溶液与pH=2的强酸溶液混合pH=7,则强碱与强酸的体积比为___。
22.某实验小组欲测定某软锰矿样品中,MnO2的质量分数。称取软锰矿样品0.1000g,对样品进行如下处理:
①用过氧化钠处理,得到MnO溶液;
②煮沸溶液,除去剩余的过氧化物;
③酸化溶液,MnO歧化为MnO和MnO2;
④滤去MnO2;
⑤用0.100mol L-1Fe2+标准溶液滴定滤液中MnO,共用去20.80mL。
计算:
(1)滤液中MnO的物质的量___mol。
(2)样品中MnO2的质量分数___(用百分数表示,保留1位小数)。
23.化合物M{ [(CH3COO)2Cr]2·2H2O,相对分子质量为376}不溶于冷水,是常用的氧气吸收剂。实验室中以锌粒、三氧化铬溶液、醋酸钠溶液和盐酸为主要原料制备该化合物,其装置如图所示,且仪器2中预先加入锌粒。已知二价铬不稳定,极易被氧气氧化,不与锌反应。制备过程中发生的相关反应如下:
Zn(s)+2HCl(aq)═ZnCl2(aq)+H2(g)
2CrCl3(aq)+Zn(s)═2CrCl2(aq)+ZnCl2(aq)
2Cr2+(aq)+4CH3COO-(aq)+2H2O(l)═[Cr(CH3COO)2]2 2H2O(s)
请回答下列问题:
(1)仪器1的名称是___________;
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是___________ (填序号);目的是___________。
A.盐酸和三氯化铬溶液同时加入
B.先加三氯化铬溶液,一段时间后再加盐酸
C.先加盐酸,一段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与醋酸钠溶液顺利混合,应关闭阀门___________(填“A”或“B”,下同),打开阀门___________。
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与醋酸钠溶液反应外,另一个作用是___________。
(5)铬的离子会污染水,常温下要除去上述实验中多余的Cr2+,最好往废液中通入足量的___________,再加入碱液,调节pH至少为___________才能使铬的离子沉淀完全(铬的离子浓度应小于10-5mol/L)。(已知Cr(OH)3的溶度积为6.3×10-31,=4,lg2≈0.3)
参考答案
1.A 2.A 3.D 4.C 5.C 6.A 7.B 8.C 9.A 10.B 11.B 12.C 13.B 14.A 15.A
16.CO2 H2O Na2CO3 CO2+H2O+Na2CO3=2NaHCO3 2H+ +CO=H2O+CO2↑ + H+= H2O+CO2↑ +OH-= H2O+ CO
17.bc 3
18.
(1) CO2的通入量不易控制 过程繁琐,操作复杂
(2)反应①应充分进行,①步骤后将NaHCO3溶液煮沸排除过量CO2,反应①②所用NaOH溶液的体积应相等
(3) 能 固体样品的质量和沉淀总质量
(4) CO+H2OHCO+OH- 浅红 酚酞的变色范围为8.2~10.0,而0.10mol/L的NaHCO3溶液的pH为8.3 CO水解:CO+H2OHCO+OH-,该反应为吸热反应,升高温度,促进水解,c(OH-)增大,碱性增强,颜色加深; >
19.NH4Cl+2HCl3H2↑+NCl3 2.5 8H++2ClO2+10I-=5I2+2Cl-+4H2O 蓝色消失并在30s内不复原 13.5cV×10-3g
20.BaSO4 BaCO3 Ag++Cl-=AgCl↓ 除去过量的Ba(NO3)2和AgNO3 Na2CO3 HNO3
21.增大 0.01mol·L-1 2 12 = 1:10
22.4.16×10-4 54.3%
23.
(1)分液漏斗
(2) C 先利用锌与盐酸反应产生的氢气排出装置内的空气创造还原性气氛,然后锌与三氯化铬反应生成二价铬离子
(3) B A
(4)使锌与CrCl3充分反应得到CrCl2
(5) 氧气 5.3
一、单选题(共15题)
1.下列各组离子在指定环境中能大量共存的是
A.在c()=0.1 mol L 1的溶液中:K+、、Cl-、
B.在常温下由水电离出的c(OH-)=1×10 12 mol L 1的溶液中:Fe2+、ClO-、Na+、
C.在加入苯酚会显紫色的溶液中:、Cl-、Na+、SCN-
D.在能使蓝色石蕊试纸变红的溶液中:、、Na+、K+
2.常温下,往的溶液中通入HCl或加入NaOH固体调节溶液的pH(忽略体积变化),溶液中随pH变化的曲线如图。下列说法正确的是
A.水的电离程度:
B.
C.c点溶液中存在:
D.d点溶液中存在:
3.某溶液中可能含有Na+、SO、SO、Cl-、Br-、CO、HCO中的一种或多种,进行如图所示的实验,每次实验所加试剂均过量。下列说法正确的是
A.一定有SO B.不能确定是否含有HCO
C.可能存在Br- D.肯定存在的离子有Na+、CO、HCO
4.向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中含硫各微粒(H2S、HS-、S2-)的分布分数(平衡时某微粒的浓度占各种微粒浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出)。下列说法正确的是
A.X点对应溶液中:c(Na+)>3[c(H2S)+c(HS—)+c(S2—)]
B.若知Y点处的pH,可计算出Ka2(H2S)
C.已知NaHS溶液呈碱性,若向NaHS溶液中加入CuSO4溶液至恰好完全反应,所得溶液呈强酸性
D.X、Y点对应溶液中水的电离程度大小关系为:X
A.氢氧化铁溶于氢碘酸:
B.小苏打溶液呈碱性的原因:
C.溴化亚铁溶液中通入足量氯气:
D.向硫酸铝铵溶液中滴加少量溶液:
6.某溶液中含有Al3+、Fe2+、Cu2+、Ag+等离子,为了逐一将其沉淀并过滤,可采取:①通入H2S;②通入CO2,③加HCl溶液,④加NaOH溶液这4个步骤,若试剂均过量,其正确的操作顺序是
A.③①④② B.①③④② C.④②①③ D.④②③①
7.下列离子在溶液中一定能大量共存的一组是
A.c(Fe3+)=1.0mol·L-1的溶液中:Na+、K+、、
B.能使甲基橙变红的溶液中:Na+、、、
C.mol·L-1的溶液中:Na+、Ca2+、、Cl-
D.水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、、
8.设NA为阿伏加德罗常数的值,下列叙述正确的是
A.密闭容器中,1molN2和3molH2充分催化反应后分子总数为2NA
B.1L0.1mol·L-1NH4Cl溶液中,NH的数量为0.1NA
C.1molNa与足量O2反应生成Na2O和Na2O2的混合物,转移的电子数为NA
D.25℃时,1LpH=13的Ba(OH)2溶液中,含有的OH-数目为0.2NA
9.试剂可以鉴别乙醇、乙醛、乙酸、甲酸四种无色溶液
A.新制Cu(OH)2悬浊液 B.浓溴水
C.银氨溶液 D.FeCl3溶液
10.把NaCl晶体溶于水充分搅拌后,溶液中仍有晶体存在,下列说法正确的是
A.溶解过程停止 B.此时溶解速率等于结晶速率
C.此时溶质不再溶解 D.溶解过程停止
11.羟胺()是一种还原剂。现用羟胺的酸性溶液与足量硫酸铁溶液反应,生成的用酸性溶液滴定,达到滴定终点,消耗溶液。下列有关叙述正确的是
A.羟胺的氧化产物是
B.还原性:羟胺
C.与酸性溶液反应时,氧化剂与还原剂的物质的量之比为
D.滴定过程中,可用溶液作指示剂
12.向1L含0.01mol AlCl3和0.01mol HCl的溶液中缓慢通入NH3随n(NH3)增大,先后发生两个不同的反应,下列对应关系正确的是
选项 n(NH3) /mol 溶液中离子的物质的量浓度
A 0 c( Al3+ )+c(H+)=c(Cl-)+c(OH-)
B 0.01 c(Cl- )>c( Al3+ )>c( H+ )>c( NH)
C 0.04. c(Cl-)=c(NH3·H2O) +c(NH)
D 0.04 c( NH)>c(Cl- )>c( OH- )>c(H+)
A.A B.B C.C D.D
13.以硼镁泥(主要成分是MgO,还含有Na2B4O7、CaO、Fe2O3、FeO、SiO2等杂质)制取七水硫酸镁的工艺流程如图:
已知:CaSO4和MgSO4的溶解度数据如表,下列说法错误的是
温度 20 40 50 60 80
MgSO4溶解度/g 25.1 30.8 32.9 34.3 34.9
CaSO4溶解度/g 0.231 0.210 0.207 0.201 0.193
A.Na2B4O7中B的化合价为+3
B.“操作A”为蒸发浓缩、冷却结晶、过滤
C.加入MgO的目的是:调节溶液的pH值,使Fe3+转化为Fe(OH)3除去
D.NaClO的作用为将溶液中的Fe2+转化为Fe3+
14.氨基酸分子中含有—NH2和COOH两种官能团,氨基酸分子表面不带电荷时的pH称为等电点,等电点时甘氨酸(H3NCH2COO- )记作HA.已知H2AHAA- ,pK= -1g K。25℃时用NaOH溶液滴定。pH=0的甘氨酸,甘氨酸被滴定的百分数[被滴定的百分数=×100%]与溶液pH的关系如图所示,下列说法错误的是
A.X点时,c(HA) =c(A- )
B.Y点的pH=(pK1+ pK2)/2
C.从Y点到Z点的过程中发生的反应为HA +OH-= A- +H2O
D.—COO- 结合H+的能力比—NH2的弱
15.下列有关说法正确的是
A.298K时,反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的ΔH<0
B.表示硫的燃烧热的热化学方程式:S(s)+O2(g)=SO3(g) ΔH=-315kJ/mol
C.在硫酸钡悬浊液中加入足量饱和Na2CO3溶液处理,向所得沉淀中加入盐酸有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3)
D.常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同
二、填空题(共8题)
16.下列三组物质中,均有一种物质的类别与其他三种不同。
①MgO、Na2O、CO2、CuO ②HCl、H2O、H2SO4、HNO3 ③NaOH、Na2CO3、KOH、Cu(OH)2
(1)三种物质依次是(填化学式): A___________;B___________;C___________。
(2)这三种物质相互作用可生成一种新物质,写出其反应的化学方程式:___________
(3)写出物质 C 与足量稀硫酸反应的离子方程式:___________。
(4)与 H+、OH-在溶液中都不能大量共存,试用离子方程式说明___________、___________。
17.弱电解质的研究是重要课题。
(1)①已知不同条件下,水溶液中碳元素的存在形态如图所示.下列说法不正确的是_______
a.时,溶液中含碳元素的微粒主要是
b.A点,溶液中和浓度相同
c.当时,
②向上述的水溶液中加入溶液时发生反应的离子方程式是_______。
(2)以及其它部分弱酸的电离平衡常数如表:
弱酸
电离平衡常数
按要求回答下列问题:
①的酸性由强到弱的顺序为_______。
②将少量气体通入溶液中,写出该反应的离子方程式:_______。
(3)常温下,已知一元酸溶液中。
①常温下,溶液的_______;
②的与的溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是:_______。
18.某化学课外活动小组欲制取纯Na2CO3溶液并讨论实验过程中的相关问题。可供选择的试剂有:
A.大理石 B.盐酸 C.氢氧化钠溶液 D.澄清石灰水
三名同学设计的制备纯Na2CO3的溶液的实验方案的反应流程分别如下:
甲:NaOH溶液Na2CO3溶液
乙:NaOH溶液NaHCO3溶液Na2CO3固体Na2CO3溶液
丙:NaOH溶液NaHCO3溶液Na2CO3溶液
(1)请指出甲、乙两方案的主要缺点:
甲方案:___________;
乙方案:___________。
(2)若采用丙方案制取纯Na2CO3溶液,其实验的关键是:___________。
(3)假设反应②所得的Na2CO3固体中混有未分解的NaHCO3,乙同学选择澄清石灰水测定其中NaHCO3的质量分数,乙同学___________(填“能”或“不能”)达到实验目的:若能,请说明计算所需的数据;若不能,请简要说明理由;___________。
(4)已知物质的量浓度均为0.10mol/L的NaHCO3、Na2CO3和Na2S溶液pH如下:
溶液 NaHCO3 Na2CO3 Na2S
pH 8.3 11.6 12.5
①Na2CO3水溶液呈碱性的原因是___________(用离子方程式表示)。NaHCO3溶液中滴加酚酞溶液显___________色,原因是___________;微热溶液颜色变深,可能的原因是___________(结合离子方程式说明)。
②从表中数据可知,K2CO3溶液中c(CO)___________K2S溶液中的c(S2-)(填“>”“<”或“=”)。
19.二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的消毒剂,是一种黄绿色的气体,易溶于水,沸点为11℃。
(1)用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如图所示:
①写出电解时发生反应的化学方程式:___。
②ClO2的消毒效率(以转移电子数目的多少为依据)是等物质的量的Cl2的___倍。
(2)产品中ClO2含量的测量:向锥形瓶中加入由适量碘化钾、3mL硫酸组成的混合溶液,将上述反应过程中生成的一部分ClO2气体通入锥形瓶中充分反应。再加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定(I2+2=2I-+S,通入的气体中不存在能与I2、反应的成分),共用去VmL硫代硫酸钠溶液。
①请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式:___。
②滴定终点的现象是___。
③测得通入ClO2的质量m(ClO2)=___(用含c、V的代数式表示)。
20.现有含有少量NaCl、Na2SO4、Na2CO3等杂质的NaNO3溶液,选择适当地试剂除去杂质,得到纯净的NaNO3固体,实验流程如图所示。
(1)沉淀A的主要成分是_______、________(填化学式)。
(2)②中相关的离子方程式为________;③中加入过量的Na2CO3溶液的目的是_______。
(3)溶液3经过处理可以得到NaNO3固体,溶液3中肯定含有的杂质是_______,为了除去杂质,可向溶液3中加入适量的_______溶液。
21.(1)常温下,稀释0.5mol/L的醋酸溶液过程中,溶液中随着加水量的增加,c(OH-)___(填“增大”、“减小”、或“不变”)。
(2)常温下0.01mol·L-1HCl溶液中c(H+)=___,pH=____;常温下0.01mol·L-1NaOH溶液:pH=___。
(3)pH=3的盐酸稀释100倍,pH___5(填“>”、“=”、或“<”)。
(4)pH=13的强碱溶液与pH=2的强酸溶液混合pH=7,则强碱与强酸的体积比为___。
22.某实验小组欲测定某软锰矿样品中,MnO2的质量分数。称取软锰矿样品0.1000g,对样品进行如下处理:
①用过氧化钠处理,得到MnO溶液;
②煮沸溶液,除去剩余的过氧化物;
③酸化溶液,MnO歧化为MnO和MnO2;
④滤去MnO2;
⑤用0.100mol L-1Fe2+标准溶液滴定滤液中MnO,共用去20.80mL。
计算:
(1)滤液中MnO的物质的量___mol。
(2)样品中MnO2的质量分数___(用百分数表示,保留1位小数)。
23.化合物M{ [(CH3COO)2Cr]2·2H2O,相对分子质量为376}不溶于冷水,是常用的氧气吸收剂。实验室中以锌粒、三氧化铬溶液、醋酸钠溶液和盐酸为主要原料制备该化合物,其装置如图所示,且仪器2中预先加入锌粒。已知二价铬不稳定,极易被氧气氧化,不与锌反应。制备过程中发生的相关反应如下:
Zn(s)+2HCl(aq)═ZnCl2(aq)+H2(g)
2CrCl3(aq)+Zn(s)═2CrCl2(aq)+ZnCl2(aq)
2Cr2+(aq)+4CH3COO-(aq)+2H2O(l)═[Cr(CH3COO)2]2 2H2O(s)
请回答下列问题:
(1)仪器1的名称是___________;
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是___________ (填序号);目的是___________。
A.盐酸和三氯化铬溶液同时加入
B.先加三氯化铬溶液,一段时间后再加盐酸
C.先加盐酸,一段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与醋酸钠溶液顺利混合,应关闭阀门___________(填“A”或“B”,下同),打开阀门___________。
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与醋酸钠溶液反应外,另一个作用是___________。
(5)铬的离子会污染水,常温下要除去上述实验中多余的Cr2+,最好往废液中通入足量的___________,再加入碱液,调节pH至少为___________才能使铬的离子沉淀完全(铬的离子浓度应小于10-5mol/L)。(已知Cr(OH)3的溶度积为6.3×10-31,=4,lg2≈0.3)
参考答案
1.A 2.A 3.D 4.C 5.C 6.A 7.B 8.C 9.A 10.B 11.B 12.C 13.B 14.A 15.A
16.CO2 H2O Na2CO3 CO2+H2O+Na2CO3=2NaHCO3 2H+ +CO=H2O+CO2↑ + H+= H2O+CO2↑ +OH-= H2O+ CO
17.bc 3
18.
(1) CO2的通入量不易控制 过程繁琐,操作复杂
(2)反应①应充分进行,①步骤后将NaHCO3溶液煮沸排除过量CO2,反应①②所用NaOH溶液的体积应相等
(3) 能 固体样品的质量和沉淀总质量
(4) CO+H2OHCO+OH- 浅红 酚酞的变色范围为8.2~10.0,而0.10mol/L的NaHCO3溶液的pH为8.3 CO水解:CO+H2OHCO+OH-,该反应为吸热反应,升高温度,促进水解,c(OH-)增大,碱性增强,颜色加深; >
19.NH4Cl+2HCl3H2↑+NCl3 2.5 8H++2ClO2+10I-=5I2+2Cl-+4H2O 蓝色消失并在30s内不复原 13.5cV×10-3g
20.BaSO4 BaCO3 Ag++Cl-=AgCl↓ 除去过量的Ba(NO3)2和AgNO3 Na2CO3 HNO3
21.增大 0.01mol·L-1 2 12 = 1:10
22.4.16×10-4 54.3%
23.
(1)分液漏斗
(2) C 先利用锌与盐酸反应产生的氢气排出装置内的空气创造还原性气氛,然后锌与三氯化铬反应生成二价铬离子
(3) B A
(4)使锌与CrCl3充分反应得到CrCl2
(5) 氧气 5.3
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
