2020-2021学年高二上学期鲁科版(2019)化学选择性必修1 第三章《物质在水溶液中的行为》测试题(含答案)
文档属性
| 名称 | 2020-2021学年高二上学期鲁科版(2019)化学选择性必修1 第三章《物质在水溶液中的行为》测试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 367.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-11 20:49:15 | ||
图片预览



文档简介
第三章《物质在水溶液中的行为》测试题
一、单选题(共15题)
1.NA是阿伏加德罗常数的值。下列说法正确的是
A.119.5gCHCl3中含有NA个Cl—H键
B.常温常压下,11.2LCO2的分子数为0.5NA
C.1L 0.1 mol L 1 (NH4)2HPO4溶液中的离子总数为0.3NA
D.16gCH4和36gH2O中含有的共价键数均为4NA
2.要确认集气瓶中是否集满氯气,正确的操作是
A.将AgNO3溶液滴入集气瓶中,观察是否生成白色沉淀
B.用手将湿润的淀粉碘化钾试纸放在集气瓶上方,观察是否变蓝
C.将湿润的淀粉碘化钾试纸粘在玻棒一端,伸到集气瓶口附近,观察是否变蓝
D.将紫色石蕊液试滴入集气瓶中,观察是否先变红后褪色
3.常温下,下列各组离子一定能大量共存的是
A.在水电离的的溶液中:、、、
B.在强碱溶液中:、、、
C.在的溶液中:、、、
D.在含大量的溶液中:、、、
4.H2S水溶液中存在电离平衡H2S H++HS- 和HS- H++S2-。若向H2S溶液中
A.加水稀释,平衡向右移动,溶液中氢离子浓度增大
B.通入HCl气体,平衡向左移动,溶液pH值增大
C.滴加新制氯水,平衡向左移动,溶液pH值减小
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
5.化学是以实验为基础的学科。下列实验操作或做法正确且能达到目的的是
选项 操作或做法 目的
A 将SO2气体通入紫色石蕊溶液中 验证SO2的漂白性
B 向2 mL 0.l mol· L-1MgCl2溶液中加入 l mL 0.1 mol·L-1 NaOH溶液,再加入几滴FeCl3溶液 验证Mg(OH)2沉淀能否转化为Fe(OH)3沉淀
C 向Fe(NO3)2 溶液中滴入硫酸酸化的H2O2溶液 验证氧化性: H2O2>Fe3+
D 淀粉溶液加入稀硫酸,加热,冷却后滴入碘水 探究淀粉是否发生水解
A.A B.B C.C D.D
6.Al2(SO4)3溶液分别与下列物质反应,能用Al3++3OH-→Al(OH)3↓表示的是
A.少量氨水 B.少量NaOH溶液
C.少量石灰乳 D.少量Ba(OH)2溶液
7.下列实验操作对应的离子方程式正确的是
实验操作 离子方程式
A AgCl溶于过量氨水 Ag++2NH3·H2O=[Ag(NH3)]++2H2O
B 向硫酸铜溶液中加入过量的NaHS溶液 Cu2++2HS-=CuS↓+2H+
C 向氢氧化亚铁中加入足量的稀硝酸 Fe(OH)2+2H+=Fe2++2H2O
D AgI加入Na2S溶液中,固体变黑 S2-(aq)+2AgI(s)=Ag2S(s)+2I-(aq)
A.A B.B C.C D.D
8.下列有关说法错误的是
A.有的物质在不电离的条件下,也能导电
B.硫酸钡、醋酸铵、碳酸氢钠都是强电解质
C.若平衡正向移动,则平衡常数一定增大
D.若化学平衡向逆反应方向移动,则正反应速率不一定减小
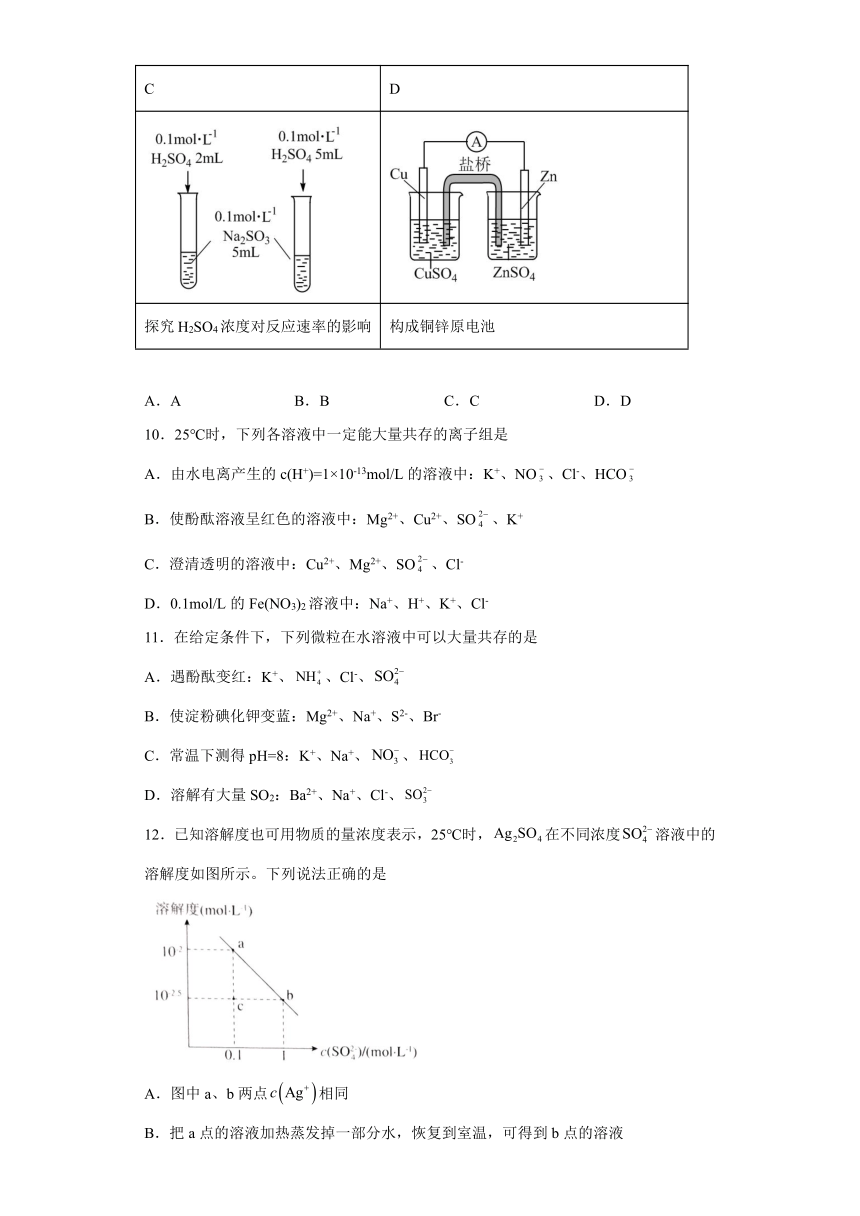
9.下列有关图及实验的描述正确的是
A B
蒸发FeCl3溶液制备无水FeCl3 测定中和热
C D
探究H2SO4浓度对反应速率的影响 构成铜锌原电池
A.A B.B C.C D.D
10.25℃时,下列各溶液中一定能大量共存的离子组是
A.由水电离产生的c(H+)=1×10-13mol/L的溶液中:K+、NO、Cl-、HCO
B.使酚酞溶液呈红色的溶液中:Mg2+、Cu2+、SO、K+
C.澄清透明的溶液中:Cu2+、Mg2+、SO、Cl-
D.0.1mol/L的Fe(NO3)2溶液中:Na+、H+、K+、Cl-
11.在给定条件下,下列微粒在水溶液中可以大量共存的是
A.遇酚酞变红:K+、、Cl-、
B.使淀粉碘化钾变蓝:Mg2+、Na+、S2-、Br-
C.常温下测得pH=8:K+、Na+、、
D.溶解有大量SO2:Ba2+、Na+、Cl-、
12.已知溶解度也可用物质的量浓度表示,25℃时,在不同浓度溶液中的溶解度如图所示。下列说法正确的是
A.图中a、b两点相同
B.把a点的溶液加热蒸发掉一部分水,恢复到室温,可得到b点的溶液
C.该温度下,溶度积的数量级为
D.在c点的溶液中加入少量固体,溶液可变为b点
13.设NA为阿伏加德罗常数的值,下列叙述正确的是
A.常温常压下,1mol氦气含有的电子数目为4NA
B.若FeCl3溶液中Fe3+的数目为NA,则Cl-的数目大于3NA
C.含4molHCl的浓盐酸与足量MnO2加热反应,生成Cl2的数目为NA
D.100g17%的氨水中含有的NH3分子数为NA
14.已知25℃时,几种弱酸的电离常数如下:
弱酸的化学式 CH3COOH HCN H2S
电离常数 1.8×10-5 4.9×10-10 K1=9.1×10-8 K2=1.1×10-12
25℃时,下列说法正确的是
A.某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=10-dmol/L
B.用0.1mol/L的NaOH溶液滴定pH值相等的CH3COOH和HCN溶液,CH3COOH消耗的NaOH溶液体积更大
C.NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+c(S2-)
D.等物质的量浓度的各溶液pH关系为:pH(Na2S)>pH(NaCN)>pH(NaHS)>pH(CH3COONa)
15.常温下,用0.10 mol·L-1 NaOH溶液分别滴定20.00 mL浓度均为0.10 mol·L-1 HA溶液和HB溶液,所得滴定曲线如图所示(其中HA的滴定曲线部分未画出)。下列说法错误的是
已知:M点溶液中c(A-)=c(HA)
A.=105.8
B.P点溶液中溶质为NaB和HB,由水电离出的c(H+)=1.0×10-7 mol·L-1
C.M点溶液中,2c(Na+)>c(HA)+c(A-)
D.等体积等浓度的HB溶液和NaA溶液混合后的溶液中:c(OH-)<c(H+)
二、填空题(共8题)
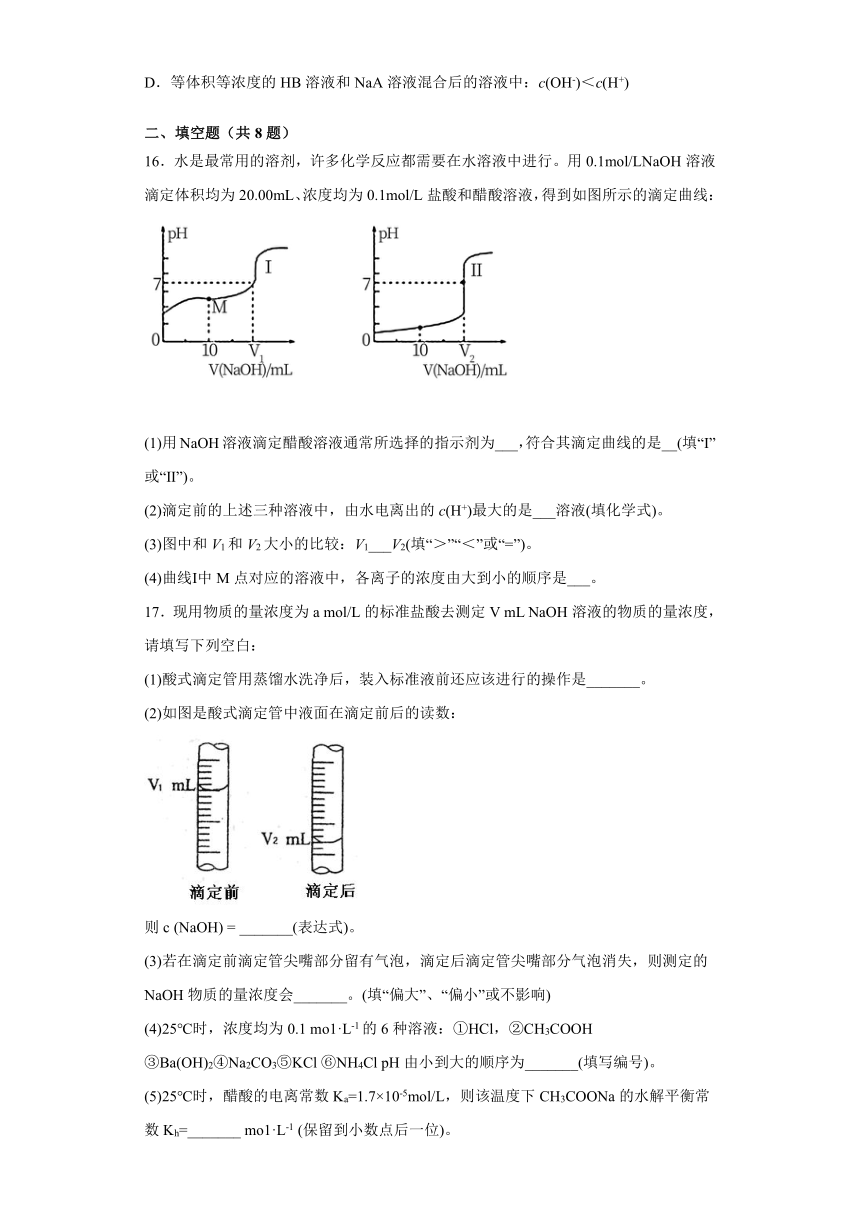
16.水是最常用的溶剂,许多化学反应都需要在水溶液中进行。用0.1mol/LNaOH溶液滴定体积均为20.00mL、浓度均为0.1mol/L盐酸和醋酸溶液,得到如图所示的滴定曲线:
(1)用NaOH溶液滴定醋酸溶液通常所选择的指示剂为___,符合其滴定曲线的是__(填“Ⅰ”或“Ⅱ”)。
(2)滴定前的上述三种溶液中,由水电离出的c(H+)最大的是___溶液(填化学式)。
(3)图中和V1和V2大小的比较:V1___V2(填“>”“<”或“=”)。
(4)曲线Ⅰ中M点对应的溶液中,各离子的浓度由大到小的顺序是___。
17.现用物质的量浓度为a mol/L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:
(1)酸式滴定管用蒸馏水洗净后,装入标准液前还应该进行的操作是_______。
(2)如图是酸式滴定管中液面在滴定前后的读数:
则c (NaOH) = _______(表达式)。
(3)若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度会_______。(填“偏大”、“偏小”或不影响)
(4)25℃时,浓度均为0.1 mo1·L-1的6种溶液:①HCl,②CH3COOH ③Ba(OH)2④Na2CO3⑤KCl ⑥NH4Cl pH由小到大的顺序为_______(填写编号)。
(5)25℃时,醋酸的电离常数Ka=1.7×10-5mol/L,则该温度下CH3COONa的水解平衡常数Kh=_______ mo1·L-1 (保留到小数点后一位)。
(6)25℃时,pH=3 的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈_______(填“酸性”,“中性”或“碱性”),请写出溶液中离子浓度间的一个等式:_______。
(7)25℃时,将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后,溶液的pH= 7,则溶液中c (CH3COO-)+c(CH3COOH)= _______,m与n的大小关系是m_______n (填“>”“=”或“<”)。
(8)当300mL 1 mo1·L-1的NaOH 溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为_______。
18.常温下,有浓度均为0.1mol/L的下列4种溶液:①NaCN溶液 ②NaOH溶液 ③溶液 ④溶液
HCN
(1)这4种溶液pH由大到小的顺序是___________(填序号),其中②由水电离出的浓度为___________。
(2)①中各离子浓度由大到小的顺序是___________。
(3)④中的水解平衡常数Kb=___________(保留2位有效数字)。
(4)若向等体积的③和④中滴加等浓度的盐酸至溶液呈中性,则消耗盐酸的体积③___________④(填“>”“<”或“=”)。
(5)25℃时,测得HCN和NaCN的混合溶液的,则约为___________(保留1位有效数字)。向NaCN溶液中通入少量,发生反应的离子方程式为___________。
19.某校化学兴趣小组同学猜想自来水中可能含有大量Ca2+、Mg2+和某些阴离子,从而进行了三组实验:
①取适量自来水于试管中,滴加足量的NaOH溶液,产生白色沉淀;
②过滤后取滤液于试管中,滴加足量的Na2CO3溶液,又有白色沉淀生成;
③另取适量自来水于试管中,滴加足量稀硝酸后再滴加AgNO3溶液,也产生白色沉淀。
请回答以下问题:
(1) 通过实验可初步确定自来水中________(填“含有”或“不含有”)大量Ca2+、Mg2+。
(2) 自来水中所含阴离子可以确定有___________,该离子遇AgNO3溶液发生反应的离子方程式为________
20.A、B、D和E四种元素均为短周期元素,原子序数逐渐增大。A元素原子的核外电子数、电子层数和最外层电子数均相等。B、D、E三种元素在周期表中相对位置如图①所示,只有E元素的单质能与水反应生成两种酸。甲、乙、M、W、 X、Y、Z七种物质均由A、 B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为N2H4,可做火箭燃料;甲、乙为非金属单质: X分子中含有10个电子。它们之间的转化关系如图②所示。回答下列问题:
(1)A、B、D、E形成的盐中E显+1价,请写出该盐的电子式______
(2)一定量E的单质与NaOH溶液恰好完全反应后,所得溶液的pH_____ 7(填“大于”“等于”或“小于”),原因是_______________(用离子方程式表示)。
(3)Z与X反应的化学方程式________________________
(4)A与B形成的简单化合物与Y在一定条件下反应,生成可直接排放到大气中的无毒无害物质为_____________、______________(用化学式表示)
21.(1)联氨()是二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为______。(已知:),联氨与硫酸形成的酸式盐的化学式为_______。
(2)0.20mol/L的小苏打溶液中各离子浓度由小到大的顺序是___。
(3)如图所示为二元酸H2A溶液中各微粒的物质的量分数(δ)随溶液pH的变化曲线(25°C)。
H2A的电离平衡常数=_________,溶液pH=7时,=_______。
22.常温时,Ksp[Mg(OH)2]=4×10﹣12,Ksp[Fe(OH)3]=8.0×10﹣38;通常认为某离子残留在溶液中的浓度小于1×10﹣5mol L﹣1时就认为该离子已经沉淀完全。假定原溶液中c(Mg2+)=1mol L﹣1,c(Fe3+)=0.01mol L﹣1.(已知lg2=0.3)
(1)使Fe3+开始沉淀时溶液中pH约为___________。
(2)当Fe3+沉淀完全时溶液中c(OH﹣)约为___________mol/L;此时Mg2+___________
A.尚未开始沉淀B.已经开始沉淀C.已经沉淀完全
(3)结论:在含有少量Fe3+的Mg2+溶液中,___________(填A:可以;B:不可以)用调节pH的方法来除杂。
23.硫酸铜晶体在工农业生产中具有重要作用。某学习小组对硫酸铜晶体的制备和纯度的测定进行如下探究。
(1)粗硫酸铜晶体的制备
在盛有铜屑的蒸发皿中加入20 mL 3 mol·L-1的硫酸,水浴加热,分多次缓慢加入浓硝酸,待反应缓和后,盖上表面皿。将所得溶液加热浓缩、趁热过滤,冷却,得到粗硫酸铜晶体。反应原理为浓硝酸将铜氧化成Cu2+,Cu2+与SO结合得到硫酸铜,该反应的化学方程式为___________。
(2)硫酸铜晶体的提纯
实验室提纯硫酸铜晶体的一种方法如下:
①提纯过程中需要加入氧化剂,检验其氧化完全的方法是___________。
②溶液中金属离子开始沉淀和沉淀完全的pH如下表所示。提纯过程中需要调节pH=4.0,其原因是___________。
金属离子 Fe3+ Cu2+
开始沉淀时的pH 1.9 4.7
沉淀完全时的pH 3.2 6.7
③操作I、II、III都要用到的玻璃仪器有___________。
(3)硫酸铜晶体纯度的测定
称取样品0.3125 g于250 mL锥形瓶中,加入适量稀硫酸和水使之完全溶解。加入过量的KI溶液(杂质不参与反应),再加入几滴淀粉溶液,用0.1000 mol·L-1 Na2S2O3溶液滴定至终点时消耗Na2S2O3溶液10.00 mL。(已知:2Cu2++4I-=2CuI↓+I2,I2+2S2O=S4O+2I-),则所测试样中硫酸铜晶体的纯度为___________。
参考答案
1.D 2.C 3.B 4.C 5.B 6.B 7.D 8.C 9.D 10.C 11.C 12.D 13.B 14.D 15.D
16.酚酞 Ⅰ CH3COOH < c(CH3COO-)>c (Na+)>c (H+)>c (OH-)
17.润洗 偏大 ①<②<⑥<⑤<④<③ 5.9×10-10 酸性 c (H+)+ c (Na+)= c (CH3COO-)+c(OH-) mol/L > c(Na+)>c(HCO)>c(CO)>c(OH-)>c(H+)
18.②>①>④>③ < 0.02
19.含有 Cl-(或氯离子)
20. 大于 ClO- +H2O HClO+OH- 3NO2+ H2O =2HNO3+NO N2 H2O
21.8.7×10 7 N2H6(HSO4)2 c()<c(H+)<c(OH-)<c()<c(Na+) 1×10 4.2 1×100.8
22.2.3 2.0×10﹣11 A A
23.3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O 滴加酸性KMnO4溶液,不褪色;或滴加K3[Fe(CN)6]溶液,无蓝色沉淀生成 保证Fe3+沉淀完全,而Cu2+未开始沉淀 烧杯、玻璃棒、漏斗 80%
一、单选题(共15题)
1.NA是阿伏加德罗常数的值。下列说法正确的是
A.119.5gCHCl3中含有NA个Cl—H键
B.常温常压下,11.2LCO2的分子数为0.5NA
C.1L 0.1 mol L 1 (NH4)2HPO4溶液中的离子总数为0.3NA
D.16gCH4和36gH2O中含有的共价键数均为4NA
2.要确认集气瓶中是否集满氯气,正确的操作是
A.将AgNO3溶液滴入集气瓶中,观察是否生成白色沉淀
B.用手将湿润的淀粉碘化钾试纸放在集气瓶上方,观察是否变蓝
C.将湿润的淀粉碘化钾试纸粘在玻棒一端,伸到集气瓶口附近,观察是否变蓝
D.将紫色石蕊液试滴入集气瓶中,观察是否先变红后褪色
3.常温下,下列各组离子一定能大量共存的是
A.在水电离的的溶液中:、、、
B.在强碱溶液中:、、、
C.在的溶液中:、、、
D.在含大量的溶液中:、、、
4.H2S水溶液中存在电离平衡H2S H++HS- 和HS- H++S2-。若向H2S溶液中
A.加水稀释,平衡向右移动,溶液中氢离子浓度增大
B.通入HCl气体,平衡向左移动,溶液pH值增大
C.滴加新制氯水,平衡向左移动,溶液pH值减小
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
5.化学是以实验为基础的学科。下列实验操作或做法正确且能达到目的的是
选项 操作或做法 目的
A 将SO2气体通入紫色石蕊溶液中 验证SO2的漂白性
B 向2 mL 0.l mol· L-1MgCl2溶液中加入 l mL 0.1 mol·L-1 NaOH溶液,再加入几滴FeCl3溶液 验证Mg(OH)2沉淀能否转化为Fe(OH)3沉淀
C 向Fe(NO3)2 溶液中滴入硫酸酸化的H2O2溶液 验证氧化性: H2O2>Fe3+
D 淀粉溶液加入稀硫酸,加热,冷却后滴入碘水 探究淀粉是否发生水解
A.A B.B C.C D.D
6.Al2(SO4)3溶液分别与下列物质反应,能用Al3++3OH-→Al(OH)3↓表示的是
A.少量氨水 B.少量NaOH溶液
C.少量石灰乳 D.少量Ba(OH)2溶液
7.下列实验操作对应的离子方程式正确的是
实验操作 离子方程式
A AgCl溶于过量氨水 Ag++2NH3·H2O=[Ag(NH3)]++2H2O
B 向硫酸铜溶液中加入过量的NaHS溶液 Cu2++2HS-=CuS↓+2H+
C 向氢氧化亚铁中加入足量的稀硝酸 Fe(OH)2+2H+=Fe2++2H2O
D AgI加入Na2S溶液中,固体变黑 S2-(aq)+2AgI(s)=Ag2S(s)+2I-(aq)
A.A B.B C.C D.D
8.下列有关说法错误的是
A.有的物质在不电离的条件下,也能导电
B.硫酸钡、醋酸铵、碳酸氢钠都是强电解质
C.若平衡正向移动,则平衡常数一定增大
D.若化学平衡向逆反应方向移动,则正反应速率不一定减小
9.下列有关图及实验的描述正确的是
A B
蒸发FeCl3溶液制备无水FeCl3 测定中和热
C D
探究H2SO4浓度对反应速率的影响 构成铜锌原电池
A.A B.B C.C D.D
10.25℃时,下列各溶液中一定能大量共存的离子组是
A.由水电离产生的c(H+)=1×10-13mol/L的溶液中:K+、NO、Cl-、HCO
B.使酚酞溶液呈红色的溶液中:Mg2+、Cu2+、SO、K+
C.澄清透明的溶液中:Cu2+、Mg2+、SO、Cl-
D.0.1mol/L的Fe(NO3)2溶液中:Na+、H+、K+、Cl-
11.在给定条件下,下列微粒在水溶液中可以大量共存的是
A.遇酚酞变红:K+、、Cl-、
B.使淀粉碘化钾变蓝:Mg2+、Na+、S2-、Br-
C.常温下测得pH=8:K+、Na+、、
D.溶解有大量SO2:Ba2+、Na+、Cl-、
12.已知溶解度也可用物质的量浓度表示,25℃时,在不同浓度溶液中的溶解度如图所示。下列说法正确的是
A.图中a、b两点相同
B.把a点的溶液加热蒸发掉一部分水,恢复到室温,可得到b点的溶液
C.该温度下,溶度积的数量级为
D.在c点的溶液中加入少量固体,溶液可变为b点
13.设NA为阿伏加德罗常数的值,下列叙述正确的是
A.常温常压下,1mol氦气含有的电子数目为4NA
B.若FeCl3溶液中Fe3+的数目为NA,则Cl-的数目大于3NA
C.含4molHCl的浓盐酸与足量MnO2加热反应,生成Cl2的数目为NA
D.100g17%的氨水中含有的NH3分子数为NA
14.已知25℃时,几种弱酸的电离常数如下:
弱酸的化学式 CH3COOH HCN H2S
电离常数 1.8×10-5 4.9×10-10 K1=9.1×10-8 K2=1.1×10-12
25℃时,下列说法正确的是
A.某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=10-dmol/L
B.用0.1mol/L的NaOH溶液滴定pH值相等的CH3COOH和HCN溶液,CH3COOH消耗的NaOH溶液体积更大
C.NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+c(S2-)
D.等物质的量浓度的各溶液pH关系为:pH(Na2S)>pH(NaCN)>pH(NaHS)>pH(CH3COONa)
15.常温下,用0.10 mol·L-1 NaOH溶液分别滴定20.00 mL浓度均为0.10 mol·L-1 HA溶液和HB溶液,所得滴定曲线如图所示(其中HA的滴定曲线部分未画出)。下列说法错误的是
已知:M点溶液中c(A-)=c(HA)
A.=105.8
B.P点溶液中溶质为NaB和HB,由水电离出的c(H+)=1.0×10-7 mol·L-1
C.M点溶液中,2c(Na+)>c(HA)+c(A-)
D.等体积等浓度的HB溶液和NaA溶液混合后的溶液中:c(OH-)<c(H+)
二、填空题(共8题)
16.水是最常用的溶剂,许多化学反应都需要在水溶液中进行。用0.1mol/LNaOH溶液滴定体积均为20.00mL、浓度均为0.1mol/L盐酸和醋酸溶液,得到如图所示的滴定曲线:
(1)用NaOH溶液滴定醋酸溶液通常所选择的指示剂为___,符合其滴定曲线的是__(填“Ⅰ”或“Ⅱ”)。
(2)滴定前的上述三种溶液中,由水电离出的c(H+)最大的是___溶液(填化学式)。
(3)图中和V1和V2大小的比较:V1___V2(填“>”“<”或“=”)。
(4)曲线Ⅰ中M点对应的溶液中,各离子的浓度由大到小的顺序是___。
17.现用物质的量浓度为a mol/L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:
(1)酸式滴定管用蒸馏水洗净后,装入标准液前还应该进行的操作是_______。
(2)如图是酸式滴定管中液面在滴定前后的读数:
则c (NaOH) = _______(表达式)。
(3)若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度会_______。(填“偏大”、“偏小”或不影响)
(4)25℃时,浓度均为0.1 mo1·L-1的6种溶液:①HCl,②CH3COOH ③Ba(OH)2④Na2CO3⑤KCl ⑥NH4Cl pH由小到大的顺序为_______(填写编号)。
(5)25℃时,醋酸的电离常数Ka=1.7×10-5mol/L,则该温度下CH3COONa的水解平衡常数Kh=_______ mo1·L-1 (保留到小数点后一位)。
(6)25℃时,pH=3 的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈_______(填“酸性”,“中性”或“碱性”),请写出溶液中离子浓度间的一个等式:_______。
(7)25℃时,将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后,溶液的pH= 7,则溶液中c (CH3COO-)+c(CH3COOH)= _______,m与n的大小关系是m_______n (填“>”“=”或“<”)。
(8)当300mL 1 mo1·L-1的NaOH 溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为_______。
18.常温下,有浓度均为0.1mol/L的下列4种溶液:①NaCN溶液 ②NaOH溶液 ③溶液 ④溶液
HCN
(1)这4种溶液pH由大到小的顺序是___________(填序号),其中②由水电离出的浓度为___________。
(2)①中各离子浓度由大到小的顺序是___________。
(3)④中的水解平衡常数Kb=___________(保留2位有效数字)。
(4)若向等体积的③和④中滴加等浓度的盐酸至溶液呈中性,则消耗盐酸的体积③___________④(填“>”“<”或“=”)。
(5)25℃时,测得HCN和NaCN的混合溶液的,则约为___________(保留1位有效数字)。向NaCN溶液中通入少量,发生反应的离子方程式为___________。
19.某校化学兴趣小组同学猜想自来水中可能含有大量Ca2+、Mg2+和某些阴离子,从而进行了三组实验:
①取适量自来水于试管中,滴加足量的NaOH溶液,产生白色沉淀;
②过滤后取滤液于试管中,滴加足量的Na2CO3溶液,又有白色沉淀生成;
③另取适量自来水于试管中,滴加足量稀硝酸后再滴加AgNO3溶液,也产生白色沉淀。
请回答以下问题:
(1) 通过实验可初步确定自来水中________(填“含有”或“不含有”)大量Ca2+、Mg2+。
(2) 自来水中所含阴离子可以确定有___________,该离子遇AgNO3溶液发生反应的离子方程式为________
20.A、B、D和E四种元素均为短周期元素,原子序数逐渐增大。A元素原子的核外电子数、电子层数和最外层电子数均相等。B、D、E三种元素在周期表中相对位置如图①所示,只有E元素的单质能与水反应生成两种酸。甲、乙、M、W、 X、Y、Z七种物质均由A、 B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为N2H4,可做火箭燃料;甲、乙为非金属单质: X分子中含有10个电子。它们之间的转化关系如图②所示。回答下列问题:
(1)A、B、D、E形成的盐中E显+1价,请写出该盐的电子式______
(2)一定量E的单质与NaOH溶液恰好完全反应后,所得溶液的pH_____ 7(填“大于”“等于”或“小于”),原因是_______________(用离子方程式表示)。
(3)Z与X反应的化学方程式________________________
(4)A与B形成的简单化合物与Y在一定条件下反应,生成可直接排放到大气中的无毒无害物质为_____________、______________(用化学式表示)
21.(1)联氨()是二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为______。(已知:),联氨与硫酸形成的酸式盐的化学式为_______。
(2)0.20mol/L的小苏打溶液中各离子浓度由小到大的顺序是___。
(3)如图所示为二元酸H2A溶液中各微粒的物质的量分数(δ)随溶液pH的变化曲线(25°C)。
H2A的电离平衡常数=_________,溶液pH=7时,=_______。
22.常温时,Ksp[Mg(OH)2]=4×10﹣12,Ksp[Fe(OH)3]=8.0×10﹣38;通常认为某离子残留在溶液中的浓度小于1×10﹣5mol L﹣1时就认为该离子已经沉淀完全。假定原溶液中c(Mg2+)=1mol L﹣1,c(Fe3+)=0.01mol L﹣1.(已知lg2=0.3)
(1)使Fe3+开始沉淀时溶液中pH约为___________。
(2)当Fe3+沉淀完全时溶液中c(OH﹣)约为___________mol/L;此时Mg2+___________
A.尚未开始沉淀B.已经开始沉淀C.已经沉淀完全
(3)结论:在含有少量Fe3+的Mg2+溶液中,___________(填A:可以;B:不可以)用调节pH的方法来除杂。
23.硫酸铜晶体在工农业生产中具有重要作用。某学习小组对硫酸铜晶体的制备和纯度的测定进行如下探究。
(1)粗硫酸铜晶体的制备
在盛有铜屑的蒸发皿中加入20 mL 3 mol·L-1的硫酸,水浴加热,分多次缓慢加入浓硝酸,待反应缓和后,盖上表面皿。将所得溶液加热浓缩、趁热过滤,冷却,得到粗硫酸铜晶体。反应原理为浓硝酸将铜氧化成Cu2+,Cu2+与SO结合得到硫酸铜,该反应的化学方程式为___________。
(2)硫酸铜晶体的提纯
实验室提纯硫酸铜晶体的一种方法如下:
①提纯过程中需要加入氧化剂,检验其氧化完全的方法是___________。
②溶液中金属离子开始沉淀和沉淀完全的pH如下表所示。提纯过程中需要调节pH=4.0,其原因是___________。
金属离子 Fe3+ Cu2+
开始沉淀时的pH 1.9 4.7
沉淀完全时的pH 3.2 6.7
③操作I、II、III都要用到的玻璃仪器有___________。
(3)硫酸铜晶体纯度的测定
称取样品0.3125 g于250 mL锥形瓶中,加入适量稀硫酸和水使之完全溶解。加入过量的KI溶液(杂质不参与反应),再加入几滴淀粉溶液,用0.1000 mol·L-1 Na2S2O3溶液滴定至终点时消耗Na2S2O3溶液10.00 mL。(已知:2Cu2++4I-=2CuI↓+I2,I2+2S2O=S4O+2I-),则所测试样中硫酸铜晶体的纯度为___________。
参考答案
1.D 2.C 3.B 4.C 5.B 6.B 7.D 8.C 9.D 10.C 11.C 12.D 13.B 14.D 15.D
16.酚酞 Ⅰ CH3COOH < c(CH3COO-)>c (Na+)>c (H+)>c (OH-)
17.润洗 偏大 ①<②<⑥<⑤<④<③ 5.9×10-10 酸性 c (H+)+ c (Na+)= c (CH3COO-)+c(OH-) mol/L > c(Na+)>c(HCO)>c(CO)>c(OH-)>c(H+)
18.②>①>④>③ < 0.02
19.含有 Cl-(或氯离子)
20. 大于 ClO- +H2O HClO+OH- 3NO2+ H2O =2HNO3+NO N2 H2O
21.8.7×10 7 N2H6(HSO4)2 c()<c(H+)<c(OH-)<c()<c(Na+) 1×10 4.2 1×100.8
22.2.3 2.0×10﹣11 A A
23.3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O 滴加酸性KMnO4溶液,不褪色;或滴加K3[Fe(CN)6]溶液,无蓝色沉淀生成 保证Fe3+沉淀完全,而Cu2+未开始沉淀 烧杯、玻璃棒、漏斗 80%
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
