2021-2022学年高二上学期化学鲁科版(2019)选择性必修1第一章《化学反应与能量转化》检测题(含答案)
文档属性
| 名称 | 2021-2022学年高二上学期化学鲁科版(2019)选择性必修1第一章《化学反应与能量转化》检测题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 625.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-11 20:57:31 | ||
图片预览



文档简介
第一章《化学反应与能量转化》检测题
一、单选题(共14题)
1.下列说法正确的是
A.任何酸与碱发生中和反应生成1molH2O的过程中,能量变化均相同
B.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
C.已知:①2H2(g)+O2(g)=2H2O(g) ΔH=-akJ·mol-1,②2H2(g)+O2(g)=2H2O(1) ΔH=-bkJ·mol-1,则a>b
D.已知:①C(s,石墨)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1,②C(s,金刚石)+O2(g)=CO2(g) ΔH=-395.0kJ·mol-1,则C(s,石墨)=C(s,金刚石) ΔH=+1.5kJ·mol-1
2.某酸性酒精检测仪的工作原理如图所示。下列分析正确的是
A.该检测仪利用了电解池原理
B.正极区溶液的降低
C.工作中由电极(Ⅰ)经质子交换膜流向电极(Ⅱ)
D.电极(Ⅰ)的电极反应为
3.用饱和食盐水可以得到重要的化工产品。在电解装置的阳极产生一种用途广泛的气体,用来检验该气体的是
A.点燃 B.加热 C.湿润的淀粉KI试纸 D.干燥的淀粉KI试纸
4.物质C、CH4、H2、CH3OH完全燃烧所放出的热量依次是33kJ·g-1、143kJ·g-1、56kJ·g-1、23kJ·g-1,则下列热化学方程式正确的是
A.C(s)+O2(g)=CO(g) ΔH=-396kJ·mol-1
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-896kJ·mol-1
C.2H2(g)+O2(g)=2H2O(l) ΔH=-286kJ·mol-1
D.CH3OH(l)+O2(g)=CO2(g)+2H2O(l) ΔH=736kJ·mol-1
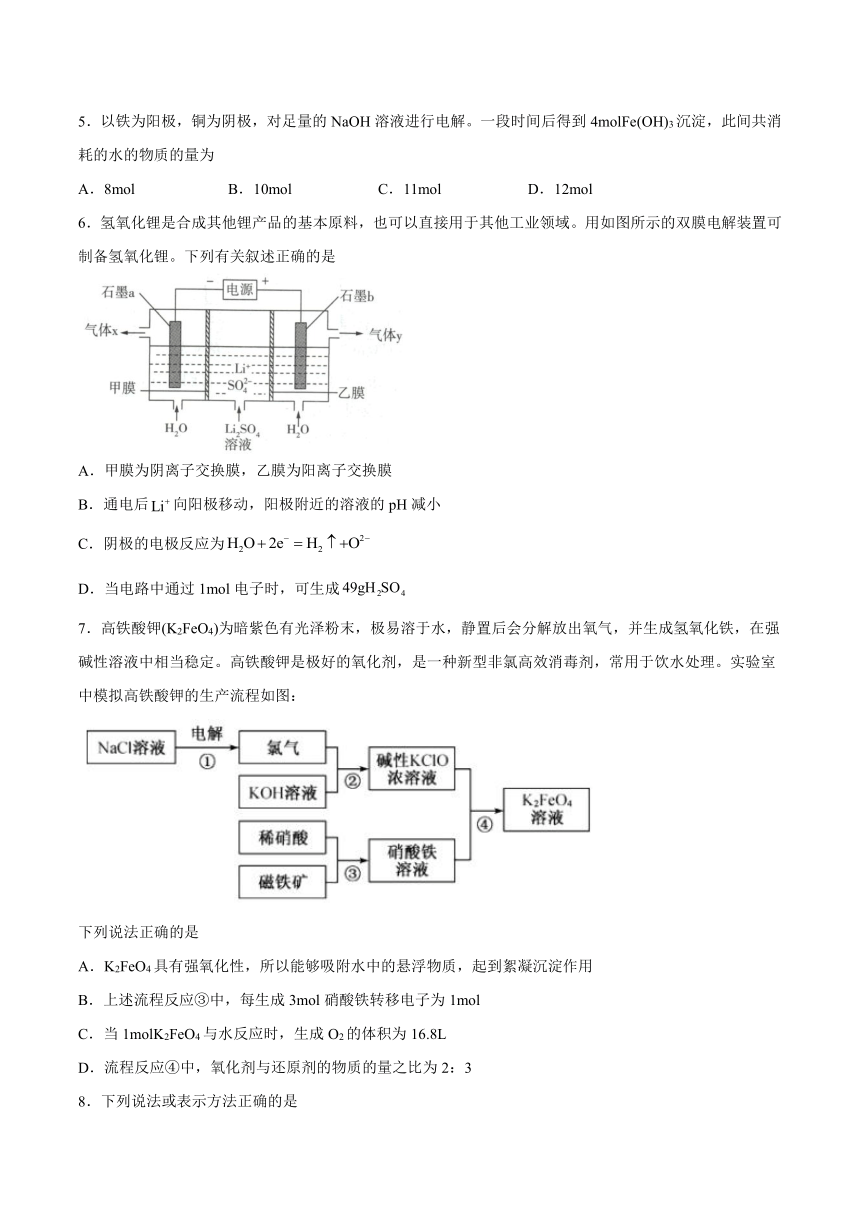
5.以铁为阳极,铜为阴极,对足量的NaOH溶液进行电解。一段时间后得到4molFe(OH)3沉淀,此间共消耗的水的物质的量为
A.8mol B.10mol C.11mol D.12mol
6.氢氧化锂是合成其他锂产品的基本原料,也可以直接用于其他工业领域。用如图所示的双膜电解装置可制备氢氧化锂。下列有关叙述正确的是
A.甲膜为阴离子交换膜,乙膜为阳离子交换膜
B.通电后向阳极移动,阳极附近的溶液的pH减小
C.阴极的电极反应为
D.当电路中通过1mol电子时,可生成
7.高铁酸钾(K2FeO4)为暗紫色有光泽粉末,极易溶于水,静置后会分解放出氧气,并生成氢氧化铁,在强碱性溶液中相当稳定。高铁酸钾是极好的氧化剂,是一种新型非氯高效消毒剂,常用于饮水处理。实验室中模拟高铁酸钾的生产流程如图:
下列说法正确的是
A.K2FeO4具有强氧化性,所以能够吸附水中的悬浮物质,起到絮凝沉淀作用
B.上述流程反应③中,每生成3mol硝酸铁转移电子为1mol
C.当1molK2FeO4与水反应时,生成O2的体积为16.8L
D.流程反应④中,氧化剂与还原剂的物质的量之比为2:3
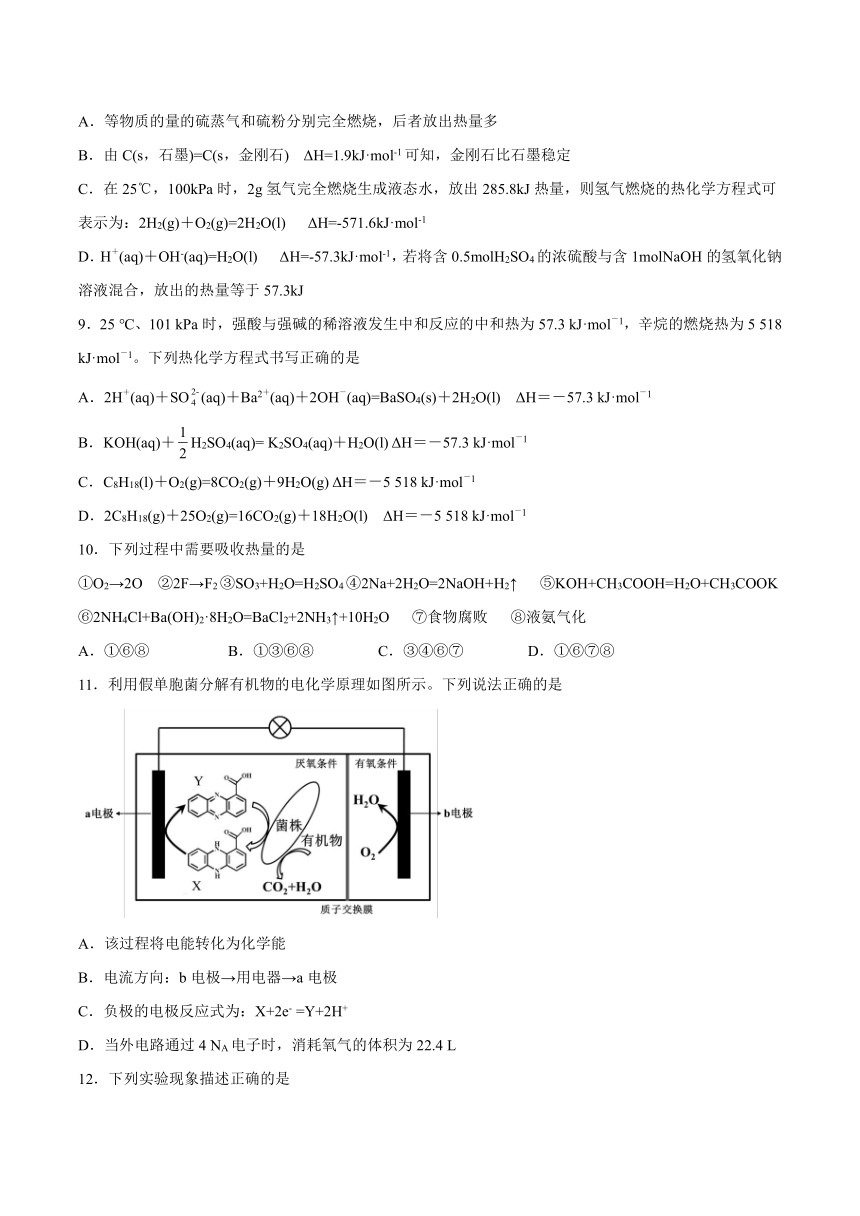
8.下列说法或表示方法正确的是
A.等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多
B.由C(s,石墨)=C(s,金刚石) ΔH=1.9kJ·mol-1可知,金刚石比石墨稳定
C.在25℃,100kPa时,2g氢气完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
D.H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1,若将含0.5molH2SO4的浓硫酸与含1molNaOH的氢氧化钠溶液混合,放出的热量等于57.3kJ
9.25 ℃、101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ·mol-1,辛烷的燃烧热为5 518 kJ·mol-1。下列热化学方程式书写正确的是
A.2H+(aq)+SO(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l) ΔH=-57.3 kJ·mol-1
B.KOH(aq)+H2SO4(aq)= K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
C.C8H18(l)+O2(g)=8CO2(g)+9H2O(g) ΔH=-5 518 kJ·mol-1
D.2C8H18(g)+25O2(g)=16CO2(g)+18H2O(l) ΔH=-5 518 kJ·mol-1
10.下列过程中需要吸收热量的是
①O2→2O ②2F→F2 ③SO3+H2O=H2SO4 ④2Na+2H2O=2NaOH+H2↑ ⑤KOH+CH3COOH=H2O+CH3COOK ⑥2NH4Cl+Ba(OH)2·8H2O=BaCl2+2NH3↑+10H2O ⑦食物腐败 ⑧液氨气化
A.①⑥⑧ B.①③⑥⑧ C.③④⑥⑦ D.①⑥⑦⑧
11.利用假单胞菌分解有机物的电化学原理如图所示。下列说法正确的是
A.该过程将电能转化为化学能
B.电流方向:b电极→用电器→a电极
C.负极的电极反应式为:X+2e- =Y+2H+
D.当外电路通过4 NA电子时,消耗氧气的体积为22.4 L
12.下列实验现象描述正确的是
A.碘水中加入少量直馏汽油振荡,静置后上层颜色变浅,下层颜色变为紫红色
B.红热的铜丝在氯气中燃烧,产生了棕黄色的烟雾
C.电解氯化钠饱和溶液,将阴极气体产物通入淀粉 碘化钾溶液中,溶液变蓝
D.溴化钠溶液中加入少量新制的氯水振荡,再加入少量四氯化碳振荡,静置后上层颜色变浅,下层颜色变为橙红色
13.某硝酸厂处理尾气中NO的方法是在催化剂存在下,用将NO还原为,其热化学方程式为 ,其能量变化过程如下(其中a、b、c、d均为正值):
下列说法正确的是
A.过程①、②、③、④都是放热过程 B.
C. D.
14.微生物脱盐电池是高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以NaCl溶液模拟海水,采用惰性电极,用下图装置处理有机废水(以含CH3COO-的溶液为例)。下列说法错误的是
A.隔膜1为阳离子交换膜,隔膜2为阴离子交换膜
B.电池工作一段时间后,正、负极产生气体的物质的量之比为2:1
C.当电路中转移1 mol电子时,模拟海水理论上除盐58.5 g
D.负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+
二、非选择题(共10题)
15.A、B、C、D、E、F为原子序数递增的短周期主族元素,其中A的气态氢化物甲可用作制冷剂,B与E同主族且能形成具有漂白性的二元化合物乙,C原子半径在短周期元素中最大,D元素的最高正价与最低价之和为零。回答下列问题:
(1)D元素在周期表中的位置是___________,该元素的单质应用广泛,请列举其中之一___________。
(2)甲的电子式___________,工业上常用甲的水溶液作为乙的吸收剂,请写出甲溶液吸收足量乙的离子方程式___________。
(3)D与F两元素的单质反应生成34g化合物丙,恢复室温时测得放热130kJ,已知丙熔点为 69℃,沸点为58℃。请写出该反应的热化学方程式___________。
(4)某种电池由熔融的C、E两种单质作为两极,其结构示意图如下所示:则熔融C电极为___________(填“正”或“负”)极。若放电时总反应为2C+xE=C2Ex,则充电时,每当转移0.2mol电子时,阴、阳极区的质量变化差为___________g。
16.X、Y、Z、W代表四种短周期主族元素,有关它们的部分结构信息及性质信息如下表所示:
元素 部分结构信息 部分性质信息
X X原子的最外层电子数等于其电子层数 由X元素形成的单质是最清洁的燃料
Y Y原子的最外层电子数是其次外层电子数的3倍 Y与X能形成两种化合物
Z Y、Z同主族 ZY2的排放易造成空气污染
W W是短周期主族元素中原子半径最大的元素 与XY剧烈反应
请按要求回答下列问题:
(1)W元素为_________(填元素符号),Z在元素周期表中的位置是_______。
(2)Y、Z的最简单氢化物中稳定性较强的是_______(填化学式)。
(3)X2Y2的电子式为__________,X2Y2可与ZY2反应,写出此反应的化学方程式:____。
(4)写出W的氧化物对应的水化物与Z的最高价氧化物对应的水化物反应的离子方程式:___。
(5)一种ZY2—Y2质子交换膜燃料电池可以利用大气所含的ZY2进行放电,其原理如图所示。
①放电时消耗ZY2和Y2的物质的量之比为_______。
②负极的电极反应式为___________。
17.现有10种元素的性质、数据如下表所列,它们均为短周期元素。
A B C D E F G H I J
原子半径(10-10m) 0.74 1.60 1.52 1.10 0.99 1.86 0.75 0.82 0.102 0.037
最高或最低
化合价 +2 +1 +5 +7 +1 +5 +3 +6 +1
-2 -3 -1 - -2
回答下列问题:
(1)D的元素名称是______________,H的元素符号是______________;B在元素周期表中的位置是(周期、族)____________
(2)在以上元素形成的最高价氧化物的水化物中,酸性最强的化合物的分子式是______。化合物F2A2的电子式是:_________,构成该物质的化学键类型为________________
(3)用电子式表示A的简单氢化物的形成过程如下:________________;G的氢化物的结构式为_________。
(4)一定条件下,IA2气体与足量的A单质充分反应生成20g气态化合物,放出24.6 kJ热量,写出其热化学方程式____________________________。
(5)用J元素的单质与A元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的惰性电极甲和乙浸入KOH溶液,在甲极通入J的单质,乙极通入A的单质,则甲极的电极反应式为:____________________。
18.天然气的主要成分为CH4,一般还含有C2H6等烃类,是重要的燃料和化工原料。乙烷在一定条件可发生如下反应:C2H6(g)=C2H4(g)+H2(g) H,相关物质的燃烧热数据如下表所示:
物质 C2H6(g) C2H4(g) H2(g)
燃烧热 H/(kJ·mol 1) 1560 1411 -286
H=_______kJ·mol 1。
19.(1)0.3mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水放出649.5kJ热量,其热化学方程式为:_______;又已知H2O(l)=H2O(g) ΔH=+44kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_______kJ。
(2)已知H—H键键能为436kJ·mol-1,H—N键键能为391kJ·mol-1,根据化学方程式:N2+3H2 2NH3 ΔH=-92.4kJ·mol-1,则N≡N键键能是_______。
(3)1mol氧气与足量氢气反应生成水蒸气放热483.6kJ,写出该反应的热化学方程式:_______。若1g水蒸气转化成液态水放热2.444kJ,写出表示氢气燃烧热的热化学方程式:_______。
(4)含11.2gKOH的稀溶液与1L0.1mol·L-1的H2SO4溶液反应放出11.46kJ的热量,该离子反应的热化学方程式为_______,则KOH与H2SO4反应的中和热为_______。
(5)已知:①C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566kJ·mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH3=+141kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=_______。
20.用盐酸与溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是_______。
(2)做1次完整的中和热测定实验,温度计需使用_______次。
(3)烧杯间填满碎纸条的作用是_______。
(4)大烧杯上如不盖硬纸板,求得的中和热数值_______(填“偏大、偏小、无影响”)
(5)如果用盐酸与溶液进行反应,与上述实验相比,所放出的热量_______(填“相等、不相等”),所求中和热_______(填“相等、不相等”)。
(6)用相同浓度和体积的氨水()代替溶液进行上述实验,测得的中和热的数值会____。(填“偏大”、“偏小”、“无影响”)。
21.在学习氧化还原反应时,某同学提出Ag+具有较强氧化性,I-具有较强还原性,二者也可发生氧化还原反应。为验证这个问题,该学生设计了系列实验。
(1)研究AgNO3溶液与KI溶液反应产物
向盛有1mL1mol/LAgNO3溶液的试管中加入1mL1mol/LKI溶液,振荡试管,向其中加入___,溶液无明显变化。(提示:若发生氧化还原反应,I-应被氧化为单质)
(实验结论)二者混合只发生沉淀反应,无明显氧化还原反应。
(2)验证Ag+的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中铁的氧化产物,将溶液中的Ag+除尽后,进行了如下实验。可选用试剂:①KSCN溶液②NaOH溶液③酸性KMnO4溶液。请完成下表:
操作 现象 结论
取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 ____ 存在Fe3+
取少量除尽Ag+后的溶液于试管中,加入1~2滴____(填序号)溶液,振荡 _____ 存在Fe2+
(实验结论)铁的氧化产物为Fe2+和Fe3+,则Ag+氧化性强于Fe3+。
另一同学用pH计测得常温该硝酸银溶液的pH为5.50,于是该同学对实验结论提出质疑。你认为他提出质疑的理由可能是____。
(3)电池原理探究Ag+与I-之间的氧化还原反应
按图设计原电池。电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。读懂文中划线部分内容,请回答以下问题:
根据下表数据,盐桥中应选择_____作为电解质。
阳离子 u∞×108(m2 s-1 V-1) 阴离子 u∞×108(m2 s-1 V-1)
Li+ 4.07 4.61
Na+ 5.19 7.40
Ca2+ 6.59 Cl- 7.91
K+ 7.62 8.27
(4)已知Cl2能氧化+4价的硫为+6价的硫。请写出Na2SO3溶液和Cl2反应反应的离子方程式____。
(5)硫酸亚铁受热可按下式分解:aFeSO4=bFeO+cFe2O3+dSO3+eSO2+fO2,a、b、c、d、e、f为待定系数,若d:e:f=3:4:1,则b:c=_____。
22.电解池
(1)概念:将___________能转化为___________能的装置。
(2)两个电极
阴极:与电源___________极相连的电极,在该电极上发生___________反应。
阳极:与电源___________极相连的电极,在该电极上发生___________反应。
23.可逆反应的ΔH表示完全反应时的热量变化,与反应是否可逆无关。 _____
24.人们的日常生活和工农业生产都离不开电能,当今世界电能的开发和利用已是科学工作者十分重视的课题。
(1)可自发进行,据此设计的下列实验装置中属于原电池,且电池工作时可发生上述反应的是___________(填序号)。
A. B. C. D.
(2)上述D装置若能构成原电池,其盐桥的作用是___________(回答两点),盐桥中物质能不能改用含的琼胶?并说明理由:___________。
(3)在某新型催化剂作用下可形成新型燃料电池,其工作原理如图。
①Y极的电极反应式为___________。
②当有电子通过负载时,X极生成的体积为___________L(标准状况)。
参考答案
1.D 2.C 3.C 4.B 5.B 6.D 7.B 8.C 9.B 10.A 11.B 12.D 13.B 14.A
15.第三周期第ⅣA族 半导体、芯片或光电池(任意一个) SO2+NH3·H2O=+ Si(s)+2Cl2(g)=SiCl4(l) 负 9.2
16.Na 第三周期ⅥA族 H2O 2:1
17.磷 B 第三周期第ⅡA族 HClO4 离子键、非极性键 2SO2(g)+O2(g)2SO3(g); △H=-196.8 kJ/mol H2– 2e- + 2OH-==2H2O
18.+137
19.B2H6(g)+3O2(g)=B2O3(s)+3H2O(l) H=-2165kJmol-1 1016.5 945.6kJ·mol-1 2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1 H2(g)+O2(g)=H2O(l) ΔH=-285.8kJ·mol-1 OH-(aq)+H+(aq)=H2O(l) ΔH=-57.3kJ·mol-1 57.3kJ·mol-1 -80kJ·mol-1
20.环形玻璃搅拌棒 3 保温、隔热,减少实验过程中的热量损失 偏小 不相等 相等 偏小
21.淀粉溶液 溶液变为红色 ③ 溶液的紫色褪去 NO具有强氧化性,可将Fe2+氧化为Fe3+ KNO3 +Cl2+H2O=+2Cl +2H+ 3:2
22.
(1) 电 化学
(2) 负 还原 正 氧化
23.对
24.BD 平衡电荷,形成闭合回路(合理即可) 不能,因为盐桥中的会与反应生成沉淀,使盐桥失去作用 11.2
一、单选题(共14题)
1.下列说法正确的是
A.任何酸与碱发生中和反应生成1molH2O的过程中,能量变化均相同
B.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
C.已知:①2H2(g)+O2(g)=2H2O(g) ΔH=-akJ·mol-1,②2H2(g)+O2(g)=2H2O(1) ΔH=-bkJ·mol-1,则a>b
D.已知:①C(s,石墨)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1,②C(s,金刚石)+O2(g)=CO2(g) ΔH=-395.0kJ·mol-1,则C(s,石墨)=C(s,金刚石) ΔH=+1.5kJ·mol-1
2.某酸性酒精检测仪的工作原理如图所示。下列分析正确的是
A.该检测仪利用了电解池原理
B.正极区溶液的降低
C.工作中由电极(Ⅰ)经质子交换膜流向电极(Ⅱ)
D.电极(Ⅰ)的电极反应为
3.用饱和食盐水可以得到重要的化工产品。在电解装置的阳极产生一种用途广泛的气体,用来检验该气体的是
A.点燃 B.加热 C.湿润的淀粉KI试纸 D.干燥的淀粉KI试纸
4.物质C、CH4、H2、CH3OH完全燃烧所放出的热量依次是33kJ·g-1、143kJ·g-1、56kJ·g-1、23kJ·g-1,则下列热化学方程式正确的是
A.C(s)+O2(g)=CO(g) ΔH=-396kJ·mol-1
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-896kJ·mol-1
C.2H2(g)+O2(g)=2H2O(l) ΔH=-286kJ·mol-1
D.CH3OH(l)+O2(g)=CO2(g)+2H2O(l) ΔH=736kJ·mol-1
5.以铁为阳极,铜为阴极,对足量的NaOH溶液进行电解。一段时间后得到4molFe(OH)3沉淀,此间共消耗的水的物质的量为
A.8mol B.10mol C.11mol D.12mol
6.氢氧化锂是合成其他锂产品的基本原料,也可以直接用于其他工业领域。用如图所示的双膜电解装置可制备氢氧化锂。下列有关叙述正确的是
A.甲膜为阴离子交换膜,乙膜为阳离子交换膜
B.通电后向阳极移动,阳极附近的溶液的pH减小
C.阴极的电极反应为
D.当电路中通过1mol电子时,可生成
7.高铁酸钾(K2FeO4)为暗紫色有光泽粉末,极易溶于水,静置后会分解放出氧气,并生成氢氧化铁,在强碱性溶液中相当稳定。高铁酸钾是极好的氧化剂,是一种新型非氯高效消毒剂,常用于饮水处理。实验室中模拟高铁酸钾的生产流程如图:
下列说法正确的是
A.K2FeO4具有强氧化性,所以能够吸附水中的悬浮物质,起到絮凝沉淀作用
B.上述流程反应③中,每生成3mol硝酸铁转移电子为1mol
C.当1molK2FeO4与水反应时,生成O2的体积为16.8L
D.流程反应④中,氧化剂与还原剂的物质的量之比为2:3
8.下列说法或表示方法正确的是
A.等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多
B.由C(s,石墨)=C(s,金刚石) ΔH=1.9kJ·mol-1可知,金刚石比石墨稳定
C.在25℃,100kPa时,2g氢气完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
D.H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1,若将含0.5molH2SO4的浓硫酸与含1molNaOH的氢氧化钠溶液混合,放出的热量等于57.3kJ
9.25 ℃、101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ·mol-1,辛烷的燃烧热为5 518 kJ·mol-1。下列热化学方程式书写正确的是
A.2H+(aq)+SO(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l) ΔH=-57.3 kJ·mol-1
B.KOH(aq)+H2SO4(aq)= K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
C.C8H18(l)+O2(g)=8CO2(g)+9H2O(g) ΔH=-5 518 kJ·mol-1
D.2C8H18(g)+25O2(g)=16CO2(g)+18H2O(l) ΔH=-5 518 kJ·mol-1
10.下列过程中需要吸收热量的是
①O2→2O ②2F→F2 ③SO3+H2O=H2SO4 ④2Na+2H2O=2NaOH+H2↑ ⑤KOH+CH3COOH=H2O+CH3COOK ⑥2NH4Cl+Ba(OH)2·8H2O=BaCl2+2NH3↑+10H2O ⑦食物腐败 ⑧液氨气化
A.①⑥⑧ B.①③⑥⑧ C.③④⑥⑦ D.①⑥⑦⑧
11.利用假单胞菌分解有机物的电化学原理如图所示。下列说法正确的是
A.该过程将电能转化为化学能
B.电流方向:b电极→用电器→a电极
C.负极的电极反应式为:X+2e- =Y+2H+
D.当外电路通过4 NA电子时,消耗氧气的体积为22.4 L
12.下列实验现象描述正确的是
A.碘水中加入少量直馏汽油振荡,静置后上层颜色变浅,下层颜色变为紫红色
B.红热的铜丝在氯气中燃烧,产生了棕黄色的烟雾
C.电解氯化钠饱和溶液,将阴极气体产物通入淀粉 碘化钾溶液中,溶液变蓝
D.溴化钠溶液中加入少量新制的氯水振荡,再加入少量四氯化碳振荡,静置后上层颜色变浅,下层颜色变为橙红色
13.某硝酸厂处理尾气中NO的方法是在催化剂存在下,用将NO还原为,其热化学方程式为 ,其能量变化过程如下(其中a、b、c、d均为正值):
下列说法正确的是
A.过程①、②、③、④都是放热过程 B.
C. D.
14.微生物脱盐电池是高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以NaCl溶液模拟海水,采用惰性电极,用下图装置处理有机废水(以含CH3COO-的溶液为例)。下列说法错误的是
A.隔膜1为阳离子交换膜,隔膜2为阴离子交换膜
B.电池工作一段时间后,正、负极产生气体的物质的量之比为2:1
C.当电路中转移1 mol电子时,模拟海水理论上除盐58.5 g
D.负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+
二、非选择题(共10题)
15.A、B、C、D、E、F为原子序数递增的短周期主族元素,其中A的气态氢化物甲可用作制冷剂,B与E同主族且能形成具有漂白性的二元化合物乙,C原子半径在短周期元素中最大,D元素的最高正价与最低价之和为零。回答下列问题:
(1)D元素在周期表中的位置是___________,该元素的单质应用广泛,请列举其中之一___________。
(2)甲的电子式___________,工业上常用甲的水溶液作为乙的吸收剂,请写出甲溶液吸收足量乙的离子方程式___________。
(3)D与F两元素的单质反应生成34g化合物丙,恢复室温时测得放热130kJ,已知丙熔点为 69℃,沸点为58℃。请写出该反应的热化学方程式___________。
(4)某种电池由熔融的C、E两种单质作为两极,其结构示意图如下所示:则熔融C电极为___________(填“正”或“负”)极。若放电时总反应为2C+xE=C2Ex,则充电时,每当转移0.2mol电子时,阴、阳极区的质量变化差为___________g。
16.X、Y、Z、W代表四种短周期主族元素,有关它们的部分结构信息及性质信息如下表所示:
元素 部分结构信息 部分性质信息
X X原子的最外层电子数等于其电子层数 由X元素形成的单质是最清洁的燃料
Y Y原子的最外层电子数是其次外层电子数的3倍 Y与X能形成两种化合物
Z Y、Z同主族 ZY2的排放易造成空气污染
W W是短周期主族元素中原子半径最大的元素 与XY剧烈反应
请按要求回答下列问题:
(1)W元素为_________(填元素符号),Z在元素周期表中的位置是_______。
(2)Y、Z的最简单氢化物中稳定性较强的是_______(填化学式)。
(3)X2Y2的电子式为__________,X2Y2可与ZY2反应,写出此反应的化学方程式:____。
(4)写出W的氧化物对应的水化物与Z的最高价氧化物对应的水化物反应的离子方程式:___。
(5)一种ZY2—Y2质子交换膜燃料电池可以利用大气所含的ZY2进行放电,其原理如图所示。
①放电时消耗ZY2和Y2的物质的量之比为_______。
②负极的电极反应式为___________。
17.现有10种元素的性质、数据如下表所列,它们均为短周期元素。
A B C D E F G H I J
原子半径(10-10m) 0.74 1.60 1.52 1.10 0.99 1.86 0.75 0.82 0.102 0.037
最高或最低
化合价 +2 +1 +5 +7 +1 +5 +3 +6 +1
-2 -3 -1 - -2
回答下列问题:
(1)D的元素名称是______________,H的元素符号是______________;B在元素周期表中的位置是(周期、族)____________
(2)在以上元素形成的最高价氧化物的水化物中,酸性最强的化合物的分子式是______。化合物F2A2的电子式是:_________,构成该物质的化学键类型为________________
(3)用电子式表示A的简单氢化物的形成过程如下:________________;G的氢化物的结构式为_________。
(4)一定条件下,IA2气体与足量的A单质充分反应生成20g气态化合物,放出24.6 kJ热量,写出其热化学方程式____________________________。
(5)用J元素的单质与A元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的惰性电极甲和乙浸入KOH溶液,在甲极通入J的单质,乙极通入A的单质,则甲极的电极反应式为:____________________。
18.天然气的主要成分为CH4,一般还含有C2H6等烃类,是重要的燃料和化工原料。乙烷在一定条件可发生如下反应:C2H6(g)=C2H4(g)+H2(g) H,相关物质的燃烧热数据如下表所示:
物质 C2H6(g) C2H4(g) H2(g)
燃烧热 H/(kJ·mol 1) 1560 1411 -286
H=_______kJ·mol 1。
19.(1)0.3mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水放出649.5kJ热量,其热化学方程式为:_______;又已知H2O(l)=H2O(g) ΔH=+44kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_______kJ。
(2)已知H—H键键能为436kJ·mol-1,H—N键键能为391kJ·mol-1,根据化学方程式:N2+3H2 2NH3 ΔH=-92.4kJ·mol-1,则N≡N键键能是_______。
(3)1mol氧气与足量氢气反应生成水蒸气放热483.6kJ,写出该反应的热化学方程式:_______。若1g水蒸气转化成液态水放热2.444kJ,写出表示氢气燃烧热的热化学方程式:_______。
(4)含11.2gKOH的稀溶液与1L0.1mol·L-1的H2SO4溶液反应放出11.46kJ的热量,该离子反应的热化学方程式为_______,则KOH与H2SO4反应的中和热为_______。
(5)已知:①C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566kJ·mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH3=+141kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=_______。
20.用盐酸与溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是_______。
(2)做1次完整的中和热测定实验,温度计需使用_______次。
(3)烧杯间填满碎纸条的作用是_______。
(4)大烧杯上如不盖硬纸板,求得的中和热数值_______(填“偏大、偏小、无影响”)
(5)如果用盐酸与溶液进行反应,与上述实验相比,所放出的热量_______(填“相等、不相等”),所求中和热_______(填“相等、不相等”)。
(6)用相同浓度和体积的氨水()代替溶液进行上述实验,测得的中和热的数值会____。(填“偏大”、“偏小”、“无影响”)。
21.在学习氧化还原反应时,某同学提出Ag+具有较强氧化性,I-具有较强还原性,二者也可发生氧化还原反应。为验证这个问题,该学生设计了系列实验。
(1)研究AgNO3溶液与KI溶液反应产物
向盛有1mL1mol/LAgNO3溶液的试管中加入1mL1mol/LKI溶液,振荡试管,向其中加入___,溶液无明显变化。(提示:若发生氧化还原反应,I-应被氧化为单质)
(实验结论)二者混合只发生沉淀反应,无明显氧化还原反应。
(2)验证Ag+的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中铁的氧化产物,将溶液中的Ag+除尽后,进行了如下实验。可选用试剂:①KSCN溶液②NaOH溶液③酸性KMnO4溶液。请完成下表:
操作 现象 结论
取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 ____ 存在Fe3+
取少量除尽Ag+后的溶液于试管中,加入1~2滴____(填序号)溶液,振荡 _____ 存在Fe2+
(实验结论)铁的氧化产物为Fe2+和Fe3+,则Ag+氧化性强于Fe3+。
另一同学用pH计测得常温该硝酸银溶液的pH为5.50,于是该同学对实验结论提出质疑。你认为他提出质疑的理由可能是____。
(3)电池原理探究Ag+与I-之间的氧化还原反应
按图设计原电池。电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。读懂文中划线部分内容,请回答以下问题:
根据下表数据,盐桥中应选择_____作为电解质。
阳离子 u∞×108(m2 s-1 V-1) 阴离子 u∞×108(m2 s-1 V-1)
Li+ 4.07 4.61
Na+ 5.19 7.40
Ca2+ 6.59 Cl- 7.91
K+ 7.62 8.27
(4)已知Cl2能氧化+4价的硫为+6价的硫。请写出Na2SO3溶液和Cl2反应反应的离子方程式____。
(5)硫酸亚铁受热可按下式分解:aFeSO4=bFeO+cFe2O3+dSO3+eSO2+fO2,a、b、c、d、e、f为待定系数,若d:e:f=3:4:1,则b:c=_____。
22.电解池
(1)概念:将___________能转化为___________能的装置。
(2)两个电极
阴极:与电源___________极相连的电极,在该电极上发生___________反应。
阳极:与电源___________极相连的电极,在该电极上发生___________反应。
23.可逆反应的ΔH表示完全反应时的热量变化,与反应是否可逆无关。 _____
24.人们的日常生活和工农业生产都离不开电能,当今世界电能的开发和利用已是科学工作者十分重视的课题。
(1)可自发进行,据此设计的下列实验装置中属于原电池,且电池工作时可发生上述反应的是___________(填序号)。
A. B. C. D.
(2)上述D装置若能构成原电池,其盐桥的作用是___________(回答两点),盐桥中物质能不能改用含的琼胶?并说明理由:___________。
(3)在某新型催化剂作用下可形成新型燃料电池,其工作原理如图。
①Y极的电极反应式为___________。
②当有电子通过负载时,X极生成的体积为___________L(标准状况)。
参考答案
1.D 2.C 3.C 4.B 5.B 6.D 7.B 8.C 9.B 10.A 11.B 12.D 13.B 14.A
15.第三周期第ⅣA族 半导体、芯片或光电池(任意一个) SO2+NH3·H2O=+ Si(s)+2Cl2(g)=SiCl4(l) 负 9.2
16.Na 第三周期ⅥA族 H2O 2:1
17.磷 B 第三周期第ⅡA族 HClO4 离子键、非极性键 2SO2(g)+O2(g)2SO3(g); △H=-196.8 kJ/mol H2– 2e- + 2OH-==2H2O
18.+137
19.B2H6(g)+3O2(g)=B2O3(s)+3H2O(l) H=-2165kJmol-1 1016.5 945.6kJ·mol-1 2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1 H2(g)+O2(g)=H2O(l) ΔH=-285.8kJ·mol-1 OH-(aq)+H+(aq)=H2O(l) ΔH=-57.3kJ·mol-1 57.3kJ·mol-1 -80kJ·mol-1
20.环形玻璃搅拌棒 3 保温、隔热,减少实验过程中的热量损失 偏小 不相等 相等 偏小
21.淀粉溶液 溶液变为红色 ③ 溶液的紫色褪去 NO具有强氧化性,可将Fe2+氧化为Fe3+ KNO3 +Cl2+H2O=+2Cl +2H+ 3:2
22.
(1) 电 化学
(2) 负 还原 正 氧化
23.对
24.BD 平衡电荷,形成闭合回路(合理即可) 不能,因为盐桥中的会与反应生成沉淀,使盐桥失去作用 11.2
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
