2021-2022学年高二上学期鲁科版(2019)化学选择性必修1第一章《化学反应与能量转化》检测题(含答案)
文档属性
| 名称 | 2021-2022学年高二上学期鲁科版(2019)化学选择性必修1第一章《化学反应与能量转化》检测题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 763.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-11 20:58:50 | ||
图片预览


文档简介
第一章《化学反应与能量转化》检测题
一、单选题(共15题)
1.化学与人类生活密切相关。下列说法正确的是
A.单质Si用于制作光导纤维和光电池
B.常温下,浓硫酸可以用铁槽车运输
C.SO2的漂白没有涉及到化学变化
D.日常生产生活中钢铁的腐蚀主要原因不是电化学腐蚀
2.在盛有稀H2SO4的烧杯中放入用导线连接锌片和铜片,下列叙述正确的是
A.SO向铜片移动 B.电子通过导线由铜片流向锌片
C.正极有O2逸出 D.铜片上有H2逸出
3.萘四甲酸二酐(NTCDA)展现出高比容量,放电原理为2NaxCn+x→2nC+x,装置如图。下列说法正确的是
A.放电时,Na+向N移动
B.放电时,负极电极反应:NaxCn-xe-=nC+xNa+
C.充电时,M与电源的负极相连
D.充电时,阴极电极反应:x+2e-+2Na+
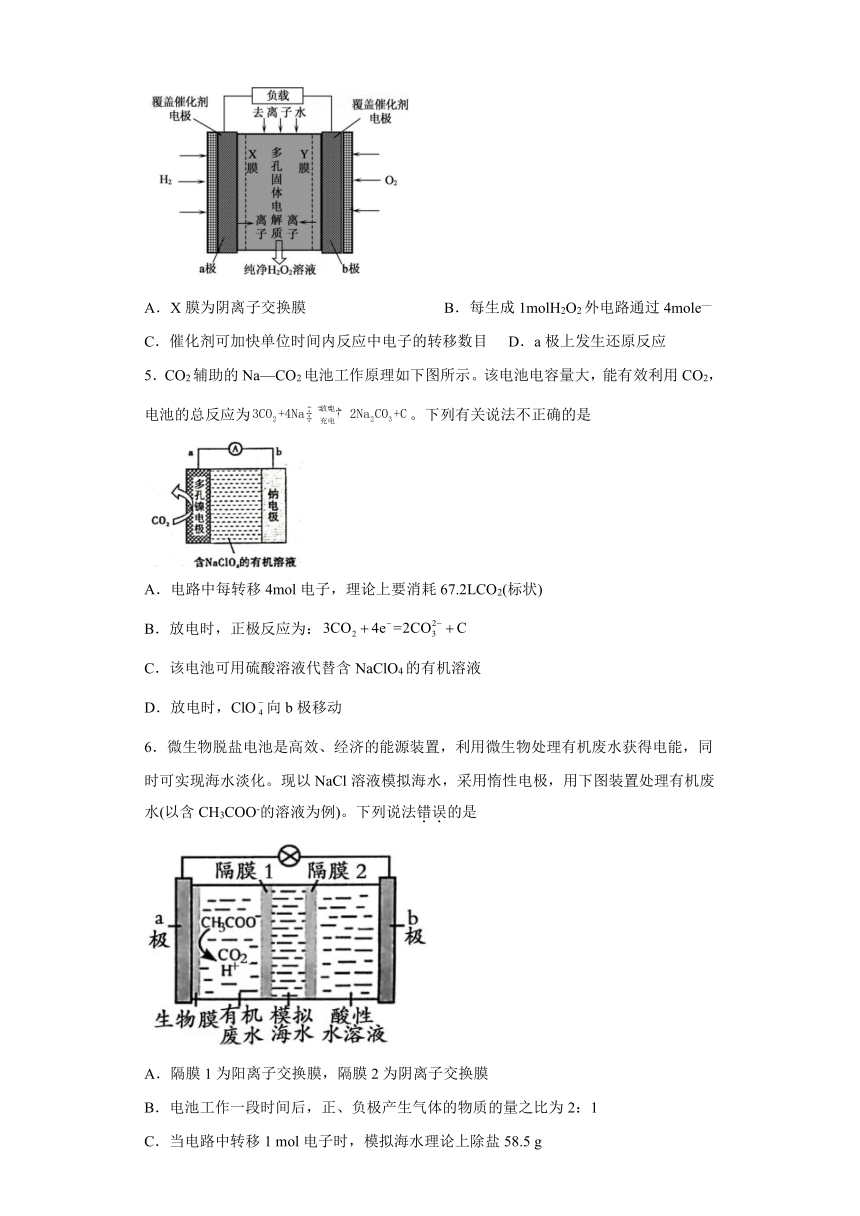
4.《Science》杂志报道了王浩天教授团队发明的制取H2O2的绿色方法,原理如图所示(已知:H2O2H++HO,Ka=2.4×10-12)。下列说法正确的是
A.X膜为阴离子交换膜 B.每生成1molH2O2外电路通过4mole—
C.催化剂可加快单位时间内反应中电子的转移数目 D.a极上发生还原反应
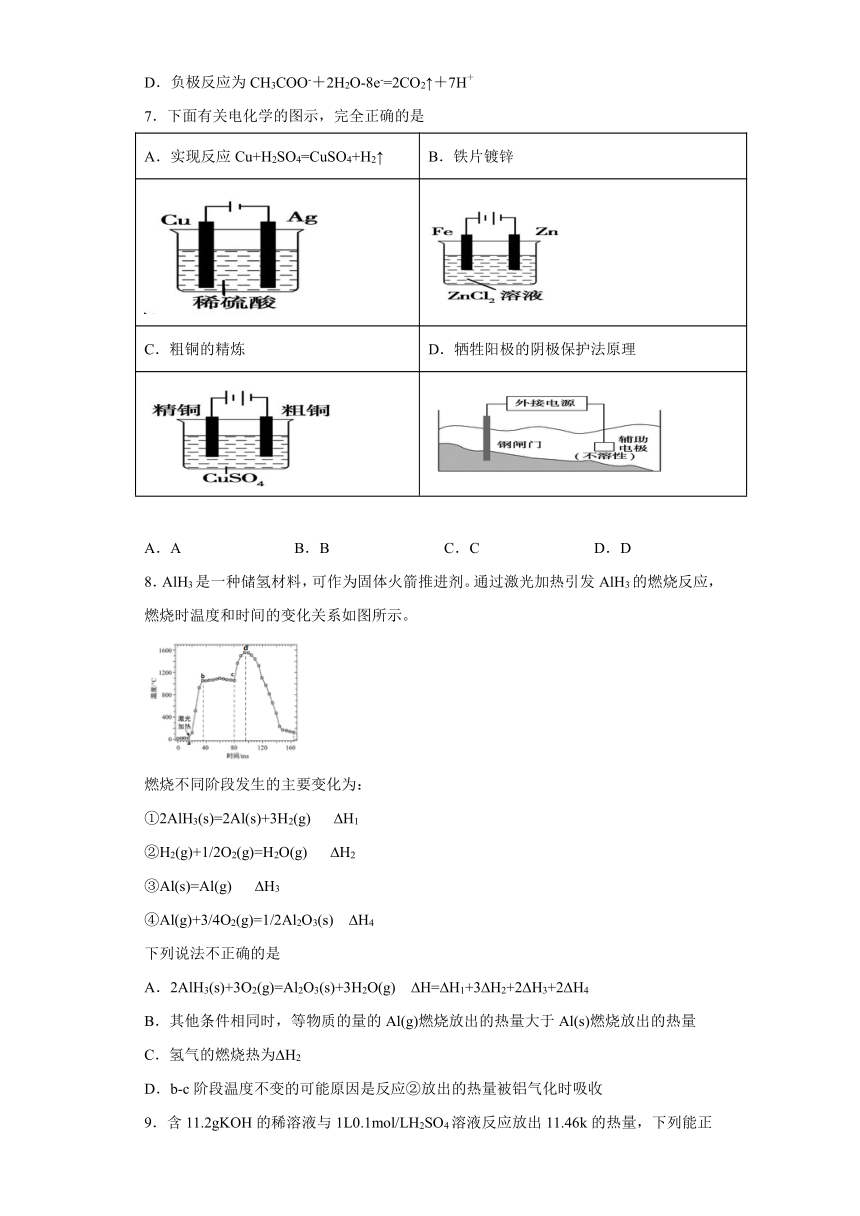
5.CO2辅助的Na—CO2电池工作原理如下图所示。该电池电容量大,能有效利用CO2,电池的总反应为。下列有关说法不正确的是
A.电路中每转移4mol电子,理论上要消耗67.2LCO2(标状)
B.放电时,正极反应为:
C.该电池可用硫酸溶液代替含NaClO4的有机溶液
D.放电时,ClO向b极移动
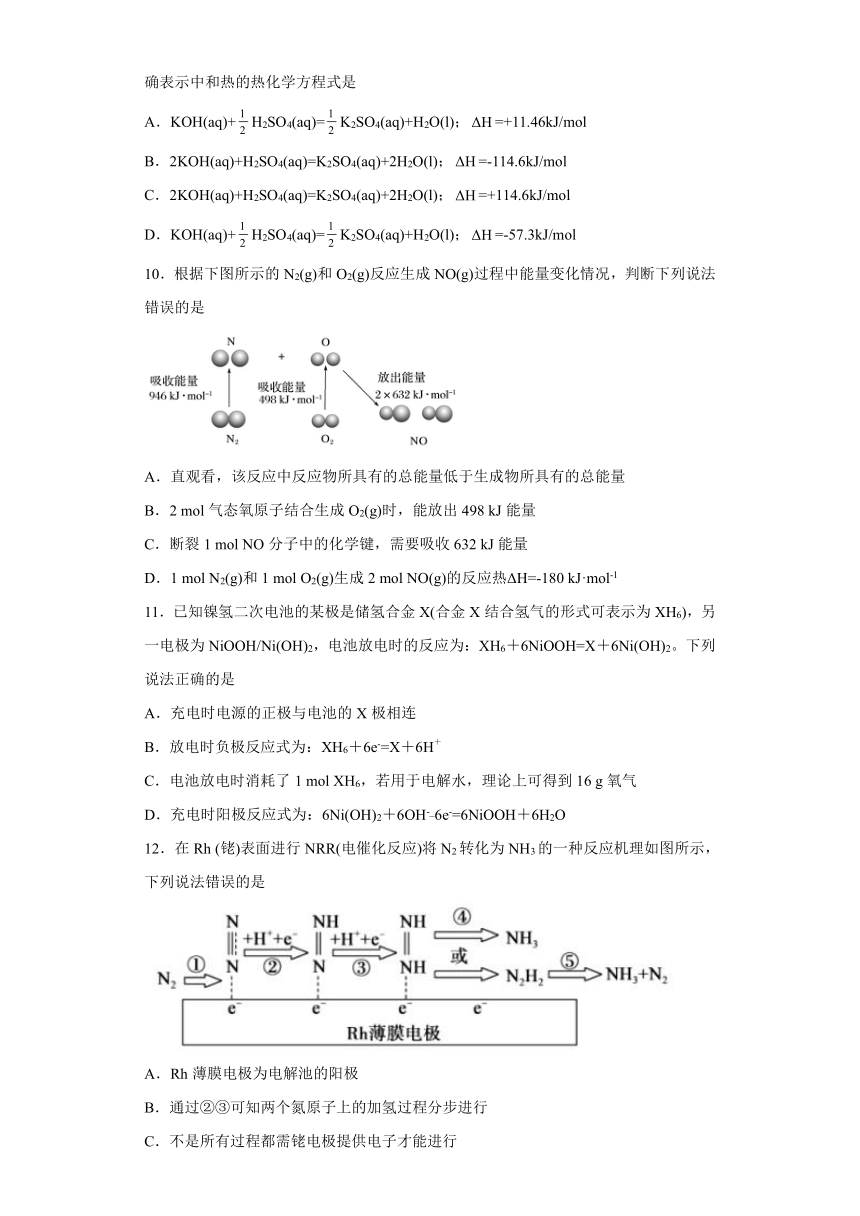
6.微生物脱盐电池是高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以NaCl溶液模拟海水,采用惰性电极,用下图装置处理有机废水(以含CH3COO-的溶液为例)。下列说法错误的是
A.隔膜1为阳离子交换膜,隔膜2为阴离子交换膜
B.电池工作一段时间后,正、负极产生气体的物质的量之比为2:1
C.当电路中转移1 mol电子时,模拟海水理论上除盐58.5 g
D.负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+
7.下面有关电化学的图示,完全正确的是
A.实现反应Cu+H2SO4=CuSO4+H2↑ B.铁片镀锌
C.粗铜的精炼 D.牺牲阳极的阴极保护法原理
A.A B.B C.C D.D
8.AlH3是一种储氢材料,可作为固体火箭推进剂。通过激光加热引发AlH3的燃烧反应,燃烧时温度和时间的变化关系如图所示。
燃烧不同阶段发生的主要变化为:
①2AlH3(s)=2Al(s)+3H2(g) H1
②H2(g)+1/2O2(g)=H2O(g) H2
③Al(s)=Al(g) H3
④Al(g)+3/4O2(g)=1/2Al2O3(s) H4
下列说法不正确的是
A.2AlH3(s)+3O2(g)=Al2O3(s)+3H2O(g) H= H1+3 H2+2 H3+2 H4
B.其他条件相同时,等物质的量的Al(g)燃烧放出的热量大于Al(s)燃烧放出的热量
C.氢气的燃烧热为 H2
D.b-c阶段温度不变的可能原因是反应②放出的热量被铝气化时吸收
9.含11.2gKOH的稀溶液与1L0.1mol/LH2SO4溶液反应放出11.46k的热量,下列能正确表示中和热的热化学方程式是
A.KOH(aq)+H2SO4(aq)=K2SO4(aq)+H2O(l);=+11.46kJ/mol
B.2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(l);=-114.6kJ/mol
C.2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(l);=+114.6kJ/mol
D.KOH(aq)+H2SO4(aq)=K2SO4(aq)+H2O(l);=-57.3kJ/mol
10.根据下图所示的N2(g)和O2(g)反应生成NO(g)过程中能量变化情况,判断下列说法错误的是
A.直观看,该反应中反应物所具有的总能量低于生成物所具有的总能量
B.2 mol气态氧原子结合生成O2(g)时,能放出498 kJ能量
C.断裂1 mol NO分子中的化学键,需要吸收632 kJ能量
D.1 mol N2(g)和1 mol O2(g)生成2 mol NO(g)的反应热ΔH=-180 kJ·mol-1
11.已知镍氢二次电池的某极是储氢合金X(合金X结合氢气的形式可表示为XH6),另一电极为NiOOH/Ni(OH)2,电池放电时的反应为:XH6+6NiOOH=X+6Ni(OH)2。下列说法正确的是
A.充电时电源的正极与电池的X极相连
B.放电时负极反应式为:XH6+6e-=X+6H+
C.电池放电时消耗了1 mol XH6,若用于电解水,理论上可得到16 g氧气
D.充电时阳极反应式为:6Ni(OH)2+6OH-_6e-=6NiOOH+6H2O
12.在Rh (铑)表面进行NRR(电催化反应)将N2转化为NH3的一种反应机理如图所示,下列说法错误的是
A.Rh薄膜电极为电解池的阳极
B.通过②③可知两个氮原子上的加氢过程分步进行
C.不是所有过程都需铑电极提供电子才能进行
D.反应⑤每转移2mol电子,生成22.4LN2(标准状况下)
13.光电池在光照条件下可产生电压,如图所示装置可实现光能的充分利用。双极膜复合层间的H2O能解离为H+和OH-,且双极膜能实现H+和OH-的定向通过。下列说法正确的是
A.该装置的能量转化形式只有电能转化为化学能
B.再生池中的反应为2V2++2H2O=2V3++2OH-+H2↑
C.当阳极生成22.4LO2时,电路中转移电子数为4NA
D.光照过程中阳极区溶液中的n(OH-)基本不变
14.已知:
①Sn(s,白)
②Sn(s,灰)
③Sn(s,灰)Sn(s,白)
下列说法不正确的是
A.灰锡与白锡互为同素异形体 B.锡在标准状况下以灰锡状态存在
C.反应①是放热反应 D.
15.下列叙述不正确的是
A.用天然气火力发电时,每一步都需要化学反应来完成
B.利用太阳能、风能等清洁能源代替化石燃料,有利于节约资源,保护环境
C.化学键的断裂和形成是化学反应中能量变化的主要原因
D.化学反应必然伴随着能量变化
二、填空题(共8题)
16.用Cu+2FeCl3 =CuCl2+2FeCl2反应,设计一个原电池。
(1)正极材料选用_______,正极反应式为_______负极材料选用_______,负极反应式为_______
(2)电解液为_______
(3)画出你设计的实验装置图并用箭头标出电子流动的方向,指出正负极的位置_____
17.化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效广谱的灭菌消毒剂。某化学小组针对氯气及其化合物展开以下实验:氯碱工业是工业上制备氯气的主要方法,该实验小组采用如下图所示的装置来模拟工业制取氯气。回答下列问题:
(1)氯气的逸出口是_______(填“a”或“b”),为了获得比较纯净的NaOH溶液,电解过程中最好选用_______离子交换膜(填“阴”或“阳”),电解过程总反应的离子方程式为_______。
(2)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为_______
18.(1)如图为某原电池装置示意图,若A为Cu,B为石墨,电解质为FeCl3溶液,工作时的总反应为:2FeCl3+Cu=FeCl2+CuCl2.写出B的电极反应式___________;该电池在工作时,A电极的质量将___________(填“增加”或“减少”或“不变”)。
(2)一种新型燃料电池可用于制取乙醛(CH3CHO),总反应式为,电池的主要构成要素如图所示,请回答下列问题:
①该装置的能量转化形式为___________。
②a电极为燃料电池的___________极,该电极的电极反应式为___________。
③电池工作时,H+由___________电极(填“a”或“b”,下同)移向___________电极。
④生成3.3g乙醛时,需要消耗标准状况下的氧气___________mL。
19.下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。
(1)表中字母h元素在周期表中位置___。
(2)写出b元素的最高价氧化物对应的水化物所含化学键类型___。
(3)下列事实能说明a元素的非金属性比c元素的非金属性强的有___。
A.a单质与c的氢化物溶液反应,溶液变浑浊
B.在氧化还原反应中,1mola单质比1molc单质得电子数目多
C.a和c两元素的简单氢化物受热分解,前者的分解温度高
(4)g与h两元素的单质反应生成1molg的最高价化合物。恢复至室温,放热687kJ。已知该化合物的熔、沸点分别为-69℃和58℃。写出该反应的热化学方程式___。
(5)常温下d遇浓硫酸形成致密氧化膜,若薄膜为具有磁性的该元素氧化物,写出该反应的化学方程式___。
(6)e与f形成的1mol化合物Q与水反应,生成2mol氢氧化物和1mol烃,该烃分子中碳氢质量比为9∶1,写出烃分子电子式___。
20.已知D、M、H是常见得非金属单质,其中M是无色气体,H是有色气体。J是一种金属单质(其同族的某种元素是形成化合物种类最多的元素),A、C是金属氧化物,C和J均是某种常见电池的电极材料,J元素的+2价化合物比+4价化合物稳定,B与C反应时,每生成1molH同时消耗4molB和1molC。K只知含有CO或CO2中的一种或两种。它们关系如下图所示:
(1)写出A物质中所含金属元素在周期表中的位置:_________________。
(2)写出化合物L的电子式:______________ 反应②的化学方程式为_________________。
(3)向图中的红褐色透明液体中逐滴滴入HI溶液,可以观察到先产生红褐色沉淀,后红褐色沉淀溶解,红褐色沉淀溶解的离子方程式为_______________。
(4)由金属氧化物A和C得到其相应的金属,在冶金工业上一般可用_______________(填序号)方法
①热还原法 ②电解法 ③热分解法
其中从A得到其相应金属也可用铝热法,若反应中1molA参加反应,转移电子的物质的量为________mol。
(5)用C、J作电极,与硫酸构成如图所示原电池,负极的电极反应为__________,当反应转移2mol电子时,负极质量增加______克。
21.氢气作为一种清洁能源,一直是能源研究的热点,工业上制取氢气有多种方法:
①C(s)+H2O(g)=CO(g)+H2(g) △H1=
②CH4 (g)+CO2(g)=2CO(g)+2H2 (g) △H2=
③CH4 (g)+H2O(g)=CO(g)+3H2 (g) △H3=
④CH3OH(1)=CO(g)+2H2 (g) △H4=
(1)根据以上数据,请写出CH4(g)分解生成C(s)和H2(g)的热化学方程式______。
(2)几种化学键的键能如下表所示:
化学键 C=O H—H C—H O—H
键能/kJ·mol-1 803 436 x 414 463
根据以上有关反应的△H,计算 x=______。
(3)我国科学家通过计算机模拟,研究了在某催化剂表面上发生反应④的反应历程(吸附在催化剂表面的物质,用"*"标注)。甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式Ⅰ:
方式Ⅱ:
活化能E值推测,甲醇脱氢过程中主要历程的方式为______(填"Ⅰ"或"Ⅱ")。计算机模拟的各步反应的能量变化示意图如下。
该历程中最大能垒(活化能)E正=______ kJ/mol,写出该步骤的化学方程式______。
22.用50mL0.50 mol·L-1盐酸与50mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是:___________。
(2)烧杯间填满碎纸条的作用是:_________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值_________(填“偏大、偏小、无影响”)
(4)如果用60mL0.50 mol·L-1盐酸与50mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等、不相等”),所求中和热________(填“偏大、偏小、无影响”)
23.某化学兴趣小组的几位同学探究原电池原理的应用时,做了如图的实验:
I.原电池原理判断金属的活泼性
(1)实验前,甲同学认为“构成原电池的负极总是较活泼的金属材料”,若根据他的判断,两个装置中的Al都是___极;实际实验时发现两个装置中的电流表偏转方向不同,则以下的有关中判断正确的是___。
A.利用原电池反应判断金属活动性顺序时应注意选择合适的电解质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序已过时,已没有实用价值
D.该实验说明化学研究对象复杂,反应受条件影响较大,故应具体问题具体分析
(2)乙同学利用打磨过的铜片和铝片设计了如图的实验装置,并测量和绘制了原电池的电流(I)随时间(t)的变化曲线(极短时间电流反转),则图中t1时刻之后阶段,负极材料是___。
II.铜与浓硝酸反应探究
(3)乙同学又将铜片直接放入浓硝酸中:
①实验现象为___,溶液显绿色。
②待反应停止后,若铜有剩余,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,原因是___(用离子方程式表示)。
(4)电化学降解NO的原理如题图所示。
电源正极为___(填“A”或“B”),阳极的电极反应式为___。
参考答案
1.B 2.D 3.B 4.C 5.C 6.A 7.A 8.C 9.D 10.D 11.D 12.A 13.D 14.D 15.A
16.石墨或惰性金属 Fe3++e-=Fe2+ Cu Cu-2e-=Cu2+ FeCl3溶液
17.a 阳 2Cl-+2H2OCl2↑+H2↑+2OH- 2Cl2+HgO= HgCl2+Cl2O
18.2Fe3++2e-=2Fe2+(Fe3++e-=Fe2+) 减小 化学能转化为电能 正 b a 840
19.第三周期、ⅦA族 离子键、(极性)共价键 AC Si(s)+2Cl2(g)=SiCl4(l) H= -687kJ·mol-1 3Fe+4H2SO4(浓)=Fe3O4+4SO2↑+4H2O
20.第四周期第Ⅷ族 PbO2+4HCl(浓)PbCl2+Cl2↑+2H2O 2Fe(OH)3+2I +6H+=I2+2Fe2++6H2O ① 8mol Pb 2e +SO42-=PbSO4 96
21.CH4(g)═C(s)+2H2(g) △H=+75 kJ/mol 1068 Ⅰ 179.6 CO*+4H*= CO*+2H2(g)[或4H*= 2H2(g)]
22.环形玻璃搅拌棒 减少实验过程中的热量损失 偏小 不相等 无影响
23.正 AD Cu 铜片逐渐溶解,有红棕色气体生成 3Cu+8H++3NO=3Cu2++2NO↑+4H2O A 2H2O-4e-=O2↑+4H+(或4OH--4e-=O2↑+2H2O)
一、单选题(共15题)
1.化学与人类生活密切相关。下列说法正确的是
A.单质Si用于制作光导纤维和光电池
B.常温下,浓硫酸可以用铁槽车运输
C.SO2的漂白没有涉及到化学变化
D.日常生产生活中钢铁的腐蚀主要原因不是电化学腐蚀
2.在盛有稀H2SO4的烧杯中放入用导线连接锌片和铜片,下列叙述正确的是
A.SO向铜片移动 B.电子通过导线由铜片流向锌片
C.正极有O2逸出 D.铜片上有H2逸出
3.萘四甲酸二酐(NTCDA)展现出高比容量,放电原理为2NaxCn+x→2nC+x,装置如图。下列说法正确的是
A.放电时,Na+向N移动
B.放电时,负极电极反应:NaxCn-xe-=nC+xNa+
C.充电时,M与电源的负极相连
D.充电时,阴极电极反应:x+2e-+2Na+
4.《Science》杂志报道了王浩天教授团队发明的制取H2O2的绿色方法,原理如图所示(已知:H2O2H++HO,Ka=2.4×10-12)。下列说法正确的是
A.X膜为阴离子交换膜 B.每生成1molH2O2外电路通过4mole—
C.催化剂可加快单位时间内反应中电子的转移数目 D.a极上发生还原反应
5.CO2辅助的Na—CO2电池工作原理如下图所示。该电池电容量大,能有效利用CO2,电池的总反应为。下列有关说法不正确的是
A.电路中每转移4mol电子,理论上要消耗67.2LCO2(标状)
B.放电时,正极反应为:
C.该电池可用硫酸溶液代替含NaClO4的有机溶液
D.放电时,ClO向b极移动
6.微生物脱盐电池是高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以NaCl溶液模拟海水,采用惰性电极,用下图装置处理有机废水(以含CH3COO-的溶液为例)。下列说法错误的是
A.隔膜1为阳离子交换膜,隔膜2为阴离子交换膜
B.电池工作一段时间后,正、负极产生气体的物质的量之比为2:1
C.当电路中转移1 mol电子时,模拟海水理论上除盐58.5 g
D.负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+
7.下面有关电化学的图示,完全正确的是
A.实现反应Cu+H2SO4=CuSO4+H2↑ B.铁片镀锌
C.粗铜的精炼 D.牺牲阳极的阴极保护法原理
A.A B.B C.C D.D
8.AlH3是一种储氢材料,可作为固体火箭推进剂。通过激光加热引发AlH3的燃烧反应,燃烧时温度和时间的变化关系如图所示。
燃烧不同阶段发生的主要变化为:
①2AlH3(s)=2Al(s)+3H2(g) H1
②H2(g)+1/2O2(g)=H2O(g) H2
③Al(s)=Al(g) H3
④Al(g)+3/4O2(g)=1/2Al2O3(s) H4
下列说法不正确的是
A.2AlH3(s)+3O2(g)=Al2O3(s)+3H2O(g) H= H1+3 H2+2 H3+2 H4
B.其他条件相同时,等物质的量的Al(g)燃烧放出的热量大于Al(s)燃烧放出的热量
C.氢气的燃烧热为 H2
D.b-c阶段温度不变的可能原因是反应②放出的热量被铝气化时吸收
9.含11.2gKOH的稀溶液与1L0.1mol/LH2SO4溶液反应放出11.46k的热量,下列能正确表示中和热的热化学方程式是
A.KOH(aq)+H2SO4(aq)=K2SO4(aq)+H2O(l);=+11.46kJ/mol
B.2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(l);=-114.6kJ/mol
C.2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(l);=+114.6kJ/mol
D.KOH(aq)+H2SO4(aq)=K2SO4(aq)+H2O(l);=-57.3kJ/mol
10.根据下图所示的N2(g)和O2(g)反应生成NO(g)过程中能量变化情况,判断下列说法错误的是
A.直观看,该反应中反应物所具有的总能量低于生成物所具有的总能量
B.2 mol气态氧原子结合生成O2(g)时,能放出498 kJ能量
C.断裂1 mol NO分子中的化学键,需要吸收632 kJ能量
D.1 mol N2(g)和1 mol O2(g)生成2 mol NO(g)的反应热ΔH=-180 kJ·mol-1
11.已知镍氢二次电池的某极是储氢合金X(合金X结合氢气的形式可表示为XH6),另一电极为NiOOH/Ni(OH)2,电池放电时的反应为:XH6+6NiOOH=X+6Ni(OH)2。下列说法正确的是
A.充电时电源的正极与电池的X极相连
B.放电时负极反应式为:XH6+6e-=X+6H+
C.电池放电时消耗了1 mol XH6,若用于电解水,理论上可得到16 g氧气
D.充电时阳极反应式为:6Ni(OH)2+6OH-_6e-=6NiOOH+6H2O
12.在Rh (铑)表面进行NRR(电催化反应)将N2转化为NH3的一种反应机理如图所示,下列说法错误的是
A.Rh薄膜电极为电解池的阳极
B.通过②③可知两个氮原子上的加氢过程分步进行
C.不是所有过程都需铑电极提供电子才能进行
D.反应⑤每转移2mol电子,生成22.4LN2(标准状况下)
13.光电池在光照条件下可产生电压,如图所示装置可实现光能的充分利用。双极膜复合层间的H2O能解离为H+和OH-,且双极膜能实现H+和OH-的定向通过。下列说法正确的是
A.该装置的能量转化形式只有电能转化为化学能
B.再生池中的反应为2V2++2H2O=2V3++2OH-+H2↑
C.当阳极生成22.4LO2时,电路中转移电子数为4NA
D.光照过程中阳极区溶液中的n(OH-)基本不变
14.已知:
①Sn(s,白)
②Sn(s,灰)
③Sn(s,灰)Sn(s,白)
下列说法不正确的是
A.灰锡与白锡互为同素异形体 B.锡在标准状况下以灰锡状态存在
C.反应①是放热反应 D.
15.下列叙述不正确的是
A.用天然气火力发电时,每一步都需要化学反应来完成
B.利用太阳能、风能等清洁能源代替化石燃料,有利于节约资源,保护环境
C.化学键的断裂和形成是化学反应中能量变化的主要原因
D.化学反应必然伴随着能量变化
二、填空题(共8题)
16.用Cu+2FeCl3 =CuCl2+2FeCl2反应,设计一个原电池。
(1)正极材料选用_______,正极反应式为_______负极材料选用_______,负极反应式为_______
(2)电解液为_______
(3)画出你设计的实验装置图并用箭头标出电子流动的方向,指出正负极的位置_____
17.化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效广谱的灭菌消毒剂。某化学小组针对氯气及其化合物展开以下实验:氯碱工业是工业上制备氯气的主要方法,该实验小组采用如下图所示的装置来模拟工业制取氯气。回答下列问题:
(1)氯气的逸出口是_______(填“a”或“b”),为了获得比较纯净的NaOH溶液,电解过程中最好选用_______离子交换膜(填“阴”或“阳”),电解过程总反应的离子方程式为_______。
(2)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为_______
18.(1)如图为某原电池装置示意图,若A为Cu,B为石墨,电解质为FeCl3溶液,工作时的总反应为:2FeCl3+Cu=FeCl2+CuCl2.写出B的电极反应式___________;该电池在工作时,A电极的质量将___________(填“增加”或“减少”或“不变”)。
(2)一种新型燃料电池可用于制取乙醛(CH3CHO),总反应式为,电池的主要构成要素如图所示,请回答下列问题:
①该装置的能量转化形式为___________。
②a电极为燃料电池的___________极,该电极的电极反应式为___________。
③电池工作时,H+由___________电极(填“a”或“b”,下同)移向___________电极。
④生成3.3g乙醛时,需要消耗标准状况下的氧气___________mL。
19.下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。
(1)表中字母h元素在周期表中位置___。
(2)写出b元素的最高价氧化物对应的水化物所含化学键类型___。
(3)下列事实能说明a元素的非金属性比c元素的非金属性强的有___。
A.a单质与c的氢化物溶液反应,溶液变浑浊
B.在氧化还原反应中,1mola单质比1molc单质得电子数目多
C.a和c两元素的简单氢化物受热分解,前者的分解温度高
(4)g与h两元素的单质反应生成1molg的最高价化合物。恢复至室温,放热687kJ。已知该化合物的熔、沸点分别为-69℃和58℃。写出该反应的热化学方程式___。
(5)常温下d遇浓硫酸形成致密氧化膜,若薄膜为具有磁性的该元素氧化物,写出该反应的化学方程式___。
(6)e与f形成的1mol化合物Q与水反应,生成2mol氢氧化物和1mol烃,该烃分子中碳氢质量比为9∶1,写出烃分子电子式___。
20.已知D、M、H是常见得非金属单质,其中M是无色气体,H是有色气体。J是一种金属单质(其同族的某种元素是形成化合物种类最多的元素),A、C是金属氧化物,C和J均是某种常见电池的电极材料,J元素的+2价化合物比+4价化合物稳定,B与C反应时,每生成1molH同时消耗4molB和1molC。K只知含有CO或CO2中的一种或两种。它们关系如下图所示:
(1)写出A物质中所含金属元素在周期表中的位置:_________________。
(2)写出化合物L的电子式:______________ 反应②的化学方程式为_________________。
(3)向图中的红褐色透明液体中逐滴滴入HI溶液,可以观察到先产生红褐色沉淀,后红褐色沉淀溶解,红褐色沉淀溶解的离子方程式为_______________。
(4)由金属氧化物A和C得到其相应的金属,在冶金工业上一般可用_______________(填序号)方法
①热还原法 ②电解法 ③热分解法
其中从A得到其相应金属也可用铝热法,若反应中1molA参加反应,转移电子的物质的量为________mol。
(5)用C、J作电极,与硫酸构成如图所示原电池,负极的电极反应为__________,当反应转移2mol电子时,负极质量增加______克。
21.氢气作为一种清洁能源,一直是能源研究的热点,工业上制取氢气有多种方法:
①C(s)+H2O(g)=CO(g)+H2(g) △H1=
②CH4 (g)+CO2(g)=2CO(g)+2H2 (g) △H2=
③CH4 (g)+H2O(g)=CO(g)+3H2 (g) △H3=
④CH3OH(1)=CO(g)+2H2 (g) △H4=
(1)根据以上数据,请写出CH4(g)分解生成C(s)和H2(g)的热化学方程式______。
(2)几种化学键的键能如下表所示:
化学键 C=O H—H C—H O—H
键能/kJ·mol-1 803 436 x 414 463
根据以上有关反应的△H,计算 x=______。
(3)我国科学家通过计算机模拟,研究了在某催化剂表面上发生反应④的反应历程(吸附在催化剂表面的物质,用"*"标注)。甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式Ⅰ:
方式Ⅱ:
活化能E值推测,甲醇脱氢过程中主要历程的方式为______(填"Ⅰ"或"Ⅱ")。计算机模拟的各步反应的能量变化示意图如下。
该历程中最大能垒(活化能)E正=______ kJ/mol,写出该步骤的化学方程式______。
22.用50mL0.50 mol·L-1盐酸与50mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是:___________。
(2)烧杯间填满碎纸条的作用是:_________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值_________(填“偏大、偏小、无影响”)
(4)如果用60mL0.50 mol·L-1盐酸与50mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等、不相等”),所求中和热________(填“偏大、偏小、无影响”)
23.某化学兴趣小组的几位同学探究原电池原理的应用时,做了如图的实验:
I.原电池原理判断金属的活泼性
(1)实验前,甲同学认为“构成原电池的负极总是较活泼的金属材料”,若根据他的判断,两个装置中的Al都是___极;实际实验时发现两个装置中的电流表偏转方向不同,则以下的有关中判断正确的是___。
A.利用原电池反应判断金属活动性顺序时应注意选择合适的电解质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序已过时,已没有实用价值
D.该实验说明化学研究对象复杂,反应受条件影响较大,故应具体问题具体分析
(2)乙同学利用打磨过的铜片和铝片设计了如图的实验装置,并测量和绘制了原电池的电流(I)随时间(t)的变化曲线(极短时间电流反转),则图中t1时刻之后阶段,负极材料是___。
II.铜与浓硝酸反应探究
(3)乙同学又将铜片直接放入浓硝酸中:
①实验现象为___,溶液显绿色。
②待反应停止后,若铜有剩余,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,原因是___(用离子方程式表示)。
(4)电化学降解NO的原理如题图所示。
电源正极为___(填“A”或“B”),阳极的电极反应式为___。
参考答案
1.B 2.D 3.B 4.C 5.C 6.A 7.A 8.C 9.D 10.D 11.D 12.A 13.D 14.D 15.A
16.石墨或惰性金属 Fe3++e-=Fe2+ Cu Cu-2e-=Cu2+ FeCl3溶液
17.a 阳 2Cl-+2H2OCl2↑+H2↑+2OH- 2Cl2+HgO= HgCl2+Cl2O
18.2Fe3++2e-=2Fe2+(Fe3++e-=Fe2+) 减小 化学能转化为电能 正 b a 840
19.第三周期、ⅦA族 离子键、(极性)共价键 AC Si(s)+2Cl2(g)=SiCl4(l) H= -687kJ·mol-1 3Fe+4H2SO4(浓)=Fe3O4+4SO2↑+4H2O
20.第四周期第Ⅷ族 PbO2+4HCl(浓)PbCl2+Cl2↑+2H2O 2Fe(OH)3+2I +6H+=I2+2Fe2++6H2O ① 8mol Pb 2e +SO42-=PbSO4 96
21.CH4(g)═C(s)+2H2(g) △H=+75 kJ/mol 1068 Ⅰ 179.6 CO*+4H*= CO*+2H2(g)[或4H*= 2H2(g)]
22.环形玻璃搅拌棒 减少实验过程中的热量损失 偏小 不相等 无影响
23.正 AD Cu 铜片逐渐溶解,有红棕色气体生成 3Cu+8H++3NO=3Cu2++2NO↑+4H2O A 2H2O-4e-=O2↑+4H+(或4OH--4e-=O2↑+2H2O)
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
