2021-2022学年高二化学鲁科版(2019)选择性必修2第一章《原子结构与元素性质》检测题(含答案)
文档属性
| 名称 | 2021-2022学年高二化学鲁科版(2019)选择性必修2第一章《原子结构与元素性质》检测题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 418.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-11 21:04:48 | ||
图片预览




文档简介
第一章《原子结构与元素性质》检测题
一、单选题(共15题)
1.砷(As)原子核内含有33个质子,下列叙述正确的是
A.砷元素位于元素周期表中第四周期VA族
B.砷是一种金属元素,有半导体的性能
C.AsH3的稳定性比NH3的稳定性强
D.H3AsO4是一种强酸
2.某元素的原子最外层电子排布是6s26p4,该元素或其化合物不可能具有的性质是
A.该元素单质可能是导体
B.该元素的最高化合价呈+6价
C.该元素能与氢气反应生成气态氢化物
D.基态该原子的价电子排布图为
3.下列事实能证明碳的非金属性比硅强的是
①Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3
②SiO2+2CSi+2CO↑
③Na2CO3+SiO2Na2SiO3+CO2↑
④CH4比SiH4稳定
A.①④ B.②③ C.③④ D.①②③④
4.下列各组原子中,彼此化学性质一定相似的是
A.2p轨道上只有两个电子的X原子与3p轨道上只有两个电子的Y原子
B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
C.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子
D.最外层都只有一个电子的X、Y原子
5.短周期主族元素W、X、Y、Z的原子序数依次增大,其中只有一种金属元素,X原子的K层与M层电子数相等,W原子的最外层电子数等于X原子与Y原子的最外层电子数之和。W、Z不同主族且单质通常均为气体。下列说法正确的是
A.原子半径:W>X>Y>Z
B.W与Y形成的化合物只能与碱反应
C.Z单质的危险品标志为
D.X与Y的固体单质均能导电
6.下列说法中不正确的是
A.IBr分子中,Br为-1价
B.某元素原子的价电子排布为nsn-2npn+1,该元素位于第4周期ⅦA族
C.基态18O原子中有8种运动状态完全不同的电子
D.2p3表示2p能级有三个轨道
7.13Al、12Mg、16S、17Cl是周期表中的短周期主族元素。下列有关说法正确的是
A.元素S在周期表中位于第4周期ⅢA族
B.元素S的简单气态氢化物的化学式为H2S
C.第一电离能:I1(Mg)D.最高价氧化物的水化物的碱性:Mg(OH)28.下列说法正确的是
A.目前ds区的元素种数最少
B.目前f区的元素种数最少
C.p区的元素的原子最后排布的电子均在p能级上
D.s区元素全部是金属元素
9.已知W、X、Y、Z为短周期元素,原子序数依次增大。W、Z同主族,X、Y、Z同周期,其中只有X为金属元素。下列说法一定错误的是
A.电负性:W>Z>Y>X
B.气态氢化物熔沸点:W > Z
C.简单离子的半径:W>X>Z
D.若X与W原子序数之差为5,则形成化合物的化学式为X3W2
10.短周期主族元素X、Y、Z、W的原子序数依次增大。X可分别和Y、Z、W形成含18个电子的型分子,且X与Y、Z与W均可形成如图所示结构的分子。下列说法正确的是
A.简单离子的半径:
B.第一电离能:
C.简单气态氢化物的热稳定性:
D.单质的沸点:
11.X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z原子的最外层电子数是内层电子总数的3倍。下列有关叙述正确的是
A.Y原子的价层电子排布式为3s23p5 B.稳定性:Y的氢化物>Z的氢化物
C.第一电离能:Y<Z D.X、Y两元素形成的化合物为离子化合物
12.下列各项叙述正确的是
A.Na原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态
B.价电子排布为4s24p3的元素位于第四周期第IIIA族,属于金属元素
C.所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同
D.29Cu原子的电子排布图是1s22s22p63s23p63d104s1
13.某新型电池材料结构如图,其中除外均满足8电子稳定结构,、、、、是同周期主族元素,的最外层电子数是的最外层电子数的2倍。下列说法正确的是
A.和的单质反应能生成
B.最简单氢化物的稳定性:
C.电负性:
D.化合物中所有原子在同一平面上
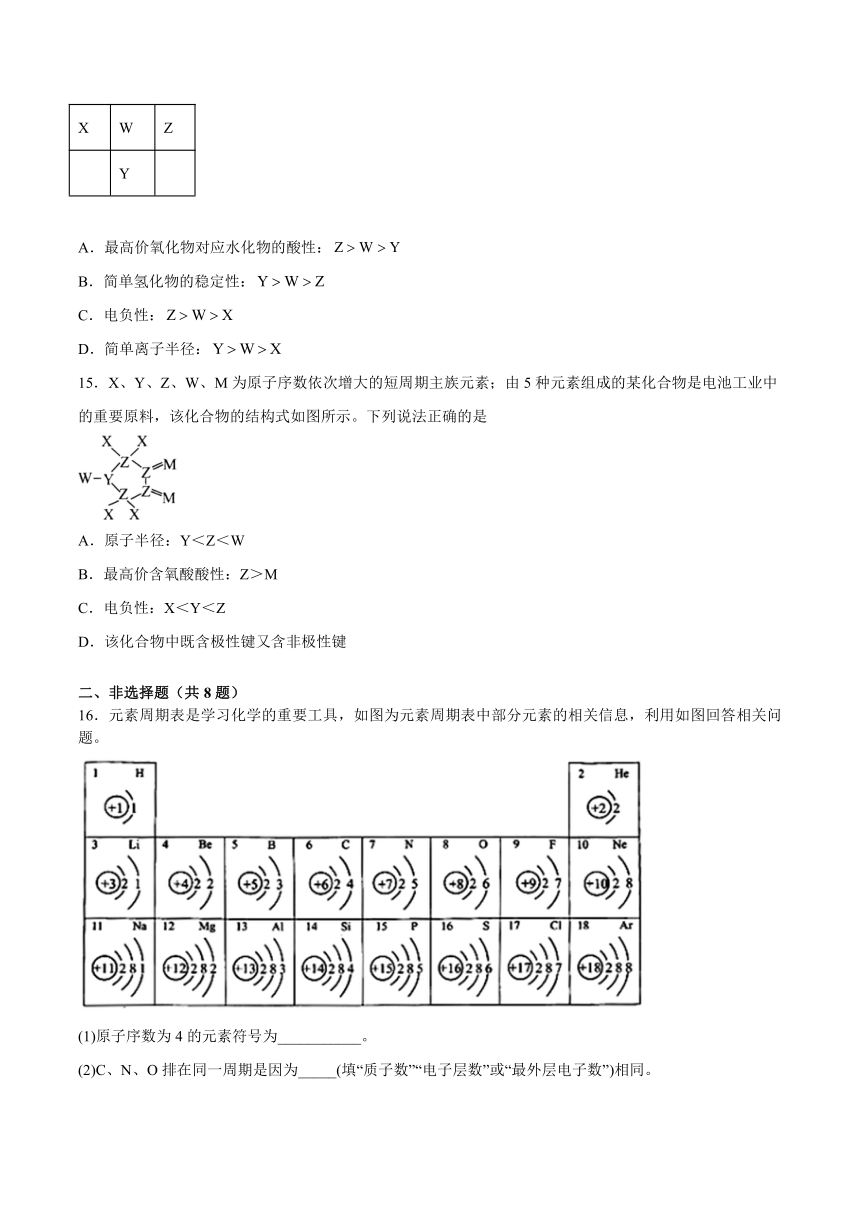
14.短周期元素X、Y、Z、W在元素周期表中的位置如图所示,已知X、Z的原子核外电子数之和等于Y的核外电子数。下列判断正确的是
X W Z
Y
A.最高价氧化物对应水化物的酸性:
B.简单氢化物的稳定性:
C.电负性:
D.简单离子半径:
15.X、Y、Z、W、M为原子序数依次增大的短周期主族元素;由5种元素组成的某化合物是电池工业中的重要原料,该化合物的结构式如图所示。下列说法正确的是
A.原子半径:Y<Z<W
B.最高价含氧酸酸性:Z>M
C.电负性:X<Y<Z
D.该化合物中既含极性键又含非极性键
二、非选择题(共8题)
16.元素周期表是学习化学的重要工具,如图为元素周期表中部分元素的相关信息,利用如图回答相关问题。
(1)原子序数为4的元素符号为___________。
(2)C、N、O排在同一周期是因为_____(填“质子数”“电子层数”或“最外层电子数”)相同。
(3)He和Mg的化学性质_______(填“相似”或“不相似”)。
(4)画出Na+的结构示意图_____。
(5)一个磷原子含有_____个质子,一个NH含有_____个电子。
17.(1)某质量数为32,核内有16个中子的原子,其电子排布式是______,该原子中有______个未成对电子,这些未成对电子具有______(填“相同”或“不同”)的自旋状态。
(2)某元素基态原子的最外层电子排布式为,它的次外层电子的电子云形状有______种,该原子中所有电子占有______个轨道,核外共有______个电子。
(3)M能层上有______个能级,有______个轨道,作为内层时最多可容纳______个电子,作为最外层时最多可含有______个未成对电子。
(4)在元素周期表中,最外层只有1个未成对电子的主族元素位于______族;最外层有2个未成对电子的主族元素位于______族。
18.下表为元素周期表的一部分,用请化学用语回答有关问题:
IA IIA IIIA IVA VA VIA VIIA 0
2 E F
3 A C D G R
4 B H
(1)C的元素符号是___________________;
(2)表中A与F的简单氢化物反应的化学方程式____________________________,E的单质与其下一周期同族元素的最高价氧化物在高温下反应的化学方程式_______________________________;
(3)表中所列元素中最高价氧化物对应水化物酸性最强的是__________________ (填写化学式)
(4)表中能形成的两性氢氧化物与A的最高价氧化物对应水化物反应的离子方程式____________________________________________________________。
19.有原子序数小于20的A、B、C、D、E、F六种元素,它们的原子序数依次增大. 已知B元素是地壳中含量最多的元素; A和C的价电子数相同,B和D的价电子数也相同,且A和C两元素原子核外电子数之和是B、D两元素原子核内质子数之和的二分之一;C、D、E三种元素的基态原子具有相同的电子层数,且E原子的p轨道上电子数比D原子的p轨道上多一个电子;六种元素的基态原子中,F原子的电子层数最多且和A处在同一主族.回答下列问题:
(1)写出基态F原子的核外电子排布式____________
(2)A、B、C共同形成的化合物中化学键的类型____________。
20.下表是元素周期表的一部分,回答下列有关问题(用化学符号回答):
H He
① ② ③ ④
⑤ ⑥ ⑦ ⑧ ⑨
(1)①~⑨元素中,非金属性最强的元素是___________(填元素符号)。
(2)⑥⑨两种元素的原子半径较大的是___________(填元素符号)。
(3)⑧号元素形成的氢化物中含___________(填“极性”或“非极性”)共价键。
(4)写出元素②的单质的电子式___________。
(5)元素①和元素③以1∶2的个数比形成化合物,写出该物质的结构式___________。
(6)①~⑨元素的最高价氧化物对应的水化物中,碱性最强的是___________(填化学式),呈两性的是___________(填化学式)。
21.某同学设计实验以探究元素性质的递变规律。
实验I:根据元素最高价含氧酸的酸性强弱探究元素非金属性递变规律。利用下图装置一次性完成Cl、C、Si三种非金属元素的非金属性强弱比较的实验研究
(1)实验中选用的物质名称为: A_______。
(2)C处刚出现现象时发生反应的离子方程式为_______。
(3)根据实验现象推知,可得出碳、硅、氯三种元素非金属性的强弱顺序是_________。
实验II:已知常温下高锰酸钾与浓盐酸混合可产生氯气和Mn2+,利用下图装置探究卤族元素性质的递变规律,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。
(4)写出圆底烧瓶中发生反应的离子方程式:_______。
(5)B处的实验现象为_____。
(6)根据A、B两处的实验现象能否推出非金属性Cl>Br>I,______ (填“能”或“否”, 原因是_______。
22.某同学做元素周期律性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表(记录现象时随手记在了纸片上,不对应,需整理):
实验方案 实验现象
①砂纸打磨后的镁带与沸水反应,再向反应液中滴加酚酞溶液 A.浮于水面,熔成小球,在水面上无定向移动并随之消失,溶液变成红色
②向新制的H2S饱和溶液中滴加新制的氯水 B.产生大量气体,可在空气中燃烧,溶液变成浅红色
③钠与滴有酚酞溶液的冷水反应 C.反应不剧烈,产生的气体可以在空气中燃烧
④用砂纸打磨后的镁带与2 mol·L-1的盐酸反应 D.剧烈反应,产生的气体可以在空气中燃烧
⑤用砂纸打磨后的铝条与2 mol·L-1的盐酸反应 E.生成白色胶状沉淀,继而沉淀消失
⑥向氯化铝溶液中滴加氢氧化钠溶液 F.生成淡黄色沉淀
请帮助该同学整理并完成实验报告。
(1)实验目的:_______。
(2)实验用品:_______、_______、砂纸、镊子、小刀、胶头滴管等。
(3)实验内容:
实验方案(填序号) 实验现象(填字母) 有关化学方程式
③ _______ _______
_______ B _______
④ _______ _______
⑤ _______ _______
_______ E _______
_______ F _______
(4)实验结论:
金属性:_______。
非金属性:_______。
23.在复习元素周期律过程中,某研究性学习小组的几位同学拟通过具体的实验来探讨某些金属元素的性质差异,下面是他们设计的探究性实验方案,请填写下列空白:
(1)实验目的:比较钠、镁、铝金属性强弱。
(2)实验用品:试管、_______、酒精灯、试管夹、砂纸、滤纸、钠、镁条、铝片、酚酞、蒸馏水、6mol·L-1的盐酸。
(3)实验过程与现象记录
实验过程 预期现象 实际观察到的现象
a.取已切去表皮的一小块金属钠,放入盛有水的某容器中 立即剧烈反应 开始时钠块浮在水面上不反应,稍后才开始与水剧烈反应
b.向盛有适量水(内含2滴酚酞)的试管中加入一小段镁条 有气泡产生,溶液变成红色 没有相应现象,加热后仍无明显变化
c.向两支盛有3 mL 6 mol·L-1盐酸的试管中,分别加入大小相同的镁片和铝片 铝、镁与盐酸反应产生气泡剧烈程度不同 镁与盐酸反应产生气泡速率较快
I.甲同学的方案如下:
①你认为a、b两步实验中出现异常现象的可能原因是:
a._______
b._______
②上面的实验表明:钠、镁、铝三种元素的金属性由强到弱的顺序为_______
II.乙同学方案:他认为只需要一种试剂就可以确定钠、镁、铝的金属性强弱,预计他的主要实验操作是_______,写出镁与这种试剂反应的化学方程式:_______。
参考答案
1.A 2.C 3.A 4.A 5.D 6.D 7.B 8.A 9.C 10.D 11.C 12.C 13.D 14.C 15.D
16.Be 电子层数 不相似 15 10
17. 2 相同 2 8 14 3 9 18 3 ⅠA、ⅢA、ⅦA ⅣA、ⅥA
18.Mg 2Na+2H2O=2NaOH+H2↑ 2C+SiO2Si+2CO HClO4 Al(OH)3+OH-=AlO2-+2H2O
19.1s22s22p63s23p64s1 共价键 离子键
20.F Mg 极性 O=C=O NaOH Al(OH)3
21.高氯酸 +CO2+H2O=H2SiO3↓+ Cl> C> Si 2+16H++10C1-=2Mn2++5Cl2↑+8H2O 试纸变蓝 否 因Cl2也能将B处的KI氧化
22.验证Na、Mg、Al元素从左到右金属性递减,S、Cl元素从左到右非金属性递增的规律 试管 酒精灯 A ① D C ⑥ 、 ② Na>Mg>Al S23.烧杯或水槽 钠表面的煤油没有用滤纸吸干净 镁表面的氧化膜没有被除去 钠>镁>铝 用滤纸将一小块钠表面的煤油吸干后放入盛有水的烧杯中,将除了氧化膜的镁条、铝片分别放入盛有适量水的试管中并加热 Mg+2H2OMg(OH)2+H2↑
一、单选题(共15题)
1.砷(As)原子核内含有33个质子,下列叙述正确的是
A.砷元素位于元素周期表中第四周期VA族
B.砷是一种金属元素,有半导体的性能
C.AsH3的稳定性比NH3的稳定性强
D.H3AsO4是一种强酸
2.某元素的原子最外层电子排布是6s26p4,该元素或其化合物不可能具有的性质是
A.该元素单质可能是导体
B.该元素的最高化合价呈+6价
C.该元素能与氢气反应生成气态氢化物
D.基态该原子的价电子排布图为
3.下列事实能证明碳的非金属性比硅强的是
①Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3
②SiO2+2CSi+2CO↑
③Na2CO3+SiO2Na2SiO3+CO2↑
④CH4比SiH4稳定
A.①④ B.②③ C.③④ D.①②③④
4.下列各组原子中,彼此化学性质一定相似的是
A.2p轨道上只有两个电子的X原子与3p轨道上只有两个电子的Y原子
B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
C.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子
D.最外层都只有一个电子的X、Y原子
5.短周期主族元素W、X、Y、Z的原子序数依次增大,其中只有一种金属元素,X原子的K层与M层电子数相等,W原子的最外层电子数等于X原子与Y原子的最外层电子数之和。W、Z不同主族且单质通常均为气体。下列说法正确的是
A.原子半径:W>X>Y>Z
B.W与Y形成的化合物只能与碱反应
C.Z单质的危险品标志为
D.X与Y的固体单质均能导电
6.下列说法中不正确的是
A.IBr分子中,Br为-1价
B.某元素原子的价电子排布为nsn-2npn+1,该元素位于第4周期ⅦA族
C.基态18O原子中有8种运动状态完全不同的电子
D.2p3表示2p能级有三个轨道
7.13Al、12Mg、16S、17Cl是周期表中的短周期主族元素。下列有关说法正确的是
A.元素S在周期表中位于第4周期ⅢA族
B.元素S的简单气态氢化物的化学式为H2S
C.第一电离能:I1(Mg)
A.目前ds区的元素种数最少
B.目前f区的元素种数最少
C.p区的元素的原子最后排布的电子均在p能级上
D.s区元素全部是金属元素
9.已知W、X、Y、Z为短周期元素,原子序数依次增大。W、Z同主族,X、Y、Z同周期,其中只有X为金属元素。下列说法一定错误的是
A.电负性:W>Z>Y>X
B.气态氢化物熔沸点:W > Z
C.简单离子的半径:W>X>Z
D.若X与W原子序数之差为5,则形成化合物的化学式为X3W2
10.短周期主族元素X、Y、Z、W的原子序数依次增大。X可分别和Y、Z、W形成含18个电子的型分子,且X与Y、Z与W均可形成如图所示结构的分子。下列说法正确的是
A.简单离子的半径:
B.第一电离能:
C.简单气态氢化物的热稳定性:
D.单质的沸点:
11.X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z原子的最外层电子数是内层电子总数的3倍。下列有关叙述正确的是
A.Y原子的价层电子排布式为3s23p5 B.稳定性:Y的氢化物>Z的氢化物
C.第一电离能:Y<Z D.X、Y两元素形成的化合物为离子化合物
12.下列各项叙述正确的是
A.Na原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态
B.价电子排布为4s24p3的元素位于第四周期第IIIA族,属于金属元素
C.所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同
D.29Cu原子的电子排布图是1s22s22p63s23p63d104s1
13.某新型电池材料结构如图,其中除外均满足8电子稳定结构,、、、、是同周期主族元素,的最外层电子数是的最外层电子数的2倍。下列说法正确的是
A.和的单质反应能生成
B.最简单氢化物的稳定性:
C.电负性:
D.化合物中所有原子在同一平面上
14.短周期元素X、Y、Z、W在元素周期表中的位置如图所示,已知X、Z的原子核外电子数之和等于Y的核外电子数。下列判断正确的是
X W Z
Y
A.最高价氧化物对应水化物的酸性:
B.简单氢化物的稳定性:
C.电负性:
D.简单离子半径:
15.X、Y、Z、W、M为原子序数依次增大的短周期主族元素;由5种元素组成的某化合物是电池工业中的重要原料,该化合物的结构式如图所示。下列说法正确的是
A.原子半径:Y<Z<W
B.最高价含氧酸酸性:Z>M
C.电负性:X<Y<Z
D.该化合物中既含极性键又含非极性键
二、非选择题(共8题)
16.元素周期表是学习化学的重要工具,如图为元素周期表中部分元素的相关信息,利用如图回答相关问题。
(1)原子序数为4的元素符号为___________。
(2)C、N、O排在同一周期是因为_____(填“质子数”“电子层数”或“最外层电子数”)相同。
(3)He和Mg的化学性质_______(填“相似”或“不相似”)。
(4)画出Na+的结构示意图_____。
(5)一个磷原子含有_____个质子,一个NH含有_____个电子。
17.(1)某质量数为32,核内有16个中子的原子,其电子排布式是______,该原子中有______个未成对电子,这些未成对电子具有______(填“相同”或“不同”)的自旋状态。
(2)某元素基态原子的最外层电子排布式为,它的次外层电子的电子云形状有______种,该原子中所有电子占有______个轨道,核外共有______个电子。
(3)M能层上有______个能级,有______个轨道,作为内层时最多可容纳______个电子,作为最外层时最多可含有______个未成对电子。
(4)在元素周期表中,最外层只有1个未成对电子的主族元素位于______族;最外层有2个未成对电子的主族元素位于______族。
18.下表为元素周期表的一部分,用请化学用语回答有关问题:
IA IIA IIIA IVA VA VIA VIIA 0
2 E F
3 A C D G R
4 B H
(1)C的元素符号是___________________;
(2)表中A与F的简单氢化物反应的化学方程式____________________________,E的单质与其下一周期同族元素的最高价氧化物在高温下反应的化学方程式_______________________________;
(3)表中所列元素中最高价氧化物对应水化物酸性最强的是__________________ (填写化学式)
(4)表中能形成的两性氢氧化物与A的最高价氧化物对应水化物反应的离子方程式____________________________________________________________。
19.有原子序数小于20的A、B、C、D、E、F六种元素,它们的原子序数依次增大. 已知B元素是地壳中含量最多的元素; A和C的价电子数相同,B和D的价电子数也相同,且A和C两元素原子核外电子数之和是B、D两元素原子核内质子数之和的二分之一;C、D、E三种元素的基态原子具有相同的电子层数,且E原子的p轨道上电子数比D原子的p轨道上多一个电子;六种元素的基态原子中,F原子的电子层数最多且和A处在同一主族.回答下列问题:
(1)写出基态F原子的核外电子排布式____________
(2)A、B、C共同形成的化合物中化学键的类型____________。
20.下表是元素周期表的一部分,回答下列有关问题(用化学符号回答):
H He
① ② ③ ④
⑤ ⑥ ⑦ ⑧ ⑨
(1)①~⑨元素中,非金属性最强的元素是___________(填元素符号)。
(2)⑥⑨两种元素的原子半径较大的是___________(填元素符号)。
(3)⑧号元素形成的氢化物中含___________(填“极性”或“非极性”)共价键。
(4)写出元素②的单质的电子式___________。
(5)元素①和元素③以1∶2的个数比形成化合物,写出该物质的结构式___________。
(6)①~⑨元素的最高价氧化物对应的水化物中,碱性最强的是___________(填化学式),呈两性的是___________(填化学式)。
21.某同学设计实验以探究元素性质的递变规律。
实验I:根据元素最高价含氧酸的酸性强弱探究元素非金属性递变规律。利用下图装置一次性完成Cl、C、Si三种非金属元素的非金属性强弱比较的实验研究
(1)实验中选用的物质名称为: A_______。
(2)C处刚出现现象时发生反应的离子方程式为_______。
(3)根据实验现象推知,可得出碳、硅、氯三种元素非金属性的强弱顺序是_________。
实验II:已知常温下高锰酸钾与浓盐酸混合可产生氯气和Mn2+,利用下图装置探究卤族元素性质的递变规律,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。
(4)写出圆底烧瓶中发生反应的离子方程式:_______。
(5)B处的实验现象为_____。
(6)根据A、B两处的实验现象能否推出非金属性Cl>Br>I,______ (填“能”或“否”, 原因是_______。
22.某同学做元素周期律性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表(记录现象时随手记在了纸片上,不对应,需整理):
实验方案 实验现象
①砂纸打磨后的镁带与沸水反应,再向反应液中滴加酚酞溶液 A.浮于水面,熔成小球,在水面上无定向移动并随之消失,溶液变成红色
②向新制的H2S饱和溶液中滴加新制的氯水 B.产生大量气体,可在空气中燃烧,溶液变成浅红色
③钠与滴有酚酞溶液的冷水反应 C.反应不剧烈,产生的气体可以在空气中燃烧
④用砂纸打磨后的镁带与2 mol·L-1的盐酸反应 D.剧烈反应,产生的气体可以在空气中燃烧
⑤用砂纸打磨后的铝条与2 mol·L-1的盐酸反应 E.生成白色胶状沉淀,继而沉淀消失
⑥向氯化铝溶液中滴加氢氧化钠溶液 F.生成淡黄色沉淀
请帮助该同学整理并完成实验报告。
(1)实验目的:_______。
(2)实验用品:_______、_______、砂纸、镊子、小刀、胶头滴管等。
(3)实验内容:
实验方案(填序号) 实验现象(填字母) 有关化学方程式
③ _______ _______
_______ B _______
④ _______ _______
⑤ _______ _______
_______ E _______
_______ F _______
(4)实验结论:
金属性:_______。
非金属性:_______。
23.在复习元素周期律过程中,某研究性学习小组的几位同学拟通过具体的实验来探讨某些金属元素的性质差异,下面是他们设计的探究性实验方案,请填写下列空白:
(1)实验目的:比较钠、镁、铝金属性强弱。
(2)实验用品:试管、_______、酒精灯、试管夹、砂纸、滤纸、钠、镁条、铝片、酚酞、蒸馏水、6mol·L-1的盐酸。
(3)实验过程与现象记录
实验过程 预期现象 实际观察到的现象
a.取已切去表皮的一小块金属钠,放入盛有水的某容器中 立即剧烈反应 开始时钠块浮在水面上不反应,稍后才开始与水剧烈反应
b.向盛有适量水(内含2滴酚酞)的试管中加入一小段镁条 有气泡产生,溶液变成红色 没有相应现象,加热后仍无明显变化
c.向两支盛有3 mL 6 mol·L-1盐酸的试管中,分别加入大小相同的镁片和铝片 铝、镁与盐酸反应产生气泡剧烈程度不同 镁与盐酸反应产生气泡速率较快
I.甲同学的方案如下:
①你认为a、b两步实验中出现异常现象的可能原因是:
a._______
b._______
②上面的实验表明:钠、镁、铝三种元素的金属性由强到弱的顺序为_______
II.乙同学方案:他认为只需要一种试剂就可以确定钠、镁、铝的金属性强弱,预计他的主要实验操作是_______,写出镁与这种试剂反应的化学方程式:_______。
参考答案
1.A 2.C 3.A 4.A 5.D 6.D 7.B 8.A 9.C 10.D 11.C 12.C 13.D 14.C 15.D
16.Be 电子层数 不相似 15 10
17. 2 相同 2 8 14 3 9 18 3 ⅠA、ⅢA、ⅦA ⅣA、ⅥA
18.Mg 2Na+2H2O=2NaOH+H2↑ 2C+SiO2Si+2CO HClO4 Al(OH)3+OH-=AlO2-+2H2O
19.1s22s22p63s23p64s1 共价键 离子键
20.F Mg 极性 O=C=O NaOH Al(OH)3
21.高氯酸 +CO2+H2O=H2SiO3↓+ Cl> C> Si 2+16H++10C1-=2Mn2++5Cl2↑+8H2O 试纸变蓝 否 因Cl2也能将B处的KI氧化
22.验证Na、Mg、Al元素从左到右金属性递减,S、Cl元素从左到右非金属性递增的规律 试管 酒精灯 A ① D C ⑥ 、 ② Na>Mg>Al S
