2021-2022学年九年级化学鲁教版(五四制)全一册3.2 海水“晒盐”课件(18张PPT)
文档属性
| 名称 | 2021-2022学年九年级化学鲁教版(五四制)全一册3.2 海水“晒盐”课件(18张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 6.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-08 22:15:23 | ||
图片预览






文档简介
(共18张PPT)
第二节 海水“晒盐”
第三单元 海水中的化学
鲁教版(五四制) 化学 九年级
情景导入
?
海水“晒盐”
的过程
01
河北的长芦盐场
山东的莱州湾盐场
辽东湾盐区
江苏盐场
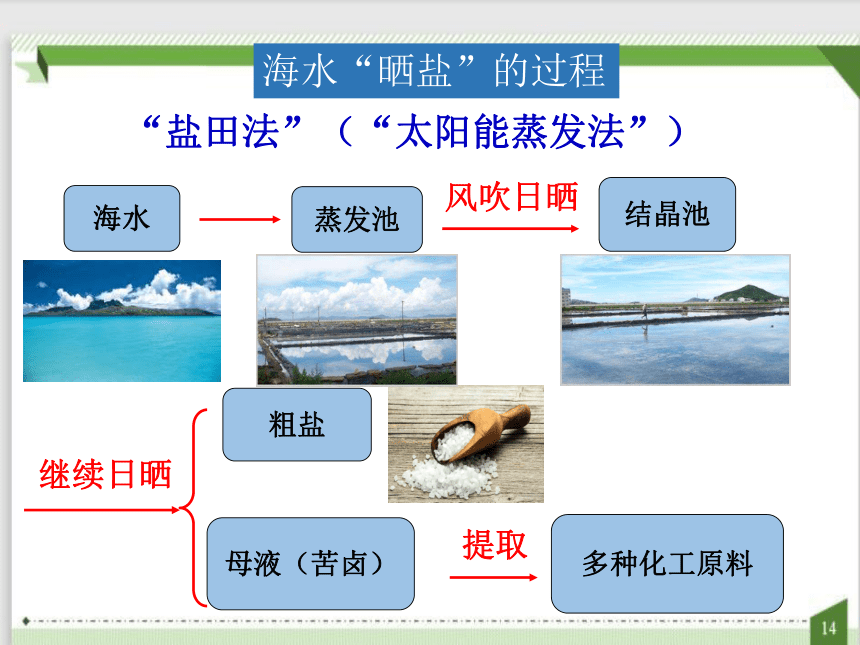
海水“晒盐”的过程
海水
蒸发池
结晶池
粗盐
母液(苦卤)
多种化工原料
“盐田法”(“太阳能蒸发法”)
风吹日晒
继续日晒
提取
海水“晒盐”的过程
实验现象:
有白色晶体析出
食盐晶体
取少许不饱和氯化钠溶液,滴在洁净的玻璃片上,用电热吹风机向玻璃片上的溶液吹热风,观察现象。
活动天地
1、氯化钠溶液从不饱和变为饱和的途径是什么?如何从现象上判断溶液饱和?
2、哪些自然条件有利于海水“晒盐”?为什么?
蒸发溶剂
当液滴的周围出现少量白色物质时说明溶液已经饱和
这些条件有利于加速水分的蒸发
气候温和、光照充足、大片平坦的海边滩涂
思考
固体物质从它的饱和溶液中以晶体的形式析出的过程。
晶体:具有规则几何外形的固体。
结晶:
硫酸铜晶体
硝酸钾晶体
明矾晶体
结晶
蒸发结晶
降温结晶
重结晶
食盐晶体
海水“晒盐”的过程
粗盐的提纯
02
粗盐经溶解、沉淀、过滤、蒸发,可制得精盐。
海水、湖水、井水
提纯,除去不溶物
除去可溶物
精盐
蒸发
粗盐
(含泥沙、MgCl2、CaCl2)
二、粗盐的提纯
粗盐的提纯
操作步骤
温馨提示:
蒸发时,用玻璃棒不断搅拌。
等蒸发皿中出现较多量固体时,停止加热,利用余热将水分蒸干。
二、粗盐的提纯
粗盐的提纯
反思交流: 在溶解、过滤、蒸发、转移中都用到了玻璃棒,它的作用分别是什么
1.溶解时用玻璃棒搅拌,加速固体的溶解。
2.过滤时用玻璃棒引流。
3.蒸发时用玻璃棒搅拌,防止液体受热不均匀,引起液滴飞溅。
4.转移固体,将提纯后的食盐转移到纸上。
粗盐的提纯
二、粗盐的提纯
流程:
溶解 →
过滤 →
蒸发
重结晶法
物理变化
难溶性杂质(泥沙等)
可溶性杂质( SO42-、Ca2+、Mg2+等 )
除难溶性杂质
除可溶性杂质
NaCl
MgCl2
CaCl2
Na2SO4
溶液
过量BaCl2溶液
BaSO4↓
NaCl、MgCl2
CaCl2 、剩余BaCl2
过量
Na2CO3溶液
NaCl、
剩余NaOH、Na2CO3
溶液:
沉淀:
溶液:
沉淀:
CaCO3 ↓
BaCO3 ↓
过量NaOH溶液
溶液:
沉淀:
NaCl、CaCl2
剩余 NaOH、BaCl2
Mg(OH)2
过滤后加适量稀HCl
NaCl
溶液
NaCl晶体
蒸发结晶
粗盐中的可溶性杂质:
MgCl2、CaCl2、Na2SO4等
大于原氯化钠的质量
除可溶性杂质
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
2NaOH+ MgCl2 =Mg(OH)2↓ + 2NaCl
Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl
Na2CO3 + BaCl2 = BaCO3↓ + 2NaCl
NaOH+HCl= NaCl+H2O
Na2CO3+2HCl=2NaCl+CO2↑+H2O
②NaOH 、 BaCl2 、 Na2CO3、 稀HCl
①BaCl2 、 Na2CO3、 NaOH 、 稀HCl
其他除杂流程顺序:
(1)过量BaCl2溶液
(2)过量NaOH溶液
(3)过量Na2CO3溶液
(4)过滤后加适量稀HCl
同时除去剩余的BaCl2:
除去剩余的NaOH 和Na2CO3
Na2CO3必须放在BaCl2之后,以除去过量的Ba2+
除去可溶性杂质,要考虑:
1.加入合适的试剂,转化为沉淀、气体或水
2.试剂的用量
3.过量试剂的处理
4.不能引入新的杂质
除可溶性杂质
教学课件
鲁教版(五四制) 化学 九年级
感谢观看
第二节 海水“晒盐”
第三单元 海水中的化学
鲁教版(五四制) 化学 九年级
情景导入
?
海水“晒盐”
的过程
01
河北的长芦盐场
山东的莱州湾盐场
辽东湾盐区
江苏盐场
海水“晒盐”的过程
海水
蒸发池
结晶池
粗盐
母液(苦卤)
多种化工原料
“盐田法”(“太阳能蒸发法”)
风吹日晒
继续日晒
提取
海水“晒盐”的过程
实验现象:
有白色晶体析出
食盐晶体
取少许不饱和氯化钠溶液,滴在洁净的玻璃片上,用电热吹风机向玻璃片上的溶液吹热风,观察现象。
活动天地
1、氯化钠溶液从不饱和变为饱和的途径是什么?如何从现象上判断溶液饱和?
2、哪些自然条件有利于海水“晒盐”?为什么?
蒸发溶剂
当液滴的周围出现少量白色物质时说明溶液已经饱和
这些条件有利于加速水分的蒸发
气候温和、光照充足、大片平坦的海边滩涂
思考
固体物质从它的饱和溶液中以晶体的形式析出的过程。
晶体:具有规则几何外形的固体。
结晶:
硫酸铜晶体
硝酸钾晶体
明矾晶体
结晶
蒸发结晶
降温结晶
重结晶
食盐晶体
海水“晒盐”的过程
粗盐的提纯
02
粗盐经溶解、沉淀、过滤、蒸发,可制得精盐。
海水、湖水、井水
提纯,除去不溶物
除去可溶物
精盐
蒸发
粗盐
(含泥沙、MgCl2、CaCl2)
二、粗盐的提纯
粗盐的提纯
操作步骤
温馨提示:
蒸发时,用玻璃棒不断搅拌。
等蒸发皿中出现较多量固体时,停止加热,利用余热将水分蒸干。
二、粗盐的提纯
粗盐的提纯
反思交流: 在溶解、过滤、蒸发、转移中都用到了玻璃棒,它的作用分别是什么
1.溶解时用玻璃棒搅拌,加速固体的溶解。
2.过滤时用玻璃棒引流。
3.蒸发时用玻璃棒搅拌,防止液体受热不均匀,引起液滴飞溅。
4.转移固体,将提纯后的食盐转移到纸上。
粗盐的提纯
二、粗盐的提纯
流程:
溶解 →
过滤 →
蒸发
重结晶法
物理变化
难溶性杂质(泥沙等)
可溶性杂质( SO42-、Ca2+、Mg2+等 )
除难溶性杂质
除可溶性杂质
NaCl
MgCl2
CaCl2
Na2SO4
溶液
过量BaCl2溶液
BaSO4↓
NaCl、MgCl2
CaCl2 、剩余BaCl2
过量
Na2CO3溶液
NaCl、
剩余NaOH、Na2CO3
溶液:
沉淀:
溶液:
沉淀:
CaCO3 ↓
BaCO3 ↓
过量NaOH溶液
溶液:
沉淀:
NaCl、CaCl2
剩余 NaOH、BaCl2
Mg(OH)2
过滤后加适量稀HCl
NaCl
溶液
NaCl晶体
蒸发结晶
粗盐中的可溶性杂质:
MgCl2、CaCl2、Na2SO4等
大于原氯化钠的质量
除可溶性杂质
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
2NaOH+ MgCl2 =Mg(OH)2↓ + 2NaCl
Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl
Na2CO3 + BaCl2 = BaCO3↓ + 2NaCl
NaOH+HCl= NaCl+H2O
Na2CO3+2HCl=2NaCl+CO2↑+H2O
②NaOH 、 BaCl2 、 Na2CO3、 稀HCl
①BaCl2 、 Na2CO3、 NaOH 、 稀HCl
其他除杂流程顺序:
(1)过量BaCl2溶液
(2)过量NaOH溶液
(3)过量Na2CO3溶液
(4)过滤后加适量稀HCl
同时除去剩余的BaCl2:
除去剩余的NaOH 和Na2CO3
Na2CO3必须放在BaCl2之后,以除去过量的Ba2+
除去可溶性杂质,要考虑:
1.加入合适的试剂,转化为沉淀、气体或水
2.试剂的用量
3.过量试剂的处理
4.不能引入新的杂质
除可溶性杂质
教学课件
鲁教版(五四制) 化学 九年级
感谢观看
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
