广东省茂名高州市2020-2021学年高一下学期期末考试化学试题(Word版含答案)
文档属性
| 名称 | 广东省茂名高州市2020-2021学年高一下学期期末考试化学试题(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-12 14:50:11 | ||
图片预览


文档简介
高州市2020~2021学年度第二学期高一期末教学质量监测
化学
2021.7
考生注意:
1.本试卷分选择题和非选择题两部分。满分100分,考试时间75分钟。
2.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
3.本卷命题范围:必修第二册。
可能用到的相对原子质量:H1 C12 O16 Cu64
一、选择题:本题共16小题,共44分。第1~10题,每小题2分,第11~16题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.2021年5月15日,我国火星探测器“天问一号”成功着陆火星。天问一号探测器上使用了重量轻、强度高、刚性好、宽温度范围下尺寸稳定的新型增强铝基复合材料。下列说法错误的是( )
A.是一种新型硅酸盐材料
B.俗称金刚砂,具有类似金刚石的结构
C.中的碳原子和硅原子通过共价键连接
D.具有优异的高温抗氧化性能
2.下列过程属于物理变化的是( )
A.石油裂化 B.煤的干馏 C.海水晒盐 D.海水提溴
3.下列过程的相应产物与酸雨无关的是( )
A.含硫矿物冶炼时生成的二氧化硫
B.化石燃料燃烧生成的二氧化碳
C.机车发动机中氮气与氧气反应生成的氮氧化物
D.工业制硝酸排放的含有氮氧化物的尾气
4.氧化还原反应广泛应用于金属的冶炼,下列有关金属冶炼的说法错误的是( )
A.电解熔融氯化钠制取金属钠的反应中,钠离子被还原,氯离子被氧化
B.热分解法、热还原法、电解法冶炼金属中,金属元素都由化合态转变为游离态
C.铝热反应中铝作为还原剂将铁从其氧化物中置换出来
D.用磁铁矿炼铁的反应中,1被还原成Fe,转移9电子
5.下列关于浓硫酸的说法正确的是( )
A.常温下不能用铁制容器盛装冷浓硫酸
B.稀释浓硫酸应将水沿着容器壁慢慢倒入浓硫酸中
C.浓硫酸能使蔗糖变黑,体现了浓硫酸的脱水性
D.浓硫酸是一种常用的液体干燥剂,可用于干燥氨气
6.下列说法正确的是( )
A.异戊橡胶属于天然橡胶,经硫化后具有更好的弹性
B.聚丙烯是由结构单元重复连接而成的
C.维生素C具有还原性,可用作食品抗氧化剂
D.淀粉、橡胶、腈纶都是天然高分子化合物
7.下列关于烃的叙述错误的是( )
A.饱和烃的组成都满足通式
B.烯烃、炔烃、芳香烃都属于不饱和烃
C.分子中碳碳键只有两种
D.乙炔分子中4个原子在同一直线上
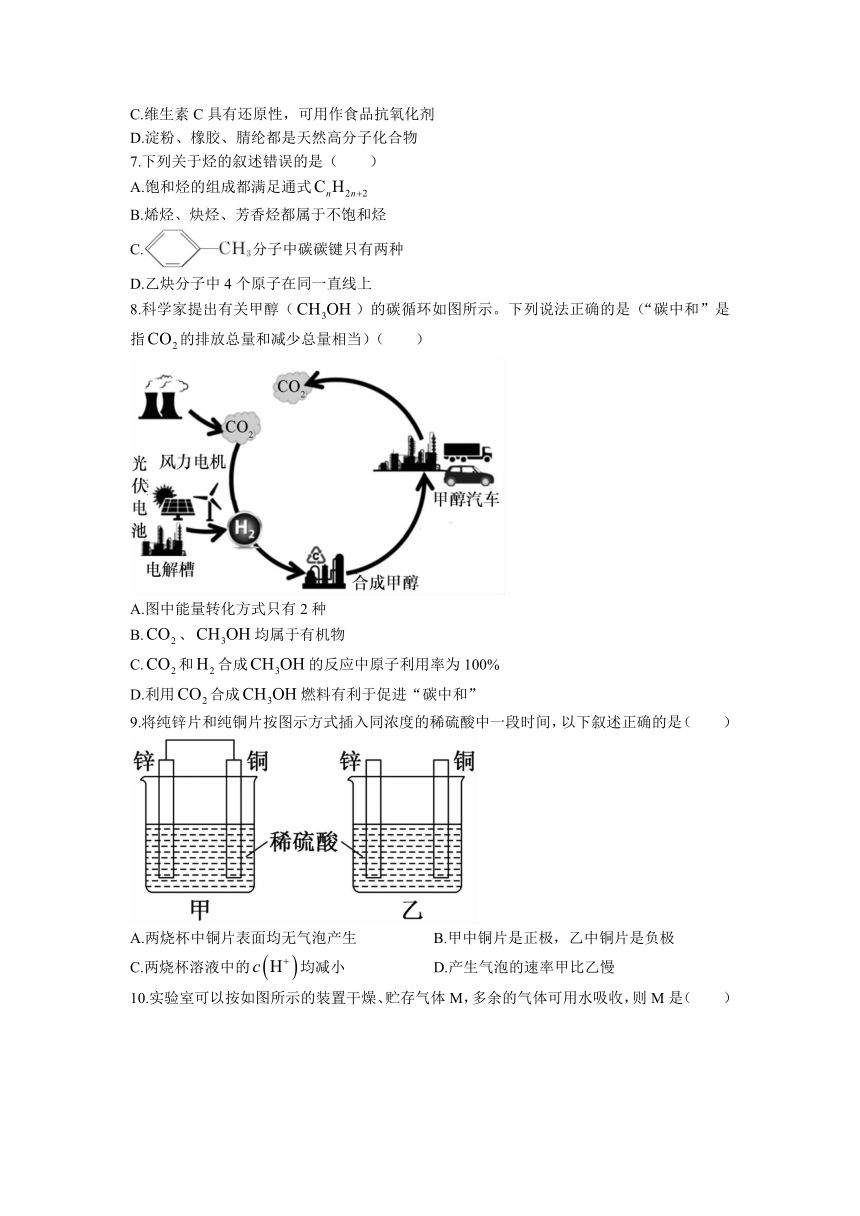
8.科学家提出有关甲醇()的碳循环如图所示。下列说法正确的是(“碳中和”是指的排放总量和减少总量相当)( )
A.图中能量转化方式只有2种
B.、均属于有机物
C.和合成的反应中原子利用率为100%
D.利用合成燃料有利于促进“碳中和”
9.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生 B.甲中铜片是正极,乙中铜片是负极
C.两烧杯溶液中的均减小 D.产生气泡的速率甲比乙慢
10.实验室可以按如图所示的装置干燥、贮存气体M,多余的气体可用水吸收,则M是( )
A.一氧化氮 B.氨 C.二氧化氮 D.氯化氢
11.在密闭容器中进行如下反应:,已知反应过程中某一时刻、、的浓度分别为0.2、0.1、0.2,当反应达平衡时,可能存在的数据是( )
A.为0.25 B.为0.4
C.、均为0.15 D.为0.4
12.微型纽扣电池在现代生活中有广泛应用。一种银锌纽扣电池的电极分别为和,电解质溶液为,电极反应为和。下列说法错误的是( )
A.在使用过程中,电池负极区溶液的碱性减弱
B.使用过程中,电子由极经外电路流向极
C.电池总反应为
D.是负极发生还原反应,是正极发生氧化反应
13.对于下列实验,描述其反应的离子方程式正确的是( )
A.向澄清石灰水中通入少量气体:
B.向氢氧化钠溶液中通入过量气体:
C.向溴水中通入适量气体:
D.向氢硫酸溶液中通入少量氯气:
14.晶体硅(熔点1410℃)是良好的半导体材料。由石英砂()制纯硅过程如下:
下列叙述错误的是( )
A.生成粗硅的化学方程式为
B.上述流程中的化学反应均为氧化还原反应
C.气态中混有杂质元素的氯化物,提纯的方法是冷凝成液态后蒸馏
D.还原时,生成的两种产物分别为固态和气态,容易分离
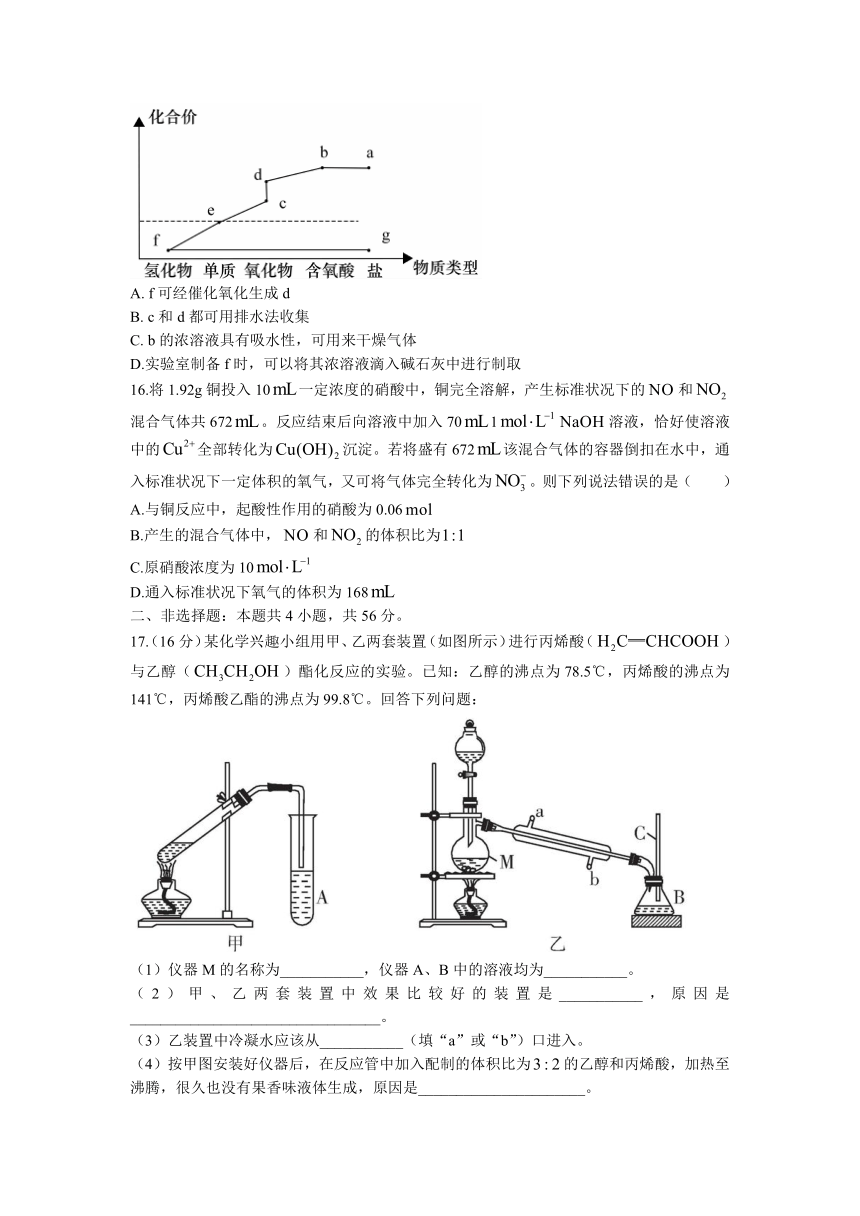
15.如图是某元素的化合价——物质类型二维图。其中正盐g与反应可生成f,d的相对分子质量比c大16。下列说法正确的是( )
A. f可经催化氧化生成d
B. c和d都可用排水法收集
C. b的浓溶液具有吸水性,可用来干燥气体
D.实验室制备f时,可以将其浓溶液滴入碱石灰中进行制取
16.将1.92g铜投入10一定浓度的硝酸中,铜完全溶解,产生标准状况下的和混合气体共672。反应结束后向溶液中加入701溶液,恰好使溶液中的全部转化为沉淀。若将盛有672该混合气体的容器倒扣在水中,通入标准状况下一定体积的氧气,又可将气体完全转化为。则下列说法错误的是( )
A.与铜反应中,起酸性作用的硝酸为0.06
B.产生的混合气体中,和的体积比为
C.原硝酸浓度为10
D.通入标准状况下氧气的体积为168
二、非选择题:本题共4小题,共56分。
17.(16分)某化学兴趣小组用甲、乙两套装置(如图所示)进行丙烯酸()与乙醇()酯化反应的实验。已知:乙醇的沸点为78.5℃,丙烯酸的沸点为141℃,丙烯酸乙酯的沸点为99.8℃。回答下列问题:
(1)仪器M的名称为___________,仪器A、B中的溶液均为___________。
(2)甲、乙两套装置中效果比较好的装置是___________,原因是_________________________________。
(3)乙装置中冷凝水应该从___________(填“a”或“b”)口进入。
(4)按甲图安装好仪器后,在反应管中加入配制的体积比为的乙醇和丙烯酸,加热至沸腾,很久也没有果香味液体生成,原因是______________________。
(5)根据题干数据分析,乙醇需要过量一些的原因是______________________。
(6)某同学对酯化反应中到底是酸失去羟基、醇失去氢还是酸失去氢、醇失去羟基进行探究,供选用反应物的有①、②、③、④、⑤,请帮助设计实验方案,并给出预期现象和结论:
选用反应物(填编号) 预期现象和结论
18.(12分)茉莉花香气的成分有多种,乙酸苯甲酯是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
回答下列问题:
(1)B的官能团是____________(填名称)。
(2)流程中7种有机物(含乙醇)中能与反应生成的有__________种,1甲苯最多可与__________反应。
(3)写出反应①的化学方程式:________________________________。反应③的反应类型为___________。
(4)下列有关乙酸苯甲酯的说法正确的是___________(填标号)。
A.能与反应 B.易溶于水
C.能发生水解反应 D.苯环上一氯代物有3种
19.(14分)实验室以孔雀石[主要成分是,还含有少量杂质、、]为原料制备步骤如下:
回答下列问题:
(1)“酸浸”时通常将孔雀石进行粉碎,其目的是___________。
(2)写出与稀硫酸反应的离子方程式:_________________________________,滤渣A是___________(填化学式)。
(3)某实验小组设计如下3种方案在实验室制取硫酸铜:
方案一:浓硫酸与铜加热反应
方案二:铜加入稀硝酸和稀硫酸的混合酸中
方案三:铜粉与稀硫酸的混合物中通入热空气反应
其中,最佳方案是___________(填编号),理由是_________________________________。
(4)由溶液获得的操作a包括___________、___________、过滤、洗涤、干燥等步骤。
20.(14分)一定温度下,在体积为0.5L的恒容密闭容器中,和之间发生反应:(红棕色)(无色),反应过程中各物质的物质的量与时间的关系如图所示。回答下列问题:
(1)曲线___________(填“X”或“Y”)表示的物质的量随时间的变化曲线。
(2)在0~3内,用表示的反应速率为___________。
(3)若在一保温容器中加入一定量,反应一段时间后,混合气体温度升高,说明2的能量比1的能量__________(填“高”或“低”)。
(4)反应达到平衡后,若降低温度,混合气体的颜色变浅,相对于降温前v(正)__________(填“增大”“减小”或“不变”,下同),v(逆)__________。
(5)氮氧化物是重要的大气污染物,下图是监测含量的传感器工作原理示意图。电极发生__________(填“氧化”或“还原”)反应,电极是电池__________(填“正极”或“负极”)。
高州市2020~2021学年度第二学期高一教学质量监测·化学
参考答案、提示及评分细则
1.A 不属于硅酸盐。
2.C 3.B
4.D 用磁铁矿炼铁的反应为,当有1被还原成时,转移8电子,D项错误。
5.C 6.C 7.A
8.D 图中能量转化方式有风能转化为电能、太阳能转化为电能、电能转化为化学能、化学能转化为热能等,A项错误;属于无机物,属于有机物,B项错误;制取的反应为,该反应除生成甲醇外还生成了水,原子利用率未达到100%,C项错误;利用合成燃料有利于减少碳排放,D项正确。
9.C 甲中,锌片和铜片通过导线相连,甲烧杯为原电池装置,乙中,锌片和铜片没有通过导线相连,乙烧杯不是原电池装置,甲烧杯中铜片表面有气泡产生,乙烧杯中铜片表面没有有气泡产生,A项错误;甲中铜片是正极,乙中铜片既不是正极也不是是负极,B项错误;两烧杯溶液中的均减小,C项正确;产生气泡的速率甲比乙快,D项错误。
10.B 图中气体收集装置是短导管进气、长导管出气,则收集的气体的密度必须小于空气且不与空气中的氧气反应,图中尾气处理有防倒吸装置,则收集的气体在水中的溶解度非常大,B项符合题意。
11.A 反应达平衡时,、、均存在,且平衡前后硫原子守恒,可知只有A项正确。
12.D 电极发生氧化反应,电极发生还原反应,D项错误。
13.B 向澄清石灰水中通入少量气体,正确的离子方程式为,A项错误;向溴水中通入适量气体,正确的离子方程式为,C项错误;向氢硫酸溶液中通入少量氯气,正确的离子方程式为,D项错误。
14.A
15.D g能与反应生成氢化物,则g是铵盐,f是氨气,d是二氧化氮,c是一氧化氮,e是氮气,b是硝酸,a是硝酸钠。f催化氧化生成c,A项错误;不能用排水法收集,B项错误;浓硝酸不具有吸水性,不可用来干燥气体,C项错误;实验室制备时,可以将浓氨水滴入碱石灰中进行制取,D项正确。
16.D ,生成的的物质的量为0.03。将0.03全部转化为沉淀,只需消耗0.06,而实际消耗了0.07,这说明硝酸与铜反应后,过量的为0.01。与铜反应中,起酸性作用的硝酸的物质的量,A项正确;根据得失电子守恒可列出方程,根据产生标准状况下的混合气体的体积可列出方程,解得,故产生的混合气体中,和的体积比为,B项正确;与铜反应中,起氧化作用的硝酸的物质的量,原硝酸溶液中溶质的物质的量,原硝酸浓度,C项正确;和的体积比为的混合气体与氧气和水发生反应的化学方程式为,故通入标准状况下氧气的物质的量为0.015,体积为336(标准状况),D项错误。
17.(1)蒸馏烧瓶 饱和溶液(各1分)
(2)乙 乙的冷凝效果好,可减少丙烯酸乙酯的损失(各2分)
(3)b(2分)
(4)漏加浓硫酸(2分)
(5)乙醇的沸点比丙烯酸低,易挥发而损耗(2分)
(6)
反应物(填编号) 预期现象和结论
①⑤ 若产物水中不含,则为酸脱羟基醇脱氢,若产物水中含,则为酸脱氢醇脱羟基 (4分,或其他合理答案)
18.(1)羧基
(2)3 3
(3) 酯化(或取代)反应
(4)CD(每空2分)
19.(1)加快溶解速率(2分)
(2)(2分) (2分)
(3)方案三(2分) 方案一和方案二均产生有害气体,酸的利用率也不高(2分)
(4)蒸发浓缩 冷却结晶(各2分)
20.(1)Y
(2)0.4
(3)高
(4)减小 减小
(5)氧化 (每空2分)
化学
2021.7
考生注意:
1.本试卷分选择题和非选择题两部分。满分100分,考试时间75分钟。
2.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
3.本卷命题范围:必修第二册。
可能用到的相对原子质量:H1 C12 O16 Cu64
一、选择题:本题共16小题,共44分。第1~10题,每小题2分,第11~16题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.2021年5月15日,我国火星探测器“天问一号”成功着陆火星。天问一号探测器上使用了重量轻、强度高、刚性好、宽温度范围下尺寸稳定的新型增强铝基复合材料。下列说法错误的是( )
A.是一种新型硅酸盐材料
B.俗称金刚砂,具有类似金刚石的结构
C.中的碳原子和硅原子通过共价键连接
D.具有优异的高温抗氧化性能
2.下列过程属于物理变化的是( )
A.石油裂化 B.煤的干馏 C.海水晒盐 D.海水提溴
3.下列过程的相应产物与酸雨无关的是( )
A.含硫矿物冶炼时生成的二氧化硫
B.化石燃料燃烧生成的二氧化碳
C.机车发动机中氮气与氧气反应生成的氮氧化物
D.工业制硝酸排放的含有氮氧化物的尾气
4.氧化还原反应广泛应用于金属的冶炼,下列有关金属冶炼的说法错误的是( )
A.电解熔融氯化钠制取金属钠的反应中,钠离子被还原,氯离子被氧化
B.热分解法、热还原法、电解法冶炼金属中,金属元素都由化合态转变为游离态
C.铝热反应中铝作为还原剂将铁从其氧化物中置换出来
D.用磁铁矿炼铁的反应中,1被还原成Fe,转移9电子
5.下列关于浓硫酸的说法正确的是( )
A.常温下不能用铁制容器盛装冷浓硫酸
B.稀释浓硫酸应将水沿着容器壁慢慢倒入浓硫酸中
C.浓硫酸能使蔗糖变黑,体现了浓硫酸的脱水性
D.浓硫酸是一种常用的液体干燥剂,可用于干燥氨气
6.下列说法正确的是( )
A.异戊橡胶属于天然橡胶,经硫化后具有更好的弹性
B.聚丙烯是由结构单元重复连接而成的
C.维生素C具有还原性,可用作食品抗氧化剂
D.淀粉、橡胶、腈纶都是天然高分子化合物
7.下列关于烃的叙述错误的是( )
A.饱和烃的组成都满足通式
B.烯烃、炔烃、芳香烃都属于不饱和烃
C.分子中碳碳键只有两种
D.乙炔分子中4个原子在同一直线上
8.科学家提出有关甲醇()的碳循环如图所示。下列说法正确的是(“碳中和”是指的排放总量和减少总量相当)( )
A.图中能量转化方式只有2种
B.、均属于有机物
C.和合成的反应中原子利用率为100%
D.利用合成燃料有利于促进“碳中和”
9.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生 B.甲中铜片是正极,乙中铜片是负极
C.两烧杯溶液中的均减小 D.产生气泡的速率甲比乙慢
10.实验室可以按如图所示的装置干燥、贮存气体M,多余的气体可用水吸收,则M是( )
A.一氧化氮 B.氨 C.二氧化氮 D.氯化氢
11.在密闭容器中进行如下反应:,已知反应过程中某一时刻、、的浓度分别为0.2、0.1、0.2,当反应达平衡时,可能存在的数据是( )
A.为0.25 B.为0.4
C.、均为0.15 D.为0.4
12.微型纽扣电池在现代生活中有广泛应用。一种银锌纽扣电池的电极分别为和,电解质溶液为,电极反应为和。下列说法错误的是( )
A.在使用过程中,电池负极区溶液的碱性减弱
B.使用过程中,电子由极经外电路流向极
C.电池总反应为
D.是负极发生还原反应,是正极发生氧化反应
13.对于下列实验,描述其反应的离子方程式正确的是( )
A.向澄清石灰水中通入少量气体:
B.向氢氧化钠溶液中通入过量气体:
C.向溴水中通入适量气体:
D.向氢硫酸溶液中通入少量氯气:
14.晶体硅(熔点1410℃)是良好的半导体材料。由石英砂()制纯硅过程如下:
下列叙述错误的是( )
A.生成粗硅的化学方程式为
B.上述流程中的化学反应均为氧化还原反应
C.气态中混有杂质元素的氯化物,提纯的方法是冷凝成液态后蒸馏
D.还原时,生成的两种产物分别为固态和气态,容易分离
15.如图是某元素的化合价——物质类型二维图。其中正盐g与反应可生成f,d的相对分子质量比c大16。下列说法正确的是( )
A. f可经催化氧化生成d
B. c和d都可用排水法收集
C. b的浓溶液具有吸水性,可用来干燥气体
D.实验室制备f时,可以将其浓溶液滴入碱石灰中进行制取
16.将1.92g铜投入10一定浓度的硝酸中,铜完全溶解,产生标准状况下的和混合气体共672。反应结束后向溶液中加入701溶液,恰好使溶液中的全部转化为沉淀。若将盛有672该混合气体的容器倒扣在水中,通入标准状况下一定体积的氧气,又可将气体完全转化为。则下列说法错误的是( )
A.与铜反应中,起酸性作用的硝酸为0.06
B.产生的混合气体中,和的体积比为
C.原硝酸浓度为10
D.通入标准状况下氧气的体积为168
二、非选择题:本题共4小题,共56分。
17.(16分)某化学兴趣小组用甲、乙两套装置(如图所示)进行丙烯酸()与乙醇()酯化反应的实验。已知:乙醇的沸点为78.5℃,丙烯酸的沸点为141℃,丙烯酸乙酯的沸点为99.8℃。回答下列问题:
(1)仪器M的名称为___________,仪器A、B中的溶液均为___________。
(2)甲、乙两套装置中效果比较好的装置是___________,原因是_________________________________。
(3)乙装置中冷凝水应该从___________(填“a”或“b”)口进入。
(4)按甲图安装好仪器后,在反应管中加入配制的体积比为的乙醇和丙烯酸,加热至沸腾,很久也没有果香味液体生成,原因是______________________。
(5)根据题干数据分析,乙醇需要过量一些的原因是______________________。
(6)某同学对酯化反应中到底是酸失去羟基、醇失去氢还是酸失去氢、醇失去羟基进行探究,供选用反应物的有①、②、③、④、⑤,请帮助设计实验方案,并给出预期现象和结论:
选用反应物(填编号) 预期现象和结论
18.(12分)茉莉花香气的成分有多种,乙酸苯甲酯是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
回答下列问题:
(1)B的官能团是____________(填名称)。
(2)流程中7种有机物(含乙醇)中能与反应生成的有__________种,1甲苯最多可与__________反应。
(3)写出反应①的化学方程式:________________________________。反应③的反应类型为___________。
(4)下列有关乙酸苯甲酯的说法正确的是___________(填标号)。
A.能与反应 B.易溶于水
C.能发生水解反应 D.苯环上一氯代物有3种
19.(14分)实验室以孔雀石[主要成分是,还含有少量杂质、、]为原料制备步骤如下:
回答下列问题:
(1)“酸浸”时通常将孔雀石进行粉碎,其目的是___________。
(2)写出与稀硫酸反应的离子方程式:_________________________________,滤渣A是___________(填化学式)。
(3)某实验小组设计如下3种方案在实验室制取硫酸铜:
方案一:浓硫酸与铜加热反应
方案二:铜加入稀硝酸和稀硫酸的混合酸中
方案三:铜粉与稀硫酸的混合物中通入热空气反应
其中,最佳方案是___________(填编号),理由是_________________________________。
(4)由溶液获得的操作a包括___________、___________、过滤、洗涤、干燥等步骤。
20.(14分)一定温度下,在体积为0.5L的恒容密闭容器中,和之间发生反应:(红棕色)(无色),反应过程中各物质的物质的量与时间的关系如图所示。回答下列问题:
(1)曲线___________(填“X”或“Y”)表示的物质的量随时间的变化曲线。
(2)在0~3内,用表示的反应速率为___________。
(3)若在一保温容器中加入一定量,反应一段时间后,混合气体温度升高,说明2的能量比1的能量__________(填“高”或“低”)。
(4)反应达到平衡后,若降低温度,混合气体的颜色变浅,相对于降温前v(正)__________(填“增大”“减小”或“不变”,下同),v(逆)__________。
(5)氮氧化物是重要的大气污染物,下图是监测含量的传感器工作原理示意图。电极发生__________(填“氧化”或“还原”)反应,电极是电池__________(填“正极”或“负极”)。
高州市2020~2021学年度第二学期高一教学质量监测·化学
参考答案、提示及评分细则
1.A 不属于硅酸盐。
2.C 3.B
4.D 用磁铁矿炼铁的反应为,当有1被还原成时,转移8电子,D项错误。
5.C 6.C 7.A
8.D 图中能量转化方式有风能转化为电能、太阳能转化为电能、电能转化为化学能、化学能转化为热能等,A项错误;属于无机物,属于有机物,B项错误;制取的反应为,该反应除生成甲醇外还生成了水,原子利用率未达到100%,C项错误;利用合成燃料有利于减少碳排放,D项正确。
9.C 甲中,锌片和铜片通过导线相连,甲烧杯为原电池装置,乙中,锌片和铜片没有通过导线相连,乙烧杯不是原电池装置,甲烧杯中铜片表面有气泡产生,乙烧杯中铜片表面没有有气泡产生,A项错误;甲中铜片是正极,乙中铜片既不是正极也不是是负极,B项错误;两烧杯溶液中的均减小,C项正确;产生气泡的速率甲比乙快,D项错误。
10.B 图中气体收集装置是短导管进气、长导管出气,则收集的气体的密度必须小于空气且不与空气中的氧气反应,图中尾气处理有防倒吸装置,则收集的气体在水中的溶解度非常大,B项符合题意。
11.A 反应达平衡时,、、均存在,且平衡前后硫原子守恒,可知只有A项正确。
12.D 电极发生氧化反应,电极发生还原反应,D项错误。
13.B 向澄清石灰水中通入少量气体,正确的离子方程式为,A项错误;向溴水中通入适量气体,正确的离子方程式为,C项错误;向氢硫酸溶液中通入少量氯气,正确的离子方程式为,D项错误。
14.A
15.D g能与反应生成氢化物,则g是铵盐,f是氨气,d是二氧化氮,c是一氧化氮,e是氮气,b是硝酸,a是硝酸钠。f催化氧化生成c,A项错误;不能用排水法收集,B项错误;浓硝酸不具有吸水性,不可用来干燥气体,C项错误;实验室制备时,可以将浓氨水滴入碱石灰中进行制取,D项正确。
16.D ,生成的的物质的量为0.03。将0.03全部转化为沉淀,只需消耗0.06,而实际消耗了0.07,这说明硝酸与铜反应后,过量的为0.01。与铜反应中,起酸性作用的硝酸的物质的量,A项正确;根据得失电子守恒可列出方程,根据产生标准状况下的混合气体的体积可列出方程,解得,故产生的混合气体中,和的体积比为,B项正确;与铜反应中,起氧化作用的硝酸的物质的量,原硝酸溶液中溶质的物质的量,原硝酸浓度,C项正确;和的体积比为的混合气体与氧气和水发生反应的化学方程式为,故通入标准状况下氧气的物质的量为0.015,体积为336(标准状况),D项错误。
17.(1)蒸馏烧瓶 饱和溶液(各1分)
(2)乙 乙的冷凝效果好,可减少丙烯酸乙酯的损失(各2分)
(3)b(2分)
(4)漏加浓硫酸(2分)
(5)乙醇的沸点比丙烯酸低,易挥发而损耗(2分)
(6)
反应物(填编号) 预期现象和结论
①⑤ 若产物水中不含,则为酸脱羟基醇脱氢,若产物水中含,则为酸脱氢醇脱羟基 (4分,或其他合理答案)
18.(1)羧基
(2)3 3
(3) 酯化(或取代)反应
(4)CD(每空2分)
19.(1)加快溶解速率(2分)
(2)(2分) (2分)
(3)方案三(2分) 方案一和方案二均产生有害气体,酸的利用率也不高(2分)
(4)蒸发浓缩 冷却结晶(各2分)
20.(1)Y
(2)0.4
(3)高
(4)减小 减小
(5)氧化 (每空2分)
同课章节目录
