2021-2022学年沪科版高中化学第4单元《剖析物质变化中的能量变化》单元检测题(含答案)
文档属性
| 名称 | 2021-2022学年沪科版高中化学第4单元《剖析物质变化中的能量变化》单元检测题(含答案) |

|
|
| 格式 | zip | ||
| 文件大小 | 525.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-12 16:09:45 | ||
图片预览


文档简介
第4单元《剖析物质变化中的能量变化》单元检测题
一、单选题(共13题)
1.下列与化学反应能量变化相关的叙述中,正确的是
A.热化学方程式的ΔH大小与化学计量数无关
B.利用盖斯定律,可计算某些难以直接测量的反应焓变
C.H2(g)的燃烧热ΔH=-285.8kJ·mol-1,则反应2H2O(g)=2H2(g)+O2(g)的反应热ΔH=+571.6kJ·mol-1
D.测定中和反应反应热的时候,测量盐酸和NaOH混合溶液刚开始的温度,记为反应前体系的温度
2.下列叙述错误的是
A.世界是物质的,物质是在不断变化的,而物质的变化总是伴随着能量的变化
B.人类日常利用的煤、天然气、石油等的能量,归根到底是由太阳能转变来的
C.反应热是指反应过程中以热能的形式释放或吸收的反应物和生成物中具有的总能量的差值
D.天然气是二级能源
3.某兴趣小组以相同大小的铜片和锌片为电极研究水果电池,装置如图,实验所得数据如下:
实验编号 水果种类 电极间距离/cm 电流/μA
1 番茄 1 98.7
2 番茄 2 72.5
3 苹果 2 27.2
电池工作时,下列说法不正确的是
A.化学能主要转化为电能 B.负极的电极反应为Zn-2e-=Zn2+
C.电子从锌片经水果流向铜片 D.水果种类和电极间距离对电流的大小均有影响
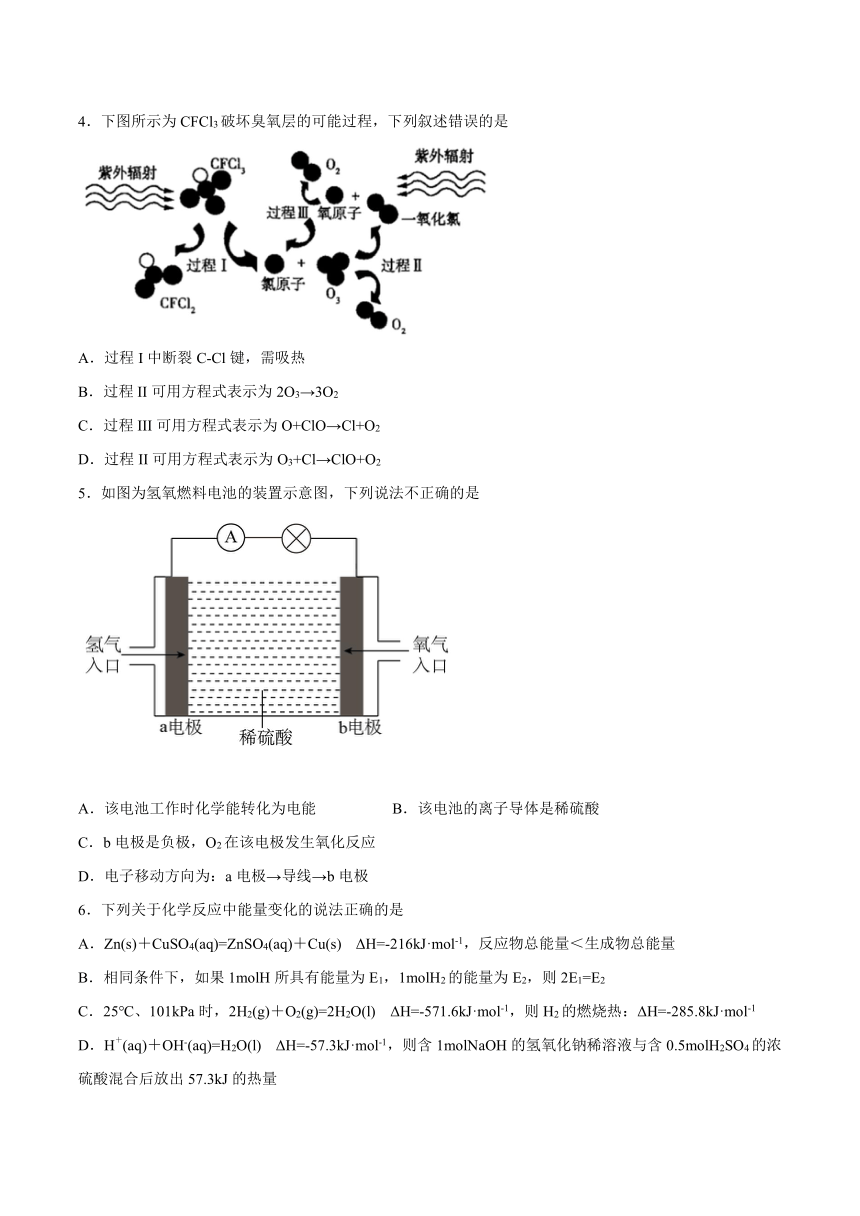
4.下图所示为CFCl3破坏臭氧层的可能过程,下列叙述错误的是
A.过程I中断裂C-Cl键,需吸热
B.过程II可用方程式表示为2O3→3O2
C.过程III可用方程式表示为O+ClO→Cl+O2
D.过程II可用方程式表示为O3+Cl→ClO+O2
5.如图为氢氧燃料电池的装置示意图,下列说法不正确的是
A.该电池工作时化学能转化为电能 B.该电池的离子导体是稀硫酸
C.b电极是负极,O2在该电极发生氧化反应
D.电子移动方向为:a电极→导线→b电极
6.下列关于化学反应中能量变化的说法正确的是
A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s) ΔH=-216kJ·mol-1,反应物总能量<生成物总能量
B.相同条件下,如果1molH所具有能量为E1,1molH2的能量为E2,则2E1=E2
C.25℃、101kPa时,2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1,则H2的燃烧热:ΔH=-285.8kJ·mol-1
D.H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1,则含1molNaOH的氢氧化钠稀溶液与含0.5molH2SO4的浓硫酸混合后放出57.3kJ的热量
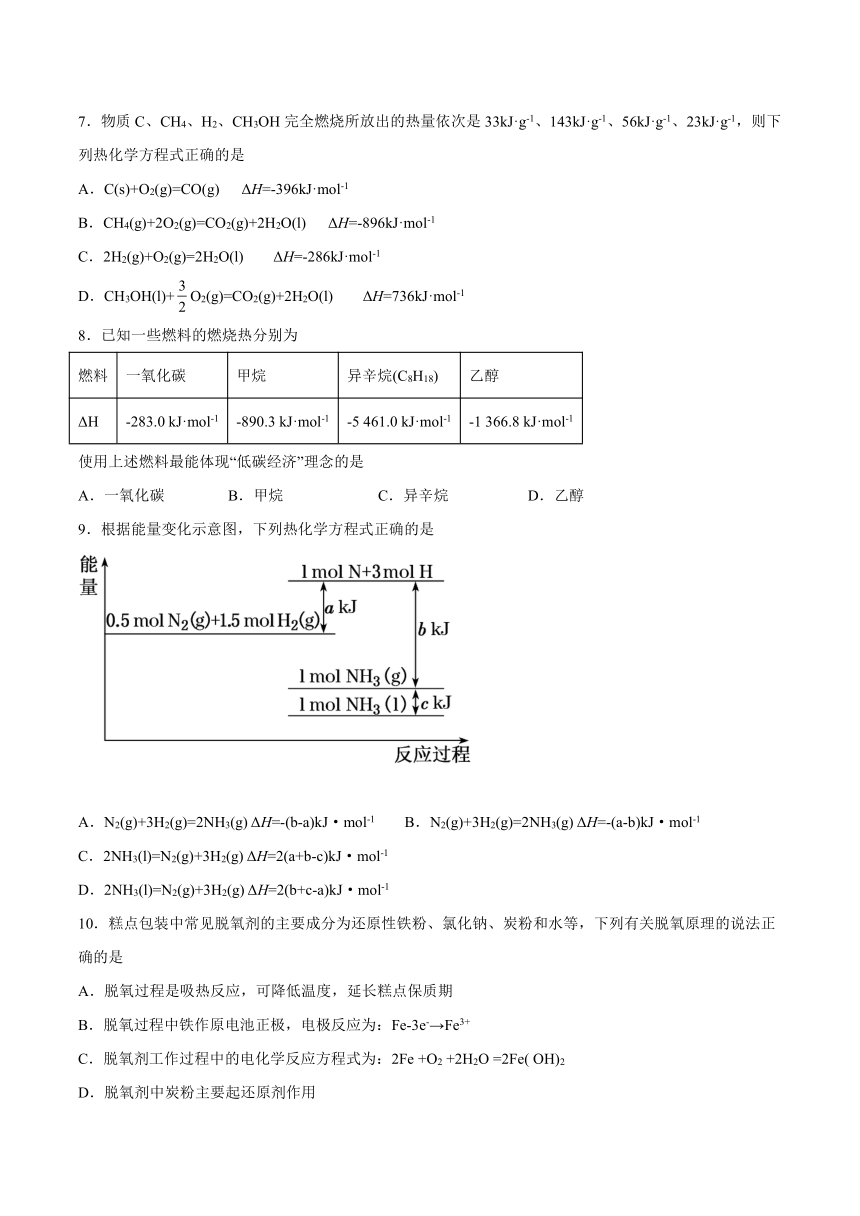
7.物质C、CH4、H2、CH3OH完全燃烧所放出的热量依次是33kJ·g-1、143kJ·g-1、56kJ·g-1、23kJ·g-1,则下列热化学方程式正确的是
A.C(s)+O2(g)=CO(g) ΔH=-396kJ·mol-1
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-896kJ·mol-1
C.2H2(g)+O2(g)=2H2O(l) ΔH=-286kJ·mol-1
D.CH3OH(l)+O2(g)=CO2(g)+2H2O(l) ΔH=736kJ·mol-1
8.已知一些燃料的燃烧热分别为
燃料 一氧化碳 甲烷 异辛烷(C8H18) 乙醇
ΔH -283.0 kJ·mol-1 -890.3 kJ·mol-1 -5 461.0 kJ·mol-1 -1 366.8 kJ·mol-1
使用上述燃料最能体现“低碳经济”理念的是
A.一氧化碳 B.甲烷 C.异辛烷 D.乙醇
9.根据能量变化示意图,下列热化学方程式正确的是
A.N2(g)+3H2(g)=2NH3(g) ΔH=-(b-a)kJ·mol-1 B.N2(g)+3H2(g)=2NH3(g) ΔH=-(a-b)kJ·mol-1
C.2NH3(l)=N2(g)+3H2(g) ΔH=2(a+b-c)kJ·mol-1
D.2NH3(l)=N2(g)+3H2(g) ΔH=2(b+c-a)kJ·mol-1
10.糕点包装中常见脱氧剂的主要成分为还原性铁粉、氯化钠、炭粉和水等,下列有关脱氧原理的说法正确的是
A.脱氧过程是吸热反应,可降低温度,延长糕点保质期
B.脱氧过程中铁作原电池正极,电极反应为:Fe-3e-→Fe3+
C.脱氧剂工作过程中的电化学反应方程式为:2Fe +O2 +2H2O =2Fe( OH)2
D.脱氧剂中炭粉主要起还原剂作用
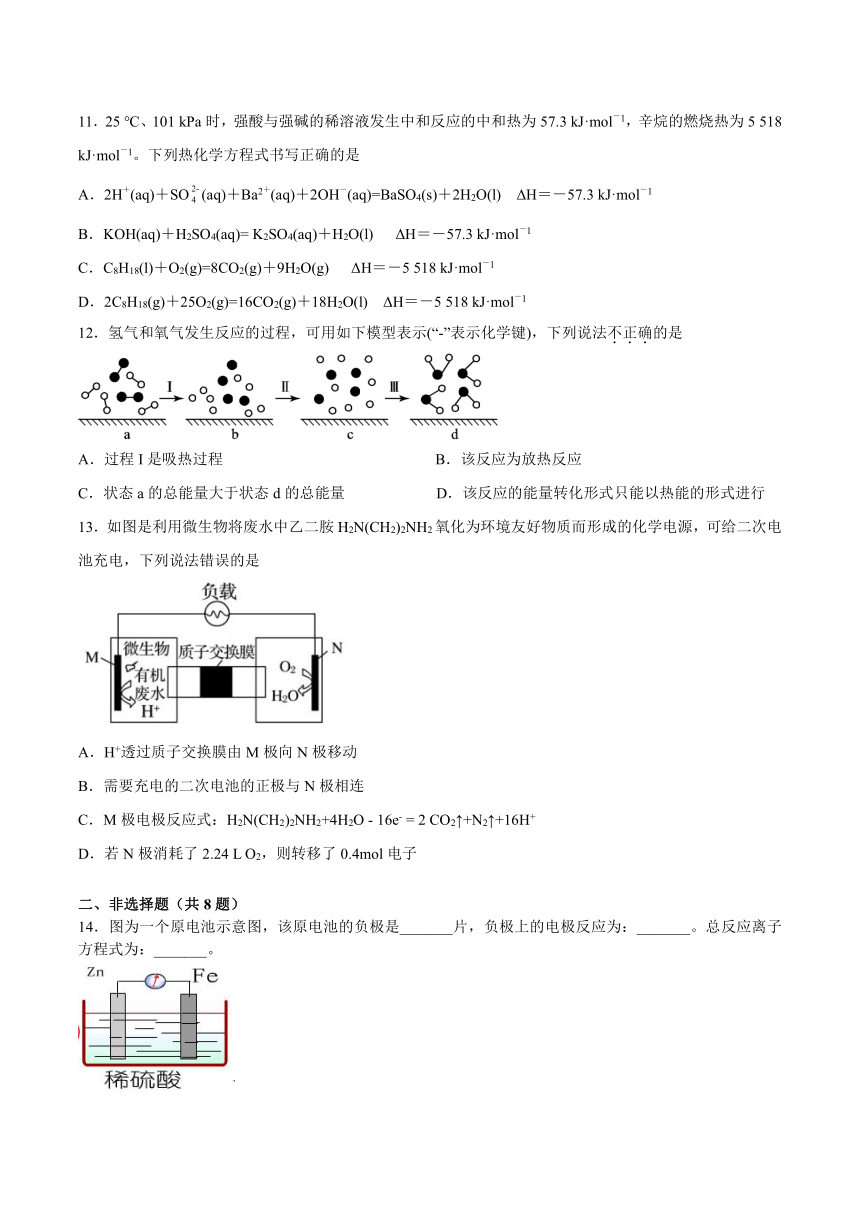
11.25 ℃、101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ·mol-1,辛烷的燃烧热为5 518 kJ·mol-1。下列热化学方程式书写正确的是
A.2H+(aq)+SO(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l) ΔH=-57.3 kJ·mol-1
B.KOH(aq)+H2SO4(aq)= K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
C.C8H18(l)+O2(g)=8CO2(g)+9H2O(g) ΔH=-5 518 kJ·mol-1
D.2C8H18(g)+25O2(g)=16CO2(g)+18H2O(l) ΔH=-5 518 kJ·mol-1
12.氢气和氧气发生反应的过程,可用如下模型表示(“-”表示化学键),下列说法不正确的是
A.过程I是吸热过程 B.该反应为放热反应
C.状态a的总能量大于状态d的总能量 D.该反应的能量转化形式只能以热能的形式进行
13.如图是利用微生物将废水中乙二胺H2N(CH2)2NH2氧化为环境友好物质而形成的化学电源,可给二次电池充电,下列说法错误的是
A.H+透过质子交换膜由M极向N极移动
B.需要充电的二次电池的正极与N极相连
C.M极电极反应式:H2N(CH2)2NH2+4H2O - 16e- = 2 CO2↑+N2↑+16H+
D.若N极消耗了2.24 L O2,则转移了0.4mol电子
二、非选择题(共8题)
14.图为一个原电池示意图,该原电池的负极是_______片,负极上的电极反应为:_______。总反应离子方程式为:_______。
15.现有纯铝片、纯铜片、导线和的溶液、量简,用如图所示装置利用原电池原理制备一定量的氢气。
(1)如图所示,装置气密性良好,且量筒已注满水,刚开始实验时,根据构成原电池必须满足的条件,首先要进行的操作是___________
(2)b的电极材料为___________,作原电池的___________极;电子经外电路由___________(①②,请填序号回答)
(3)a极上发生的电极反应为___________;反应时a极附近浓度___________(填“逐渐增大”“逐渐减小”或“始终不变”)。
(4)在标准状况下,假设反应过程中溶液体积不变,当浓度降低至一半时,通过导线的电子的物质的量为___________,该反应的氧化剂为___________,量筒中收集的气体体积最接近___________(填字母)。
A.400 B.500 C.600 D.700
16.A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的主族元素。请回答下列问题:
(1)C在元素周期表中的位置为__________,G的离子结构示意图是___________。
(2)D与E按原子个数比1:1形成化合物甲,其电子式为__________,所含化学键类型为_______。
(3)E、F、G形成的简单离子,半径由大到小顺序是_______。(用离子符号表示)
(4)用BA4、D2和EDA的水溶液组成燃料电池,电极材料为多孔惰性金属电极。在a极通入BA4气体,b极通入D2气体,则b极是该电池的_____极,负极的电极反应式为__________
17.短周期主族元素X、Y、Z、Q、R的原子序数依次增大,其中X的单质是密度最小的气体,Z是同周期中原子半径最大的元素,Y与Q同主族,且Q的原子序数是Y的两倍。回答下列问题:
(1)Z的原子结构示意图为__________,R在元素周期表中的位置是______________。
(2)Z的最高价氧化物对应水化物所含化学键类型是_______________。Q、R的最高价氧化物对应的水化物酸性较强的是__________(填化学式)。
(3)由X和Y可以形成一种液态化合物T,T分子含18个电子,则其电子式为_______。将Q的低价氧化物通入T可以生成一种强酸,反应的化学方程式为___________________。
(4)氮元素的一种氢化物M,M分子含18个电子,用惰性电极,M、氧气和Z的最高价氧化物对应水化物的溶液设计一个燃料电池,则M发生的电极反应式为______________________。
(5)在2 L密闭容器中分别充入4 mol A气体和6 mol B气体,在一定条件下发生反应:4A(g)+5B(g)4C(g)+xD(g),5 min后达到平衡状态,经测定B的转化率为75%,D的浓度为2.7 mol·L-1。则x=_______;A在平衡混合物中的体积分数为________;从反应开始至平衡时,以C的浓度变化表示该反应的平均速率v(C)=_____________。
18.利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50mL0.50mol/L盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50mL0.55mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,混合均匀,测得混合液最高温度。
回答下列问题:
(1)写出该反应的热化学方程式(已知生成lmol液态水的反应热为-57.3kJ/mol)______________________。
(2)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和 1L1mol/L盐酸恰好完全反应,其反应热分别为 H1、 H2、 H3,则 H1、 H2、 H3的大小关系为________________________。
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和反应后生成溶液的比热容c=4.18J/(g·℃),为了计算中和热,某学生实验记录数据如表:
实验序号 起始温度 终止温度
盐酸 氢氧化钠溶液 混合溶液
1 20.0 20.2 23.2
2 20.2 20.4 23.4
3 20.4 20.6 23.6
4 20.1 20.3 26.9
依据该学生的实验数据计算,该实验测得的中和热 H_____(结果保留一位小数)。
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量__________ (填“相等、不相等”),所求中和热__________(填“相等、不相等”)。
(5)利用简易量热计测量室温下盐酸与氢氧化钠溶液中和反应的反应热,下列措施不能提高实验精度的是(_______)
A.利用移液管(精确至0.01 mL)代替量筒(精确至0.1 mL)量取反应液
B.快速将两溶液混合,匀速搅拌并记录最高温度
C.在内、外筒之间填充隔热物质,防止热量损失
D.用量程为500℃的温度计代替量程为100℃的温度
19.取0.55 mol L-1的NaOH溶液50 mL与0.25 mol L-1的硫酸50 mL置于下图所示的装置中进行中和热的测定实验,回答下列问题:
(1)从如图实验装置可知,缺少的一种仪器名称是 ______________。
(2)在操作正确的前提下,提高中和热测定准确性的关键是_________。
(3)若改用60 mL 0.25 mol L-1 H2SO4和50 mL 0.55 mol L-1 NaOH 溶液进行反应,则比上述实验所放出的热量________(填“多”或“少”),若实验操作均正确,最少需要测定 _________ 次温度。
(4)写出用稀H2SO4和稀氢氧化钠溶液的反应表示中和热的热化学方程式(中和热数值为 57.3kJ mol-1):______________________________。
(5)某学生实验记录数据如下:
实验 起始温度 t1/℃ 终止温度 t2/℃
序号 硫酸 氢氧化钠溶液 混合溶液
1 20.0 20.2 23.2
2 20.2 20.4 23.4
3 20.4 20.6 23.6
依据该学生的实验数据计算,该实验测得的中和热ΔH=_______(结果保留一位小数)(已知稀溶液的比热容为4.18 J/(g ℃),稀溶液的密度1 g/cm3)。
(6)上述实验数值结果与57.3 kJ mol -1有偏差,产生偏差的原因可能是 __________。
a.用温度计测定NaOH溶液起始温度后直接测定硫酸的温度 b.量取硫酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中 d.实验装置保温、隔热效果差
20.到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源。
请回答下列问题:
⑴2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2599kJ·mol-1,
则乙炔的燃烧热为_______。
⑵有些反应进行得很慢,有些反应不容易直接发生,有些反应的产品不纯(有副反应发生),这给测定反应热造成了困难,此时可利用盖斯定律,就可以间接地把它们的反应热计算出来。已知
①CO(g)+1/2O2(g)=== CO2(g) ΔH1=-283.0kJ·mol-1 ②C(s)+O2(g)===CO2(g) ΔH2=-393.5kJ·mol-1
则C(s)+1/2O2(g)=CO(g) ΔH =__________。
⑶从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。已知键能数据如下表。
化学键 键能(kJ/mol) 化学键 键能(kJ/mol)
N≡N 942 H-O 460
N-H 391 O=O 499
H-H 437
反应N2+3H22NH3△H=akJ·mol-1。试根据表中所列键能数据估算a的数值__________。
⑷最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。该方法既有液氢燃料电池的优点,又克服了液氢不易保存的不足。其装置为用铂黑作为电极,插入强碱溶液中,一个电极通入空气,另一电极通入氨气。其电池总反应为4NH3+3O2═2N2+6H2O。试写出负极电极反应式______________。
21.I.写出下列反应的热化学方程式。
(1)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是_____________________。
(2)在1.01×105 Pa时,16 g S固体在足量的氧气中充分燃烧生成二氧化硫,放出148.5 kJ的热量,则S固体燃烧热的热化学方程式为________________________。
II.研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(3)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S固体。已知:
①CO(g)+O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH=-296.0 kJ·mol-1
此反应的热化学方程式是_____________________。
(4)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
若用标准状况下3.36 L CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为________mol,放出的热量为______________kJ(用含有a和b的代数式表示)。
参考答案
1.B 2.D 3.C 4.B 5.C 6.C 7.B 8.B 9.D 10.C 11.B 12.D 13.D
14.Zn Zn-2e- =Zn2+ Zn + 2H+=Zn2++H2↑
15.用导线把a、b连接起来 纯铜片 正极 ① Al-3e-+4OH- =AlO+2H2O 逐渐减小 0.06mol H2O D
16.第二周期VA族 Na+[:::]2- Na+ 离子键、非极性共价键(或共价键) S2->Cl->Na+ 正 CH4+10OH--8e-=CO32-+7H2O
17. 第三周期ⅦA族 离子键、(极性)共价键 HClO4 SO2+H2O2==H2SO4 N2H4—4e- +4OH- =N2+4H2O 6 3.7% 0.36 mol/(L·min)
18.HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ/mol △H1=△H2<△H3 -51.8kJ/mol 不相等 相等 D
19.环形玻璃搅拌器 减少热量损失 多 3 H2SO4(aq)+NaOH(aq)=Na2SO4(aq)+H2O(l) ΔH =-57.3 kJ mol-1
或 H+(aq)+OH-(aq)=H2O(l) ΔH =-57.3 kJ mol-1 -51.8 kJ mol-1 acd
20.1299.5 kJ·mol-1 -110.5 kJ·mol-1 a=-93 2NH3+6OH--6e-=N2+6H2O
21.4CuCl(s)+O2(g)=2CuCl2(s)+2CuO(s) ΔH=-177.6 kJ·mol-1 S(s)+O2(g)SO2(g) ΔH=-297 kJ·mol-1 2CO(g)+SO2(g)= S(s)+2CO2(g) ΔH=-270 kJ·mol-1 0.3
一、单选题(共13题)
1.下列与化学反应能量变化相关的叙述中,正确的是
A.热化学方程式的ΔH大小与化学计量数无关
B.利用盖斯定律,可计算某些难以直接测量的反应焓变
C.H2(g)的燃烧热ΔH=-285.8kJ·mol-1,则反应2H2O(g)=2H2(g)+O2(g)的反应热ΔH=+571.6kJ·mol-1
D.测定中和反应反应热的时候,测量盐酸和NaOH混合溶液刚开始的温度,记为反应前体系的温度
2.下列叙述错误的是
A.世界是物质的,物质是在不断变化的,而物质的变化总是伴随着能量的变化
B.人类日常利用的煤、天然气、石油等的能量,归根到底是由太阳能转变来的
C.反应热是指反应过程中以热能的形式释放或吸收的反应物和生成物中具有的总能量的差值
D.天然气是二级能源
3.某兴趣小组以相同大小的铜片和锌片为电极研究水果电池,装置如图,实验所得数据如下:
实验编号 水果种类 电极间距离/cm 电流/μA
1 番茄 1 98.7
2 番茄 2 72.5
3 苹果 2 27.2
电池工作时,下列说法不正确的是
A.化学能主要转化为电能 B.负极的电极反应为Zn-2e-=Zn2+
C.电子从锌片经水果流向铜片 D.水果种类和电极间距离对电流的大小均有影响
4.下图所示为CFCl3破坏臭氧层的可能过程,下列叙述错误的是
A.过程I中断裂C-Cl键,需吸热
B.过程II可用方程式表示为2O3→3O2
C.过程III可用方程式表示为O+ClO→Cl+O2
D.过程II可用方程式表示为O3+Cl→ClO+O2
5.如图为氢氧燃料电池的装置示意图,下列说法不正确的是
A.该电池工作时化学能转化为电能 B.该电池的离子导体是稀硫酸
C.b电极是负极,O2在该电极发生氧化反应
D.电子移动方向为:a电极→导线→b电极
6.下列关于化学反应中能量变化的说法正确的是
A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s) ΔH=-216kJ·mol-1,反应物总能量<生成物总能量
B.相同条件下,如果1molH所具有能量为E1,1molH2的能量为E2,则2E1=E2
C.25℃、101kPa时,2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1,则H2的燃烧热:ΔH=-285.8kJ·mol-1
D.H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1,则含1molNaOH的氢氧化钠稀溶液与含0.5molH2SO4的浓硫酸混合后放出57.3kJ的热量
7.物质C、CH4、H2、CH3OH完全燃烧所放出的热量依次是33kJ·g-1、143kJ·g-1、56kJ·g-1、23kJ·g-1,则下列热化学方程式正确的是
A.C(s)+O2(g)=CO(g) ΔH=-396kJ·mol-1
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-896kJ·mol-1
C.2H2(g)+O2(g)=2H2O(l) ΔH=-286kJ·mol-1
D.CH3OH(l)+O2(g)=CO2(g)+2H2O(l) ΔH=736kJ·mol-1
8.已知一些燃料的燃烧热分别为
燃料 一氧化碳 甲烷 异辛烷(C8H18) 乙醇
ΔH -283.0 kJ·mol-1 -890.3 kJ·mol-1 -5 461.0 kJ·mol-1 -1 366.8 kJ·mol-1
使用上述燃料最能体现“低碳经济”理念的是
A.一氧化碳 B.甲烷 C.异辛烷 D.乙醇
9.根据能量变化示意图,下列热化学方程式正确的是
A.N2(g)+3H2(g)=2NH3(g) ΔH=-(b-a)kJ·mol-1 B.N2(g)+3H2(g)=2NH3(g) ΔH=-(a-b)kJ·mol-1
C.2NH3(l)=N2(g)+3H2(g) ΔH=2(a+b-c)kJ·mol-1
D.2NH3(l)=N2(g)+3H2(g) ΔH=2(b+c-a)kJ·mol-1
10.糕点包装中常见脱氧剂的主要成分为还原性铁粉、氯化钠、炭粉和水等,下列有关脱氧原理的说法正确的是
A.脱氧过程是吸热反应,可降低温度,延长糕点保质期
B.脱氧过程中铁作原电池正极,电极反应为:Fe-3e-→Fe3+
C.脱氧剂工作过程中的电化学反应方程式为:2Fe +O2 +2H2O =2Fe( OH)2
D.脱氧剂中炭粉主要起还原剂作用
11.25 ℃、101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ·mol-1,辛烷的燃烧热为5 518 kJ·mol-1。下列热化学方程式书写正确的是
A.2H+(aq)+SO(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l) ΔH=-57.3 kJ·mol-1
B.KOH(aq)+H2SO4(aq)= K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
C.C8H18(l)+O2(g)=8CO2(g)+9H2O(g) ΔH=-5 518 kJ·mol-1
D.2C8H18(g)+25O2(g)=16CO2(g)+18H2O(l) ΔH=-5 518 kJ·mol-1
12.氢气和氧气发生反应的过程,可用如下模型表示(“-”表示化学键),下列说法不正确的是
A.过程I是吸热过程 B.该反应为放热反应
C.状态a的总能量大于状态d的总能量 D.该反应的能量转化形式只能以热能的形式进行
13.如图是利用微生物将废水中乙二胺H2N(CH2)2NH2氧化为环境友好物质而形成的化学电源,可给二次电池充电,下列说法错误的是
A.H+透过质子交换膜由M极向N极移动
B.需要充电的二次电池的正极与N极相连
C.M极电极反应式:H2N(CH2)2NH2+4H2O - 16e- = 2 CO2↑+N2↑+16H+
D.若N极消耗了2.24 L O2,则转移了0.4mol电子
二、非选择题(共8题)
14.图为一个原电池示意图,该原电池的负极是_______片,负极上的电极反应为:_______。总反应离子方程式为:_______。
15.现有纯铝片、纯铜片、导线和的溶液、量简,用如图所示装置利用原电池原理制备一定量的氢气。
(1)如图所示,装置气密性良好,且量筒已注满水,刚开始实验时,根据构成原电池必须满足的条件,首先要进行的操作是___________
(2)b的电极材料为___________,作原电池的___________极;电子经外电路由___________(①②,请填序号回答)
(3)a极上发生的电极反应为___________;反应时a极附近浓度___________(填“逐渐增大”“逐渐减小”或“始终不变”)。
(4)在标准状况下,假设反应过程中溶液体积不变,当浓度降低至一半时,通过导线的电子的物质的量为___________,该反应的氧化剂为___________,量筒中收集的气体体积最接近___________(填字母)。
A.400 B.500 C.600 D.700
16.A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的主族元素。请回答下列问题:
(1)C在元素周期表中的位置为__________,G的离子结构示意图是___________。
(2)D与E按原子个数比1:1形成化合物甲,其电子式为__________,所含化学键类型为_______。
(3)E、F、G形成的简单离子,半径由大到小顺序是_______。(用离子符号表示)
(4)用BA4、D2和EDA的水溶液组成燃料电池,电极材料为多孔惰性金属电极。在a极通入BA4气体,b极通入D2气体,则b极是该电池的_____极,负极的电极反应式为__________
17.短周期主族元素X、Y、Z、Q、R的原子序数依次增大,其中X的单质是密度最小的气体,Z是同周期中原子半径最大的元素,Y与Q同主族,且Q的原子序数是Y的两倍。回答下列问题:
(1)Z的原子结构示意图为__________,R在元素周期表中的位置是______________。
(2)Z的最高价氧化物对应水化物所含化学键类型是_______________。Q、R的最高价氧化物对应的水化物酸性较强的是__________(填化学式)。
(3)由X和Y可以形成一种液态化合物T,T分子含18个电子,则其电子式为_______。将Q的低价氧化物通入T可以生成一种强酸,反应的化学方程式为___________________。
(4)氮元素的一种氢化物M,M分子含18个电子,用惰性电极,M、氧气和Z的最高价氧化物对应水化物的溶液设计一个燃料电池,则M发生的电极反应式为______________________。
(5)在2 L密闭容器中分别充入4 mol A气体和6 mol B气体,在一定条件下发生反应:4A(g)+5B(g)4C(g)+xD(g),5 min后达到平衡状态,经测定B的转化率为75%,D的浓度为2.7 mol·L-1。则x=_______;A在平衡混合物中的体积分数为________;从反应开始至平衡时,以C的浓度变化表示该反应的平均速率v(C)=_____________。
18.利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50mL0.50mol/L盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50mL0.55mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,混合均匀,测得混合液最高温度。
回答下列问题:
(1)写出该反应的热化学方程式(已知生成lmol液态水的反应热为-57.3kJ/mol)______________________。
(2)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和 1L1mol/L盐酸恰好完全反应,其反应热分别为 H1、 H2、 H3,则 H1、 H2、 H3的大小关系为________________________。
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和反应后生成溶液的比热容c=4.18J/(g·℃),为了计算中和热,某学生实验记录数据如表:
实验序号 起始温度 终止温度
盐酸 氢氧化钠溶液 混合溶液
1 20.0 20.2 23.2
2 20.2 20.4 23.4
3 20.4 20.6 23.6
4 20.1 20.3 26.9
依据该学生的实验数据计算,该实验测得的中和热 H_____(结果保留一位小数)。
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量__________ (填“相等、不相等”),所求中和热__________(填“相等、不相等”)。
(5)利用简易量热计测量室温下盐酸与氢氧化钠溶液中和反应的反应热,下列措施不能提高实验精度的是(_______)
A.利用移液管(精确至0.01 mL)代替量筒(精确至0.1 mL)量取反应液
B.快速将两溶液混合,匀速搅拌并记录最高温度
C.在内、外筒之间填充隔热物质,防止热量损失
D.用量程为500℃的温度计代替量程为100℃的温度
19.取0.55 mol L-1的NaOH溶液50 mL与0.25 mol L-1的硫酸50 mL置于下图所示的装置中进行中和热的测定实验,回答下列问题:
(1)从如图实验装置可知,缺少的一种仪器名称是 ______________。
(2)在操作正确的前提下,提高中和热测定准确性的关键是_________。
(3)若改用60 mL 0.25 mol L-1 H2SO4和50 mL 0.55 mol L-1 NaOH 溶液进行反应,则比上述实验所放出的热量________(填“多”或“少”),若实验操作均正确,最少需要测定 _________ 次温度。
(4)写出用稀H2SO4和稀氢氧化钠溶液的反应表示中和热的热化学方程式(中和热数值为 57.3kJ mol-1):______________________________。
(5)某学生实验记录数据如下:
实验 起始温度 t1/℃ 终止温度 t2/℃
序号 硫酸 氢氧化钠溶液 混合溶液
1 20.0 20.2 23.2
2 20.2 20.4 23.4
3 20.4 20.6 23.6
依据该学生的实验数据计算,该实验测得的中和热ΔH=_______(结果保留一位小数)(已知稀溶液的比热容为4.18 J/(g ℃),稀溶液的密度1 g/cm3)。
(6)上述实验数值结果与57.3 kJ mol -1有偏差,产生偏差的原因可能是 __________。
a.用温度计测定NaOH溶液起始温度后直接测定硫酸的温度 b.量取硫酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中 d.实验装置保温、隔热效果差
20.到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源。
请回答下列问题:
⑴2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2599kJ·mol-1,
则乙炔的燃烧热为_______。
⑵有些反应进行得很慢,有些反应不容易直接发生,有些反应的产品不纯(有副反应发生),这给测定反应热造成了困难,此时可利用盖斯定律,就可以间接地把它们的反应热计算出来。已知
①CO(g)+1/2O2(g)=== CO2(g) ΔH1=-283.0kJ·mol-1 ②C(s)+O2(g)===CO2(g) ΔH2=-393.5kJ·mol-1
则C(s)+1/2O2(g)=CO(g) ΔH =__________。
⑶从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。已知键能数据如下表。
化学键 键能(kJ/mol) 化学键 键能(kJ/mol)
N≡N 942 H-O 460
N-H 391 O=O 499
H-H 437
反应N2+3H22NH3△H=akJ·mol-1。试根据表中所列键能数据估算a的数值__________。
⑷最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。该方法既有液氢燃料电池的优点,又克服了液氢不易保存的不足。其装置为用铂黑作为电极,插入强碱溶液中,一个电极通入空气,另一电极通入氨气。其电池总反应为4NH3+3O2═2N2+6H2O。试写出负极电极反应式______________。
21.I.写出下列反应的热化学方程式。
(1)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是_____________________。
(2)在1.01×105 Pa时,16 g S固体在足量的氧气中充分燃烧生成二氧化硫,放出148.5 kJ的热量,则S固体燃烧热的热化学方程式为________________________。
II.研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(3)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S固体。已知:
①CO(g)+O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH=-296.0 kJ·mol-1
此反应的热化学方程式是_____________________。
(4)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
若用标准状况下3.36 L CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为________mol,放出的热量为______________kJ(用含有a和b的代数式表示)。
参考答案
1.B 2.D 3.C 4.B 5.C 6.C 7.B 8.B 9.D 10.C 11.B 12.D 13.D
14.Zn Zn-2e- =Zn2+ Zn + 2H+=Zn2++H2↑
15.用导线把a、b连接起来 纯铜片 正极 ① Al-3e-+4OH- =AlO+2H2O 逐渐减小 0.06mol H2O D
16.第二周期VA族 Na+[:::]2- Na+ 离子键、非极性共价键(或共价键) S2->Cl->Na+ 正 CH4+10OH--8e-=CO32-+7H2O
17. 第三周期ⅦA族 离子键、(极性)共价键 HClO4 SO2+H2O2==H2SO4 N2H4—4e- +4OH- =N2+4H2O 6 3.7% 0.36 mol/(L·min)
18.HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ/mol △H1=△H2<△H3 -51.8kJ/mol 不相等 相等 D
19.环形玻璃搅拌器 减少热量损失 多 3 H2SO4(aq)+NaOH(aq)=Na2SO4(aq)+H2O(l) ΔH =-57.3 kJ mol-1
或 H+(aq)+OH-(aq)=H2O(l) ΔH =-57.3 kJ mol-1 -51.8 kJ mol-1 acd
20.1299.5 kJ·mol-1 -110.5 kJ·mol-1 a=-93 2NH3+6OH--6e-=N2+6H2O
21.4CuCl(s)+O2(g)=2CuCl2(s)+2CuO(s) ΔH=-177.6 kJ·mol-1 S(s)+O2(g)SO2(g) ΔH=-297 kJ·mol-1 2CO(g)+SO2(g)= S(s)+2CO2(g) ΔH=-270 kJ·mol-1 0.3
