2021-2022学年沪科版高中化学拓展课程第2章《化学键与晶体结构》检测题(含答案)
文档属性
| 名称 | 2021-2022学年沪科版高中化学拓展课程第2章《化学键与晶体结构》检测题(含答案) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-12 17:21:02 | ||
图片预览



文档简介
第2章《化学键与晶体结构》检测题
一、单选题(共15题)
1.区分晶体和非晶体最可靠的科学方法是
A.测定熔、沸点 B.观察外形
C.对固体进行X射线衍射 D.通过比较硬度确定
2.下列关于晶体性质的描述中,正确的是
A.晶体具有物理性质各向同性的特点
B.形成晶体的形态与结晶过程的速率无关
C.用射线衍射实验可以区分晶体和非晶体
D.晶体表现自范性的过程是自发过程,不需要外界条件
3.下列关于物质性质或结构的比较,错误的是
A.硬度:金刚石>碳化硅>晶体硅 B.熔点:
C.沸点: D.键角:
4.下列表示物质结构的化学用语或模型正确的是
A.中子数为18的氯原子: B.丙烯的结构简式:
C.CH3CHO的球棍模型:
D.用电子式表示NaCl的形成过程:
5.下列说法不正确的是
A.用红外光谱可以确定有机物的官能团
B.用原子光谱的特征谱线可以鉴定元素
C.用质谱图可以确定有机物的结构
D.用X-射线衍射实验可以区分晶体和非晶体
6.下列关于晶体的说法正确的是
A.共价晶体中,共价键键能越大,熔点越高
B.晶体中有阳离子时,必有阴离子
C.晶胞是晶体中最小的平行六面体
D.玻璃吊坠具有规则的几何外形,所以玻璃是晶体
7.含氯消毒剂是指溶于水能产生具有杀微生物活性的次氯酸的消毒剂,如次氯酸钠、氯化磷酸三钠等。苯扎氯铵是一种低毒、高效的杀菌剂,其结构可以表示如图。下列说法正确的是
A.氯化磷酸三钠的水溶液呈酸性
B.苯扎氯铵属于含氯消毒剂
C.苯扎氯铵中的氮原子是杂化
D.苯扎氯铵中的化学键全部是键
8.下列说法不正确的是
A.与互为等电子体,中含有的键数目为
B.某金属元素气态基态原子的逐级电离能的数值分别为738、1451、7733、10540、13630、17995、,当它与氯气反应时生成的阳离子是
C.熔融状态的不能导电,的稀溶液有弱的导电能力且可作手术刀的消毒液,从不同角度分类是一种共价化合物、非电解质、盐、离子晶体
D.酸性:,判据为中非羟基氧原子数大于HClO中非羟基氧原子数
9.下列化合物中C- H键极性大小次序为
(I)CH3F (II)CH3Br (III)CH3I (IV)CH3Cl
A.( I )>(II)>(III)>(IV) B.( I )>(IV)>(II)>(III)
C.(II)>( I)>(III)>(IV) D.(IV)>(III)>( II)>(I )
10.原子序数依次增大的元素、、、,它们的最外层电子数分别为1、6、7、1。的电子层结构与氦相同,和的次外层有8个电子,和的电子层结构相同。下列叙述错误的是
A.元素的非金属性顺序为
B.和其它3种元素均能形成离子化合物
C.和其它3种元素均能形成共价化合物
D.元素、、各自最高和最低化合价的代数和分别为0、4、6
11.以下性质的比较中,正确的是
A.碱性:Ca(OH)2 > Ba(OH)2 B.酸性:H3PO4 > H2SO4
C.元素最高化合价:F >O>N>C D.共价键的键能:H—F >H—Cl >H—Br >H—I
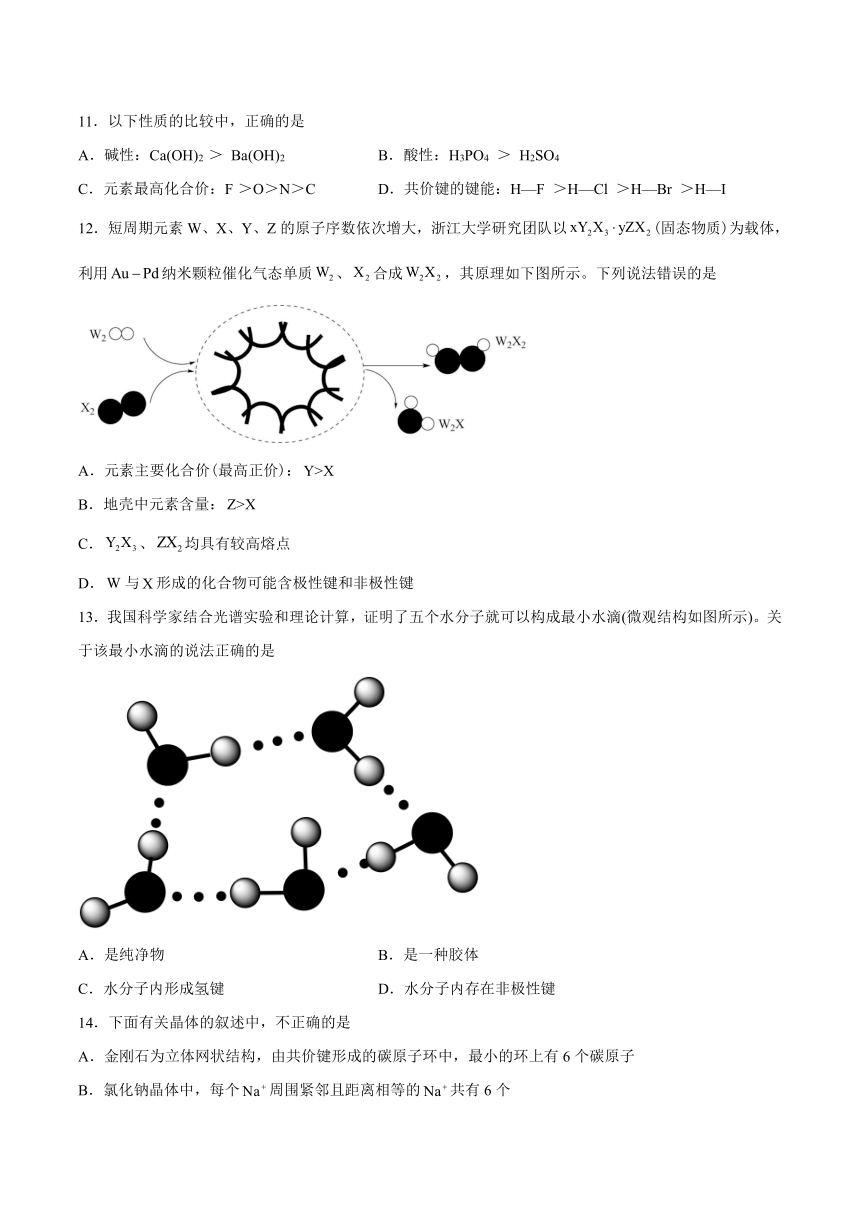
12.短周期元素W、X、Y、Z的原子序数依次增大,浙江大学研究团队以(固态物质)为载体,利用纳米颗粒催化气态单质、合成,其原理如下图所示。下列说法错误的是
A.元素主要化合价(最高正价):
B.地壳中元素含量:
C.、均具有较高熔点
D.与形成的化合物可能含极性键和非极性键
13.我国科学家结合光谱实验和理论计算,证明了五个水分子就可以构成最小水滴(微观结构如图所示)。关于该最小水滴的说法正确的是
A.是纯净物 B.是一种胶体
C.水分子内形成氢键 D.水分子内存在非极性键
14.下面有关晶体的叙述中,不正确的是
A.金刚石为立体网状结构,由共价键形成的碳原子环中,最小的环上有6个碳原子
B.氯化钠晶体中,每个周围紧邻且距离相等的共有6个
C.氯化铯晶体中,每个周围紧邻8个
D.干冰晶体中,每个分子周围紧邻12个分子
15.结构决定性质,晶体场理论认为,基态离子的轨道存在未成对电子时,电子发生跃迁是金属阳离子在水溶液中显色的主要原因。下列硫氰酸盐的水溶液有颜色的是
A. B. C. D.
二、非选择题(共10题)
16.有以下物质:①HF,②Cl2,③H2O,④N2,⑤C2H4,⑥C2H6,⑦H2O2,⑧HCN(H-C≡N)。
(1)只含有极性键的是______。
(2)只含有非极性键的是______。
(3)既有极性键,又有非极性键的是______。
(4)只有σ键的是______。
(5)既有σ键,又有π键的是______。
17.(1) N2H6Cl2属于离子化合物,且每个原子都满足稳定结构。N2H6Cl2的电子式为____。
(2)一定条件下,测定HF的相对分子质量时,实验数据明显大于理论值,原因是_____。
18.有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C在空气中燃烧时呈现黄色火焰,C的单质在加热下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述回答:
(1)写出下列元素的名称:A_____,B_____,C_____,D_____。
(2)D元素位于周期表中____周期_____族。D2-的结构示意图是____。
(3)AB2是___(填“共价”或“离子”)化合物,C2B2所含化学键的类型是___、___。写出AB2与C2B2反应的化学方程式:___________________。
(4)用电子式表示化合物C2D的形成过程:________。
19.X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大。X是元素周期表中原子半径最小的元素;Y元素基态原子有三个能级上有电子,且每个能级上的电子数相等;Z元素基态原子的单电子数在同周期元素基态原子中最多;W与Z同周期,第一电离能比Z的低;R与Y同主族;Q的最外层只有一个电子,其他电子层均有个电子(n表示电子层序数)。请回答下列问题:
(1)的核外电子排布式为______。
(2)化合物中W的杂化方式为______;的空间结构为______。
(3)Y、R的最高价氧化物中沸点较高的是______(填化学式),原因是__________________。
(4)Y有多种同素异形体,其中一种同素异形体的晶胞结构如图所示,该晶体的晶胞中所含Y原子的个数为______;若晶胞的边长为,晶体的密度为,则阿伏加德罗常数的值为______(用含a和ρ的代数式表示)。
20.Ⅰ.绿色粉末状固体化合物X由三种元素组成,取50.4gX,用蒸馏水完全溶解得绿色溶液A,将溶液A分成A1和A2两等份,完成如下实验:
请回答
(1)X的化学式是____。
(2)沉淀C分解生成固体D的过程若温度过高可能得到砖红色固体,请写出由D固体生成砖红色固体的化学方程式:____。
(3)蓝色沉淀中加入足量浓NaOH会生成一种绛蓝色溶液,原因是生成了一种和X类似的物质,请写出该反应的离子方程式____。
Ⅱ.为检验三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O的热分解产物,按如图所示装置进行实验:
请回答
(1)该套实验装置的明显缺陷是____。
(2)实验过程中观察到B中白色无水硫酸铜变成蓝色,C、F中澄清石灰水变浑浊,E中____(填实验现象),则可证明三草酸合铁酸钾热分解的气体产物是H2O、CO、CO2。
(3)样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验FeO存在的方法是:____。
21.将少量CuSO4粉末溶于盛有水的试管中得到一种天蓝色溶液,先向试管里的溶液中滴加氨水,首先形成蓝色沉淀。继续滴加氨水,沉淀溶解,得到深蓝色溶液;再加入乙醇溶剂,将析出深蓝色的晶体。
(1)溶液中呈天蓝色微粒的化学式是______,1 mol该天蓝色微粒所含的σ键数目为______。
(2)加入乙醇的作用是_____________________。
(3)写出蓝色沉淀溶解成深蓝色溶液的离子方程式______________。
(4)得到的深蓝色晶体是[Cu(NH3)4]SO4·H2O,晶体中Cu2+与NH3之间的化学键类型为_____, 该晶体中配体分子的空间构型为_________。(用文字描述)
22.某研究小组为了探究一种浅绿色盐X(仅含四种元素,不含结晶水,M(X)<908g mol-1)的组成和性质,设计并完成了如下实验:
取一定量的浅绿色盐X进行上述实验,充分反应后得到23.3g白色沉淀E、28.8g红色固体G和12.8g红色固体H。
已知:①浅绿色盐X在570℃、隔绝空气条件下受热分解为非氧化还原反应;
②常温下B呈液态且1个B分子含有10个电子。
请回答如下问题:
(1)写出B分子的电子式___。
(2)已知G溶于稀硝酸,溶液变成蓝色,并放出无色气体。请写出该反应的离子方程式为___。
(3)在隔绝空气、570℃温度下加热X至完全分解的化学反应方程式为___。
(4)一定条件下,NH3与黑色固体C发生氧化还原反应得到红色固体和气体丙(丙是大气主要成分之一),写出一个可能的化学反应方程式___。
23.回答下列问题。
(1)新型钙钛矿太阳能电池具备更加清洁、便于应用、制造成本低和效率高等显著优点。一种钙钛矿太阳能电池材料的晶胞如图所示。
该钙钛矿太阳能电池材料的化学式为______;该晶胞中,与I﹣紧邻的I﹣个数为__________。
(2)金属钼晶体中的原子堆积方式如图所示,若晶体钼的密度为ρ g·cm-3,钼原子半径为r pm,NA表示阿伏加德罗常数的值,M表示钼的相对原子质量,则钼晶胞中原子的空间利用率为________(用含有ρ、r、NA、M的代数式表示)。
(3)阿伏加德罗常数的测定有多种方法,X﹣射线衍射法就是其中的一种。通过对碲化锌晶体的X﹣射线衍射图像分析,可以得出其晶胞如图 所示。若晶体中 Te 呈立方面心最密堆积方式排列,Te 的原子半径为 a pm,晶体的密度为 ρ g·cm-3,碲化锌的摩尔质量为193g· mol-1 ,则阿伏加德罗常数 NA= _________mol-1 (列计算式表达)
(4)氮化钛的晶胞如图1所示,图2是氮化钛的晶胞截面图。NA是阿伏加德罗常数的值,氮化钛的摩尔质量为62 g· mol-1,氮化钛晶体密度为d g·cm-3,计算氮化钛晶胞中N原子半径为_________ pm。
24.下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
a
b c d e f
g h i j k l m
n o
i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
若已知 i 的原子半径为d cm,NA代表阿伏加德罗常数,i 的相对原子质量为 M,请回答:
①晶胞中i原子的配位数为___________,一个晶胞中i原子的数目为___________;
②该晶体的密度为___________g/cm3(用字母表示)。
25.磷酸盐几乎是所有食物的天然成分之一,作为重要的食品配料和功能添加剂被广泛用于食品加工中。在食品加工中使用的磷酸盐通常为钠盐钙盐、钾盐以及作为营养强化剂的铁盐和锌盐。天然存在的磷酸盐是磷矿石[主要成分为,同时还有等],用硫酸跟磷矿石反应,能生成被植物吸收的。回答下列问题:
单晶硅的晶体结构与金刚石的一种晶体结构相似,其结构如图所示,则晶胞中Si原子的体积占晶胞体积的百分率为___________(列出计算式即可)。已知该晶体的密度为,NA是阿伏加德罗常数的值。晶胞中面心上6个Si原子相连构成正八面体,该正八面体的边长为___________pm。
参考答案
1.C 2.C 3.B 4.D 5.C 6.A 7.C 8.C 9.B 10.C 11.D 12.B 13.A 14.B 15.A
16.①③⑧ ②④ ⑤⑥⑦ ①②③⑥⑦ ④⑤⑧
17. HF在通常条件下,除了正常的HF分子外,还有通过氢键联系在一起的缔合分子(HF)n,(HF)n的存在,使HF平均相对分子质量加大
18.碳 氧 钠 硫 三 ⅥA 共价 离子键 非极性共价键 2CO2+2Na2O2=2Na2CO3+O2
19.(或) 杂化 V形 为共价晶体,为分子晶体 8
20.Na2CuCl4 Cu(OH)2+2OH- = [Cu(OH)4]2- 缺少尾气处理装置 E中固体由黑色变为红色 取少量装置A中残留物,溶于稀硫酸,再滴加几滴酸性KMnO4溶液,若KMnO4溶液褪色,则证明FeO存在
21.[Cu(H2O)4]2+ 12NA 降低溶剂的极性,减小[Cu(NH3)4]SO4·H2O的溶解度 Cu(OH)2+4NH3==[Cu(NH3)4]2++2OH- 配位键(或共价健) 三角锥形
22. 3Cu2O+14H++2NO3-=6Cu2++2NO↑+7H2O Cu4(OH)6SO44CuO+SO3↑+3H2O↑ 3CuO+2NH3N2+3Cu2O+3H2O
23.PbCH3NH3I3 8 ×100%
24.12 4
25.
一、单选题(共15题)
1.区分晶体和非晶体最可靠的科学方法是
A.测定熔、沸点 B.观察外形
C.对固体进行X射线衍射 D.通过比较硬度确定
2.下列关于晶体性质的描述中,正确的是
A.晶体具有物理性质各向同性的特点
B.形成晶体的形态与结晶过程的速率无关
C.用射线衍射实验可以区分晶体和非晶体
D.晶体表现自范性的过程是自发过程,不需要外界条件
3.下列关于物质性质或结构的比较,错误的是
A.硬度:金刚石>碳化硅>晶体硅 B.熔点:
C.沸点: D.键角:
4.下列表示物质结构的化学用语或模型正确的是
A.中子数为18的氯原子: B.丙烯的结构简式:
C.CH3CHO的球棍模型:
D.用电子式表示NaCl的形成过程:
5.下列说法不正确的是
A.用红外光谱可以确定有机物的官能团
B.用原子光谱的特征谱线可以鉴定元素
C.用质谱图可以确定有机物的结构
D.用X-射线衍射实验可以区分晶体和非晶体
6.下列关于晶体的说法正确的是
A.共价晶体中,共价键键能越大,熔点越高
B.晶体中有阳离子时,必有阴离子
C.晶胞是晶体中最小的平行六面体
D.玻璃吊坠具有规则的几何外形,所以玻璃是晶体
7.含氯消毒剂是指溶于水能产生具有杀微生物活性的次氯酸的消毒剂,如次氯酸钠、氯化磷酸三钠等。苯扎氯铵是一种低毒、高效的杀菌剂,其结构可以表示如图。下列说法正确的是
A.氯化磷酸三钠的水溶液呈酸性
B.苯扎氯铵属于含氯消毒剂
C.苯扎氯铵中的氮原子是杂化
D.苯扎氯铵中的化学键全部是键
8.下列说法不正确的是
A.与互为等电子体,中含有的键数目为
B.某金属元素气态基态原子的逐级电离能的数值分别为738、1451、7733、10540、13630、17995、,当它与氯气反应时生成的阳离子是
C.熔融状态的不能导电,的稀溶液有弱的导电能力且可作手术刀的消毒液,从不同角度分类是一种共价化合物、非电解质、盐、离子晶体
D.酸性:,判据为中非羟基氧原子数大于HClO中非羟基氧原子数
9.下列化合物中C- H键极性大小次序为
(I)CH3F (II)CH3Br (III)CH3I (IV)CH3Cl
A.( I )>(II)>(III)>(IV) B.( I )>(IV)>(II)>(III)
C.(II)>( I)>(III)>(IV) D.(IV)>(III)>( II)>(I )
10.原子序数依次增大的元素、、、,它们的最外层电子数分别为1、6、7、1。的电子层结构与氦相同,和的次外层有8个电子,和的电子层结构相同。下列叙述错误的是
A.元素的非金属性顺序为
B.和其它3种元素均能形成离子化合物
C.和其它3种元素均能形成共价化合物
D.元素、、各自最高和最低化合价的代数和分别为0、4、6
11.以下性质的比较中,正确的是
A.碱性:Ca(OH)2 > Ba(OH)2 B.酸性:H3PO4 > H2SO4
C.元素最高化合价:F >O>N>C D.共价键的键能:H—F >H—Cl >H—Br >H—I
12.短周期元素W、X、Y、Z的原子序数依次增大,浙江大学研究团队以(固态物质)为载体,利用纳米颗粒催化气态单质、合成,其原理如下图所示。下列说法错误的是
A.元素主要化合价(最高正价):
B.地壳中元素含量:
C.、均具有较高熔点
D.与形成的化合物可能含极性键和非极性键
13.我国科学家结合光谱实验和理论计算,证明了五个水分子就可以构成最小水滴(微观结构如图所示)。关于该最小水滴的说法正确的是
A.是纯净物 B.是一种胶体
C.水分子内形成氢键 D.水分子内存在非极性键
14.下面有关晶体的叙述中,不正确的是
A.金刚石为立体网状结构,由共价键形成的碳原子环中,最小的环上有6个碳原子
B.氯化钠晶体中,每个周围紧邻且距离相等的共有6个
C.氯化铯晶体中,每个周围紧邻8个
D.干冰晶体中,每个分子周围紧邻12个分子
15.结构决定性质,晶体场理论认为,基态离子的轨道存在未成对电子时,电子发生跃迁是金属阳离子在水溶液中显色的主要原因。下列硫氰酸盐的水溶液有颜色的是
A. B. C. D.
二、非选择题(共10题)
16.有以下物质:①HF,②Cl2,③H2O,④N2,⑤C2H4,⑥C2H6,⑦H2O2,⑧HCN(H-C≡N)。
(1)只含有极性键的是______。
(2)只含有非极性键的是______。
(3)既有极性键,又有非极性键的是______。
(4)只有σ键的是______。
(5)既有σ键,又有π键的是______。
17.(1) N2H6Cl2属于离子化合物,且每个原子都满足稳定结构。N2H6Cl2的电子式为____。
(2)一定条件下,测定HF的相对分子质量时,实验数据明显大于理论值,原因是_____。
18.有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C在空气中燃烧时呈现黄色火焰,C的单质在加热下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述回答:
(1)写出下列元素的名称:A_____,B_____,C_____,D_____。
(2)D元素位于周期表中____周期_____族。D2-的结构示意图是____。
(3)AB2是___(填“共价”或“离子”)化合物,C2B2所含化学键的类型是___、___。写出AB2与C2B2反应的化学方程式:___________________。
(4)用电子式表示化合物C2D的形成过程:________。
19.X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大。X是元素周期表中原子半径最小的元素;Y元素基态原子有三个能级上有电子,且每个能级上的电子数相等;Z元素基态原子的单电子数在同周期元素基态原子中最多;W与Z同周期,第一电离能比Z的低;R与Y同主族;Q的最外层只有一个电子,其他电子层均有个电子(n表示电子层序数)。请回答下列问题:
(1)的核外电子排布式为______。
(2)化合物中W的杂化方式为______;的空间结构为______。
(3)Y、R的最高价氧化物中沸点较高的是______(填化学式),原因是__________________。
(4)Y有多种同素异形体,其中一种同素异形体的晶胞结构如图所示,该晶体的晶胞中所含Y原子的个数为______;若晶胞的边长为,晶体的密度为,则阿伏加德罗常数的值为______(用含a和ρ的代数式表示)。
20.Ⅰ.绿色粉末状固体化合物X由三种元素组成,取50.4gX,用蒸馏水完全溶解得绿色溶液A,将溶液A分成A1和A2两等份,完成如下实验:
请回答
(1)X的化学式是____。
(2)沉淀C分解生成固体D的过程若温度过高可能得到砖红色固体,请写出由D固体生成砖红色固体的化学方程式:____。
(3)蓝色沉淀中加入足量浓NaOH会生成一种绛蓝色溶液,原因是生成了一种和X类似的物质,请写出该反应的离子方程式____。
Ⅱ.为检验三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O的热分解产物,按如图所示装置进行实验:
请回答
(1)该套实验装置的明显缺陷是____。
(2)实验过程中观察到B中白色无水硫酸铜变成蓝色,C、F中澄清石灰水变浑浊,E中____(填实验现象),则可证明三草酸合铁酸钾热分解的气体产物是H2O、CO、CO2。
(3)样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验FeO存在的方法是:____。
21.将少量CuSO4粉末溶于盛有水的试管中得到一种天蓝色溶液,先向试管里的溶液中滴加氨水,首先形成蓝色沉淀。继续滴加氨水,沉淀溶解,得到深蓝色溶液;再加入乙醇溶剂,将析出深蓝色的晶体。
(1)溶液中呈天蓝色微粒的化学式是______,1 mol该天蓝色微粒所含的σ键数目为______。
(2)加入乙醇的作用是_____________________。
(3)写出蓝色沉淀溶解成深蓝色溶液的离子方程式______________。
(4)得到的深蓝色晶体是[Cu(NH3)4]SO4·H2O,晶体中Cu2+与NH3之间的化学键类型为_____, 该晶体中配体分子的空间构型为_________。(用文字描述)
22.某研究小组为了探究一种浅绿色盐X(仅含四种元素,不含结晶水,M(X)<908g mol-1)的组成和性质,设计并完成了如下实验:
取一定量的浅绿色盐X进行上述实验,充分反应后得到23.3g白色沉淀E、28.8g红色固体G和12.8g红色固体H。
已知:①浅绿色盐X在570℃、隔绝空气条件下受热分解为非氧化还原反应;
②常温下B呈液态且1个B分子含有10个电子。
请回答如下问题:
(1)写出B分子的电子式___。
(2)已知G溶于稀硝酸,溶液变成蓝色,并放出无色气体。请写出该反应的离子方程式为___。
(3)在隔绝空气、570℃温度下加热X至完全分解的化学反应方程式为___。
(4)一定条件下,NH3与黑色固体C发生氧化还原反应得到红色固体和气体丙(丙是大气主要成分之一),写出一个可能的化学反应方程式___。
23.回答下列问题。
(1)新型钙钛矿太阳能电池具备更加清洁、便于应用、制造成本低和效率高等显著优点。一种钙钛矿太阳能电池材料的晶胞如图所示。
该钙钛矿太阳能电池材料的化学式为______;该晶胞中,与I﹣紧邻的I﹣个数为__________。
(2)金属钼晶体中的原子堆积方式如图所示,若晶体钼的密度为ρ g·cm-3,钼原子半径为r pm,NA表示阿伏加德罗常数的值,M表示钼的相对原子质量,则钼晶胞中原子的空间利用率为________(用含有ρ、r、NA、M的代数式表示)。
(3)阿伏加德罗常数的测定有多种方法,X﹣射线衍射法就是其中的一种。通过对碲化锌晶体的X﹣射线衍射图像分析,可以得出其晶胞如图 所示。若晶体中 Te 呈立方面心最密堆积方式排列,Te 的原子半径为 a pm,晶体的密度为 ρ g·cm-3,碲化锌的摩尔质量为193g· mol-1 ,则阿伏加德罗常数 NA= _________mol-1 (列计算式表达)
(4)氮化钛的晶胞如图1所示,图2是氮化钛的晶胞截面图。NA是阿伏加德罗常数的值,氮化钛的摩尔质量为62 g· mol-1,氮化钛晶体密度为d g·cm-3,计算氮化钛晶胞中N原子半径为_________ pm。
24.下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
a
b c d e f
g h i j k l m
n o
i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
若已知 i 的原子半径为d cm,NA代表阿伏加德罗常数,i 的相对原子质量为 M,请回答:
①晶胞中i原子的配位数为___________,一个晶胞中i原子的数目为___________;
②该晶体的密度为___________g/cm3(用字母表示)。
25.磷酸盐几乎是所有食物的天然成分之一,作为重要的食品配料和功能添加剂被广泛用于食品加工中。在食品加工中使用的磷酸盐通常为钠盐钙盐、钾盐以及作为营养强化剂的铁盐和锌盐。天然存在的磷酸盐是磷矿石[主要成分为,同时还有等],用硫酸跟磷矿石反应,能生成被植物吸收的。回答下列问题:
单晶硅的晶体结构与金刚石的一种晶体结构相似,其结构如图所示,则晶胞中Si原子的体积占晶胞体积的百分率为___________(列出计算式即可)。已知该晶体的密度为,NA是阿伏加德罗常数的值。晶胞中面心上6个Si原子相连构成正八面体,该正八面体的边长为___________pm。
参考答案
1.C 2.C 3.B 4.D 5.C 6.A 7.C 8.C 9.B 10.C 11.D 12.B 13.A 14.B 15.A
16.①③⑧ ②④ ⑤⑥⑦ ①②③⑥⑦ ④⑤⑧
17. HF在通常条件下,除了正常的HF分子外,还有通过氢键联系在一起的缔合分子(HF)n,(HF)n的存在,使HF平均相对分子质量加大
18.碳 氧 钠 硫 三 ⅥA 共价 离子键 非极性共价键 2CO2+2Na2O2=2Na2CO3+O2
19.(或) 杂化 V形 为共价晶体,为分子晶体 8
20.Na2CuCl4 Cu(OH)2+2OH- = [Cu(OH)4]2- 缺少尾气处理装置 E中固体由黑色变为红色 取少量装置A中残留物,溶于稀硫酸,再滴加几滴酸性KMnO4溶液,若KMnO4溶液褪色,则证明FeO存在
21.[Cu(H2O)4]2+ 12NA 降低溶剂的极性,减小[Cu(NH3)4]SO4·H2O的溶解度 Cu(OH)2+4NH3==[Cu(NH3)4]2++2OH- 配位键(或共价健) 三角锥形
22. 3Cu2O+14H++2NO3-=6Cu2++2NO↑+7H2O Cu4(OH)6SO44CuO+SO3↑+3H2O↑ 3CuO+2NH3N2+3Cu2O+3H2O
23.PbCH3NH3I3 8 ×100%
24.12 4
25.
