江苏省省熟中2021-2022学年高二上学期10月阶段学习质量检测化学试题(扫描版含答案)
文档属性
| 名称 | 江苏省省熟中2021-2022学年高二上学期10月阶段学习质量检测化学试题(扫描版含答案) |  | |
| 格式 | |||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-13 09:30:14 | ||
图片预览

文档简介
2021~202学年度第一学期省熟中十月阶段学习质量检测
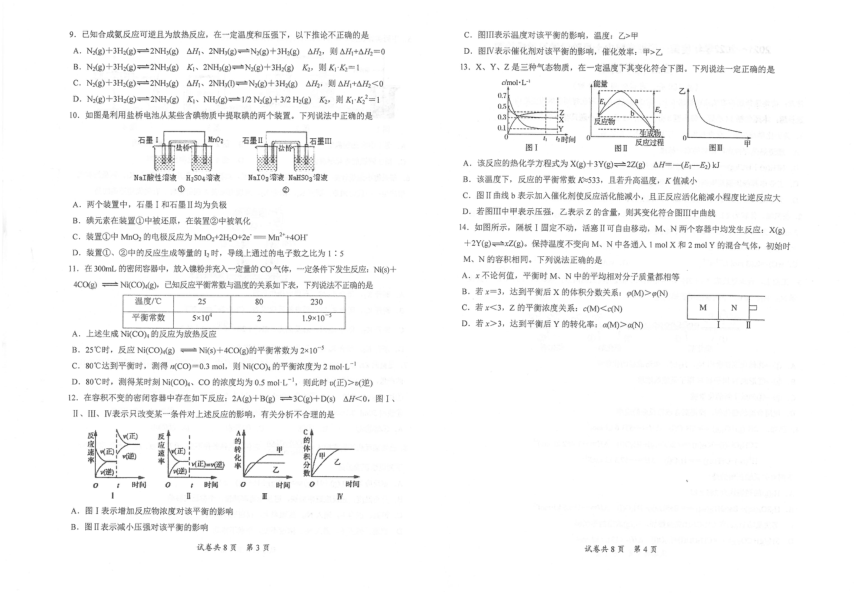
5.下列实验装置或操作均正确且能达到实验目的的是
高二化学试题
(共100分,考试时间75分钟)
注意:请将选择题答案填涂在答题卡上,非选择题答案填写在答题卷对应空格内。
立z
选择题:本题包括14小题,每小题3分,共计42分。每小题只有一个选项符合题意
1.关于化学与生活、化学与生产,下列说法不正确的是
图
A.燃烧热是评价燃料优劣的唯一标准
A.图1中和热的测定
B.图2验证温度对平衡的影响
B.NHg)+HCg)NH4CI(s)低温下能自发进行,说明该反应的△H<0
C.图3钢铁的电化学腐蚀
D.图4测定化学反应速率
℃.工业电解精炼铜用粗铜作阳极,纯铜作阴极
6.某兴趣小组设计如下图所示的微型实验装置。实验时,先断开K2,闭合K1,两极均有气
D.为了延缓海水中钢闸门的腐蚀,常将钢闸门与直流电源的负极相连
泡产生;一段时间后,断开K1,闭合K2,发现电流表A指针偏转。有关描述正确的是
2.在恒温、体积为2L的密闭容器中进行反应:2A(s)=3B(g)+C(g),若反应物在前20s由
值流电
3mol降为1.8mol,则前20s的平均反应速率为
A.HA)=0.06molL-1.s-1
B, v(B)=0.045 molL.S
石墨
C.wC)=0.03molL-1.s-1
D. v(A)=0.03 mol-L.S
3.工业上,合成氨反应N2+3H
H3的微观历程如图所示,用OO、。、d分别表
饱和食盐水
示N2、H2、NH3,下列说法不正确的是
A.断开K1,闭合K2时,石墨电极作正极
B.断开K1,闭合K2时,铜电极反应式为:C2+2e=2Cl
C.断开K2,闭合K1时,总反应为:2H+2C1C2↑+H2↑
催化剂
催化剂
催化剂
D.断开K2,闭合K1时,石墨电极附近溶液变红
A.①→②催化剂在吸附N2、H2时,未形成新的化学键
7.足量的Zn粉与50mL0.1molL的稀硫酸充分反应。为了减慢产生H2的速率而不改变H2
B.②③形成N原子和H原子是放热过程
的产量,可以采用方法有
③→④形成了新的化学键
①加Na2SO4溶液②改用50mL0.1molL的稀盐酸③减压
D.使用合适的催化剂,能提高合成氨反应的速率
④改用50mL0.1molL的硝酸⑤冰水浴
加Na2CO3溶液
4.已知:2H2(g)+O(g)=2H2O△H=-5716kJmo
A.①②③④
B.①⑤
C.①⑤⑥
D.②③⑥
2CH3OH()+302(g)=2CO2(g)+4H2O() AH=-1 452 kJ-mol
8.已知某反应平衡常数K=cH2ye(CO2)
若保持其他条件不变,升高温度,H2平衡浓度变小,
aq)OH(aq)==H2O() AH=--573 kJ mol
下列说法正确的是
下列有关说法正确的是
该反应为CO2(g)+H2(g)=CO(g)+H2Og)△H>0
A.H2(g)的燃烧热为2858kJ
B.升高温度,正反应速率加快,逆反应速率减慢,平衡正向移动
B. H2SO(aq)+ Ba(OH)2(aq) BaSO4 (s)+2H20() AH=-1146. mol
C.等质量的H2(g)和CH2OH(1)完全燃烧,H2(g)放出的热量多
C.恒温、恒容下,通入N2,压强增大,反应速率加快
D. 3H2(g)+CO2(g)=CH3OH()-H2O()AH=+131.4 kJ mol
D.恒温、恒压下,通入N2,浓度不变,平衡不移动
试卷共8页第1页
试卷共8页第2页
5.下列实验装置或操作均正确且能达到实验目的的是
高二化学试题
(共100分,考试时间75分钟)
注意:请将选择题答案填涂在答题卡上,非选择题答案填写在答题卷对应空格内。
立z
选择题:本题包括14小题,每小题3分,共计42分。每小题只有一个选项符合题意
1.关于化学与生活、化学与生产,下列说法不正确的是
图
A.燃烧热是评价燃料优劣的唯一标准
A.图1中和热的测定
B.图2验证温度对平衡的影响
B.NHg)+HCg)NH4CI(s)低温下能自发进行,说明该反应的△H<0
C.图3钢铁的电化学腐蚀
D.图4测定化学反应速率
℃.工业电解精炼铜用粗铜作阳极,纯铜作阴极
6.某兴趣小组设计如下图所示的微型实验装置。实验时,先断开K2,闭合K1,两极均有气
D.为了延缓海水中钢闸门的腐蚀,常将钢闸门与直流电源的负极相连
泡产生;一段时间后,断开K1,闭合K2,发现电流表A指针偏转。有关描述正确的是
2.在恒温、体积为2L的密闭容器中进行反应:2A(s)=3B(g)+C(g),若反应物在前20s由
值流电
3mol降为1.8mol,则前20s的平均反应速率为
A.HA)=0.06molL-1.s-1
B, v(B)=0.045 molL.S
石墨
C.wC)=0.03molL-1.s-1
D. v(A)=0.03 mol-L.S
3.工业上,合成氨反应N2+3H
H3的微观历程如图所示,用OO、。、d分别表
饱和食盐水
示N2、H2、NH3,下列说法不正确的是
A.断开K1,闭合K2时,石墨电极作正极
B.断开K1,闭合K2时,铜电极反应式为:C2+2e=2Cl
C.断开K2,闭合K1时,总反应为:2H+2C1C2↑+H2↑
催化剂
催化剂
催化剂
D.断开K2,闭合K1时,石墨电极附近溶液变红
A.①→②催化剂在吸附N2、H2时,未形成新的化学键
7.足量的Zn粉与50mL0.1molL的稀硫酸充分反应。为了减慢产生H2的速率而不改变H2
B.②③形成N原子和H原子是放热过程
的产量,可以采用方法有
③→④形成了新的化学键
①加Na2SO4溶液②改用50mL0.1molL的稀盐酸③减压
D.使用合适的催化剂,能提高合成氨反应的速率
④改用50mL0.1molL的硝酸⑤冰水浴
加Na2CO3溶液
4.已知:2H2(g)+O(g)=2H2O△H=-5716kJmo
A.①②③④
B.①⑤
C.①⑤⑥
D.②③⑥
2CH3OH()+302(g)=2CO2(g)+4H2O() AH=-1 452 kJ-mol
8.已知某反应平衡常数K=cH2ye(CO2)
若保持其他条件不变,升高温度,H2平衡浓度变小,
aq)OH(aq)==H2O() AH=--573 kJ mol
下列说法正确的是
下列有关说法正确的是
该反应为CO2(g)+H2(g)=CO(g)+H2Og)△H>0
A.H2(g)的燃烧热为2858kJ
B.升高温度,正反应速率加快,逆反应速率减慢,平衡正向移动
B. H2SO(aq)+ Ba(OH)2(aq) BaSO4 (s)+2H20() AH=-1146. mol
C.等质量的H2(g)和CH2OH(1)完全燃烧,H2(g)放出的热量多
C.恒温、恒容下,通入N2,压强增大,反应速率加快
D. 3H2(g)+CO2(g)=CH3OH()-H2O()AH=+131.4 kJ mol
D.恒温、恒压下,通入N2,浓度不变,平衡不移动
试卷共8页第1页
试卷共8页第2页
同课章节目录
