化学高一必修1人教版化学反应的速率和限度
文档属性
| 名称 | 化学高一必修1人教版化学反应的速率和限度 |

|
|
| 格式 | zip | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-08-12 12:11:23 | ||
图片预览










文档简介
(共40张PPT)
第一课时
引入新课
新课学习
课堂检测
课堂小结
50年前,故宫太和殿栏杆上雕刻着精美浮雕花纹还清晰可见,而现在却大多是模糊不清,部分已成了光板……
造成这些灾难的元凶是什么呢?为什么几百年腐蚀很慢,而近几十年腐蚀却变快了呢?
化学反应速率
引入新课
飞机上煤油爆炸是一个进行得非常快速的反应,爆炸和撞击足以爆发了911人间特大悲剧。
引入新课
美国纽约的世界贸易中心双塔
轰然倒塌
化为一片废墟
引入新课
桂林的溶洞
那千姿百态的钟乳和石笋,形成现在的样子,却让我们等了几万年!
引入新课
牛奶变质
铁棒生锈
溶洞形成
很快
较快
较慢
很慢
定性描述
为什么化学反应有快有慢?
影响快慢的因素又是什么呢?
请描述下列反应快慢程度。
爆炸
提示:可用“很快、较快、较慢、很慢” 。
新课学习
观察反应快慢的方法:
冒气泡快慢;
气球大小;
火焰明亮程度;
浑浊程度;
颜色变化;
温度变化
等等。
新课学习
一辆汽车行驶速率的决定因素是什么?
影响因素又是什么?
决定因素(内因):汽车本身的性能
影响因素(外因):
思考讨论:
如发动机的功率等
新课学习
⑴天气
⑵路况
⑶燃料质量
⑷司机的驾驶水平和经验
2、化学反应速率的影响因素
(1)内因(决定作用):
化学性质越活泼,反应速率越快
埃及法老王金制头像
反应物的性质
很快生锈的铁锅
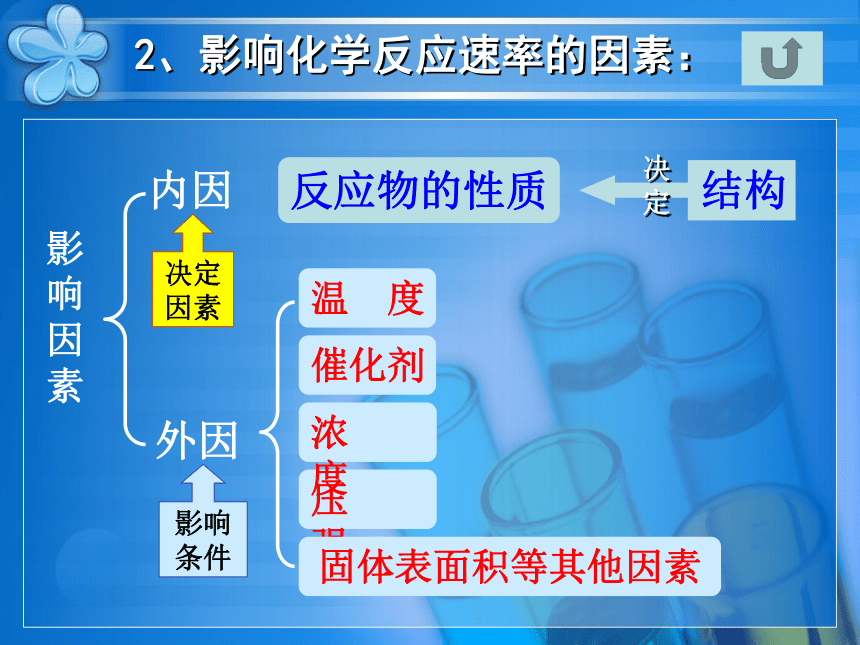
2、影响化学反应速率的因素:
内因
反应物的性质
外因
决定因素
影响条件
压 强
影响因素
温 度
催化剂
浓 度
固体表面积等其他因素
结构
决定
2、影响化学反应速率的因素:
内因
反应物的性质
外因
决定因素
影响条件
压 强
影响因素
温 度
催化剂
浓 度
固体表面积等其他因素
结构
决定
课本P48实验2-5
在2支试管中,分别装入2-3ml约5%的H2O2溶液,滴入1-2滴1mol/LFeCl3溶液。待试管中有适量气泡出现时,将试管放入盛有冷水的烧杯中,记录下观察到的现象;再将试管放入盛有热水的烧杯中,再对此观察现象,并记录。
2、化学反应速率的影响因素
(1)内因(决定作用):反应物的性质
(2)外因(外界条件):
现 象 结 论
热水中
常温
冷水中
溶液中产生气泡的速率很快
温度越高,化学反应速率越快
溶液中有气泡产生,且速率较快
常温条件下,化学反应速率还算较快
溶液中产生气泡的速率较慢
温度越低,化学反应速率越慢
在其它条件不变时,升高反应体系的温度,化学反应速率加快;
化学反应方程式为:2H2O2==== 2H2O + O2↑
FeCl3
温度对化学反应的影响
实验测得:
温度每升高10℃,化学反应速率通常增大原来的2~4倍。
温度对化学反应的影响
课本实验2-6 现 象 结 论
加入MnO2
加入FeCl3
不加其它
试 剂
立即有大量气泡产生
2H2O2==2H2O + O2↑
催化剂MnO2能加快反应速率
MnO2
有大量气泡产生
2H2O2==2H2O + O2↑
催化剂FeCl3能加快反应速率
FeCl3
溶液中有少量气泡出现
不用催化剂,化学反应速率很小
在其它条件不变时:
催化剂通常可以加快化学反应速率;
不同催化剂对同一个反应的催化能力不同。
催化剂对化学反应的影响
CA-2000新型硬铬电镀催化剂
神奇的催化剂
该厂与南京大学、江苏省化工研究所合作,研制出新型硬铬电镀催化剂。该催化剂能大幅度地降低电镀成本,提高电镀品质,产品已占全国份额90%以上。靠的就是高新技术及催化剂的神奇效果。
催化剂对化学反应的影响
任务:自学P49 神奇的催化剂
催化剂能极大地改变反应速率,而自身的组成、化学性质和质量在反应前后不发生变化。
思考与交流1:
催化剂有什么特性?
高效性
选择性(专一性)
催化剂对化学反应的影响
任务:自学P49 神奇的催化剂
思考与交流2:
你能说出催化剂对化学反应进行快慢的影响在生活中、生产中和化学实验中有什么例子、应用吗?
1.煤碳炉用的煤球
2.酿酒
3.加酶洗衣粉
4.食物的消化吸收
催化剂对化学反应的影响
压强增大
播放
压强对化学反应的影响
增大压强
容积减小
浓度增大
反应加快
减小压强
容积增大
浓度降低
反应减慢
接触面积越大,反应速率越快!
烧火煮饭,先将木柴劈小。
固体的表面积、溶剂、状态、光照等。
其他因素对化学反应的影响
化学反应速率的快慢描述
光在空气中的传播速度是3×108m/s
定量描述
用准确的数值
光的传播速度是很快的
定性描述
很快、较快、较慢、很慢
描述方法
举例
概念:用来衡量化学反应进行的快慢程度。
表示方法:
通常用单位时间内反应物浓度的减少或
生成物浓度的增加来表示。
通常用符号v表示。
计算公式: v =△C/△t =△n/(V △t)
单位: mol/(L·min) 或mol/(L·s)
mol L-1 min-1或mol L-1 S-1
3、定量表示与计算
(1)在定量表示一个化学反应的反应速率时,必须指明是用哪一种物质来表示。
如:V(N2) =△C(N2)/t =1 mol L-1 S-1
(2)化学反应速率都取正值,且是某一段时间内的平均速率。
(3)固体和纯液体的浓度视为常数(保持不变),因此,它们的化学反应速率也视为常数。
3、定量表示与计算
解: 2SO2 + O2 2SO3
n(起始) 2mol 1mol 0
n(变化)
n(2s后) 0.8mol
例1:向一个容积为1L的密闭容器中放入2mol SO2和1mol O2,在一定条件下,2S末测得容器内有0.8mol SO2,求2S内SO2、O2、SO3的平均反应速率。
1.2mol
0.6mol
1.2mol
化学反应速率的有关计算
VSO2=0.6mol/(l·s) VO2=0.3mol/(l·s) VSO3=0.6mol/(l·s)
2 : 1 : 2
结论:
各物质的速率之比等于方程式计量数之比。
常用方法: “三步法(起、变、后)”
常用规律:速率比等于化学计量数之比
化学反应速率的有关计算
常用方法: “三步法(起、变、后)”
常用规律:速率比等于化学计量数之比
好比拖拉机的前后轮因直径不同,它们的转速并不相同;
但它们代表的是拖拉机相同的行驶速度。
结论:
各物质的速率之比等于方程式计量数之比
解:5min内生成NH3的物质的量浓度为:
0.05mol/L
C(NH3)=
1.7g
17g/mol
2L
=
ν(NH3)
=
0.05mol/L
5min
=0.01mol/(L·min)
练习:反应N2+3H2=2NH3在2L的密闭容器中发生反应,5min内NH3的质量增加了1.7g,求ν(NH3)、 ν(N2)、 ν(H2)。
3、定量表示与计算
N2 + 3H2 = 2NH3
1
3
2
0.01mol/(L·min)
ν(H2)
ν(N2)
ν(H2)=
3
×
0.01mol/(L·min)
2
= 0.015mol/(L·min)
ν(N2)=
1
×
0.01mol/(L·min)
2
= 0.005mol/(L·min)
解:
3、定量表示与计算
定义:用单位时间内反应物浓度的减少量或生成物浓度的增加量来表示。
V =
△c
△t
单位:
mol/(L min) 或 mol/(L s)
请注意记好笔记
注意:1、反应速率之比等于其化学计量数之比
4、固体和纯液体的浓度不变,
2、表示指定时间内的平均速率
3、反应速率要指明具体物质并取正值
公式:
故常不用来研究反应速率。
3、定量表示与计算
4.如何控制
如何学好化学去控制化学反应速率,从而为人类所利用?
钢铁生锈可以控制吗?
【作业】
据不完全统计,全世界每年钢材产量的约1/3因腐蚀而损失。已知钢铁的腐蚀是一种缓慢氧化。请你调查研究:人们为了减慢钢铁的腐蚀,采取了哪些措施?
研究性学习
铁的缓慢氧化是一个放热反应,但因放热缓慢而不能利用。研究人员在铁粉中加入木炭、食盐等物质,装在微孔透气膜制作的内袋里,外面再套上一个不透气的外袋。这样就研制出了可治疗风湿的热敷袋。请课后查阅资料,了解热敷袋加快铁的缓慢氧化的原理。
化学热敷袋 化学暧手宝
热敷袋能够缓解疼痛,可作为送给长辈的礼物。
思考1:
为什么要将食物存放在温度低的地方(如电冰箱)?
温度越低,化学反应速率越小。
思考2: 实验时,通常要将两种块状或颗粒状的固体药品研细,并混匀后再进行反应。原因是什么?
固体表面积越大,化学反应速率越大。
课堂检测与总结
思考3:人们常把固体试剂溶于水配成溶液再进行化学实验,原因是什么?
接触的机会极大地增加,可以提高反应速率。
思考4:实验室常用约30%左右的硫酸溶液与锌粒反应制取氢气,当反应进行一段时间后,气泡变少(锌粒有剩余),如果添加一些适当浓度的硫酸溶液到反应容器中,气泡又会重新增多起来。原因是什么?
反应物浓度越大,化学反应速率越大。
课堂检测与总结
1.请预计大理石( CaCO3 )分别与0.1mol/L和1mol/L的盐酸反应的快慢。你能得出什么结论吗?
2.块状CaCO3、粉末状CaCO3与0.1 mol/L的盐酸反应谁快谁慢?为什么?
3.实验室进行化学反应 时,常常把一些固体物质溶于水配成溶液再进行反应。为什么?
4.实验室制取氢气时,是用粗锌好(有杂质)还是用纯锌好,为什么?
增大浓度反应速率加快,减小浓度反应速率减慢。
增大固体表面积可以加快反应速率(接触充分)
离子反应速率快,瞬间完成。
形成原电池可以加快反应速率。
没有旧键断裂,只有新键形成。
浓度的影响
固体表面积
形成原电池
思考与交流
5.请利用所学的知识回答下列问题:
(1)消防队员救火时,开门都很小心,因为门一打开就有可能发生爆炸。请解释其中的原因。
(2)在实验室里,硝酸、硝酸银等药品均必须用棕色试剂瓶保存,并应该存放在阴凉干燥处。为什么
(3)实验室中用碳酸钙与盐酸反应制备二氧化碳时,选择的试剂为块状碳酸钙固体而不是碳酸钙粉末,为什么
门一打开,可燃物与空气的接触面增大,迅速燃烧,可引发爆炸
因HNO3、AgNO3见光、受热均易分解,所以必须用棕色试剂瓶保存,并存放在阴凉处
因为粉状CaC03与盐酸反应速率太快,而难以控制生成的CO2的流速与流量。
思考与交流
①温度:升高温度,反应速率增大
⑥反应物接触面积:增大反应物接触面积,
能增大反应速率。
⑤反应物的状态:液态或气态比固态反应速率快
②浓度:增大反应物浓度,反应速率增大
④催化剂:催化剂能(增大或减小)反应速率
影响化学反应速率的因素:
③压强:对于气体,增大压强,反应速率增大
课堂小结
决定化学反应速率的主要因素:
注意:
反应物本身的性质
课堂小结
生活中的现象
提出假设
本质原因
验证假设
得出结论
分类归纳
描述
影响因素
应用实践
1、知识总结:
2、方法总结:科学探究流程
课堂小结
第一课时
引入新课
新课学习
课堂检测
课堂小结
50年前,故宫太和殿栏杆上雕刻着精美浮雕花纹还清晰可见,而现在却大多是模糊不清,部分已成了光板……
造成这些灾难的元凶是什么呢?为什么几百年腐蚀很慢,而近几十年腐蚀却变快了呢?
化学反应速率
引入新课
飞机上煤油爆炸是一个进行得非常快速的反应,爆炸和撞击足以爆发了911人间特大悲剧。
引入新课
美国纽约的世界贸易中心双塔
轰然倒塌
化为一片废墟
引入新课
桂林的溶洞
那千姿百态的钟乳和石笋,形成现在的样子,却让我们等了几万年!
引入新课
牛奶变质
铁棒生锈
溶洞形成
很快
较快
较慢
很慢
定性描述
为什么化学反应有快有慢?
影响快慢的因素又是什么呢?
请描述下列反应快慢程度。
爆炸
提示:可用“很快、较快、较慢、很慢” 。
新课学习
观察反应快慢的方法:
冒气泡快慢;
气球大小;
火焰明亮程度;
浑浊程度;
颜色变化;
温度变化
等等。
新课学习
一辆汽车行驶速率的决定因素是什么?
影响因素又是什么?
决定因素(内因):汽车本身的性能
影响因素(外因):
思考讨论:
如发动机的功率等
新课学习
⑴天气
⑵路况
⑶燃料质量
⑷司机的驾驶水平和经验
2、化学反应速率的影响因素
(1)内因(决定作用):
化学性质越活泼,反应速率越快
埃及法老王金制头像
反应物的性质
很快生锈的铁锅
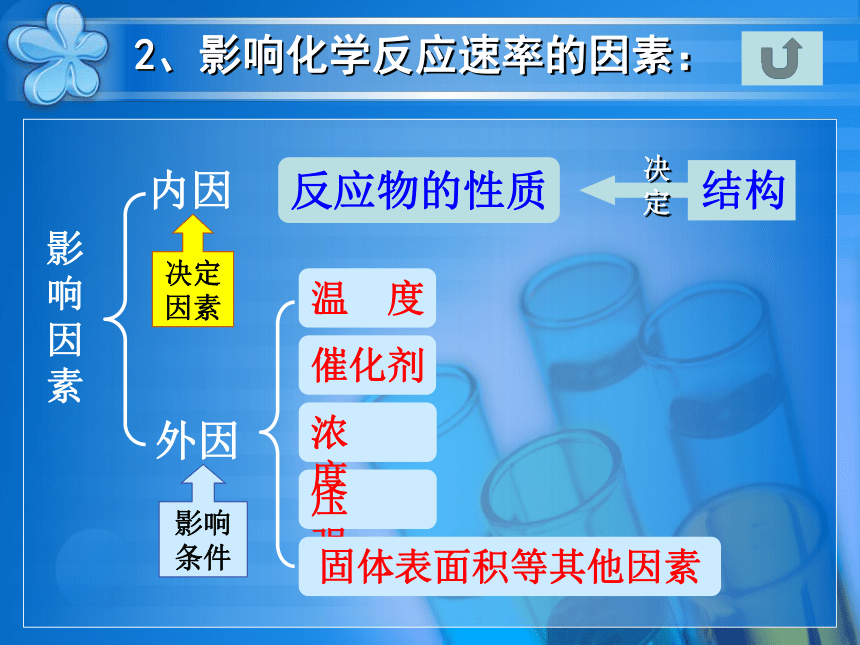
2、影响化学反应速率的因素:
内因
反应物的性质
外因
决定因素
影响条件
压 强
影响因素
温 度
催化剂
浓 度
固体表面积等其他因素
结构
决定
2、影响化学反应速率的因素:
内因
反应物的性质
外因
决定因素
影响条件
压 强
影响因素
温 度
催化剂
浓 度
固体表面积等其他因素
结构
决定
课本P48实验2-5
在2支试管中,分别装入2-3ml约5%的H2O2溶液,滴入1-2滴1mol/LFeCl3溶液。待试管中有适量气泡出现时,将试管放入盛有冷水的烧杯中,记录下观察到的现象;再将试管放入盛有热水的烧杯中,再对此观察现象,并记录。
2、化学反应速率的影响因素
(1)内因(决定作用):反应物的性质
(2)外因(外界条件):
现 象 结 论
热水中
常温
冷水中
溶液中产生气泡的速率很快
温度越高,化学反应速率越快
溶液中有气泡产生,且速率较快
常温条件下,化学反应速率还算较快
溶液中产生气泡的速率较慢
温度越低,化学反应速率越慢
在其它条件不变时,升高反应体系的温度,化学反应速率加快;
化学反应方程式为:2H2O2==== 2H2O + O2↑
FeCl3
温度对化学反应的影响
实验测得:
温度每升高10℃,化学反应速率通常增大原来的2~4倍。
温度对化学反应的影响
课本实验2-6 现 象 结 论
加入MnO2
加入FeCl3
不加其它
试 剂
立即有大量气泡产生
2H2O2==2H2O + O2↑
催化剂MnO2能加快反应速率
MnO2
有大量气泡产生
2H2O2==2H2O + O2↑
催化剂FeCl3能加快反应速率
FeCl3
溶液中有少量气泡出现
不用催化剂,化学反应速率很小
在其它条件不变时:
催化剂通常可以加快化学反应速率;
不同催化剂对同一个反应的催化能力不同。
催化剂对化学反应的影响
CA-2000新型硬铬电镀催化剂
神奇的催化剂
该厂与南京大学、江苏省化工研究所合作,研制出新型硬铬电镀催化剂。该催化剂能大幅度地降低电镀成本,提高电镀品质,产品已占全国份额90%以上。靠的就是高新技术及催化剂的神奇效果。
催化剂对化学反应的影响
任务:自学P49 神奇的催化剂
催化剂能极大地改变反应速率,而自身的组成、化学性质和质量在反应前后不发生变化。
思考与交流1:
催化剂有什么特性?
高效性
选择性(专一性)
催化剂对化学反应的影响
任务:自学P49 神奇的催化剂
思考与交流2:
你能说出催化剂对化学反应进行快慢的影响在生活中、生产中和化学实验中有什么例子、应用吗?
1.煤碳炉用的煤球
2.酿酒
3.加酶洗衣粉
4.食物的消化吸收
催化剂对化学反应的影响
压强增大
播放
压强对化学反应的影响
增大压强
容积减小
浓度增大
反应加快
减小压强
容积增大
浓度降低
反应减慢
接触面积越大,反应速率越快!
烧火煮饭,先将木柴劈小。
固体的表面积、溶剂、状态、光照等。
其他因素对化学反应的影响
化学反应速率的快慢描述
光在空气中的传播速度是3×108m/s
定量描述
用准确的数值
光的传播速度是很快的
定性描述
很快、较快、较慢、很慢
描述方法
举例
概念:用来衡量化学反应进行的快慢程度。
表示方法:
通常用单位时间内反应物浓度的减少或
生成物浓度的增加来表示。
通常用符号v表示。
计算公式: v =△C/△t =△n/(V △t)
单位: mol/(L·min) 或mol/(L·s)
mol L-1 min-1或mol L-1 S-1
3、定量表示与计算
(1)在定量表示一个化学反应的反应速率时,必须指明是用哪一种物质来表示。
如:V(N2) =△C(N2)/t =1 mol L-1 S-1
(2)化学反应速率都取正值,且是某一段时间内的平均速率。
(3)固体和纯液体的浓度视为常数(保持不变),因此,它们的化学反应速率也视为常数。
3、定量表示与计算
解: 2SO2 + O2 2SO3
n(起始) 2mol 1mol 0
n(变化)
n(2s后) 0.8mol
例1:向一个容积为1L的密闭容器中放入2mol SO2和1mol O2,在一定条件下,2S末测得容器内有0.8mol SO2,求2S内SO2、O2、SO3的平均反应速率。
1.2mol
0.6mol
1.2mol
化学反应速率的有关计算
VSO2=0.6mol/(l·s) VO2=0.3mol/(l·s) VSO3=0.6mol/(l·s)
2 : 1 : 2
结论:
各物质的速率之比等于方程式计量数之比。
常用方法: “三步法(起、变、后)”
常用规律:速率比等于化学计量数之比
化学反应速率的有关计算
常用方法: “三步法(起、变、后)”
常用规律:速率比等于化学计量数之比
好比拖拉机的前后轮因直径不同,它们的转速并不相同;
但它们代表的是拖拉机相同的行驶速度。
结论:
各物质的速率之比等于方程式计量数之比
解:5min内生成NH3的物质的量浓度为:
0.05mol/L
C(NH3)=
1.7g
17g/mol
2L
=
ν(NH3)
=
0.05mol/L
5min
=0.01mol/(L·min)
练习:反应N2+3H2=2NH3在2L的密闭容器中发生反应,5min内NH3的质量增加了1.7g,求ν(NH3)、 ν(N2)、 ν(H2)。
3、定量表示与计算
N2 + 3H2 = 2NH3
1
3
2
0.01mol/(L·min)
ν(H2)
ν(N2)
ν(H2)=
3
×
0.01mol/(L·min)
2
= 0.015mol/(L·min)
ν(N2)=
1
×
0.01mol/(L·min)
2
= 0.005mol/(L·min)
解:
3、定量表示与计算
定义:用单位时间内反应物浓度的减少量或生成物浓度的增加量来表示。
V =
△c
△t
单位:
mol/(L min) 或 mol/(L s)
请注意记好笔记
注意:1、反应速率之比等于其化学计量数之比
4、固体和纯液体的浓度不变,
2、表示指定时间内的平均速率
3、反应速率要指明具体物质并取正值
公式:
故常不用来研究反应速率。
3、定量表示与计算
4.如何控制
如何学好化学去控制化学反应速率,从而为人类所利用?
钢铁生锈可以控制吗?
【作业】
据不完全统计,全世界每年钢材产量的约1/3因腐蚀而损失。已知钢铁的腐蚀是一种缓慢氧化。请你调查研究:人们为了减慢钢铁的腐蚀,采取了哪些措施?
研究性学习
铁的缓慢氧化是一个放热反应,但因放热缓慢而不能利用。研究人员在铁粉中加入木炭、食盐等物质,装在微孔透气膜制作的内袋里,外面再套上一个不透气的外袋。这样就研制出了可治疗风湿的热敷袋。请课后查阅资料,了解热敷袋加快铁的缓慢氧化的原理。
化学热敷袋 化学暧手宝
热敷袋能够缓解疼痛,可作为送给长辈的礼物。
思考1:
为什么要将食物存放在温度低的地方(如电冰箱)?
温度越低,化学反应速率越小。
思考2: 实验时,通常要将两种块状或颗粒状的固体药品研细,并混匀后再进行反应。原因是什么?
固体表面积越大,化学反应速率越大。
课堂检测与总结
思考3:人们常把固体试剂溶于水配成溶液再进行化学实验,原因是什么?
接触的机会极大地增加,可以提高反应速率。
思考4:实验室常用约30%左右的硫酸溶液与锌粒反应制取氢气,当反应进行一段时间后,气泡变少(锌粒有剩余),如果添加一些适当浓度的硫酸溶液到反应容器中,气泡又会重新增多起来。原因是什么?
反应物浓度越大,化学反应速率越大。
课堂检测与总结
1.请预计大理石( CaCO3 )分别与0.1mol/L和1mol/L的盐酸反应的快慢。你能得出什么结论吗?
2.块状CaCO3、粉末状CaCO3与0.1 mol/L的盐酸反应谁快谁慢?为什么?
3.实验室进行化学反应 时,常常把一些固体物质溶于水配成溶液再进行反应。为什么?
4.实验室制取氢气时,是用粗锌好(有杂质)还是用纯锌好,为什么?
增大浓度反应速率加快,减小浓度反应速率减慢。
增大固体表面积可以加快反应速率(接触充分)
离子反应速率快,瞬间完成。
形成原电池可以加快反应速率。
没有旧键断裂,只有新键形成。
浓度的影响
固体表面积
形成原电池
思考与交流
5.请利用所学的知识回答下列问题:
(1)消防队员救火时,开门都很小心,因为门一打开就有可能发生爆炸。请解释其中的原因。
(2)在实验室里,硝酸、硝酸银等药品均必须用棕色试剂瓶保存,并应该存放在阴凉干燥处。为什么
(3)实验室中用碳酸钙与盐酸反应制备二氧化碳时,选择的试剂为块状碳酸钙固体而不是碳酸钙粉末,为什么
门一打开,可燃物与空气的接触面增大,迅速燃烧,可引发爆炸
因HNO3、AgNO3见光、受热均易分解,所以必须用棕色试剂瓶保存,并存放在阴凉处
因为粉状CaC03与盐酸反应速率太快,而难以控制生成的CO2的流速与流量。
思考与交流
①温度:升高温度,反应速率增大
⑥反应物接触面积:增大反应物接触面积,
能增大反应速率。
⑤反应物的状态:液态或气态比固态反应速率快
②浓度:增大反应物浓度,反应速率增大
④催化剂:催化剂能(增大或减小)反应速率
影响化学反应速率的因素:
③压强:对于气体,增大压强,反应速率增大
课堂小结
决定化学反应速率的主要因素:
注意:
反应物本身的性质
课堂小结
生活中的现象
提出假设
本质原因
验证假设
得出结论
分类归纳
描述
影响因素
应用实践
1、知识总结:
2、方法总结:科学探究流程
课堂小结
