第一章 化学反应与能量 单元测试 人教选修4(有答案解析)
文档属性
| 名称 | 第一章 化学反应与能量 单元测试 人教选修4(有答案解析) |  | |
| 格式 | zip | ||
| 文件大小 | 274.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-08-12 13:14:44 | ||
图片预览


文档简介
第一章过关检测
(时间:60分钟 满分:100分)
一、选择题(本题共8小题,每小题6分,共48分。每小题只有一个正确选项)
1.2011年7月21日,世界各国领导人在南非德班共同商讨应对气候变化的道路——“拯救人类的最后机会”。要想节能减排下列属最有希望的新能源是( )。
①天然气 ②煤 ③石油 ④水能 ⑤太阳能 ⑥地热能 ⑦风能 ⑧氢能
A.①②③④ B.⑤⑥⑦⑧
C.③④⑤⑥ D.除①②外
答案:B
2.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:
N2(g)和O2(g)反应生成NO(g)过程中的能量变化
下列说法中正确的是( )。
A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ
B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
C.通常情况下,N2(g)和O2(g)混合能直接生成NO
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
解析:选项A,根据图示可以看出拆开1 mol N2和1 mol O2需要吸收的能量分别为946 kJ和498 kJ,生成2 mol NO(g)放出的能量=2 mol×632 kJ·mol-1=1 264 kJ。故反应吸收能量为180 kJ。选项B,N2和O2的反应是吸热反应,反应物的总能量小于生成物的总能量。选项C,N2与O2在高压放电时才能化合生成NO。选项D,NO不是酸性氧化物,不能与NaOH溶液反应。
答案:B
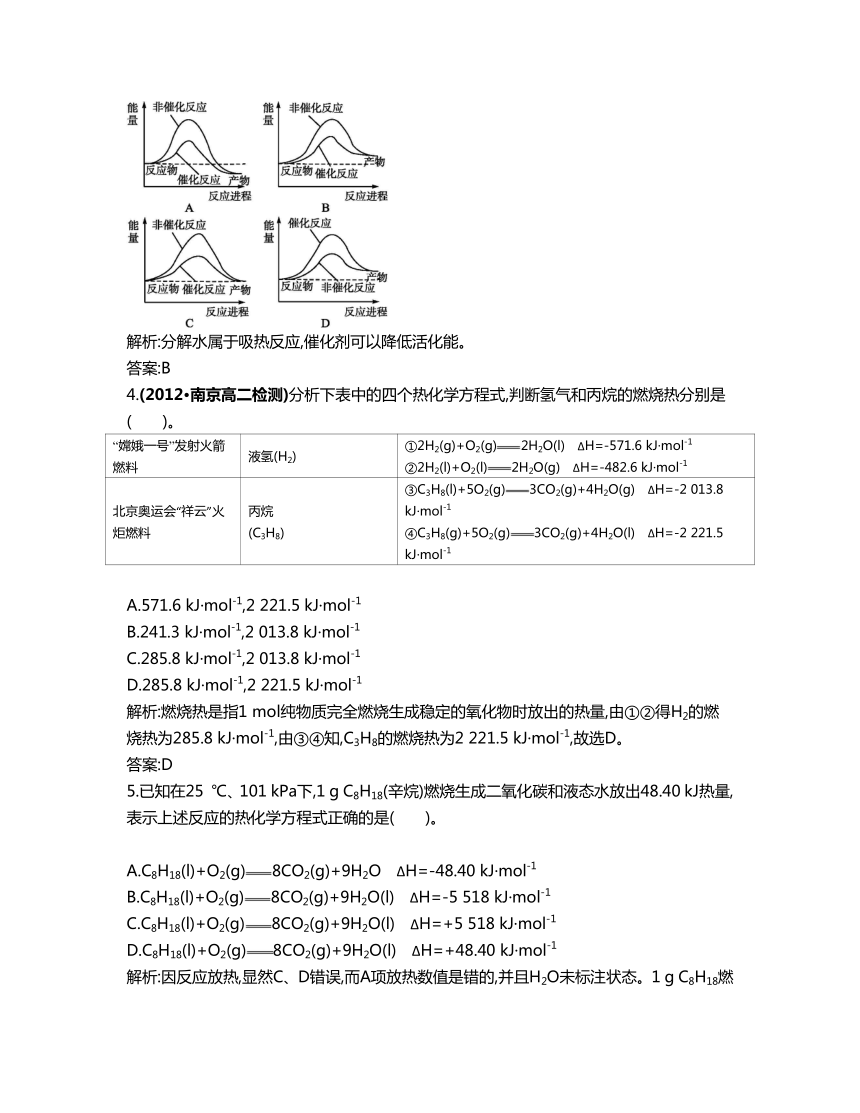
3.(2011·上海)据报道,科学家开发出了利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示意图正确的是( )。
解析:分解水属于吸热反应,催化剂可以降低活化能。
答案:B
4.(2012·南京高二检测)分析下表中的四个热化学方程式,判断氢气和丙烷的燃烧热分别是( )。
“嫦娥一号”发射火箭燃料 液氢(H2) ①2H2(g)+O2(g)2H2O(l) ΔH=-571.6 kJ·mol-1②2H2(l)+O2(l)2H2O(g) ΔH=-482.6 kJ·mol-1
北京奥运会“祥云”火炬燃料 丙烷(C3H8) ③C3H8(l)+5O2(g)3CO2(g)+4H2O(g) ΔH=-2 013.8 kJ·mol-1④C3H8(g)+5O2(g)3CO2(g)+4H2O(l) ΔH=-2 221.5 kJ·mol-1
A.571.6 kJ·mol-1,2 221.5 kJ·mol-1
B.241.3 kJ·mol-1,2 013.8 kJ·mol-1
C.285.8 kJ·mol-1,2 013.8 kJ·mol-1
D.285.8 kJ·mol-1,2 221.5 kJ·mol-1
解析:燃烧热是指1 mol纯物质完全燃烧生成稳定的氧化物时放出的热量,由①②得H2的燃烧热为285.8 kJ·mol-1,由③④知,C3H8的燃烧热为2 221.5 kJ·mol-1,故选D。
答案:D
5.已知在25 ℃、101 kPa下,1 g C8H18(辛烷)燃烧生成二氧化碳和液态水放出48.40 kJ热量,表示上述反应的热化学方程式正确的是( )。
A.C8H18(l)+O2(g)8CO2(g)+9H2O ΔH=-48.40 kJ·mol-1
B.C8H18(l)+O2(g)8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1
C.C8H18(l)+O2(g)8CO2(g)+9H2O(l) ΔH=+5 518 kJ·mol-1
D.C8H18(l)+O2(g)8CO2(g)+9H2O(l) ΔH=+48.40 kJ·mol-1
解析:因反应放热,显然C、D错误,而A项放热数值是错的,并且H2O未标注状态。1 g C8H18燃烧生成二氧化碳和液态水时放出48.40 kJ热量,即1 mol C8H18燃烧放出5 518 kJ热量,因此热化学方程式可表示为C8H18(l)+O2(g)8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1。
答案:B
6.在一定条件下,CO和CH4燃烧的热化学方程式分别为:
2CO(g)+O2(g)2CO2(g) ΔH=-566 kJ·mol-1
CH4(g)+2O2(g)CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
由1 mol CO和3 mol CH4组成的混合气体在上述条件下完全燃烧时,释放的热量为( )。
A.2 912 kJ B.2 953 kJ
C.3 236 kJ D.3 867 kJ
解析:1 mol CO完全燃烧放出的热量是 kJ,3 mol CH4完全燃烧放出的热量是890 kJ×3,释放的总热量应当是(+890×3) kJ=2 953 kJ。
答案:B
7.根据以下三个热化学方程式:2H2S(g)+3O2(g)2SO2(g)+2H2O(l) ΔH=-Q1 kJ·mol-1;2H2S(g)+O2(g)2S(s)+2H2O(l) ΔH=-Q2 kJ·mol-1;2H2S(g)+O2(g)2S(s)+2H2O(g) ΔH=-Q3 kJ·mol-1。
判断Q1、Q2、Q3三者关系正确的是( )。
A.Q1>Q2>Q3 B.Q1>Q3>Q2
C.Q3>Q2>Q1 D.Q2>Q1>Q3
解析:S(s)+O2(g)SO2(g)放热 ,Q1>Q2;H2O(g)H2O(l)放热 ,Q2>Q3。
答案:A
8.根据盖斯定律判断如图所示的物质转变过程中正确的是( )。
A.ΔH1=ΔH2=ΔH3=ΔH4
B.ΔH1+ΔH2=ΔH3+ΔH4
C.ΔH1+ΔH2+ΔH3=ΔH4
D.ΔH1=ΔH2+ΔH3+ΔH4
解析:从A转变为D有两条途径:一是由A直接得到D;二是由A生成B,再转变为C,最后得到D。根据盖斯定律,这两条途径的能量变化应相同,即有ΔH1=ΔH2+ΔH3+ΔH4。
答案:D
二、非选择题(本题共4小题,共52分)
9.(10分)(1)已知:H2(g)+O2(g)H2O(g),反应过程中能量变化如图所示,则:
①a、b、c分别代表什么意义
a ;
b ;
c 。
②该反应是反应(填“吸热”或“放热”),ΔH0(填“>”或“<”)。
(2)发射“天宫”一号的火箭使用的推进剂是液氢和液氧,这种推进剂的优点是 , 。(请写两条)
(3)已知:H2(g)+O2(g)H2O(l) ΔH=-285.8 kJ·mol-1
H2(g)H2(l) ΔH=-0.92 kJ·mol-1
O2(g)O2(l) ΔH=-6.84 kJ·mol-1
H2O(l)H2O(g) ΔH=+44.0 kJ·mol-1
请写出液氢和液氧生成气态水的热化学方程式:
。
解析:(1)化学反应是旧键断裂(吸热)和新键生成(放热)的过程。该反应是吸热还是放热要看这两个过程中能量变化的相对大小。
(3)根据题中所给数据,可求出H2(l)+O2(l)H2O(g)的焓变ΔH的数值,ΔH=(-285.8+0.92+×6.84+44) kJ·mol-1=-237.46 kJ·mol-1。
答案:(1)①1 mol H2分裂为H、0.5 mol O2分裂为O时吸收的热量 H、O结合生成1 mol H2O(g)放出的热量 1 mol H2和0.5 mol O2生成1 mol H2O(g)时,反应放出的热量
②放热 ΔH<0
(2)相同质量时,氢气放出的热量多 产物为水,无污染(其他合理答案均可)
(3)H2(l)+O2(l)H2O(g) ΔH=-237.46 kJ·mol-1
10.(12分)A~G是中学化学常见物质,A、D为单质,G是含A元素的酸性气体。已知A(s)+B(g)C(g)+D(g) ΔH=+131.4 kJ·mol-1,某同学实验测知,4 g A发生上述反应吸收43.8 kJ的热量。
(1)写出A元素的名称 。
(2)另外知:
A(s)+O2(g)G(g) ΔH=-393.6 kJ·mol-1
C(g)+O2(g)G(g) ΔH=-283 kJ·mol-1
D(g)+O2(g)B(g) ΔH=-242 kJ·mol-1
由此判断“因为283 kJ·mol-1+242 kJ·mol-1>393.6 kJ·mol-1,所以A燃烧时加少量B可以放出更多的热量”这种说法是否正确 并说明理由 。
(3)写出A+O2C的热化学方程式: 。
解析:(1)由A(s)+B(g)C(g)+D(g) ΔH=+131.4 kJ·mol-1,知n(A)== mol
M(A)==12 g·mol-1,故A为碳,B为H2O,C为CO,D为H2,G为CO2,E为浓H2SO4或浓HNO3。
(2)可把3个热化学方程式具体写为:
C(s)+O2(g)CO2(g) ΔH=-393.6 kJ·mol-1
CO(g)+O2(g)CO2(g) ΔH=-283 kJ·mol-1
H2(g)+O2(g)H2O(g) ΔH=-242 kJ·mol-1
两种途径反应热分别为:-283 kJ·mol-1-242 kJ·mol-1+131.4 kJ·mol-1=-393.6 kJ·mol-1和-393.6 kJ·mol-1,可见是相等的。
(3)将C(s)+O2(g)CO2(g) ΔH=-393.6 kJ·mol-1和CO(g)+O2(g)CO2(g) ΔH=-283 kJ·mol-1两式相减即得A+O2C的热化学方程式。
答案:(1)碳
(2)不正确,因为1 mol A与O2直接燃烧放出的热量为393.6 kJ,而1 mol A先与B反应生成C和D,C和D再与O2反应,共放热量-131.4 kJ+283 kJ+242 kJ=393.6 kJ,两者相同
(3)C(s)+O2(g)CO(g) ΔH=-110.6 kJ·mol-1
11.(2011·江苏高考20,节选)(14分)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)CO(g)+3H2(g) ΔH=+206.2 kJ·mol-1
CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH=+247.4 kJ·mol-1
2H2S(g)2H2(g)+S2(g) ΔH=+169.8 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为 。
(2)H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是 ;燃烧生成的SO2与H2S进一步反应,生成物在常温下均非气体,写出该反应的化学方程式: 。
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如下图所示。图中A、B表示的物质依次是 。
解析:本题以新能源为背景涉及元素化合物性质、热化学方程式和电极反应方程式的书写、读图读表的综合题,是以化学知识具体运用的典型试题。
(1)利用盖斯定律即可得出;(2)H2S热分解制氢属于吸热反应,需要提供能量;(3)在很高的温度下,氢气和氧气会分解生成氢原子和氧原子。
答案:(1)CH4(g)+2H2O(g)CO2(g)+4H2(g) ΔH=+165.0 kJ·mol-1
(2)为H2S热分解反应提供能量
2H2S+SO22H2O+3S(或4H2S+2SO24H2O+3S2)
(3)H、O(或氢原子、氧原子)
12.(16分)某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 mol·L-1盐酸、0.55 mol·L-1NaOH溶液,实验尚缺少的玻璃用品是 、 。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒 (填“能”或“否”),其原因是 。
(3)他们记录的实验数据如下:
实验用品 溶液温度 中和热
t1 t2 ΔH
① 50 mL0.55 mol·L-1NaOH溶液 50 mL0.5 mol·L-1HCl溶液 20 ℃ 23.3 ℃
② 50 mL0.55 mol·L-1NaOH溶液 50 mL0.5 mol·L-1HCl溶液 20 ℃ 23.5 ℃
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1 g·cm-3。
①计算完成上表。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: 。
(4)若用KOH代替NaOH,对测定结果 (填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果 (填“有”或“无”)影响。
解析:(1)中和热测定的关键是减少热量损失,需要的仪器中除题目中的仪器外,还要量取液体体积,用量筒。测量液体的温度,用温度计。
(2)否,铜丝易传导热,会增大热量散失。
(3)①由题意知:①中t2-t1=23.3 ℃-20 ℃=3.3 ℃。
②中t2-t1=23.5 ℃-20 ℃=3.5 ℃
故==3.4 ℃。
由Q=cm(t2-t1)=4.18 kJ·℃-1·kg-1×0.1 kg×3.4 ℃=1.42 kJ
则ΔH=-=-=-56.8 kJ·mol-1
②NaOH(aq)+HCl(aq)NaCl(aq)+H2O(l) ΔH=-56.8 kJ·mol-1
(4)KOH、NaOH都是强碱,对结果无影响。而用CH3COOH代替HCl,由于CH3COOH为弱酸,电离需吸热,故对测定结果有影响。
答案:(1)量筒 温度计
(2)否 金属易导热,热量散失多,导致误差偏大
(3)①-56.8 kJ·mol-1
②NaOH(aq)+HCl(aq)NaCl(aq)+H2O(l) ΔH=-56.8 kJ·mol-1
(4)无 有
(时间:60分钟 满分:100分)
一、选择题(本题共8小题,每小题6分,共48分。每小题只有一个正确选项)
1.2011年7月21日,世界各国领导人在南非德班共同商讨应对气候变化的道路——“拯救人类的最后机会”。要想节能减排下列属最有希望的新能源是( )。
①天然气 ②煤 ③石油 ④水能 ⑤太阳能 ⑥地热能 ⑦风能 ⑧氢能
A.①②③④ B.⑤⑥⑦⑧
C.③④⑤⑥ D.除①②外
答案:B
2.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:
N2(g)和O2(g)反应生成NO(g)过程中的能量变化
下列说法中正确的是( )。
A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ
B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
C.通常情况下,N2(g)和O2(g)混合能直接生成NO
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
解析:选项A,根据图示可以看出拆开1 mol N2和1 mol O2需要吸收的能量分别为946 kJ和498 kJ,生成2 mol NO(g)放出的能量=2 mol×632 kJ·mol-1=1 264 kJ。故反应吸收能量为180 kJ。选项B,N2和O2的反应是吸热反应,反应物的总能量小于生成物的总能量。选项C,N2与O2在高压放电时才能化合生成NO。选项D,NO不是酸性氧化物,不能与NaOH溶液反应。
答案:B
3.(2011·上海)据报道,科学家开发出了利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示意图正确的是( )。
解析:分解水属于吸热反应,催化剂可以降低活化能。
答案:B
4.(2012·南京高二检测)分析下表中的四个热化学方程式,判断氢气和丙烷的燃烧热分别是( )。
“嫦娥一号”发射火箭燃料 液氢(H2) ①2H2(g)+O2(g)2H2O(l) ΔH=-571.6 kJ·mol-1②2H2(l)+O2(l)2H2O(g) ΔH=-482.6 kJ·mol-1
北京奥运会“祥云”火炬燃料 丙烷(C3H8) ③C3H8(l)+5O2(g)3CO2(g)+4H2O(g) ΔH=-2 013.8 kJ·mol-1④C3H8(g)+5O2(g)3CO2(g)+4H2O(l) ΔH=-2 221.5 kJ·mol-1
A.571.6 kJ·mol-1,2 221.5 kJ·mol-1
B.241.3 kJ·mol-1,2 013.8 kJ·mol-1
C.285.8 kJ·mol-1,2 013.8 kJ·mol-1
D.285.8 kJ·mol-1,2 221.5 kJ·mol-1
解析:燃烧热是指1 mol纯物质完全燃烧生成稳定的氧化物时放出的热量,由①②得H2的燃烧热为285.8 kJ·mol-1,由③④知,C3H8的燃烧热为2 221.5 kJ·mol-1,故选D。
答案:D
5.已知在25 ℃、101 kPa下,1 g C8H18(辛烷)燃烧生成二氧化碳和液态水放出48.40 kJ热量,表示上述反应的热化学方程式正确的是( )。
A.C8H18(l)+O2(g)8CO2(g)+9H2O ΔH=-48.40 kJ·mol-1
B.C8H18(l)+O2(g)8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1
C.C8H18(l)+O2(g)8CO2(g)+9H2O(l) ΔH=+5 518 kJ·mol-1
D.C8H18(l)+O2(g)8CO2(g)+9H2O(l) ΔH=+48.40 kJ·mol-1
解析:因反应放热,显然C、D错误,而A项放热数值是错的,并且H2O未标注状态。1 g C8H18燃烧生成二氧化碳和液态水时放出48.40 kJ热量,即1 mol C8H18燃烧放出5 518 kJ热量,因此热化学方程式可表示为C8H18(l)+O2(g)8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1。
答案:B
6.在一定条件下,CO和CH4燃烧的热化学方程式分别为:
2CO(g)+O2(g)2CO2(g) ΔH=-566 kJ·mol-1
CH4(g)+2O2(g)CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
由1 mol CO和3 mol CH4组成的混合气体在上述条件下完全燃烧时,释放的热量为( )。
A.2 912 kJ B.2 953 kJ
C.3 236 kJ D.3 867 kJ
解析:1 mol CO完全燃烧放出的热量是 kJ,3 mol CH4完全燃烧放出的热量是890 kJ×3,释放的总热量应当是(+890×3) kJ=2 953 kJ。
答案:B
7.根据以下三个热化学方程式:2H2S(g)+3O2(g)2SO2(g)+2H2O(l) ΔH=-Q1 kJ·mol-1;2H2S(g)+O2(g)2S(s)+2H2O(l) ΔH=-Q2 kJ·mol-1;2H2S(g)+O2(g)2S(s)+2H2O(g) ΔH=-Q3 kJ·mol-1。
判断Q1、Q2、Q3三者关系正确的是( )。
A.Q1>Q2>Q3 B.Q1>Q3>Q2
C.Q3>Q2>Q1 D.Q2>Q1>Q3
解析:S(s)+O2(g)SO2(g)放热 ,Q1>Q2;H2O(g)H2O(l)放热 ,Q2>Q3。
答案:A
8.根据盖斯定律判断如图所示的物质转变过程中正确的是( )。
A.ΔH1=ΔH2=ΔH3=ΔH4
B.ΔH1+ΔH2=ΔH3+ΔH4
C.ΔH1+ΔH2+ΔH3=ΔH4
D.ΔH1=ΔH2+ΔH3+ΔH4
解析:从A转变为D有两条途径:一是由A直接得到D;二是由A生成B,再转变为C,最后得到D。根据盖斯定律,这两条途径的能量变化应相同,即有ΔH1=ΔH2+ΔH3+ΔH4。
答案:D
二、非选择题(本题共4小题,共52分)
9.(10分)(1)已知:H2(g)+O2(g)H2O(g),反应过程中能量变化如图所示,则:
①a、b、c分别代表什么意义
a ;
b ;
c 。
②该反应是反应(填“吸热”或“放热”),ΔH0(填“>”或“<”)。
(2)发射“天宫”一号的火箭使用的推进剂是液氢和液氧,这种推进剂的优点是 , 。(请写两条)
(3)已知:H2(g)+O2(g)H2O(l) ΔH=-285.8 kJ·mol-1
H2(g)H2(l) ΔH=-0.92 kJ·mol-1
O2(g)O2(l) ΔH=-6.84 kJ·mol-1
H2O(l)H2O(g) ΔH=+44.0 kJ·mol-1
请写出液氢和液氧生成气态水的热化学方程式:
。
解析:(1)化学反应是旧键断裂(吸热)和新键生成(放热)的过程。该反应是吸热还是放热要看这两个过程中能量变化的相对大小。
(3)根据题中所给数据,可求出H2(l)+O2(l)H2O(g)的焓变ΔH的数值,ΔH=(-285.8+0.92+×6.84+44) kJ·mol-1=-237.46 kJ·mol-1。
答案:(1)①1 mol H2分裂为H、0.5 mol O2分裂为O时吸收的热量 H、O结合生成1 mol H2O(g)放出的热量 1 mol H2和0.5 mol O2生成1 mol H2O(g)时,反应放出的热量
②放热 ΔH<0
(2)相同质量时,氢气放出的热量多 产物为水,无污染(其他合理答案均可)
(3)H2(l)+O2(l)H2O(g) ΔH=-237.46 kJ·mol-1
10.(12分)A~G是中学化学常见物质,A、D为单质,G是含A元素的酸性气体。已知A(s)+B(g)C(g)+D(g) ΔH=+131.4 kJ·mol-1,某同学实验测知,4 g A发生上述反应吸收43.8 kJ的热量。
(1)写出A元素的名称 。
(2)另外知:
A(s)+O2(g)G(g) ΔH=-393.6 kJ·mol-1
C(g)+O2(g)G(g) ΔH=-283 kJ·mol-1
D(g)+O2(g)B(g) ΔH=-242 kJ·mol-1
由此判断“因为283 kJ·mol-1+242 kJ·mol-1>393.6 kJ·mol-1,所以A燃烧时加少量B可以放出更多的热量”这种说法是否正确 并说明理由 。
(3)写出A+O2C的热化学方程式: 。
解析:(1)由A(s)+B(g)C(g)+D(g) ΔH=+131.4 kJ·mol-1,知n(A)== mol
M(A)==12 g·mol-1,故A为碳,B为H2O,C为CO,D为H2,G为CO2,E为浓H2SO4或浓HNO3。
(2)可把3个热化学方程式具体写为:
C(s)+O2(g)CO2(g) ΔH=-393.6 kJ·mol-1
CO(g)+O2(g)CO2(g) ΔH=-283 kJ·mol-1
H2(g)+O2(g)H2O(g) ΔH=-242 kJ·mol-1
两种途径反应热分别为:-283 kJ·mol-1-242 kJ·mol-1+131.4 kJ·mol-1=-393.6 kJ·mol-1和-393.6 kJ·mol-1,可见是相等的。
(3)将C(s)+O2(g)CO2(g) ΔH=-393.6 kJ·mol-1和CO(g)+O2(g)CO2(g) ΔH=-283 kJ·mol-1两式相减即得A+O2C的热化学方程式。
答案:(1)碳
(2)不正确,因为1 mol A与O2直接燃烧放出的热量为393.6 kJ,而1 mol A先与B反应生成C和D,C和D再与O2反应,共放热量-131.4 kJ+283 kJ+242 kJ=393.6 kJ,两者相同
(3)C(s)+O2(g)CO(g) ΔH=-110.6 kJ·mol-1
11.(2011·江苏高考20,节选)(14分)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)CO(g)+3H2(g) ΔH=+206.2 kJ·mol-1
CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH=+247.4 kJ·mol-1
2H2S(g)2H2(g)+S2(g) ΔH=+169.8 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为 。
(2)H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是 ;燃烧生成的SO2与H2S进一步反应,生成物在常温下均非气体,写出该反应的化学方程式: 。
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如下图所示。图中A、B表示的物质依次是 。
解析:本题以新能源为背景涉及元素化合物性质、热化学方程式和电极反应方程式的书写、读图读表的综合题,是以化学知识具体运用的典型试题。
(1)利用盖斯定律即可得出;(2)H2S热分解制氢属于吸热反应,需要提供能量;(3)在很高的温度下,氢气和氧气会分解生成氢原子和氧原子。
答案:(1)CH4(g)+2H2O(g)CO2(g)+4H2(g) ΔH=+165.0 kJ·mol-1
(2)为H2S热分解反应提供能量
2H2S+SO22H2O+3S(或4H2S+2SO24H2O+3S2)
(3)H、O(或氢原子、氧原子)
12.(16分)某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 mol·L-1盐酸、0.55 mol·L-1NaOH溶液,实验尚缺少的玻璃用品是 、 。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒 (填“能”或“否”),其原因是 。
(3)他们记录的实验数据如下:
实验用品 溶液温度 中和热
t1 t2 ΔH
① 50 mL0.55 mol·L-1NaOH溶液 50 mL0.5 mol·L-1HCl溶液 20 ℃ 23.3 ℃
② 50 mL0.55 mol·L-1NaOH溶液 50 mL0.5 mol·L-1HCl溶液 20 ℃ 23.5 ℃
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1 g·cm-3。
①计算完成上表。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: 。
(4)若用KOH代替NaOH,对测定结果 (填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果 (填“有”或“无”)影响。
解析:(1)中和热测定的关键是减少热量损失,需要的仪器中除题目中的仪器外,还要量取液体体积,用量筒。测量液体的温度,用温度计。
(2)否,铜丝易传导热,会增大热量散失。
(3)①由题意知:①中t2-t1=23.3 ℃-20 ℃=3.3 ℃。
②中t2-t1=23.5 ℃-20 ℃=3.5 ℃
故==3.4 ℃。
由Q=cm(t2-t1)=4.18 kJ·℃-1·kg-1×0.1 kg×3.4 ℃=1.42 kJ
则ΔH=-=-=-56.8 kJ·mol-1
②NaOH(aq)+HCl(aq)NaCl(aq)+H2O(l) ΔH=-56.8 kJ·mol-1
(4)KOH、NaOH都是强碱,对结果无影响。而用CH3COOH代替HCl,由于CH3COOH为弱酸,电离需吸热,故对测定结果有影响。
答案:(1)量筒 温度计
(2)否 金属易导热,热量散失多,导致误差偏大
(3)①-56.8 kJ·mol-1
②NaOH(aq)+HCl(aq)NaCl(aq)+H2O(l) ΔH=-56.8 kJ·mol-1
(4)无 有
