化学必修Ⅰ人教新课标钠的重要化合物
文档属性
| 名称 | 化学必修Ⅰ人教新课标钠的重要化合物 |  | |
| 格式 | zip | ||
| 文件大小 | 230.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-08-12 15:49:27 | ||
图片预览



文档简介
(共15张PPT)
第二节 几种重要的金属化合物
第一课时 钠的重要化合物
教学目标
1.了解Na2O2 的性质和用途
2.了解Na2CO3、NaHCO3的性质、用途及鉴别方法
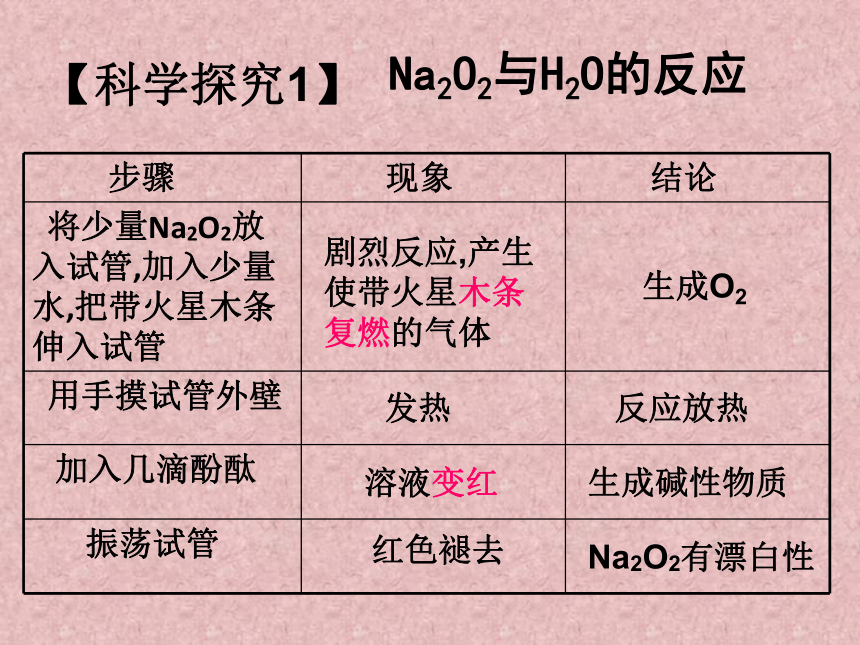
Na2O2与H2O的反应
步骤 现象 结论
将少量Na2O2放 入试管,加入少量 水,把带火星木条 伸入试管
用手摸试管外壁
加入几滴酚酞
振荡试管
剧烈反应,产生使带火星木条复燃的气体
生成O2
发热
反应放热
生成碱性物质
溶液变红
红色褪去
Na2O2有漂白性
【科学探究1】
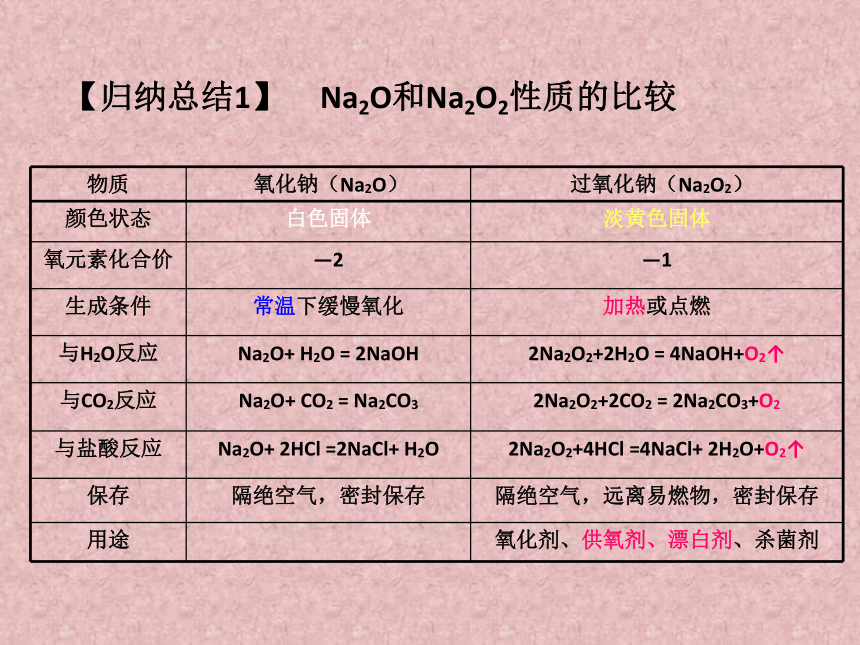
【归纳总结1】 Na2O和Na2O2性质的比较
物质 氧化钠(Na2O) 过氧化钠(Na2O2)
颜色状态 白色固体 淡黄色固体
氧元素化合价 —2 —1
生成条件 常温下缓慢氧化 加热或点燃
与H2O反应 Na2O+ H2O = 2NaOH 2Na2O2+2H2O = 4NaOH+O2↑
与CO2反应 Na2O+ CO2 = Na2CO3 2Na2O2+2CO2 = 2Na2CO3+O2
与盐酸反应 Na2O+ 2HCl =2NaCl+ H2O 2Na2O2+4HCl =4NaCl+ 2H2O+O2↑
保存 隔绝空气,密封保存 隔绝空气,远离易燃物,密封保存
用途 氧化剂、供氧剂、漂白剂、杀菌剂
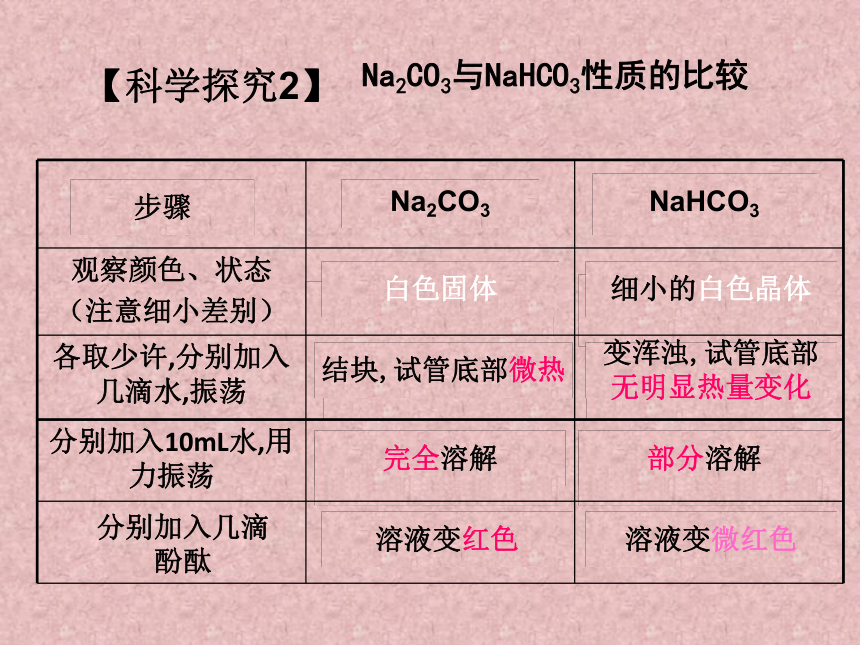
Na2CO3与NaHCO3性质的比较
观察颜色、状态
(注意细小差别)
各取少许,分别加入几滴水,振荡
分别加入10mL水,用力振荡
Na2CO3
步骤
白色固体
NaHCO3
结块,试管底部微热
细小的白色晶体
变浑浊,试管底部
无明显热量变化
完全溶解
部分溶解
溶液变红色
溶液变微红色
产生白色沉淀
产生白色沉淀
分别加入几滴 酚酞
【科学探究2】
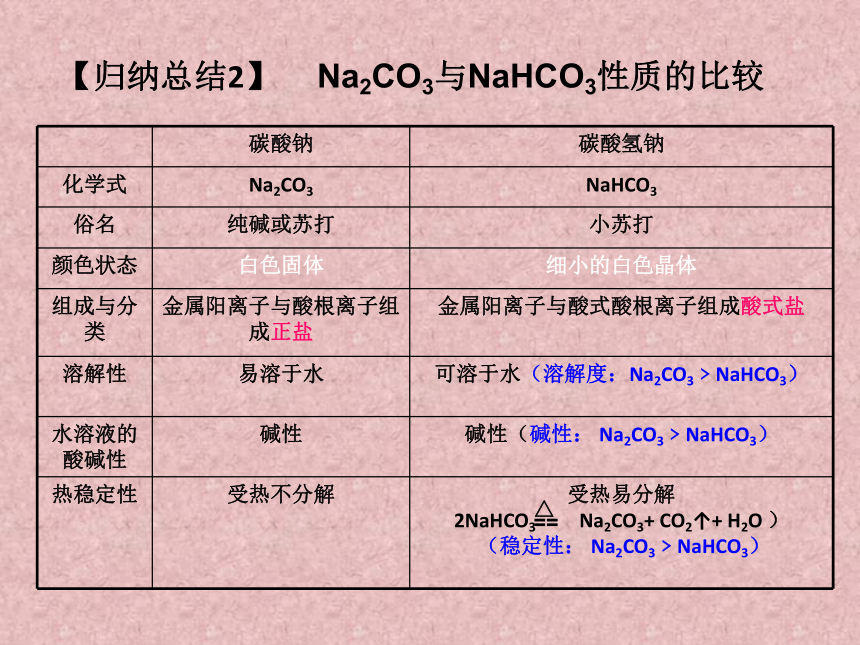
【归纳总结2】
碳酸钠 碳酸氢钠
化学式 Na2CO3 NaHCO3
俗名 纯碱或苏打 小苏打
颜色状态 白色固体 细小的白色晶体
组成与分类 金属阳离子与酸根离子组成正盐 金属阳离子与酸式酸根离子组成酸式盐
溶解性 易溶于水 可溶于水(溶解度:Na2CO3﹥NaHCO3)
水溶液的酸碱性 碱性 碱性(碱性: Na2CO3﹥NaHCO3)
热稳定性 受热不分解 受热易分解
2NaHCO3 Na2CO3+ CO2↑+ H2O )
(稳定性: Na2CO3﹥NaHCO3)
△
==
Na2CO3与NaHCO3性质的比较
等质量的Na2CO3和NaHCO3固体与足量的等体积等浓度的HCl溶液反应
Na2CO3 NaHCO3
产生气体的速度
生成气体的体积
化学方程式
较慢 较快
思考与感悟:分析上述反应产生气体快慢与多少的原因
较少 较多
Na2CO3 +2HCl=
2NaCl+CO2↑+H2O
NaHCO3+HCl=
NaCl+CO2↑+ H2O
【科学探究3】
【科学探究4】
Na2CO3溶液
NaHCO3溶液
现象: Na2CO3溶液+BaCl2溶液→
NaHCO3溶液+BaCl2溶液→
结论: Na2CO3+BaCl2 =
NaHCO3+BaCl2 =
原因:
白色沉淀
无现象
BaCO3↓+ 2NaCl
}
与BaCl2溶液能否反应
【问题与思考】
1、标出下列反应中电子转移的方向和数目,并计算 氧化剂和还原剂的物质的量之比
2Na2O2+2H2O = 4NaOH+O2↑
2Na2O2+2CO2 = 2Na2CO3+O2
2、结合今天的学习及你了解的知识归纳总结并思考Na2CO3 和NaHCO3的鉴别方法(多种) 。
3、 Na2CO3和NaHCO3溶液能否与NaOH溶液及石灰水反应?若能反应,写出反应的离子方程式;若不反应,说明理由。
【科学探究1】
1、写出Na2O与H2O、CO2的反应方程式
2、观察Na2O2的颜色和状态,分析氧元素
的化合价,这种价态常见吗
3、Na2O2与H2O、CO2能否反应,根据
性质推测Na2O2有何用途?
【科学探究2】
1、观察Na2CO3与NaHCO3的颜色和状态
2、Na2CO3与NaHCO3在水中溶解性的探讨
结论:
① Na2CO3+X H2O = Na2CO3·X H2O 放热
(x=1、7、10)
②均易溶于水(溶解度:Na2CO3﹥NaHCO3)
【归纳与总结】表3
碳酸钠 碳酸氢钠
与酸作用 CO32-+H+=HCO3-
或CO32- +2H+=CO2↑+ H2O HCO3-+H+=CO2↑+ H2O
(产生气体的速率: NaHCO3比Na2CO3快)
与NaOH
溶液反应 不反应 HCO3- +OH-= H2O+ CO32-
与石灰水
反应 Ca2++2OH-+CO32-=
CaCO3↓+H2O Ca2++2OH- + 2HCO3- =
CaCO3↓+2H2O+ CO32-
或Ca2++OH- + HCO3- =CaCO3↓+H2O
与BaCl2溶液反应 Ba2++CO32-=BaCO3↓
不反应
主要用途 制玻璃,造纸,制皂,洗涤剂 发酵粉,医药,灭火剂
相互转化
Na2CO3 NaHCO3
①CO2+H2O ②少量酸
①固体时加热 ②溶液加 NaOH
第二节 几种重要的金属化合物
第一课时 钠的重要化合物
教学目标
1.了解Na2O2 的性质和用途
2.了解Na2CO3、NaHCO3的性质、用途及鉴别方法
Na2O2与H2O的反应
步骤 现象 结论
将少量Na2O2放 入试管,加入少量 水,把带火星木条 伸入试管
用手摸试管外壁
加入几滴酚酞
振荡试管
剧烈反应,产生使带火星木条复燃的气体
生成O2
发热
反应放热
生成碱性物质
溶液变红
红色褪去
Na2O2有漂白性
【科学探究1】
【归纳总结1】 Na2O和Na2O2性质的比较
物质 氧化钠(Na2O) 过氧化钠(Na2O2)
颜色状态 白色固体 淡黄色固体
氧元素化合价 —2 —1
生成条件 常温下缓慢氧化 加热或点燃
与H2O反应 Na2O+ H2O = 2NaOH 2Na2O2+2H2O = 4NaOH+O2↑
与CO2反应 Na2O+ CO2 = Na2CO3 2Na2O2+2CO2 = 2Na2CO3+O2
与盐酸反应 Na2O+ 2HCl =2NaCl+ H2O 2Na2O2+4HCl =4NaCl+ 2H2O+O2↑
保存 隔绝空气,密封保存 隔绝空气,远离易燃物,密封保存
用途 氧化剂、供氧剂、漂白剂、杀菌剂
Na2CO3与NaHCO3性质的比较
观察颜色、状态
(注意细小差别)
各取少许,分别加入几滴水,振荡
分别加入10mL水,用力振荡
Na2CO3
步骤
白色固体
NaHCO3
结块,试管底部微热
细小的白色晶体
变浑浊,试管底部
无明显热量变化
完全溶解
部分溶解
溶液变红色
溶液变微红色
产生白色沉淀
产生白色沉淀
分别加入几滴 酚酞
【科学探究2】
【归纳总结2】
碳酸钠 碳酸氢钠
化学式 Na2CO3 NaHCO3
俗名 纯碱或苏打 小苏打
颜色状态 白色固体 细小的白色晶体
组成与分类 金属阳离子与酸根离子组成正盐 金属阳离子与酸式酸根离子组成酸式盐
溶解性 易溶于水 可溶于水(溶解度:Na2CO3﹥NaHCO3)
水溶液的酸碱性 碱性 碱性(碱性: Na2CO3﹥NaHCO3)
热稳定性 受热不分解 受热易分解
2NaHCO3 Na2CO3+ CO2↑+ H2O )
(稳定性: Na2CO3﹥NaHCO3)
△
==
Na2CO3与NaHCO3性质的比较
等质量的Na2CO3和NaHCO3固体与足量的等体积等浓度的HCl溶液反应
Na2CO3 NaHCO3
产生气体的速度
生成气体的体积
化学方程式
较慢 较快
思考与感悟:分析上述反应产生气体快慢与多少的原因
较少 较多
Na2CO3 +2HCl=
2NaCl+CO2↑+H2O
NaHCO3+HCl=
NaCl+CO2↑+ H2O
【科学探究3】
【科学探究4】
Na2CO3溶液
NaHCO3溶液
现象: Na2CO3溶液+BaCl2溶液→
NaHCO3溶液+BaCl2溶液→
结论: Na2CO3+BaCl2 =
NaHCO3+BaCl2 =
原因:
白色沉淀
无现象
BaCO3↓+ 2NaCl
}
与BaCl2溶液能否反应
【问题与思考】
1、标出下列反应中电子转移的方向和数目,并计算 氧化剂和还原剂的物质的量之比
2Na2O2+2H2O = 4NaOH+O2↑
2Na2O2+2CO2 = 2Na2CO3+O2
2、结合今天的学习及你了解的知识归纳总结并思考Na2CO3 和NaHCO3的鉴别方法(多种) 。
3、 Na2CO3和NaHCO3溶液能否与NaOH溶液及石灰水反应?若能反应,写出反应的离子方程式;若不反应,说明理由。
【科学探究1】
1、写出Na2O与H2O、CO2的反应方程式
2、观察Na2O2的颜色和状态,分析氧元素
的化合价,这种价态常见吗
3、Na2O2与H2O、CO2能否反应,根据
性质推测Na2O2有何用途?
【科学探究2】
1、观察Na2CO3与NaHCO3的颜色和状态
2、Na2CO3与NaHCO3在水中溶解性的探讨
结论:
① Na2CO3+X H2O = Na2CO3·X H2O 放热
(x=1、7、10)
②均易溶于水(溶解度:Na2CO3﹥NaHCO3)
【归纳与总结】表3
碳酸钠 碳酸氢钠
与酸作用 CO32-+H+=HCO3-
或CO32- +2H+=CO2↑+ H2O HCO3-+H+=CO2↑+ H2O
(产生气体的速率: NaHCO3比Na2CO3快)
与NaOH
溶液反应 不反应 HCO3- +OH-= H2O+ CO32-
与石灰水
反应 Ca2++2OH-+CO32-=
CaCO3↓+H2O Ca2++2OH- + 2HCO3- =
CaCO3↓+2H2O+ CO32-
或Ca2++OH- + HCO3- =CaCO3↓+H2O
与BaCl2溶液反应 Ba2++CO32-=BaCO3↓
不反应
主要用途 制玻璃,造纸,制皂,洗涤剂 发酵粉,医药,灭火剂
相互转化
Na2CO3 NaHCO3
①CO2+H2O ②少量酸
①固体时加热 ②溶液加 NaOH
