化学高一人教版元素周期表第2课时
文档属性
| 名称 | 化学高一人教版元素周期表第2课时 |

|
|
| 格式 | zip | ||
| 文件大小 | 126.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-08-12 00:00:00 | ||
图片预览







文档简介
(共31张PPT)
第一章 物质结构 元素周期律
第一节 元素周期表
(第二课时)
二、元素的 性质与原子结构
1.碱金属元素
P5科学探究
1.填表
Li Na K Rb Cs
相似性 最外层电子数为1
递
变
规
律 核电荷数逐渐增加
电子层数逐渐增多
原子半径逐渐增大
请同学们观察碱金属的原子结构示意图,分析碱金属原子结构的特点。
【科学探究】 P5
2、[实验] (1)
钾在空气中燃烧
3、思考与交流
[实验] (2)
钠、钾在烧杯中与水反应
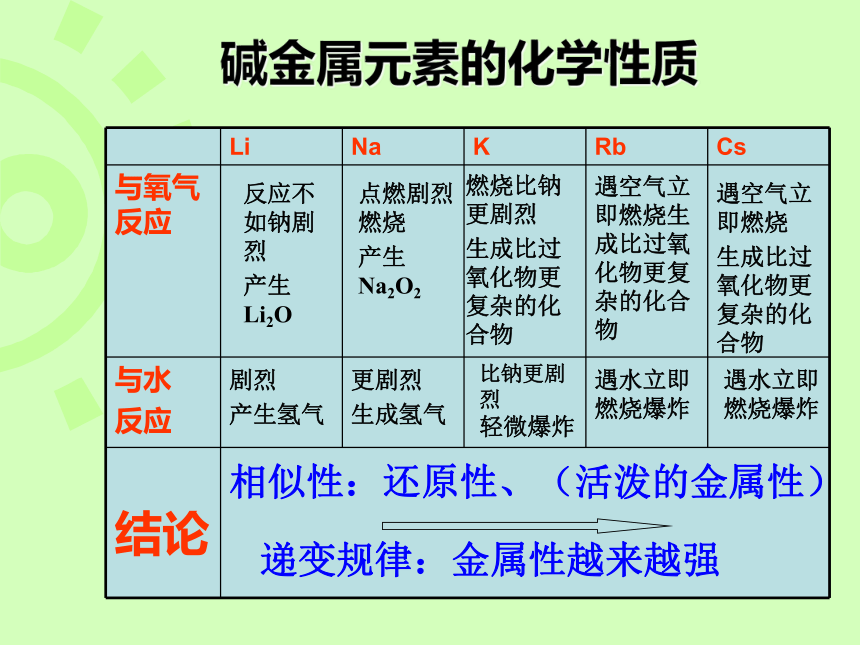
碱金属元素的化学性质
Li Na K Rb Cs
与氧气反应
与水
反应
结论
反应不如钠剧烈
产生Li2O
点燃剧烈燃烧
产生Na2O2
燃烧比钠更剧烈
生成比过氧化物更复杂的化合物
遇空气立即燃烧生成比过氧化物更复杂的化合物
遇空气立即燃烧
生成比过氧化物更复杂的化合物
剧烈
产生氢气
更剧烈
生成氢气
比钠更剧烈
轻微爆炸
遇水立即燃烧爆炸
遇水立即燃烧爆炸
相似性:还原性、(活泼的金属性)
递变规律:金属性越来越强
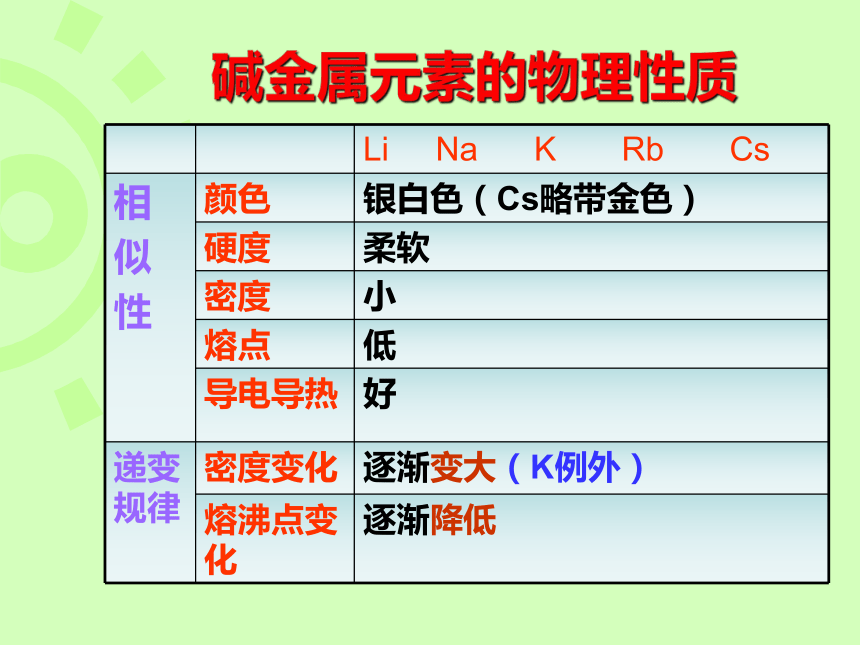
碱金属元素的物理性质
Li Na K Rb Cs
相
似
性 颜色 银白色(Cs略带金色)
硬度 柔软
密度 小
熔点 低
导电导热 好
递变规律 密度变化 逐渐变大(K例外)
熔沸点变化 逐渐降低
科学的思维模式:实验事实 分析 推断 实验验证 理论
规律:结构 性质 存在用途
决定
反映
决定
反映
学习方法:
1、下列叙述正确的是( )
A、 原子半径Li > Na > K > Rb > Cs
B、 核电荷数Li < Na < K
C、 电子层数Li < NaD、最外电子数都是1个,易得电子
课堂练习
BC
2、如何鉴别钾和钠?
1) 分别点燃,看反应的剧烈情况, 剧烈——K
2) 将少量的两种金属投入水中,与水剧烈反应,傍有轻微爆炸声——K
3) 观察两者火焰燃烧时的颜色
钠为黄色 钾为紫色网
2.卤族元素
P7学与问
卤
素
氟
氯
溴
碘
氧化性逐渐减弱
相同点:
最外层7个电子
易得一个电子,
不同点:
核电荷数递增
电子层数递增
原子半径依次增大
得电子能力逐渐减弱
核电荷数
电子层排布
元素符号
F
Cl
Br
I
9
17
35
53
2,7
2,8,7
2,8,18,7
2,8,18.18,7
原子结构
性质
决定
具氧化性
+17
2
8
7
+17
2
8
8
Cl
Cl-
(0.99)(10-10) m
(1.81)(10-10) m
+ e
半径:
卤素原子
卤素离子
得到一个电子
半径增大
为什么卤素单质是双原子分子?
卤素原子最外层都是7个电子
获得一个电子才能形成稳定结构
两个卤素原子共用一对电子就能形成 8电子
所以卤素单质是双原子分子
的稳定结构
F2
Br2
I2
Cl2
单质
颜色
密度
状态
熔沸点
浅黄绿色
黄绿色
深红棕色
紫黑色
气 体
气 体
液 体
固 体
增 大
升 高
卤素单质物理性质的变化规律
水
汽油(苯)
四氯化碳
溴
碘
黄至橙色
橙至橙红
橙至橙红
黄至褐色
淡紫至紫红
紫至深紫
溴和碘在不同溶剂中所生成溶液(由稀至浓)
的颜色变化
碘酒就是碘的酒精溶液,呈棕褐色。
(1)卤素都能跟氢气反应,生成卤化氢
试比较反应的相似点和差异点,找出递变规律。
H2 + F2 = 2HF
H2 + Cl2 = 2HCl
H2 + Br2 = 2HBr
H2 + I2 = 2HI
冷暗处就能爆炸化合,HF很稳定
强光照射爆炸化合, HCl较稳定
500度,较慢地化合,HBr较不稳定
持续加热,缓慢化合,HI同时分解
卤化氢
氧化剂
反应能力渐弱
稳定性渐弱
卤素单质结构相似
卤素原子的最外层均有七个电子
卤素单质均是通过一对共用电子形成的双原子分子
化学性质相似
课堂练习:请写出下列反应的化学方程式
溴和镁
碘和钾
氢和氟
溴和水
Mg + Br2 = MgBr2
2K + I2 = 2 KI
H2+ F2 = 2HF
Br2+ H2O = HBr + HBrO (次溴酸)
结构决定性质
(2)单质间的置换反应
[实验1]将少量新制的饱和氯水分别注盛有NaBr溶液和KI溶液的试管中,用力振荡后,在注入少量四氯化碳,振荡。观察四氯化碳层和水层的颜色变化。
NaBr溶液:四氯化碳层变橙色;水层变无色
KI溶液:四氯化碳层变紫色;水层变无色
Cl2+2NaBr==2NaCl+Br2
Cl2+2Br-==2Cl-+Br2
Cl2+2KI==2KCl+I2
Cl2+2I-==2Cl-+I2
[实验2]
将少量的溴水注入盛有KI溶液的试管中,用力振荡后,在注入少量的四氯化碳。观察四氯化碳层和水层颜色的变化。
四氯化碳层变紫色;水层变无色
Br2+2KI==2K Br +I2
Br2+2I-==2Br-+I2
(3)卤素单质与水的反应
氟与水发生剧烈的反应,生成氟化氢和氧气。
请你写出反应的化学方程式,标出电子的转移情况,
指出氧化剂和还原剂。
2F2 + 2H2O = 4HF + O2
4e
氧化剂
还原剂
溴跟水反应比氯气跟水的反应更弱一些
Br2 + H2O = HBr + HBrO
Cl2 + H2O = HCl + HClO
(碘跟水只有很微弱
的反应)
( 氟气的特殊性)
小 结
卤素原子结构的相似性,决定了单质化学性质的相似性。
与金属反应,生成卤化物。
与氢气反应,生成卤化氢。
与水反应,
卤素原子结构的差异性,决定了单质化学性质的差异
性和递变性
与氢反应的能力渐弱
氢化物的稳定性渐弱
与水反应的能力渐弱
AD
1、下列说法中错误的是 ( )
A.原子及其离子的核外电子层数等于该元素所在周期数
B.元素周期表中从ⅢB族到ⅡB族10列的元素都是金属元素
C.除氦外的稀有气体原子的最外层电子数都是8个
D.第七周期有50种元素
BD
2.鉴别Cl-、Br-、I-可以选用的试剂是( )
A.碘水,淀粉溶液
B.氯水,四氯化碳
C.淀粉,KI溶液
D.硝酸银溶液,稀HNO3
3.砹(At)是卤族元素中位于碘后面的元素,试推测砹和砹的化合物最不可能具备的性质是( )
A.砹易溶于某些有机溶剂
B.砹化氢很稳定不易分解
C.砹是有色气体
D.砹化银不溶于水或稀HNO3
BC
AC
4、在HI溶液中滴加淀粉溶液无明显变化,但加入某种物质后,溶液立即变蓝。该物质可能是。 ( )
A.FeCl3 B.K2SO3
C.KNO3 D.Na2S
5、下列关于卤素的叙述正确的( )
A、卤素只以化合态存在于自然界中
B、 随核电荷数增加,单质熔沸点升高
C、随核电荷数增加,单质氧化性增强
D、单质与水反应,均可用通式X2+H2O=HX+HXO表示
AB
布置作业:
P11-12第1、3、9题
元素金属性强弱判断依据:
1、根据金属单质与水或者与酸反应置换出氢的难易程度。置换出氢越容易,则金属性越强。
2、根据金属元素最高价氧化物对应水化物碱性强弱。碱性越强,则原金属元素的金属性越强。
第一章 物质结构 元素周期律
第一节 元素周期表
(第二课时)
二、元素的 性质与原子结构
1.碱金属元素
P5科学探究
1.填表
Li Na K Rb Cs
相似性 最外层电子数为1
递
变
规
律 核电荷数逐渐增加
电子层数逐渐增多
原子半径逐渐增大
请同学们观察碱金属的原子结构示意图,分析碱金属原子结构的特点。
【科学探究】 P5
2、[实验] (1)
钾在空气中燃烧
3、思考与交流
[实验] (2)
钠、钾在烧杯中与水反应
碱金属元素的化学性质
Li Na K Rb Cs
与氧气反应
与水
反应
结论
反应不如钠剧烈
产生Li2O
点燃剧烈燃烧
产生Na2O2
燃烧比钠更剧烈
生成比过氧化物更复杂的化合物
遇空气立即燃烧生成比过氧化物更复杂的化合物
遇空气立即燃烧
生成比过氧化物更复杂的化合物
剧烈
产生氢气
更剧烈
生成氢气
比钠更剧烈
轻微爆炸
遇水立即燃烧爆炸
遇水立即燃烧爆炸
相似性:还原性、(活泼的金属性)
递变规律:金属性越来越强
碱金属元素的物理性质
Li Na K Rb Cs
相
似
性 颜色 银白色(Cs略带金色)
硬度 柔软
密度 小
熔点 低
导电导热 好
递变规律 密度变化 逐渐变大(K例外)
熔沸点变化 逐渐降低
科学的思维模式:实验事实 分析 推断 实验验证 理论
规律:结构 性质 存在用途
决定
反映
决定
反映
学习方法:
1、下列叙述正确的是( )
A、 原子半径Li > Na > K > Rb > Cs
B、 核电荷数Li < Na < K
C、 电子层数Li < Na
课堂练习
BC
2、如何鉴别钾和钠?
1) 分别点燃,看反应的剧烈情况, 剧烈——K
2) 将少量的两种金属投入水中,与水剧烈反应,傍有轻微爆炸声——K
3) 观察两者火焰燃烧时的颜色
钠为黄色 钾为紫色网
2.卤族元素
P7学与问
卤
素
氟
氯
溴
碘
氧化性逐渐减弱
相同点:
最外层7个电子
易得一个电子,
不同点:
核电荷数递增
电子层数递增
原子半径依次增大
得电子能力逐渐减弱
核电荷数
电子层排布
元素符号
F
Cl
Br
I
9
17
35
53
2,7
2,8,7
2,8,18,7
2,8,18.18,7
原子结构
性质
决定
具氧化性
+17
2
8
7
+17
2
8
8
Cl
Cl-
(0.99)(10-10) m
(1.81)(10-10) m
+ e
半径:
卤素原子
卤素离子
得到一个电子
半径增大
为什么卤素单质是双原子分子?
卤素原子最外层都是7个电子
获得一个电子才能形成稳定结构
两个卤素原子共用一对电子就能形成 8电子
所以卤素单质是双原子分子
的稳定结构
F2
Br2
I2
Cl2
单质
颜色
密度
状态
熔沸点
浅黄绿色
黄绿色
深红棕色
紫黑色
气 体
气 体
液 体
固 体
增 大
升 高
卤素单质物理性质的变化规律
水
汽油(苯)
四氯化碳
溴
碘
黄至橙色
橙至橙红
橙至橙红
黄至褐色
淡紫至紫红
紫至深紫
溴和碘在不同溶剂中所生成溶液(由稀至浓)
的颜色变化
碘酒就是碘的酒精溶液,呈棕褐色。
(1)卤素都能跟氢气反应,生成卤化氢
试比较反应的相似点和差异点,找出递变规律。
H2 + F2 = 2HF
H2 + Cl2 = 2HCl
H2 + Br2 = 2HBr
H2 + I2 = 2HI
冷暗处就能爆炸化合,HF很稳定
强光照射爆炸化合, HCl较稳定
500度,较慢地化合,HBr较不稳定
持续加热,缓慢化合,HI同时分解
卤化氢
氧化剂
反应能力渐弱
稳定性渐弱
卤素单质结构相似
卤素原子的最外层均有七个电子
卤素单质均是通过一对共用电子形成的双原子分子
化学性质相似
课堂练习:请写出下列反应的化学方程式
溴和镁
碘和钾
氢和氟
溴和水
Mg + Br2 = MgBr2
2K + I2 = 2 KI
H2+ F2 = 2HF
Br2+ H2O = HBr + HBrO (次溴酸)
结构决定性质
(2)单质间的置换反应
[实验1]将少量新制的饱和氯水分别注盛有NaBr溶液和KI溶液的试管中,用力振荡后,在注入少量四氯化碳,振荡。观察四氯化碳层和水层的颜色变化。
NaBr溶液:四氯化碳层变橙色;水层变无色
KI溶液:四氯化碳层变紫色;水层变无色
Cl2+2NaBr==2NaCl+Br2
Cl2+2Br-==2Cl-+Br2
Cl2+2KI==2KCl+I2
Cl2+2I-==2Cl-+I2
[实验2]
将少量的溴水注入盛有KI溶液的试管中,用力振荡后,在注入少量的四氯化碳。观察四氯化碳层和水层颜色的变化。
四氯化碳层变紫色;水层变无色
Br2+2KI==2K Br +I2
Br2+2I-==2Br-+I2
(3)卤素单质与水的反应
氟与水发生剧烈的反应,生成氟化氢和氧气。
请你写出反应的化学方程式,标出电子的转移情况,
指出氧化剂和还原剂。
2F2 + 2H2O = 4HF + O2
4e
氧化剂
还原剂
溴跟水反应比氯气跟水的反应更弱一些
Br2 + H2O = HBr + HBrO
Cl2 + H2O = HCl + HClO
(碘跟水只有很微弱
的反应)
( 氟气的特殊性)
小 结
卤素原子结构的相似性,决定了单质化学性质的相似性。
与金属反应,生成卤化物。
与氢气反应,生成卤化氢。
与水反应,
卤素原子结构的差异性,决定了单质化学性质的差异
性和递变性
与氢反应的能力渐弱
氢化物的稳定性渐弱
与水反应的能力渐弱
AD
1、下列说法中错误的是 ( )
A.原子及其离子的核外电子层数等于该元素所在周期数
B.元素周期表中从ⅢB族到ⅡB族10列的元素都是金属元素
C.除氦外的稀有气体原子的最外层电子数都是8个
D.第七周期有50种元素
BD
2.鉴别Cl-、Br-、I-可以选用的试剂是( )
A.碘水,淀粉溶液
B.氯水,四氯化碳
C.淀粉,KI溶液
D.硝酸银溶液,稀HNO3
3.砹(At)是卤族元素中位于碘后面的元素,试推测砹和砹的化合物最不可能具备的性质是( )
A.砹易溶于某些有机溶剂
B.砹化氢很稳定不易分解
C.砹是有色气体
D.砹化银不溶于水或稀HNO3
BC
AC
4、在HI溶液中滴加淀粉溶液无明显变化,但加入某种物质后,溶液立即变蓝。该物质可能是。 ( )
A.FeCl3 B.K2SO3
C.KNO3 D.Na2S
5、下列关于卤素的叙述正确的( )
A、卤素只以化合态存在于自然界中
B、 随核电荷数增加,单质熔沸点升高
C、随核电荷数增加,单质氧化性增强
D、单质与水反应,均可用通式X2+H2O=HX+HXO表示
AB
布置作业:
P11-12第1、3、9题
元素金属性强弱判断依据:
1、根据金属单质与水或者与酸反应置换出氢的难易程度。置换出氢越容易,则金属性越强。
2、根据金属元素最高价氧化物对应水化物碱性强弱。碱性越强,则原金属元素的金属性越强。
