化学高一人教版乙醇说课
图片预览







文档简介
(共29张PPT)
乙醇说课
化学必修2第三章第三节
《生活中常见的有机物——乙醇和乙酸》
第一课时
一、说教材
二、说教法
三、说学法
四、说教学程序
五、说板书设计
六、说教学反思
一、说教材
(一)、本节课的地位和作用
(二)、教学三维目标
(三)、教学重点、难点
二、说教法
2、实验探究法
1、情境激学法
3、现代教育技术辅助教学法
三、说学法
1、高视角、低起点,从学生认识基础出发,加强 直观性教学
2、通过实验探究活动,规范实验习惯,培养科学素养
3、采用设问、类比启发、引导等方式,并辅以讨论,引导学生去联想、运用迁移规律
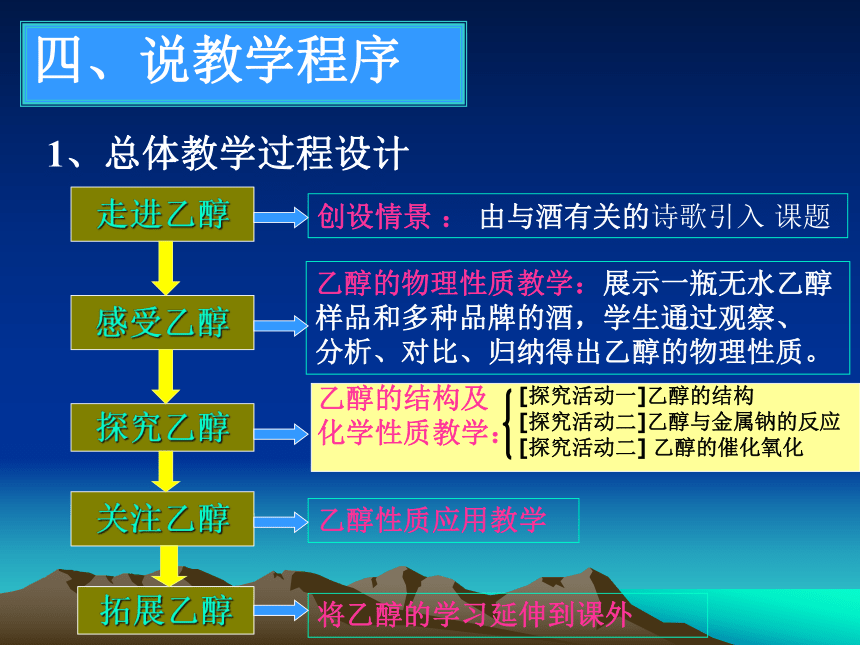
走进乙醇
感受乙醇
探究乙醇
关注乙醇
1、总体教学过程设计
四、说教学程序
拓展乙醇
创设情景 : 由与酒有关的诗歌引入 课题
乙醇的物理性质教学:展示一瓶无水乙醇
样品和多种品牌的酒,学生通过观察、
分析、对比、归纳得出乙醇的物理性质。
乙醇性质应用教学
将乙醇的学习延伸到课外
乙醇的结构及
化学性质教学:
[探究活动一]乙醇的结构
[探究活动二]乙醇与金属钠的反应
[探究活动二] 乙醇的催化氧化
走进乙醇
感受乙醇
探究乙醇
关注乙醇
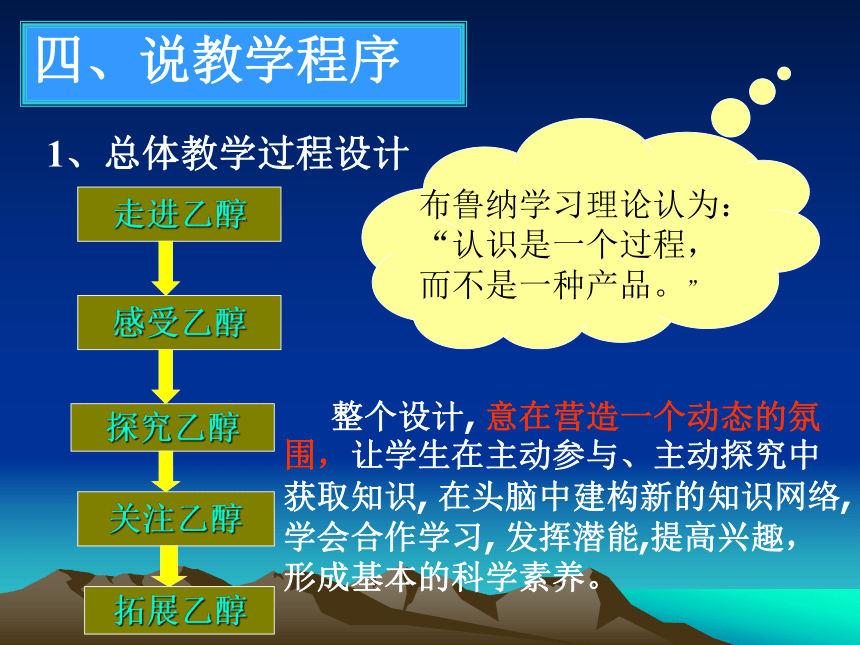
1、总体教学过程设计
四、说教学程序
拓展乙醇
整个设计, 意在营造一个动态的氛
围,让学生在主动参与、主动探究中
获取知识, 在头脑中建构新的知识网络,
学会合作学习, 发挥潜能,提高兴趣,
形成基本的科学素养。
布鲁纳学习理论认为:
“认识是一个过程,
而不是一种产品。”
2、具体教学过程
(1)导入新课
(2)乙醇的物理性质
(3)推测乙醇结构
(4)乙醇的化学性质
① 乙醇和金属Na反应
②乙醇的氧化反应
A.燃烧:
B.催化氧化
C.被强氧化剂氧化
(5)乙醇的用途
(6)课堂练习
(7)课堂小结并布置作业
五、说板书设计
乙醇
1.物理性质:
2.分子结构:
化学式:C2H6O
结构简式:CH3CH2OH或C2H5OH
3.化学性质:
(1)与Na反应
2CH3CH2OH+2Na 2CH3CH2ONa+H2↑
(2)氧化反应
①燃烧:C2H5OH+3O2 2CO2+3H2O
②催化氧化
③与强氧化剂的反应
CH3CH2OH
CH3COOH
CH3CHO
认知心理学认为,反思是对知识的再建构。因此学完本节内容教师应在课堂留时间让学生阅读书上内容,反思这一节课我学到了什么?还有哪些需要加强的? 还有哪些细节老师没讲?
六、说教学反思
教师的反思:
(一)、教材的地位和作用
本节课选自化学必修2第三章第三节《生活中常见的有机
物——乙醇和乙酸》中的第一课时的内容。
本节是以学生初中所学的有机化合物常识为基础的,提倡
从学生的生活经验出发,在介绍了有机物甲烷、乙烯、苯等
烃的基础上上引入的。通过本节的探究学习,既巩固前面所学
的知识,为后面进一步学习乙酸、糖类、油脂、蛋白质作了
铺垫,又为学习化学的学生选学《有机化学基础》打好基础。
它不仅是第三章的重点,也是高中有机化学学习的重点。
由于将来选学内容《有机化学基础》中深入介绍了乙醇
的性质,在必修中乙醇知识的教学,回避了较为复杂的结构分析,
让学生体会化学学习与自身关系密切,引起研究乙醇的欲望。
(二)、教学三维目标
为培养学生的创新精神和能力,根据新课标要求和学生实际,确定本节教学目标为:
1、知识与技能:通过对乙醇的分子结构、物理性质和化学性质的探究,使学生掌握乙醇的结构式、性质和用途。通过从动手实验,规范学生操作,全面培养、提高学生的实验能力、观察能力和对实验现象的解析能力。
2、过程与方法:通过提示问题、讨论释疑、动手实验,学习对比、推断等多种科学探究方法。
3、情感态度与价值观:让学生体验科学探究的艰辛和乐趣,认识化学与人类的密切关系,激发学生学习化学的积极性
(三)、教学重点、难点
2、教学难点:
乙醇分子结构的推断过程,乙醇的性质和用途
1、教学重点:
乙醇的催化氧化
白酒含酒精 50%-70%
小知识
啤酒含酒精 3%-5%
葡萄酒含酒精 6%-20%
黄酒含酒精 8%-15%
(均为体积分数)
?
一、乙醇
1、物理性质——展示实物、创设学习情境,提出生活实际问题、看书、交流、归纳总结。
[问题]
(1) 消毒用的“碘酒”里面含有什么?说明什么?
(2) 如何检验乙醇中是否含有水?
如何除去乙醇中少量的水?
乙醇分子式 C2H6O
设疑:根据碳的四键理论,能否根据乙醇的分子式写出乙醇可能具有的结构?
乙醇的结构式可能为:
怎样确定乙醇是哪一种结构
探究乙醇与钠的反应
学生分组实验,根据反应现象讨论:
反应生成产物?
键的断裂情况?
结合乙醇与乙烷、水的结构和性质对比,
最终得出乙醇正确的结构
2、乙醇的分子结构
羟基
C—C—O—H
H
H
H
H
H
CH3CH2OH
或C2H5OH
C2H6O
结构式:
分子式:
结构简式:
[实验探究]:学生分组实验:
a.铜丝红色→黑色→红色反复变化 b.在试管口可以闻到刺激性气味
思考:
铜丝在实验中起什么作用?
实验现象:
乙醇的催化氧化实验
[演示] 进一步通过动画演示,让学生更直观看
出反应的实质。
乙醇分子中键的断裂情况如何呢?从组成上看产物乙醛比乙醇少了什么?
工业上利用此原理生产乙醛
催化剂
2CH3CH2OH+O2 2CH3CHO+2H2O
Cu或Ag
[趣味实验]:
铜丝在酒精灯内焰和外烟上灼烧有何不同现象?原因?
CH3CH2OH
C.如果被强氧化剂如酸性高锰酸钾或重铬酸钾等氧化,乙醇会生成乙酸。
CH3COOH
橙色重铬酸钾会变为绿色
【设疑】:酒后驾车非常危险,极易发生交通事故,交通警察如何检查驾驶员是否酒后驾车呢?请阅读课本P78 页 身边的化学——交警判断酒后驾车的方法
CH3CHO
1、乙醇分子中不同的化学键如图:
化学反应中乙醇的断键位置
⑴与活泼金属反应____断裂
⑵C2H5OH燃烧_____断裂
⑶在Cu或Ag催化下和O2反应键_____断裂
①
全部
①③
课堂练习
2、把质量为m g的铜丝灼烧变黑,立即放入下列物质中,能使铜丝变红,而且质量仍为m g的是:
A 稀硫酸
B: 酒精
C 稀硝酸
D CO
3、能用来检验酒精中是否含有水的试剂是:
A: CuSO4·5H2O
B:无水硫酸铜
C:浓硫酸
D: 金属钠
B
B
D
课堂小结并布置作业
【小结】:
学生小结:本节课的收获
教师补充小结:本节课知识结构
与水互溶飘清香;电离水比乙醇强;钠粒投入放氢气;氧化成醛铜帮忙
【作业】:
1、制作一张海报,宣传酗酒的危害
2、搜集所学过的条件不同产物不同的化学反应。
乙醇说课
化学必修2第三章第三节
《生活中常见的有机物——乙醇和乙酸》
第一课时
一、说教材
二、说教法
三、说学法
四、说教学程序
五、说板书设计
六、说教学反思
一、说教材
(一)、本节课的地位和作用
(二)、教学三维目标
(三)、教学重点、难点
二、说教法
2、实验探究法
1、情境激学法
3、现代教育技术辅助教学法
三、说学法
1、高视角、低起点,从学生认识基础出发,加强 直观性教学
2、通过实验探究活动,规范实验习惯,培养科学素养
3、采用设问、类比启发、引导等方式,并辅以讨论,引导学生去联想、运用迁移规律
走进乙醇
感受乙醇
探究乙醇
关注乙醇
1、总体教学过程设计
四、说教学程序
拓展乙醇
创设情景 : 由与酒有关的诗歌引入 课题
乙醇的物理性质教学:展示一瓶无水乙醇
样品和多种品牌的酒,学生通过观察、
分析、对比、归纳得出乙醇的物理性质。
乙醇性质应用教学
将乙醇的学习延伸到课外
乙醇的结构及
化学性质教学:
[探究活动一]乙醇的结构
[探究活动二]乙醇与金属钠的反应
[探究活动二] 乙醇的催化氧化
走进乙醇
感受乙醇
探究乙醇
关注乙醇
1、总体教学过程设计
四、说教学程序
拓展乙醇
整个设计, 意在营造一个动态的氛
围,让学生在主动参与、主动探究中
获取知识, 在头脑中建构新的知识网络,
学会合作学习, 发挥潜能,提高兴趣,
形成基本的科学素养。
布鲁纳学习理论认为:
“认识是一个过程,
而不是一种产品。”
2、具体教学过程
(1)导入新课
(2)乙醇的物理性质
(3)推测乙醇结构
(4)乙醇的化学性质
① 乙醇和金属Na反应
②乙醇的氧化反应
A.燃烧:
B.催化氧化
C.被强氧化剂氧化
(5)乙醇的用途
(6)课堂练习
(7)课堂小结并布置作业
五、说板书设计
乙醇
1.物理性质:
2.分子结构:
化学式:C2H6O
结构简式:CH3CH2OH或C2H5OH
3.化学性质:
(1)与Na反应
2CH3CH2OH+2Na 2CH3CH2ONa+H2↑
(2)氧化反应
①燃烧:C2H5OH+3O2 2CO2+3H2O
②催化氧化
③与强氧化剂的反应
CH3CH2OH
CH3COOH
CH3CHO
认知心理学认为,反思是对知识的再建构。因此学完本节内容教师应在课堂留时间让学生阅读书上内容,反思这一节课我学到了什么?还有哪些需要加强的? 还有哪些细节老师没讲?
六、说教学反思
教师的反思:
(一)、教材的地位和作用
本节课选自化学必修2第三章第三节《生活中常见的有机
物——乙醇和乙酸》中的第一课时的内容。
本节是以学生初中所学的有机化合物常识为基础的,提倡
从学生的生活经验出发,在介绍了有机物甲烷、乙烯、苯等
烃的基础上上引入的。通过本节的探究学习,既巩固前面所学
的知识,为后面进一步学习乙酸、糖类、油脂、蛋白质作了
铺垫,又为学习化学的学生选学《有机化学基础》打好基础。
它不仅是第三章的重点,也是高中有机化学学习的重点。
由于将来选学内容《有机化学基础》中深入介绍了乙醇
的性质,在必修中乙醇知识的教学,回避了较为复杂的结构分析,
让学生体会化学学习与自身关系密切,引起研究乙醇的欲望。
(二)、教学三维目标
为培养学生的创新精神和能力,根据新课标要求和学生实际,确定本节教学目标为:
1、知识与技能:通过对乙醇的分子结构、物理性质和化学性质的探究,使学生掌握乙醇的结构式、性质和用途。通过从动手实验,规范学生操作,全面培养、提高学生的实验能力、观察能力和对实验现象的解析能力。
2、过程与方法:通过提示问题、讨论释疑、动手实验,学习对比、推断等多种科学探究方法。
3、情感态度与价值观:让学生体验科学探究的艰辛和乐趣,认识化学与人类的密切关系,激发学生学习化学的积极性
(三)、教学重点、难点
2、教学难点:
乙醇分子结构的推断过程,乙醇的性质和用途
1、教学重点:
乙醇的催化氧化
白酒含酒精 50%-70%
小知识
啤酒含酒精 3%-5%
葡萄酒含酒精 6%-20%
黄酒含酒精 8%-15%
(均为体积分数)
?
一、乙醇
1、物理性质——展示实物、创设学习情境,提出生活实际问题、看书、交流、归纳总结。
[问题]
(1) 消毒用的“碘酒”里面含有什么?说明什么?
(2) 如何检验乙醇中是否含有水?
如何除去乙醇中少量的水?
乙醇分子式 C2H6O
设疑:根据碳的四键理论,能否根据乙醇的分子式写出乙醇可能具有的结构?
乙醇的结构式可能为:
怎样确定乙醇是哪一种结构
探究乙醇与钠的反应
学生分组实验,根据反应现象讨论:
反应生成产物?
键的断裂情况?
结合乙醇与乙烷、水的结构和性质对比,
最终得出乙醇正确的结构
2、乙醇的分子结构
羟基
C—C—O—H
H
H
H
H
H
CH3CH2OH
或C2H5OH
C2H6O
结构式:
分子式:
结构简式:
[实验探究]:学生分组实验:
a.铜丝红色→黑色→红色反复变化 b.在试管口可以闻到刺激性气味
思考:
铜丝在实验中起什么作用?
实验现象:
乙醇的催化氧化实验
[演示] 进一步通过动画演示,让学生更直观看
出反应的实质。
乙醇分子中键的断裂情况如何呢?从组成上看产物乙醛比乙醇少了什么?
工业上利用此原理生产乙醛
催化剂
2CH3CH2OH+O2 2CH3CHO+2H2O
Cu或Ag
[趣味实验]:
铜丝在酒精灯内焰和外烟上灼烧有何不同现象?原因?
CH3CH2OH
C.如果被强氧化剂如酸性高锰酸钾或重铬酸钾等氧化,乙醇会生成乙酸。
CH3COOH
橙色重铬酸钾会变为绿色
【设疑】:酒后驾车非常危险,极易发生交通事故,交通警察如何检查驾驶员是否酒后驾车呢?请阅读课本P78 页 身边的化学——交警判断酒后驾车的方法
CH3CHO
1、乙醇分子中不同的化学键如图:
化学反应中乙醇的断键位置
⑴与活泼金属反应____断裂
⑵C2H5OH燃烧_____断裂
⑶在Cu或Ag催化下和O2反应键_____断裂
①
全部
①③
课堂练习
2、把质量为m g的铜丝灼烧变黑,立即放入下列物质中,能使铜丝变红,而且质量仍为m g的是:
A 稀硫酸
B: 酒精
C 稀硝酸
D CO
3、能用来检验酒精中是否含有水的试剂是:
A: CuSO4·5H2O
B:无水硫酸铜
C:浓硫酸
D: 金属钠
B
B
D
课堂小结并布置作业
【小结】:
学生小结:本节课的收获
教师补充小结:本节课知识结构
与水互溶飘清香;电离水比乙醇强;钠粒投入放氢气;氧化成醛铜帮忙
【作业】:
1、制作一张海报,宣传酗酒的危害
2、搜集所学过的条件不同产物不同的化学反应。
