化学必修2人教新课标1.2元素周期律
文档属性
| 名称 | 化学必修2人教新课标1.2元素周期律 |

|
|
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-08-12 00:00:00 | ||
图片预览







文档简介
(共33张PPT)
§1.2 元素周期率
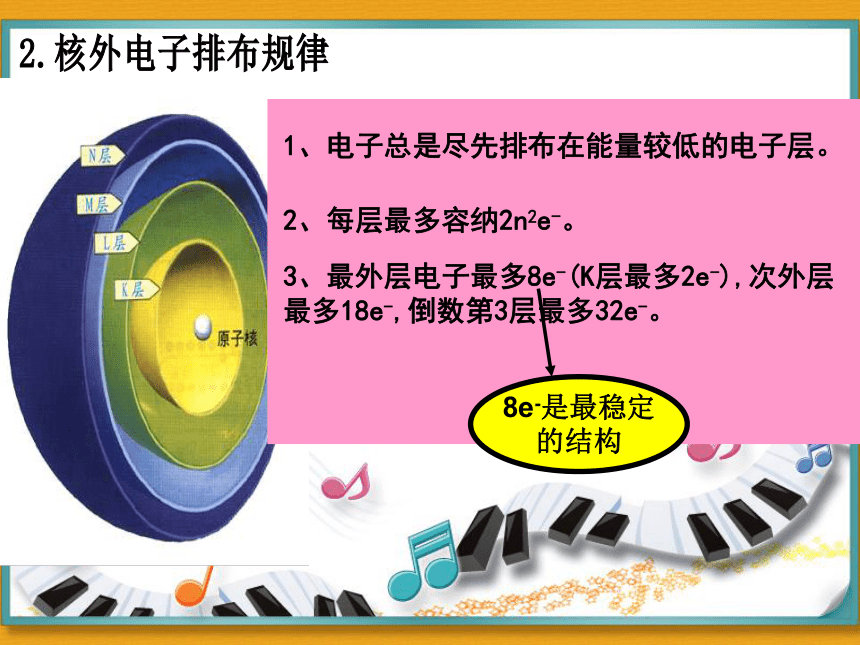
1.电子层的划分
电子层(n):
1 2 3 4 5 6 7
符号:
K L M N O P Q
离核距离:
能量:
近 远
低 高
3、最外层电子最多8e-(K层最多2e-),次外层最多18e-,倒数第3层最多32e-。
2、每层最多容纳2n2e-。
1、电子总是尽先排布在能量较低的电子层。
8e-是最稳定
的结构
阅读P14-15科学探究1,随着原子序数的递增,
原子的核外电子层排布呈现什么规律性的变化?元
素的化合价呈现什么规律性的变化?
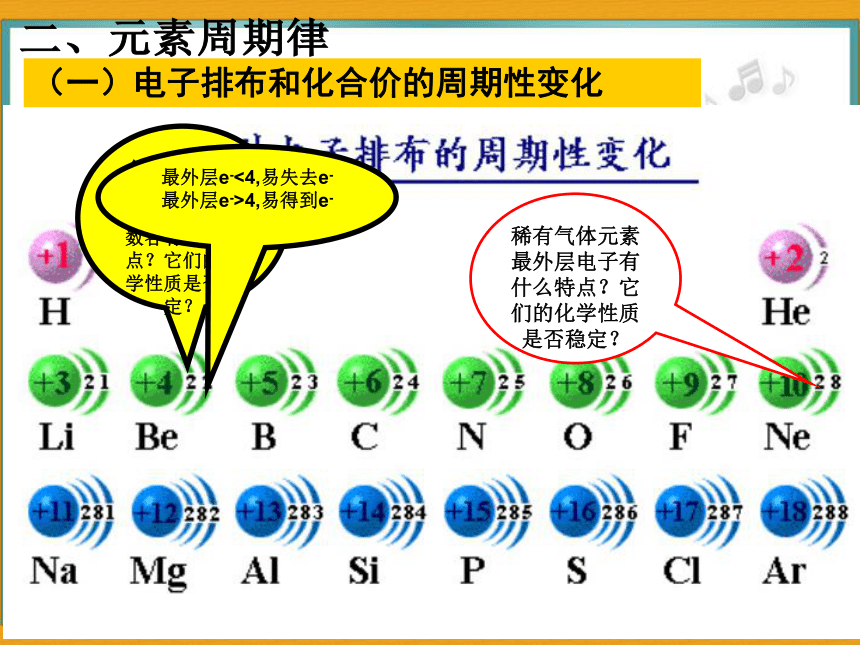
稀有气体元素最外层电子有什么特点?它们的化学性质是否稳定?
金属元素和非金属元素的原子最外层电子数各有什么特点?它们的化学性质是否稳定?
最外层e-<4,易失去e-
最外层e->4,易得到e-
(一)电子排布和化合价的周期性变化
(一)电子排布和化合价的周期性变化
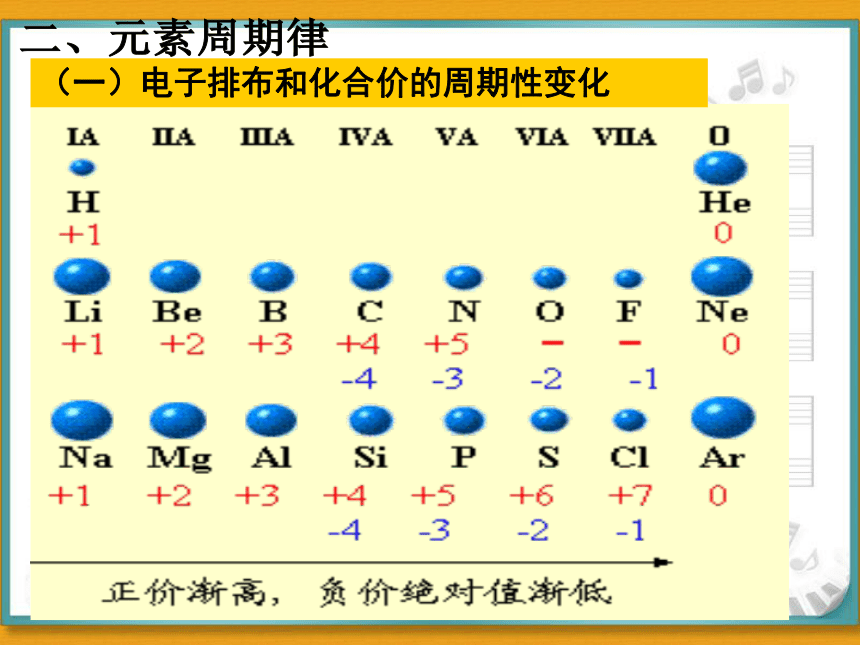
原子序数 电子层数 最外层电子数 最高或最低化合价的变化
1~2 1
3~10
11~18
2
1
8
1
8
3
+1
+5
- 4
- 1
0
+1
+7
1 2
+1 0
- 4
- 1
0
(一)电子排布和化合价的周期性变化
注:
1.稀气的化合价为0
2.金属无负价
3.O, F无正价
4.主族元素:
最高正价=最外层电子数=主族序数
价电子
最低负化合价 = 8 – 最外层电子数
最高正价 + 最低负价 = 8
H
Li
Be
B
C
N
He
Na
K
Rb
Cs
Fr
Mg
Ca
Sr
Ba
Ra
Al
Ga
In
Tl
Si
Ge
Sn
Pb
P
As
Sb
Bi
O
S
Se
Te
Po
F
Cl
Br
I
At
Ne
Ar
Kr
Xe
Rn
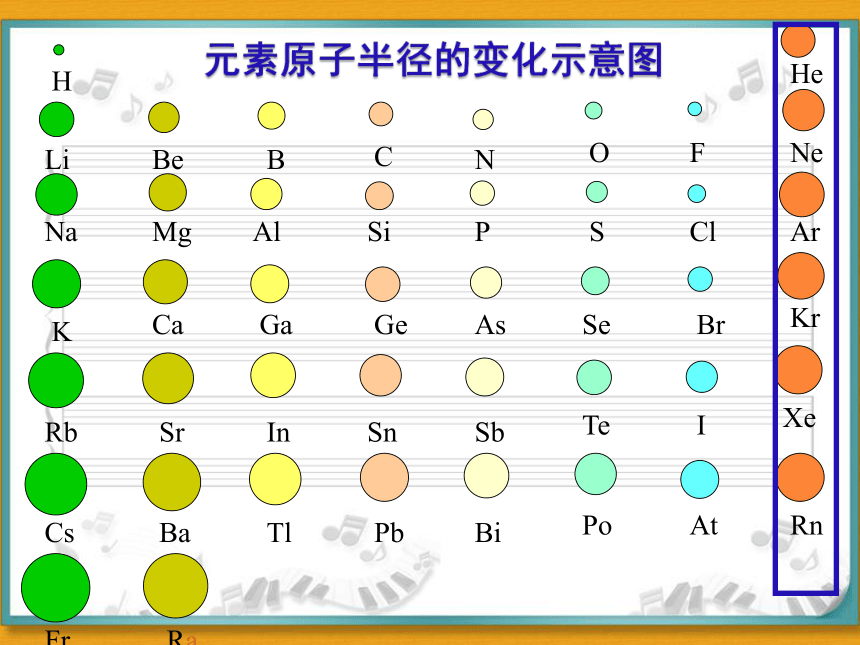
元素原子半径的变化示意图
(二)半径的周期性变化
1.同一周期:
2.同一主族:
左→右,原子序数↑,半径r↓
上→下,电子层数↑,半径r↑
探讨:
制约原子半径的因素
①电子层数:
②核电荷数(质子数Z):
③核外电子数(e-):
(二)半径的周期性变化
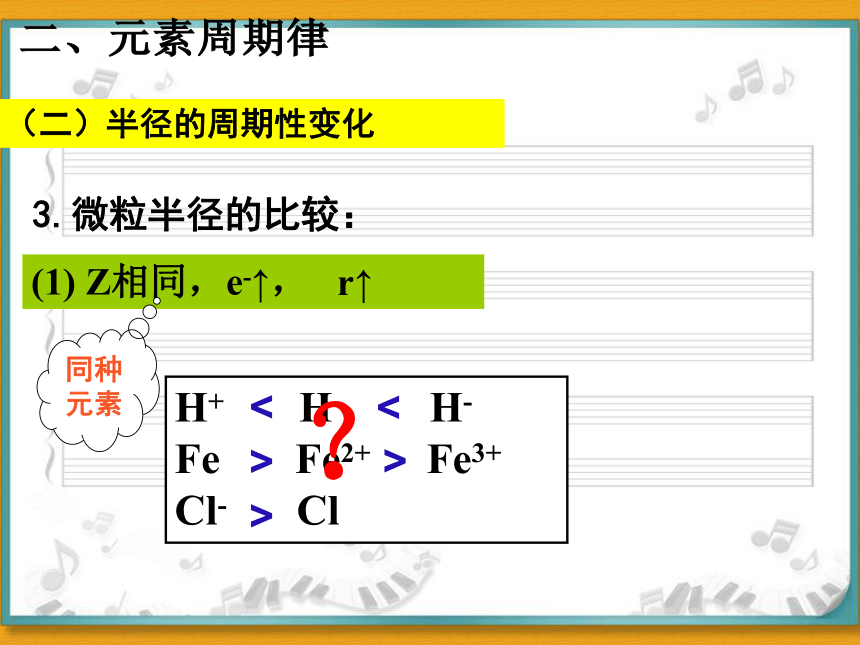
3.微粒半径的比较:
(1) Z相同,e-↑,
H+ H H-
Fe Fe2+ Fe3+
Cl- Cl
?
<
<
>
>
>
r↑
同种元素
(二)半径的周期性变化
3.微粒半径的比较:
(2) e- 相同, Z ↑,
①2e- : H- Li+ Be2+
②10e-:O2- Na+ Mg2+ Al3+
③18e-:S2- Cl- K+ Ca2+
?
>
>
>
>
>
>
>
>
r↓
(二)半径的周期性变化
Li Mg
Na Na+
O2- F-
<
>
>
注:
③ 原子半径最小的是H
②稀有气体不考虑
①先比电子层,同Z比e-,同e-比Z
元素的金属性和非金属性是否也随原子序数的变化呈现周期性变化呢?
(三)金属性和非金属性的周期性
1.元素金属性强弱判断:
⑴ 单质与水或酸反应置换出H2的难易;
⑵ 最高价氧化物对应的水化物(氢氧化物)的碱性强弱;
⑶ 单质间的置换(强制弱)
2.元素非金属性强弱判断:
⑴ 单质与H2化合生成气态氢化物的难易;
⑵ 气态氢化物的稳定性;
⑶ 最高价氧化物对应的水化物酸性强弱;
(三)金属性和非金属性的周期性
3.Na Mg Al的金属性比较
⑴与水反应
Na
冷水
2Na + 2H2O = 2NaOH +H2↑
Mg
冷水
无明显现象
沸水
Mg + 2H2O = Mg(OH)2 +H2↑
△
Al
冷水或沸水
均无明显现象
金属性:Na > Mg > Al
碱性: NaOH > Mg(OH)2 > Al(OH)3
(三)金属性和非金属性的周期性
3.Na Mg Al的金属性比较
⑵与酸反应
金属性:Na > Mg > Al
(三)金属性和非金属性的周期性
4. Si P S Cl的非金属性比较
⑴与H2反应
非金属性: Si < P < S < Cl
稳定性:
SiH4 < PH3 < H2S < HCl
酸性:
H4SiO4 < H3PO4 < H2SO4 < HClO4
SiO2 P2O5 SO3 Cl2O7
(三)金属性和非金属性的周期性
Na Mg Al Si P S Cl
金属性↓
,非金属性↑
注:
F
Cs
非金属性最强
金属性最强
随着原子序数的递增
核外电子排布呈周期性变化
元素性质呈周期性变化
元素周期律
最外层电子数 1→8
(K层电子数 1→2)
原子半径 大→小
(稀有气体元素突然增大)
化合价:+1→+7 -4→-1
(稀有气体元素为零)
决定了
归纳出
引起了
元素化学性质金属性非金属性变化
某元素X的气态氢化物化学式为H2X,下面的叙述不正确的是( )
A.该元素的原子最外电子层上有6个电子
B.该元素最高正价氧化物的化学式为XO2
C.该元素是非金属元素
D.该元素最高正价氧化物对应水化物的化学式为H2XO4
B
C
3.电子层数相同的3种元素X、Y、Z已知最高价氧化物对应水化物的酸性HXO4
>H2YO4>H3ZO4则下列判断错误的是( )
A.气态氢化物还原性HX<H2Y<ZH3
B.气态氢化物稳定性HX>H2Y>ZH3
C.非金属性X>Y>Z
D.原子半径X>Y>Z
D
4.下列递变规律不正确的是( )
A.Na、Mg、Al还原性依次减弱
B.I2、Br2、Cl2氧化性依次增强
C.C、N、O原子半径依次增大
D.P、S、Cl最高正价依次升高
5.已知An+、B(n-1)+、C(n+1)+、D(n+1)-都有相同的电子层结构,A、B、C、D的原子半径由大到小的顺序是( )
A.C>D>B>A B.A>B>C>D
C.B>A>C>D D.A>B>D>C
C
C
元素
R IA IIA IIIA IVA VA VIA VIIA
气态氢化物的通式
最高价氧化物的通式
水化物的通式
RH4
RH3
H2R
HR
R2O
RO
R2O3
RO2
R2O5
RO3
R2O7
/
ROH
R(OH)2
HRO3
H3RO4
H2RO4
R(OH)3
H2RO3
HRO4
还原性(金属性)↓,氧化性(非金属性)↑
稳定性↑
碱性↓,酸性↑
1.同一周期元素的性质
总结
RH
RH2
气态氢
化物的
通式
+1 +1 +1 +1
-1 -1
IA VIIA
2 Li F
3 Na Cl
4 K Br
5 Rb I
6 Cs
金属性
碱 性
酸 性
非金属性
酸酐
2.同一主族元素的性质
稳定性
Li2O
Na2O
K2O
Rb2O
Cs2O
Br2O7
I2O7
Cl2O7
HClO4
HBrO4
HIO4
LiOH
NaOH
KOH
RbOH
CsOH
HF
HCl
HBr
HI
+7
+7
注:
H2SO4 H2SO3
HClO HClO2 HClO 3 HClO4
>
<
<
<
同元素的水化物价态越高酸性越强
三. 位、构、性的关系
原子序数= 核电荷数
周期数= 电子层数
主族序数=最外层电子数
同位素-化学性质相同
相似性
递变性(从上至下,金属性增强,非金属性减弱)
同周期
同主族
递变性(从左到右,金属性减弱,非金属性增强)
电子层数
最外层电子数
金属性、非金属性强弱
(主族)最外层电子数
= 最高正价数
最外层电子数- 8 = 最低负价数
原子结构
表中位置
元素性质
元素位、构、性三者关系(举例)
金属性最强的元素(不包括放射性元素)是 ;
最活泼的非金属元素是 ;
最高价氧化物对应水化物的酸性最强的元素是 ;
最高价氧化物对应水化物的碱性最强的元素(不包括放射性元素)是 。
Cs
F
Cl
Cs
元素位、构、性三者关系(举例)
处于同周期的相邻两种元素A和B,A的最高价氧化物的水化物的碱性比B弱,A处于B的 边(左或右);B的原子半径比A ;若B的最外层有2个电子,则A最外层有 个电子。
处于同周期的相邻两种元素A和B,A的最高价氧化物的水化物的酸性比B弱,A处于B的 边(左或右);B的原子半径比A ;若B的最外层有3个电子,则A最外层有 个电子。
右
大
3
左
小
2
四.元素周期表的实际应用
寻找用于制取农药的元素
寻找半导体材料
寻找用于制取农药的元素
寻找半导体材料
寻找用于制取农药的元素
寻找半导体材料
§1.2 元素周期率
1.电子层的划分
电子层(n):
1 2 3 4 5 6 7
符号:
K L M N O P Q
离核距离:
能量:
近 远
低 高
3、最外层电子最多8e-(K层最多2e-),次外层最多18e-,倒数第3层最多32e-。
2、每层最多容纳2n2e-。
1、电子总是尽先排布在能量较低的电子层。
8e-是最稳定
的结构
阅读P14-15科学探究1,随着原子序数的递增,
原子的核外电子层排布呈现什么规律性的变化?元
素的化合价呈现什么规律性的变化?
稀有气体元素最外层电子有什么特点?它们的化学性质是否稳定?
金属元素和非金属元素的原子最外层电子数各有什么特点?它们的化学性质是否稳定?
最外层e-<4,易失去e-
最外层e->4,易得到e-
(一)电子排布和化合价的周期性变化
(一)电子排布和化合价的周期性变化
原子序数 电子层数 最外层电子数 最高或最低化合价的变化
1~2 1
3~10
11~18
2
1
8
1
8
3
+1
+5
- 4
- 1
0
+1
+7
1 2
+1 0
- 4
- 1
0
(一)电子排布和化合价的周期性变化
注:
1.稀气的化合价为0
2.金属无负价
3.O, F无正价
4.主族元素:
最高正价=最外层电子数=主族序数
价电子
最低负化合价 = 8 – 最外层电子数
最高正价 + 最低负价 = 8
H
Li
Be
B
C
N
He
Na
K
Rb
Cs
Fr
Mg
Ca
Sr
Ba
Ra
Al
Ga
In
Tl
Si
Ge
Sn
Pb
P
As
Sb
Bi
O
S
Se
Te
Po
F
Cl
Br
I
At
Ne
Ar
Kr
Xe
Rn
元素原子半径的变化示意图
(二)半径的周期性变化
1.同一周期:
2.同一主族:
左→右,原子序数↑,半径r↓
上→下,电子层数↑,半径r↑
探讨:
制约原子半径的因素
①电子层数:
②核电荷数(质子数Z):
③核外电子数(e-):
(二)半径的周期性变化
3.微粒半径的比较:
(1) Z相同,e-↑,
H+ H H-
Fe Fe2+ Fe3+
Cl- Cl
?
<
<
>
>
>
r↑
同种元素
(二)半径的周期性变化
3.微粒半径的比较:
(2) e- 相同, Z ↑,
①2e- : H- Li+ Be2+
②10e-:O2- Na+ Mg2+ Al3+
③18e-:S2- Cl- K+ Ca2+
?
>
>
>
>
>
>
>
>
r↓
(二)半径的周期性变化
Li Mg
Na Na+
O2- F-
<
>
>
注:
③ 原子半径最小的是H
②稀有气体不考虑
①先比电子层,同Z比e-,同e-比Z
元素的金属性和非金属性是否也随原子序数的变化呈现周期性变化呢?
(三)金属性和非金属性的周期性
1.元素金属性强弱判断:
⑴ 单质与水或酸反应置换出H2的难易;
⑵ 最高价氧化物对应的水化物(氢氧化物)的碱性强弱;
⑶ 单质间的置换(强制弱)
2.元素非金属性强弱判断:
⑴ 单质与H2化合生成气态氢化物的难易;
⑵ 气态氢化物的稳定性;
⑶ 最高价氧化物对应的水化物酸性强弱;
(三)金属性和非金属性的周期性
3.Na Mg Al的金属性比较
⑴与水反应
Na
冷水
2Na + 2H2O = 2NaOH +H2↑
Mg
冷水
无明显现象
沸水
Mg + 2H2O = Mg(OH)2 +H2↑
△
Al
冷水或沸水
均无明显现象
金属性:Na > Mg > Al
碱性: NaOH > Mg(OH)2 > Al(OH)3
(三)金属性和非金属性的周期性
3.Na Mg Al的金属性比较
⑵与酸反应
金属性:Na > Mg > Al
(三)金属性和非金属性的周期性
4. Si P S Cl的非金属性比较
⑴与H2反应
非金属性: Si < P < S < Cl
稳定性:
SiH4 < PH3 < H2S < HCl
酸性:
H4SiO4 < H3PO4 < H2SO4 < HClO4
SiO2 P2O5 SO3 Cl2O7
(三)金属性和非金属性的周期性
Na Mg Al Si P S Cl
金属性↓
,非金属性↑
注:
F
Cs
非金属性最强
金属性最强
随着原子序数的递增
核外电子排布呈周期性变化
元素性质呈周期性变化
元素周期律
最外层电子数 1→8
(K层电子数 1→2)
原子半径 大→小
(稀有气体元素突然增大)
化合价:+1→+7 -4→-1
(稀有气体元素为零)
决定了
归纳出
引起了
元素化学性质金属性非金属性变化
某元素X的气态氢化物化学式为H2X,下面的叙述不正确的是( )
A.该元素的原子最外电子层上有6个电子
B.该元素最高正价氧化物的化学式为XO2
C.该元素是非金属元素
D.该元素最高正价氧化物对应水化物的化学式为H2XO4
B
C
3.电子层数相同的3种元素X、Y、Z已知最高价氧化物对应水化物的酸性HXO4
>H2YO4>H3ZO4则下列判断错误的是( )
A.气态氢化物还原性HX<H2Y<ZH3
B.气态氢化物稳定性HX>H2Y>ZH3
C.非金属性X>Y>Z
D.原子半径X>Y>Z
D
4.下列递变规律不正确的是( )
A.Na、Mg、Al还原性依次减弱
B.I2、Br2、Cl2氧化性依次增强
C.C、N、O原子半径依次增大
D.P、S、Cl最高正价依次升高
5.已知An+、B(n-1)+、C(n+1)+、D(n+1)-都有相同的电子层结构,A、B、C、D的原子半径由大到小的顺序是( )
A.C>D>B>A B.A>B>C>D
C.B>A>C>D D.A>B>D>C
C
C
元素
R IA IIA IIIA IVA VA VIA VIIA
气态氢化物的通式
最高价氧化物的通式
水化物的通式
RH4
RH3
H2R
HR
R2O
RO
R2O3
RO2
R2O5
RO3
R2O7
/
ROH
R(OH)2
HRO3
H3RO4
H2RO4
R(OH)3
H2RO3
HRO4
还原性(金属性)↓,氧化性(非金属性)↑
稳定性↑
碱性↓,酸性↑
1.同一周期元素的性质
总结
RH
RH2
气态氢
化物的
通式
+1 +1 +1 +1
-1 -1
IA VIIA
2 Li F
3 Na Cl
4 K Br
5 Rb I
6 Cs
金属性
碱 性
酸 性
非金属性
酸酐
2.同一主族元素的性质
稳定性
Li2O
Na2O
K2O
Rb2O
Cs2O
Br2O7
I2O7
Cl2O7
HClO4
HBrO4
HIO4
LiOH
NaOH
KOH
RbOH
CsOH
HF
HCl
HBr
HI
+7
+7
注:
H2SO4 H2SO3
HClO HClO2 HClO 3 HClO4
>
<
<
<
同元素的水化物价态越高酸性越强
三. 位、构、性的关系
原子序数= 核电荷数
周期数= 电子层数
主族序数=最外层电子数
同位素-化学性质相同
相似性
递变性(从上至下,金属性增强,非金属性减弱)
同周期
同主族
递变性(从左到右,金属性减弱,非金属性增强)
电子层数
最外层电子数
金属性、非金属性强弱
(主族)最外层电子数
= 最高正价数
最外层电子数- 8 = 最低负价数
原子结构
表中位置
元素性质
元素位、构、性三者关系(举例)
金属性最强的元素(不包括放射性元素)是 ;
最活泼的非金属元素是 ;
最高价氧化物对应水化物的酸性最强的元素是 ;
最高价氧化物对应水化物的碱性最强的元素(不包括放射性元素)是 。
Cs
F
Cl
Cs
元素位、构、性三者关系(举例)
处于同周期的相邻两种元素A和B,A的最高价氧化物的水化物的碱性比B弱,A处于B的 边(左或右);B的原子半径比A ;若B的最外层有2个电子,则A最外层有 个电子。
处于同周期的相邻两种元素A和B,A的最高价氧化物的水化物的酸性比B弱,A处于B的 边(左或右);B的原子半径比A ;若B的最外层有3个电子,则A最外层有 个电子。
右
大
3
左
小
2
四.元素周期表的实际应用
寻找用于制取农药的元素
寻找半导体材料
寻找用于制取农药的元素
寻找半导体材料
寻找用于制取农药的元素
寻找半导体材料
