课时训练18原电池
图片预览

文档简介
课时训练18 原电池
1.对于原电池的电极名称,叙述错误的是( )。
A.发生氧化反应的一极为负极
B.正极为电子流入的一极
C.比较不活泼的金属为负极
D.电流流出的一极为正极
答案:C
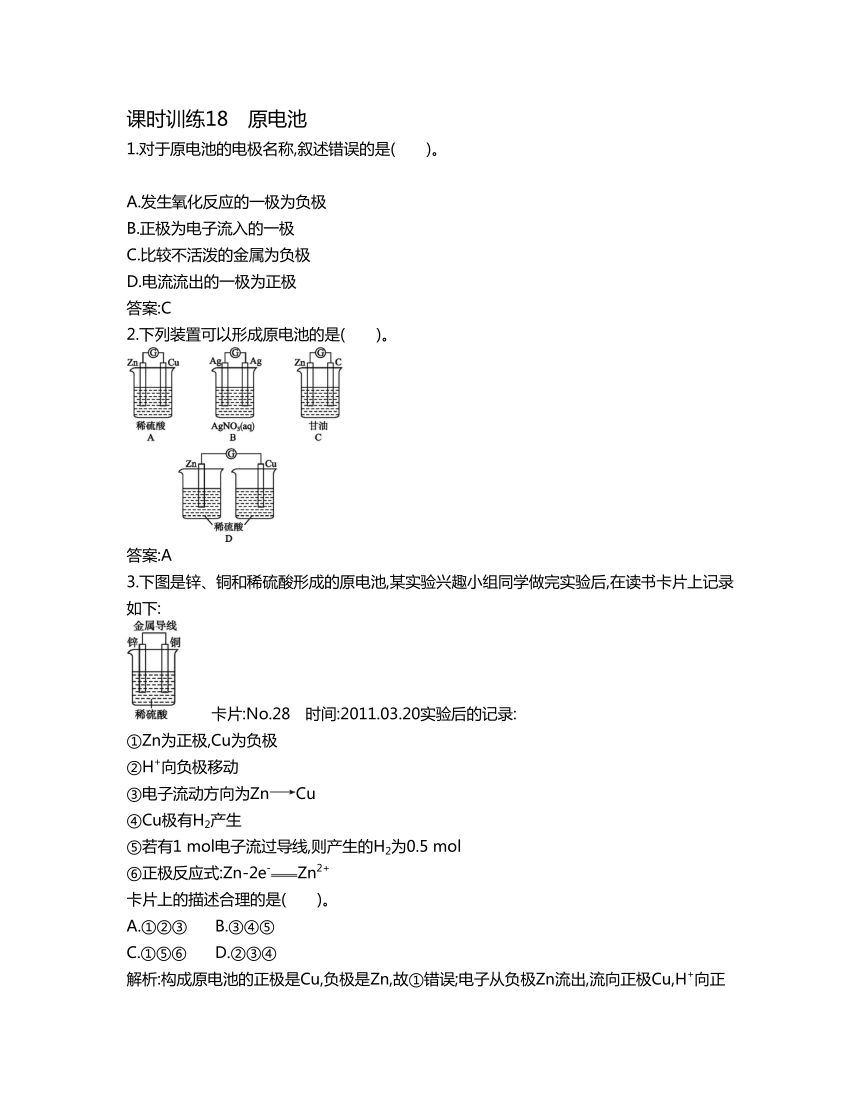
2.下列装置可以形成原电池的是( )。
答案:A
3.下图是锌、铜和稀硫酸形成的原电池,某实验兴趣小组同学做完实验后,在读书卡片上记录如下:
卡片:No.28 时间:2011.03.20实验后的记录:
①Zn为正极,Cu为负极
②H+向负极移动
③电子流动方向为ZnCu
④Cu极有H2产生
⑤若有1 mol电子流过导线,则产生的H2为0.5 mol
⑥正极反应式:Zn-2e-Zn2+
卡片上的描述合理的是( )。
A.①②③ B.③④⑤
C.①⑤⑥ D.②③④
解析:构成原电池的正极是Cu,负极是Zn,故①错误;电子从负极Zn流出,流向正极Cu,H+向正极移动,在Cu上得电子:2H++2e-H2↑,故②错误,③④正确;此原电池负极上发生的反应是Zn-2e-Zn2+,⑥错误;总反应方程式:Zn+2H+Zn2++H2↑,当有1 mol电子通过时,产生H2为0.5 mol,故⑤正确。
答案:B
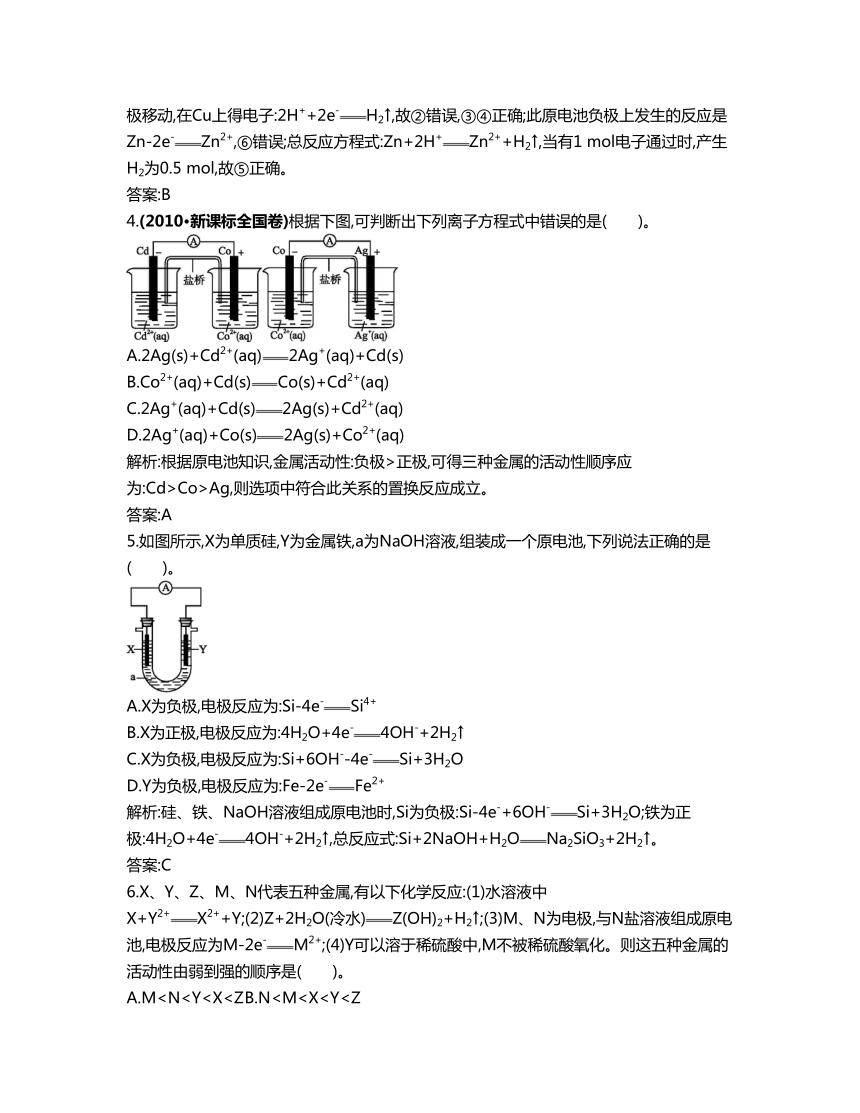
4.(2010·新课标全国卷)根据下图,可判断出下列离子方程式中错误的是( )。
A.2Ag(s)+Cd2+(aq)2Ag+(aq)+Cd(s)
B.Co2+(aq)+Cd(s)Co(s)+Cd2+(aq)
C.2Ag+(aq)+Cd(s)2Ag(s)+Cd2+(aq)
D.2Ag+(aq)+Co(s)2Ag(s)+Co2+(aq)
解析:根据原电池知识,金属活动性:负极>正极,可得三种金属的活动性顺序应为:Cd>Co>Ag,则选项中符合此关系的置换反应成立。
答案:A
5.如图所示,X为单质硅,Y为金属铁,a为NaOH溶液,组装成一个原电池,下列说法正确的是( )。
A.X为负极,电极反应为:Si-4e-Si4+
B.X为正极,电极反应为:4H2O+4e-4OH-+2H2↑
C.X为负极,电极反应为:Si+6OH--4e-Si+3H2O
D.Y为负极,电极反应为:Fe-2e-Fe2+
解析:硅、铁、NaOH溶液组成原电池时,Si为负极:Si-4e-+6OH-Si+3H2O;铁为正极:4H2O+4e-4OH-+2H2↑,总反应式:Si+2NaOH+H2ONa2SiO3+2H2↑。
答案:C
6.X、Y、Z、M、N代表五种金属,有以下化学反应:(1)水溶液中X+Y2+X2++Y;(2)Z+2H2O(冷水)Z(OH)2+H2↑;(3)M、N为电极,与N盐溶液组成原电池,电极反应为M-2e-M2+;(4)Y可以溶于稀硫酸中,M不被稀硫酸氧化。则这五种金属的活动性由弱到强的顺序是( )。
A.MC.N解析:由反应(1)可知活动性YN;由(4)可得,M答案:C
7.按下图装置实验,若x轴表示流出负极的电子的物质的量,则y轴应表示( )。
①c(Ag+) ②c(N) ③a棒的质量 ④b棒的质量
⑤溶液的质量
A.①③ B.③④ C.①②④ D.②
解析:在这个原电池中,负极:Fe-2e-Fe2+,正极:Ag++e-Ag,使b棒增重,溶液中c(N)不变。
答案:D
8.如下图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动),下列叙述正确的是( )。
A.a中铁钉附近呈现红色
B.b中铁钉上发生还原反应
C.a中铜丝上发生氧化反应
D.b中铝条附近有气泡产生
解析:a中构成原电池,铁钉作负极,铜丝作正极,故Fe失去电子生成Fe2+,呈浅绿色,在铜丝上H+得电子发生还原反应;b中也构成原电池,铁钉作正极,铝条作负极,所以Al失去电子生成Al3+,在铁钉上H+得电子发生还原反应。
答案:B
9.将等质量的两份锌粉a、b分别加入过量的稀硫酸,同时向a中加少量的CuSO4溶液,如各图中产生H2的体积V(L)与时间t(min)的关系,正确的是( )。
解析:若向a中加入少量的CuSO4溶液,则发生反应:Zn+CuSO4Cu+ZnSO4,消耗一部分Zn,生成的Cu附着于Zn上,构成无数微小的CuZn原电池,加快了Zn的反应速率,所以Zn与稀硫酸反应时,加入CuSO4溶液则反应速率加快,生成H2的量a小于b。
答案:A
10.(1)事实证明,原电池中发生的反应通常是放热反应。利用下列化学反应可以设计成原电池的是 。
A.C(s)+H2O(g)CO(g)+H2(g) ΔH>0
B.NaOH(aq)+HCl(aq)NaCl(aq)+H2O(l) ΔH<0
C.2H2(g)+O2(g)2H2O(l) ΔH<0
D.CaCO3(s)+2HCl(aq)CaCl2(aq)+H2O(l)+CO2(g) ΔH<0
E.CH4(g)+2O2(g)CO2(g)+2H2O(l) ΔH<0
(2)有A、B、C、D四种金属,将A与B用导线连接起来,浸入电解质溶液中,B不易腐蚀。将A、D分别投入等物质的量浓度的盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化,如果把铜浸入C的盐溶液里,有金属C析出。据此判断A、B、C、D的活动性由强到弱的顺序是 。
解析:(1)原电池是自发进行的氧化还原反应,由条件知反应通常是放热反应,A为吸热反应,B、D不是氧化还原反应,选C、E。
(2)本题考查原电池原理的应用。根据原电池原理:活动性不同的金属组成原电池时,活泼金属作负极,失电子,发生氧化反应,较不活泼的金属作正极,据此可以判断金属活动性的强弱。活泼金属作负极,被腐蚀,所以活动性A>B;A、D与等浓度盐酸反应时D比A反应剧烈,说明活动性D>A;铜与B的盐溶液不反应,但铜可置换出C,说明活动性B>C。即活动性由强到弱的顺序为D>A>B>C。
答案:(1)CE
(2)D>A>B>C
11.(创新题)某兴趣小组为了提高电池的效率,设计了下图所示的原电池。
请回答下列问题:
(1)若X是AlCl3溶液,Y是稀硫酸,请你写出电极名称及电极反应式:
Al片( ) ,
Cu片( ) 。
(2)若X是浓硝酸,Y是NaCl溶液,请你写出电极名称及电极反应式:
Al片( ) ,
Cu片( ) 。
解析:(1)若X是AlCl3溶液,Y是稀硫酸,实质是由Al—稀硫酸—Cu组成的原电池,由于Al比Cu活泼,所以Al为负极,失电子,被氧化为Al3+,Cu为正极,溶液中的H+得电子,被还原为H2。
(2)若X是浓硝酸,Y是NaCl溶液,实质是由Al—浓硝酸—Cu组成的原电池,由于Al遇浓硝酸钝化,不能溶解,Al为正极,Cu为负极,失电子,被氧化为Cu2+。
答案:(1)负极 2Al-6e-2Al3+
正极 6H++6e-3H2↑
(2)正极 2N+4H++2e-2NO2↑+2H2O
负极 Cu-2e-Cu2+
12.铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正极、负极,并写出电极反应式。
正极反应 ;
负极反应 。
解析:(1)Fe3+腐蚀铜板的化学方程式为2FeCl3+Cu2FeCl2+CuCl2,然后改为离子方程式。
(2)根据氧化还原反应和原电池的工作原理进行设计,铜作负极,石墨作正极,FeCl3溶液作电解质溶液。
答案:(1)2Fe3++Cu2Fe2++Cu2+
(2)装置图如图所示
正极反应:2Fe3++2e-2Fe2+
负极反应:Cu-2e-Cu2+
1.对于原电池的电极名称,叙述错误的是( )。
A.发生氧化反应的一极为负极
B.正极为电子流入的一极
C.比较不活泼的金属为负极
D.电流流出的一极为正极
答案:C
2.下列装置可以形成原电池的是( )。
答案:A
3.下图是锌、铜和稀硫酸形成的原电池,某实验兴趣小组同学做完实验后,在读书卡片上记录如下:
卡片:No.28 时间:2011.03.20实验后的记录:
①Zn为正极,Cu为负极
②H+向负极移动
③电子流动方向为ZnCu
④Cu极有H2产生
⑤若有1 mol电子流过导线,则产生的H2为0.5 mol
⑥正极反应式:Zn-2e-Zn2+
卡片上的描述合理的是( )。
A.①②③ B.③④⑤
C.①⑤⑥ D.②③④
解析:构成原电池的正极是Cu,负极是Zn,故①错误;电子从负极Zn流出,流向正极Cu,H+向正极移动,在Cu上得电子:2H++2e-H2↑,故②错误,③④正确;此原电池负极上发生的反应是Zn-2e-Zn2+,⑥错误;总反应方程式:Zn+2H+Zn2++H2↑,当有1 mol电子通过时,产生H2为0.5 mol,故⑤正确。
答案:B
4.(2010·新课标全国卷)根据下图,可判断出下列离子方程式中错误的是( )。
A.2Ag(s)+Cd2+(aq)2Ag+(aq)+Cd(s)
B.Co2+(aq)+Cd(s)Co(s)+Cd2+(aq)
C.2Ag+(aq)+Cd(s)2Ag(s)+Cd2+(aq)
D.2Ag+(aq)+Co(s)2Ag(s)+Co2+(aq)
解析:根据原电池知识,金属活动性:负极>正极,可得三种金属的活动性顺序应为:Cd>Co>Ag,则选项中符合此关系的置换反应成立。
答案:A
5.如图所示,X为单质硅,Y为金属铁,a为NaOH溶液,组装成一个原电池,下列说法正确的是( )。
A.X为负极,电极反应为:Si-4e-Si4+
B.X为正极,电极反应为:4H2O+4e-4OH-+2H2↑
C.X为负极,电极反应为:Si+6OH--4e-Si+3H2O
D.Y为负极,电极反应为:Fe-2e-Fe2+
解析:硅、铁、NaOH溶液组成原电池时,Si为负极:Si-4e-+6OH-Si+3H2O;铁为正极:4H2O+4e-4OH-+2H2↑,总反应式:Si+2NaOH+H2ONa2SiO3+2H2↑。
答案:C
6.X、Y、Z、M、N代表五种金属,有以下化学反应:(1)水溶液中X+Y2+X2++Y;(2)Z+2H2O(冷水)Z(OH)2+H2↑;(3)M、N为电极,与N盐溶液组成原电池,电极反应为M-2e-M2+;(4)Y可以溶于稀硫酸中,M不被稀硫酸氧化。则这五种金属的活动性由弱到强的顺序是( )。
A.M
7.按下图装置实验,若x轴表示流出负极的电子的物质的量,则y轴应表示( )。
①c(Ag+) ②c(N) ③a棒的质量 ④b棒的质量
⑤溶液的质量
A.①③ B.③④ C.①②④ D.②
解析:在这个原电池中,负极:Fe-2e-Fe2+,正极:Ag++e-Ag,使b棒增重,溶液中c(N)不变。
答案:D
8.如下图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动),下列叙述正确的是( )。
A.a中铁钉附近呈现红色
B.b中铁钉上发生还原反应
C.a中铜丝上发生氧化反应
D.b中铝条附近有气泡产生
解析:a中构成原电池,铁钉作负极,铜丝作正极,故Fe失去电子生成Fe2+,呈浅绿色,在铜丝上H+得电子发生还原反应;b中也构成原电池,铁钉作正极,铝条作负极,所以Al失去电子生成Al3+,在铁钉上H+得电子发生还原反应。
答案:B
9.将等质量的两份锌粉a、b分别加入过量的稀硫酸,同时向a中加少量的CuSO4溶液,如各图中产生H2的体积V(L)与时间t(min)的关系,正确的是( )。
解析:若向a中加入少量的CuSO4溶液,则发生反应:Zn+CuSO4Cu+ZnSO4,消耗一部分Zn,生成的Cu附着于Zn上,构成无数微小的CuZn原电池,加快了Zn的反应速率,所以Zn与稀硫酸反应时,加入CuSO4溶液则反应速率加快,生成H2的量a小于b。
答案:A
10.(1)事实证明,原电池中发生的反应通常是放热反应。利用下列化学反应可以设计成原电池的是 。
A.C(s)+H2O(g)CO(g)+H2(g) ΔH>0
B.NaOH(aq)+HCl(aq)NaCl(aq)+H2O(l) ΔH<0
C.2H2(g)+O2(g)2H2O(l) ΔH<0
D.CaCO3(s)+2HCl(aq)CaCl2(aq)+H2O(l)+CO2(g) ΔH<0
E.CH4(g)+2O2(g)CO2(g)+2H2O(l) ΔH<0
(2)有A、B、C、D四种金属,将A与B用导线连接起来,浸入电解质溶液中,B不易腐蚀。将A、D分别投入等物质的量浓度的盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化,如果把铜浸入C的盐溶液里,有金属C析出。据此判断A、B、C、D的活动性由强到弱的顺序是 。
解析:(1)原电池是自发进行的氧化还原反应,由条件知反应通常是放热反应,A为吸热反应,B、D不是氧化还原反应,选C、E。
(2)本题考查原电池原理的应用。根据原电池原理:活动性不同的金属组成原电池时,活泼金属作负极,失电子,发生氧化反应,较不活泼的金属作正极,据此可以判断金属活动性的强弱。活泼金属作负极,被腐蚀,所以活动性A>B;A、D与等浓度盐酸反应时D比A反应剧烈,说明活动性D>A;铜与B的盐溶液不反应,但铜可置换出C,说明活动性B>C。即活动性由强到弱的顺序为D>A>B>C。
答案:(1)CE
(2)D>A>B>C
11.(创新题)某兴趣小组为了提高电池的效率,设计了下图所示的原电池。
请回答下列问题:
(1)若X是AlCl3溶液,Y是稀硫酸,请你写出电极名称及电极反应式:
Al片( ) ,
Cu片( ) 。
(2)若X是浓硝酸,Y是NaCl溶液,请你写出电极名称及电极反应式:
Al片( ) ,
Cu片( ) 。
解析:(1)若X是AlCl3溶液,Y是稀硫酸,实质是由Al—稀硫酸—Cu组成的原电池,由于Al比Cu活泼,所以Al为负极,失电子,被氧化为Al3+,Cu为正极,溶液中的H+得电子,被还原为H2。
(2)若X是浓硝酸,Y是NaCl溶液,实质是由Al—浓硝酸—Cu组成的原电池,由于Al遇浓硝酸钝化,不能溶解,Al为正极,Cu为负极,失电子,被氧化为Cu2+。
答案:(1)负极 2Al-6e-2Al3+
正极 6H++6e-3H2↑
(2)正极 2N+4H++2e-2NO2↑+2H2O
负极 Cu-2e-Cu2+
12.铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正极、负极,并写出电极反应式。
正极反应 ;
负极反应 。
解析:(1)Fe3+腐蚀铜板的化学方程式为2FeCl3+Cu2FeCl2+CuCl2,然后改为离子方程式。
(2)根据氧化还原反应和原电池的工作原理进行设计,铜作负极,石墨作正极,FeCl3溶液作电解质溶液。
答案:(1)2Fe3++Cu2Fe2++Cu2+
(2)装置图如图所示
正极反应:2Fe3++2e-2Fe2+
负极反应:Cu-2e-Cu2+
