化学必修Ⅰ人教版硫和氮的氧化物
文档属性
| 名称 | 化学必修Ⅰ人教版硫和氮的氧化物 |

|
|
| 格式 | zip | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-08-13 00:00:00 | ||
图片预览






文档简介
(共24张PPT)
土壤、湖泊酸化
一场酸雨一场祸
森林、草原、农作物被破坏
建筑物、桥梁、工业设备、运输工具、电信电缆加速腐蚀!
对人的健康造成危害
氮的氧化物种类较多,如
N2O、NO、N2O3、NO2、N2O4、N2O5
二、二氧化氮和一氧化氮
探究课题:NO、NO2为什么会造成酸雨?
易溶于水。
1、物理性质
NO:通常状况下,无色无味的气体。密度与空气相近。
一定浓度的NO能使人中毒。
NO2:红棕色,有刺激性气味的有毒气体,密度大于空
气,易液化。
不溶于水 。
现象:无色气体变为红棕色。
2、化学性质
2NO + O2 = 2NO2
常温下NO很容易与空气中的氧气化合,生成NO2。
学生实验:NO2与水的反应
注意:轻轻晃动试管;防止污染。仔细观察现象。
实验:NO2与水的反应
现象:试管内水面上升,水进入试管。水面上方有无色气体。
观察思考:水充满整个试管了吗?
3NO2 + H2O = 2HNO3 + NO
2NO + O2 2NO2
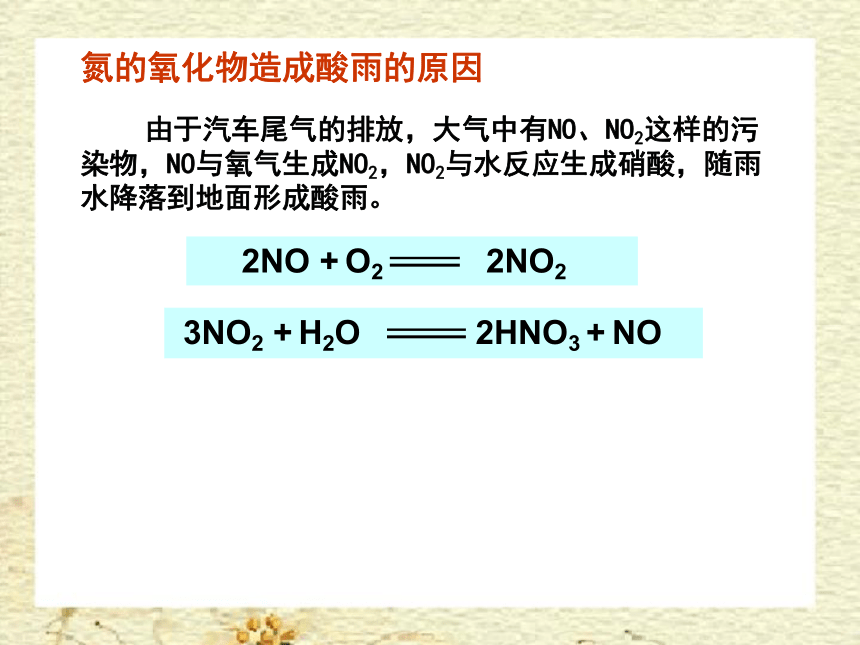
由于汽车尾气的排放,大气中有NO、NO2这样的污染物,NO与氧气生成NO2,NO2与水反应生成硝酸,随雨水降落到地面形成酸雨。
3NO2 + H2O 2HNO3 + NO
氮的氧化物造成酸雨的原因
“明星分子”---NO
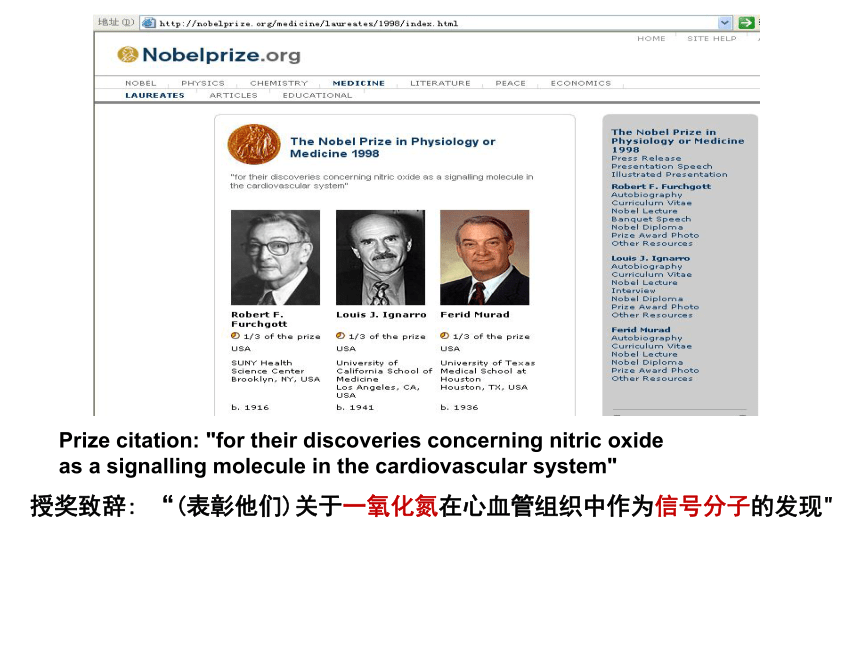
科学家发现NO在生物的生化过程中起着关键作用——它能在细胞之间进行信息的传递,从而调节生物体生理功能,因此NO 被称为生物机体内的重要信使分子。
美国Seience 杂志在1992年评选NO为一个对于科学发展和社会受益有重要影响的“明星分子”,人们还开发出了许多与NO有关的药物,对NO的研究迅速成为当前最活越的生命科学研究热点。美国纽约州立大学药学家法高特 、加州大学洛杉矶分校药学家依拿罗 和德克萨斯大学医学院药学家姆雷德 ,因为发现NO生物信使分子,获得1998年度诺贝尔医学奖。
Prize citation: "for their discoveries concerning nitric oxide as a signalling molecule in the cardiovascular system"
授奖致辞: “(表彰他们)关于一氧化氮在心血管组织中作为信号分子的发现"
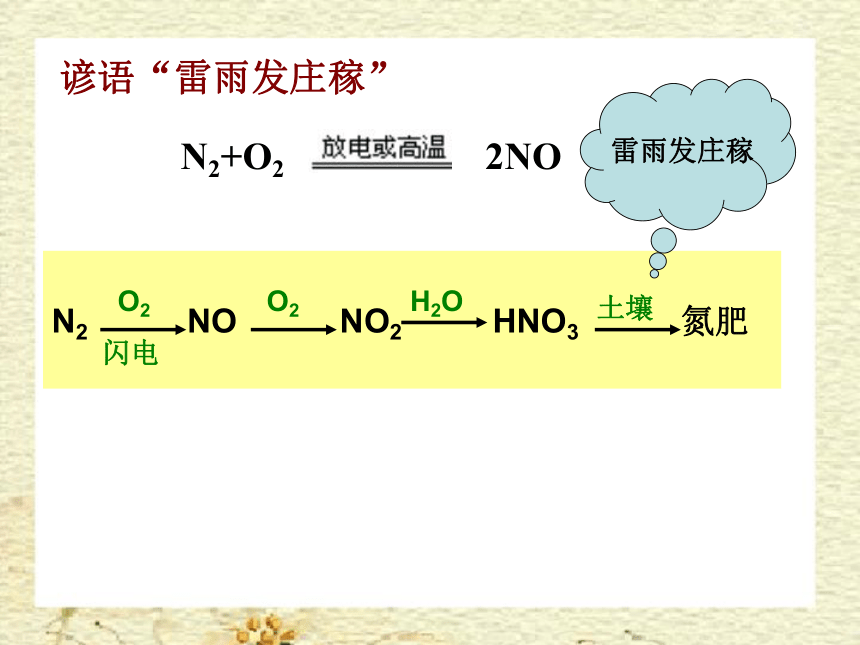
谚语“雷雨发庄稼”
N2+O2 2NO
N2 NO NO2 HNO3 氮肥
土壤
O2
闪电
O2
H2O
雷雨发庄稼
工业制取硝酸:
3NO2 + H2O = 2HNO3 + NO
科学探究
现给你一试管二氧化氮,其他药品和仪器自选
1.请设计实验,要求尽可能多地使二氧化氮被水吸收。
2. 你的设计对工业上生产硝酸有什么启示?(从原料的充分利用、减少污染物的排放等方面考虑。)
实验装置
3NO2 + H2O = 2HNO3 + NO
2NO + O2 = 2 NO2
请你设计实验,要求尽可能地使二氧化氮被水吸收。
实验步骤 现象 解释(可用化学方程式表示)
(1)
(2)
(3)
把充满NO2的试管倒扣于装有水的水槽中。
红棕色气体逐渐变无色,水逐渐上升至试管的2/3处.
3NO2+H2O
2HNO3+NO
制取少量O2
将制得的O2慢慢通入(1)的试管中
2H2O2 2H2O +O2
无色气体变红棕色,再变无色,水上升至充满整个试管.
2NO+O2 2NO2
3NO2+H2O
2HNO3+NO
工业生产硝酸,将尾气(NO)吸收通入适量的氧气后再溶解于水,经过多次循环氧化、溶解,使尾气尽可能地被吸收,既能充分利用原料,提高原料利用率,降低成本,又能减少NO的排放,保护环境,防止污染。
该实验对工业生产的启示:
人们在测定NO2的相对分子质量时发现,无论想什么办法提纯NO2,测定得到的NO2的相对分子质量的数值总是比理论值大。
阅读科学视野:火箭为什么能飞上天?
NO2 可以相互化合成无色的 N2O4
2NO2 N2O4
(红棕色) (无色)
问题:有无纯净的NO2或 N2O4?
思考:
NO一向被视为大气污染物,却在生命过程中以及植物的生长有如此重要的功能;NO2虽然会带来严重的环境问题,但同时也是一种重要的工业原料,这些例子是否能给人们一些启示呢?对此谈谈你的看法。
古老的NO分子具有两重性。对人类有利又有弊。我们在全面认识它的性质以后,要加强对NO的治理,防止它污染空气,并正确地使用,以更有效地发挥它的生物学作用,使小小的NO给人类带来巨大的福音。
小结:
NO NO2
气体生成
N2 + O2 2NO
2NO + O2=2NO2
物理性质 无色气体,不溶于水,密度与空气接近。 红棕色,刺激性气气味的毒气,易液化,易溶于水。
化学性质 2NO + O2=2NO2 3NO2+H2O=2HNO3+ NO
2NO2 N2O4
课堂思考:
1、用双线桥表示反应的电子转移
2、实验室中如何收集NO、NO2气体
3、如何除去NO中的NO2气体?
3NO2 + H2O = 2HNO3 + NO
4、工业生产中利用碱液吸收尾气中的NO、NO2。在实验
室中人们也常用烧碱溶液吸收NO、NO2。
如 2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
亚硝酸钠
NO2 + NO + 2NaOH = 2NaNO2 + H2O
问题1:指出以上反应中的氧化剂、还原剂问题2: NO、NO2是酸性氧化物吗?
课后思考:
1、从理论上分析,要NO2最大限度地被吸收,通入氧气的量有什么要求?
2、查阅资料:大气中的污染物---SO2、氮的氧化物其主要的来源是什么?人们采取什么方法防止污染、治理污染?
美国西海岸的明珠
---洛杉矶
洛杉矶光化学烟雾事件
氮的氧化物种类较多,如N2O、NO、N2O3、NO2、N2O4、N2O5
实验装置
3NO2 + H2O = 2HNO3 + NO
2NO + O2 = 2 NO2
土壤、湖泊酸化
一场酸雨一场祸
森林、草原、农作物被破坏
建筑物、桥梁、工业设备、运输工具、电信电缆加速腐蚀!
对人的健康造成危害
氮的氧化物种类较多,如
N2O、NO、N2O3、NO2、N2O4、N2O5
二、二氧化氮和一氧化氮
探究课题:NO、NO2为什么会造成酸雨?
易溶于水。
1、物理性质
NO:通常状况下,无色无味的气体。密度与空气相近。
一定浓度的NO能使人中毒。
NO2:红棕色,有刺激性气味的有毒气体,密度大于空
气,易液化。
不溶于水 。
现象:无色气体变为红棕色。
2、化学性质
2NO + O2 = 2NO2
常温下NO很容易与空气中的氧气化合,生成NO2。
学生实验:NO2与水的反应
注意:轻轻晃动试管;防止污染。仔细观察现象。
实验:NO2与水的反应
现象:试管内水面上升,水进入试管。水面上方有无色气体。
观察思考:水充满整个试管了吗?
3NO2 + H2O = 2HNO3 + NO
2NO + O2 2NO2
由于汽车尾气的排放,大气中有NO、NO2这样的污染物,NO与氧气生成NO2,NO2与水反应生成硝酸,随雨水降落到地面形成酸雨。
3NO2 + H2O 2HNO3 + NO
氮的氧化物造成酸雨的原因
“明星分子”---NO
科学家发现NO在生物的生化过程中起着关键作用——它能在细胞之间进行信息的传递,从而调节生物体生理功能,因此NO 被称为生物机体内的重要信使分子。
美国Seience 杂志在1992年评选NO为一个对于科学发展和社会受益有重要影响的“明星分子”,人们还开发出了许多与NO有关的药物,对NO的研究迅速成为当前最活越的生命科学研究热点。美国纽约州立大学药学家法高特 、加州大学洛杉矶分校药学家依拿罗 和德克萨斯大学医学院药学家姆雷德 ,因为发现NO生物信使分子,获得1998年度诺贝尔医学奖。
Prize citation: "for their discoveries concerning nitric oxide as a signalling molecule in the cardiovascular system"
授奖致辞: “(表彰他们)关于一氧化氮在心血管组织中作为信号分子的发现"
谚语“雷雨发庄稼”
N2+O2 2NO
N2 NO NO2 HNO3 氮肥
土壤
O2
闪电
O2
H2O
雷雨发庄稼
工业制取硝酸:
3NO2 + H2O = 2HNO3 + NO
科学探究
现给你一试管二氧化氮,其他药品和仪器自选
1.请设计实验,要求尽可能多地使二氧化氮被水吸收。
2. 你的设计对工业上生产硝酸有什么启示?(从原料的充分利用、减少污染物的排放等方面考虑。)
实验装置
3NO2 + H2O = 2HNO3 + NO
2NO + O2 = 2 NO2
请你设计实验,要求尽可能地使二氧化氮被水吸收。
实验步骤 现象 解释(可用化学方程式表示)
(1)
(2)
(3)
把充满NO2的试管倒扣于装有水的水槽中。
红棕色气体逐渐变无色,水逐渐上升至试管的2/3处.
3NO2+H2O
2HNO3+NO
制取少量O2
将制得的O2慢慢通入(1)的试管中
2H2O2 2H2O +O2
无色气体变红棕色,再变无色,水上升至充满整个试管.
2NO+O2 2NO2
3NO2+H2O
2HNO3+NO
工业生产硝酸,将尾气(NO)吸收通入适量的氧气后再溶解于水,经过多次循环氧化、溶解,使尾气尽可能地被吸收,既能充分利用原料,提高原料利用率,降低成本,又能减少NO的排放,保护环境,防止污染。
该实验对工业生产的启示:
人们在测定NO2的相对分子质量时发现,无论想什么办法提纯NO2,测定得到的NO2的相对分子质量的数值总是比理论值大。
阅读科学视野:火箭为什么能飞上天?
NO2 可以相互化合成无色的 N2O4
2NO2 N2O4
(红棕色) (无色)
问题:有无纯净的NO2或 N2O4?
思考:
NO一向被视为大气污染物,却在生命过程中以及植物的生长有如此重要的功能;NO2虽然会带来严重的环境问题,但同时也是一种重要的工业原料,这些例子是否能给人们一些启示呢?对此谈谈你的看法。
古老的NO分子具有两重性。对人类有利又有弊。我们在全面认识它的性质以后,要加强对NO的治理,防止它污染空气,并正确地使用,以更有效地发挥它的生物学作用,使小小的NO给人类带来巨大的福音。
小结:
NO NO2
气体生成
N2 + O2 2NO
2NO + O2=2NO2
物理性质 无色气体,不溶于水,密度与空气接近。 红棕色,刺激性气气味的毒气,易液化,易溶于水。
化学性质 2NO + O2=2NO2 3NO2+H2O=2HNO3+ NO
2NO2 N2O4
课堂思考:
1、用双线桥表示反应的电子转移
2、实验室中如何收集NO、NO2气体
3、如何除去NO中的NO2气体?
3NO2 + H2O = 2HNO3 + NO
4、工业生产中利用碱液吸收尾气中的NO、NO2。在实验
室中人们也常用烧碱溶液吸收NO、NO2。
如 2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
亚硝酸钠
NO2 + NO + 2NaOH = 2NaNO2 + H2O
问题1:指出以上反应中的氧化剂、还原剂问题2: NO、NO2是酸性氧化物吗?
课后思考:
1、从理论上分析,要NO2最大限度地被吸收,通入氧气的量有什么要求?
2、查阅资料:大气中的污染物---SO2、氮的氧化物其主要的来源是什么?人们采取什么方法防止污染、治理污染?
美国西海岸的明珠
---洛杉矶
洛杉矶光化学烟雾事件
氮的氧化物种类较多,如N2O、NO、N2O3、NO2、N2O4、N2O5
实验装置
3NO2 + H2O = 2HNO3 + NO
2NO + O2 = 2 NO2
