1.1 电子云与原子轨道 课件 【新教材】人教版(2019)高中化学选择性必修2
文档属性
| 名称 | 1.1 电子云与原子轨道 课件 【新教材】人教版(2019)高中化学选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-13 16:49:39 | ||
图片预览









文档简介
(共30张PPT)
第一节 原子结构
第四课时 电子云与原子轨道
思考: 宏观物体与微观物体(电子)的运动有什么区别
宏观物体的运动特征:
宏观物体的运动可以准确地测出它们在某一时刻所处的位置及运行的速度;可以描画它们的运动轨迹。
微观物体的运动特征:
核外电子质量小(只有9.11×10-31 kg),运动空间小(相对于宏观物体而言),运动速率大(近光速);无确定的轨道,无法描述其运动轨迹;无法计算电子在某一刻所在的位置,只能指出其在核外空间某处出现的机会的多少(概率)。
1913年,波尔提出氢原子模型,电子在线性轨道上绕核运行
量子力学指出,一定空间运动状态的电子并不在玻尔假定的线性轨道上运行,而在核外空间各处都可能出现,但出现的概率不同,可以算出它们的概率密度分布。
P表示电子在某处出现的概率
V表示该处的体积
概率密度:ρ=
1.概率密度
一、电子云
氢原子的1s电子在原子核外出现的概率分布图
小点是1s电子在原子核外出现外出现的概率密度的形象描述
小点越密,表明概率密度越大
2.电子云--电子在原子核外出现的概率密度分布图
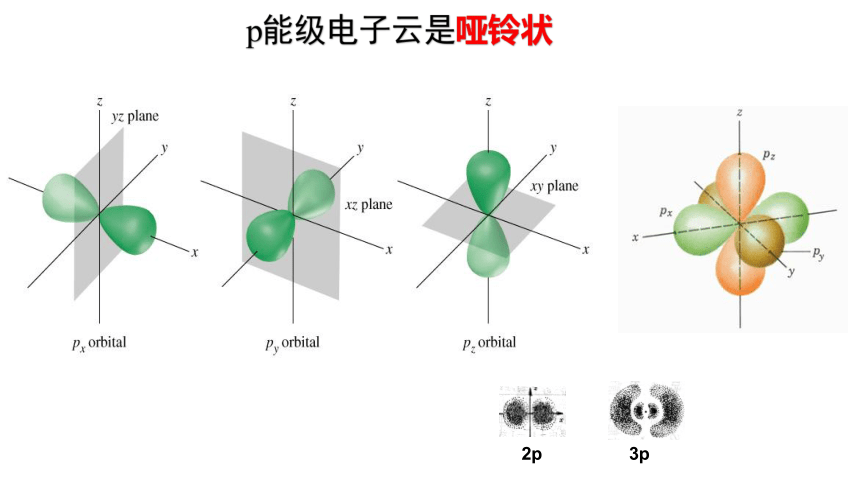
电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述。小黑点越密,表示概率密度越大。由于核外电子的概率密度分布看起来像一片云雾,因而被形象地称为电子云。s电子云为球形,p电子云是哑铃状。
1s电子在原子核外出现的概率密度分布图
由于核外电子的概率密度分布看起来像一片云雾,因而被形象地称为电子云
s电子云呈球形,p电子云呈哑铃形。
对电子云图的说明
(1)电子云图表示电子在核外空间某处出现的概率,不代表电子的运动轨迹。
(2)电子云图中的小黑点是电子在原子核外出现的概率密度的形象描述,小黑点越密,表明电子在核外出现的概率密度越大。
(3)电子云图很难绘制,使用不方便,故常使用电子云轮廓图。
3.电子云轮廓图:
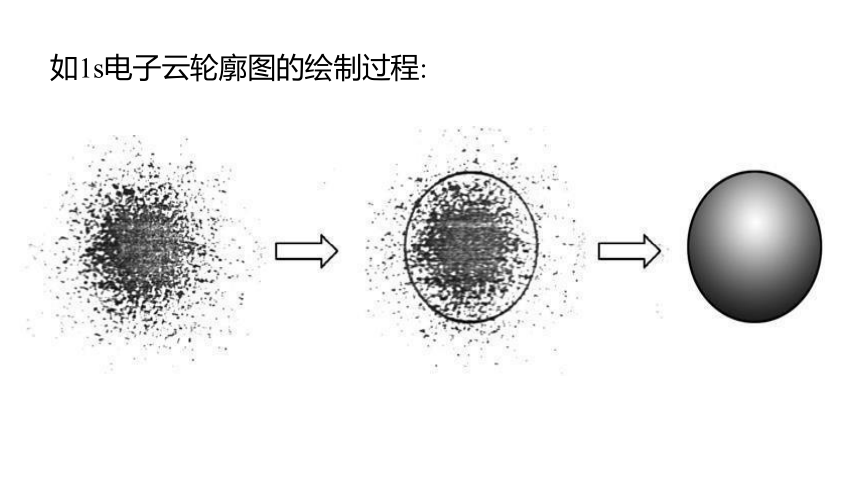
(1)绘制电子云轮廓图的目的:表示电子云轮廓的形状,对核外电子的空间运动状态有一个形象化的简便描述。
常把电子在原子核外空间出现的概率P=90%的空间圈起来,即为电子云轮廓图。
如1s电子云轮廓图的绘制过程:
(2)s电子的电子云轮廓图
所有原子的任一能层的s电子的电子云轮廓图都是球形,只是球的半径不同。同一原子的能层越高,s电子云的半径越大,如下图所示。
图:同一原子的s电子的电子云轮廓图
这是由于1s、2s、3s……电子的能量依次增高,电子在离核更远的区域出现的概率逐渐增大,电子云越来越向更大的空间扩展。
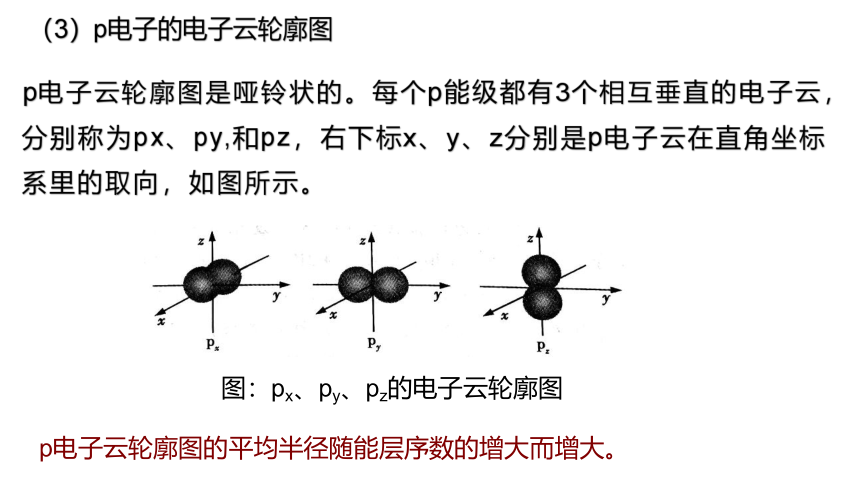
(3)p电子的电子云轮廓图
p电子云轮廓图是哑铃状的。每个p能级都有3个相互垂直的电子云,分别称为px、py,和pz,右下标x、y、z分别是p电子云在直角坐标系里的取向,如图所示。
图:px、py、pz的电子云轮廓图
p电子云轮廓图的平均半径随能层序数的增大而增大。
p能级电子云是哑铃状
2p
3p
二、原子轨道(电子云的轮廓)
量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道。
1.定义:
2.能级与原子轨道数目的关系
能级符号 ns np nd nf
轨道数目 1 3 5 7
各能级的一个伸展方向的电子云轮廓图即表示一个原子轨道
②s能级只有1个原子轨道。p能级有3个原子轨道,它们互相垂直,分别以px、py、pz表示。在同一能层中px、py、pz的能量相同。同一能级中的轨道能量相等,称为简并轨道
③原子轨道数与能层序数(n)的关系:原子轨道数目=n2。
3.原子轨道与能层序数的关系
①不同能层的同种能级的原子轨道形状相同,只是半径不同。
同一原子的能层越高,s电子云半径越大,是由于电子
的能量依次增高,电子在离核更远的区域出现的概率
逐渐增大,电子云越来越向更大的空间扩展。如图所示。
+
现代原子结构模型
原子轨道
能级 s p d f
原子轨道数
1 3 5 7
1s
2s
3s
4s
5s
2p
3p
4p
5p
3d
4d
5d
4f
5f
5g
4.s能级和p能级的原子轨道的对比
能级 s p
轨道图形
轨道形状 球形 哑铃形
轨道数目 1 3(空间相互垂直)
最多容纳电子数 2 6
相同点 ①均以原子核为对称中心 ②原子轨道的平均半径分别随能层数增大而增大,且同种能级符号的原子轨道形状相似 5.不同能层中的原子轨道
能层 能级 原子 轨道数 原子轨道名称 电子云轮廓图 形状 取向
K 1s 1 1s 球形 —
L 2s 1 2s 球形 —
2p 3 2px、2py、2pz 哑铃形 相互垂直
M 3s 1 3s 球形 —
3p 3 3px、3py、3pz 哑铃形 相互垂直
3d 5 …… …… ……
能层 能级 原子 轨道数 原子轨道名称 电子云轮廓图 形状 取向
N 4s 1 4s 球形 —
4p 3 4px、4py、4pz 哑铃形 相互垂直
4d 5 …… …… ……
4f 7 …… …… ……
…… …… …… …… …… ……
思考与讨论
(1)电子云图中的小黑点的含义是什么 小黑点的密度表示什么
提示:小黑点是电子在原子核外出现的概率密度的形象表述。小黑点密度越大,表明电子在核外出现概率密度越大。
(2)电子在原子核外出现的概率有什么规律
提示:离核越近,电子出现的概率越大,电子云越密集。
(3)不同能层的同种能级符号的原子轨道形状是否完全相同
提示:不同能层的同种能级符号的原子轨道形状相似,但不完全相同。只是原子轨道的半径不同,能级序数n越大,电子的能量越大,原子轨道的半径越大。例如1s、2s、3s轨道均为球形,原子轨道半径:r(1s)例1 下列关于电子云的叙述中不正确的是( )
A.电子云是用小黑点的疏密程度来表示电子在核外空间出现概率大小的图形
B.电子云实际上是电子运动形成的类似云一样的图形
C.电子云图说明离核越近,电子出现概率越大;离核越远,电子出现概率越小
D.能级类别不同,电子云的形态也不一样
B
[解析] 电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述,而不是电子的实际运动轨迹。人们常用小黑点的疏密程度来表示电子在原子核外空间出现概率的大小。从电子云图中可以看出,离核越近,电子出现概率越大;离核越远,电子出现概率越小。
例2 如图是s能级和p能级的原子轨道图,下列说法正确的是( )
A.s能级和p能级的原子轨道形状相同
B.每个p能级都有6个原子轨道
C.s能级的原子轨道半径与能层序数有关
D.钠原子的电子在11个原子轨道上高速运动
C
[解析] s轨道为球形,p轨道为哑铃形,A项错误;
每个p能级只有3个原子轨道,B项错误;
能层序数越小,s能级的原子轨道半径越小,C项正确;
钠原子的电子在6个原子轨道上高速运动,D项错误。
[易错警示]
电子云图与电子云轮廓图不是同一个概念,电子云轮廓图实际上是电子云图的大部分区域;电子云轮廓图就是我们通常所说的原子轨道图。
原子轨道
轨道形状
ns能级电子的原子轨道呈球形对称
np能级电子的原子轨道呈纺锤形或 哑铃形
各能级上的原子轨道数目
n s能级上1个轨道
n p能级上3个轨道
n d能级上5个轨道
n f能级上7个轨道
........
能量关系
(1) 同一能层上各原子轨道能量的高低:
ns<np<nd<nf……
(2)形状相同的原子轨道能量的高低:
1s<2s<3s<4s<5s……
(3)同一能层内形状相同而伸展方向不同的原子轨道的能量相等,如npx、npy和npz轨道的能量相等。
原子轨道的特点:
(1)在原子中第n能层,电子占有的轨道数最多为n2。 ( )
(2)同一原子中的npx与npy轨道形状相同,半径相同且在空间相互垂直。( )
(3)电子云图中小黑点密度的大小可表示电子的多少。( )
(4)p轨道呈哑铃形,因此p轨道上的电子运动轨迹呈哑铃形。
( )
1.判断正误(正确的打“√”,错误的打“×”)
√
√
×
×
2.如图是2pz原子轨道电子云形状的示意图,请观察图示并判断下列说法中不正确的是( )
A.2pz轨道上的电子在空间出现的概率分布是z轴对称
B.s电子的电子云形状是球形对称的
C.电子先沿z轴正半轴运动,然后再沿负半轴运动
D.2pz原子轨道形状为哑铃形
解析:电子云是表示电子在一定区域内出现概率大小的图形,它并不是电子运动的实际轨迹,故C错;s轨道是球形对称的,s电子的电子云是球形对称的,故B对;观察该图可知A对;该p轨道为哑铃形,D正确。
C
3.观察氢原子1s电子的电子云示意图,判断下列说法正确的是( )
A.一个小点表示1个自由运动的电子
B.1s原子轨道的电子云形状为圆形
C.电子在1s原子轨道上运动就像地球围绕太阳旋转
D.1s原子轨道电子云小点的疏密表示电子在某一位置出现概率的大小
D
解析:图中的小点不表示电子,只表示电子在此位置出现概率的大小。
4.图1和图2分别是1s电子的概率密度分布图和原子轨道图。下列有关认识正确的是( )
A.图1中的每个小黑点表示1个电子
B.图2表示1s电子只能在球体内出现
C.图2表明1s轨道呈圆形,有无数对称轴
D.图1中小黑点的疏密表示某一时刻电子在核外出现概率的大小
D
解析:图2只是表示电子在该区域出现的概率较大,在此之外也能出现,不过概率很小,B错误;1s轨道在空间呈球形而不是圆形,C错误。
5.下列说法正确的是( )
A.因为p轨道是“8”字形,所以p电子是“8”字形
B.能层数为3时,有3s、3p、3d 9个轨道
C.氢原子中只有1个电子,故氢原子核外只有
1个轨道
D.电子云图即是电子云轮廓图,都是用来形象描述电子运动状态的
B
[解析] p轨道呈哑铃形,是指电子出现概率高的区域,而不是电子的形状,
A项错误;
能层数为3时,有3s、3p、3d 3个能级,共有9个轨道,B项正确;
氢原子中确实只有1个电子,但轨道是人为规定的,可以是空轨道,C项错误。
6.下面是s能级、p能级的原子轨道图,据图回答下列问题:
(1)s能级的原子轨道呈 形,每个s能级有 个原子轨道;p能级中的原子轨道分别相对于x、y、z轴 ,每个p能级有 个原子轨道。
(2)s能级原子轨道、p能级原子轨道的半径与什么因素有关 是什么关系
球
对称
1
3
原子轨道的半径与能层数有关,并随能层数增大而增大
解析:s能级中的原子轨道在三维空间分布的图形为球形,p能级中的原子轨道在空间分布的图形分别相对于x、y、z轴对称;原子轨道的半径与能层数有关,并随能层数增大而增大。
第一节 原子结构
第四课时 电子云与原子轨道
思考: 宏观物体与微观物体(电子)的运动有什么区别
宏观物体的运动特征:
宏观物体的运动可以准确地测出它们在某一时刻所处的位置及运行的速度;可以描画它们的运动轨迹。
微观物体的运动特征:
核外电子质量小(只有9.11×10-31 kg),运动空间小(相对于宏观物体而言),运动速率大(近光速);无确定的轨道,无法描述其运动轨迹;无法计算电子在某一刻所在的位置,只能指出其在核外空间某处出现的机会的多少(概率)。
1913年,波尔提出氢原子模型,电子在线性轨道上绕核运行
量子力学指出,一定空间运动状态的电子并不在玻尔假定的线性轨道上运行,而在核外空间各处都可能出现,但出现的概率不同,可以算出它们的概率密度分布。
P表示电子在某处出现的概率
V表示该处的体积
概率密度:ρ=
1.概率密度
一、电子云
氢原子的1s电子在原子核外出现的概率分布图
小点是1s电子在原子核外出现外出现的概率密度的形象描述
小点越密,表明概率密度越大
2.电子云--电子在原子核外出现的概率密度分布图
电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述。小黑点越密,表示概率密度越大。由于核外电子的概率密度分布看起来像一片云雾,因而被形象地称为电子云。s电子云为球形,p电子云是哑铃状。
1s电子在原子核外出现的概率密度分布图
由于核外电子的概率密度分布看起来像一片云雾,因而被形象地称为电子云
s电子云呈球形,p电子云呈哑铃形。
对电子云图的说明
(1)电子云图表示电子在核外空间某处出现的概率,不代表电子的运动轨迹。
(2)电子云图中的小黑点是电子在原子核外出现的概率密度的形象描述,小黑点越密,表明电子在核外出现的概率密度越大。
(3)电子云图很难绘制,使用不方便,故常使用电子云轮廓图。
3.电子云轮廓图:
(1)绘制电子云轮廓图的目的:表示电子云轮廓的形状,对核外电子的空间运动状态有一个形象化的简便描述。
常把电子在原子核外空间出现的概率P=90%的空间圈起来,即为电子云轮廓图。
如1s电子云轮廓图的绘制过程:
(2)s电子的电子云轮廓图
所有原子的任一能层的s电子的电子云轮廓图都是球形,只是球的半径不同。同一原子的能层越高,s电子云的半径越大,如下图所示。
图:同一原子的s电子的电子云轮廓图
这是由于1s、2s、3s……电子的能量依次增高,电子在离核更远的区域出现的概率逐渐增大,电子云越来越向更大的空间扩展。
(3)p电子的电子云轮廓图
p电子云轮廓图是哑铃状的。每个p能级都有3个相互垂直的电子云,分别称为px、py,和pz,右下标x、y、z分别是p电子云在直角坐标系里的取向,如图所示。
图:px、py、pz的电子云轮廓图
p电子云轮廓图的平均半径随能层序数的增大而增大。
p能级电子云是哑铃状
2p
3p
二、原子轨道(电子云的轮廓)
量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道。
1.定义:
2.能级与原子轨道数目的关系
能级符号 ns np nd nf
轨道数目 1 3 5 7
各能级的一个伸展方向的电子云轮廓图即表示一个原子轨道
②s能级只有1个原子轨道。p能级有3个原子轨道,它们互相垂直,分别以px、py、pz表示。在同一能层中px、py、pz的能量相同。同一能级中的轨道能量相等,称为简并轨道
③原子轨道数与能层序数(n)的关系:原子轨道数目=n2。
3.原子轨道与能层序数的关系
①不同能层的同种能级的原子轨道形状相同,只是半径不同。
同一原子的能层越高,s电子云半径越大,是由于电子
的能量依次增高,电子在离核更远的区域出现的概率
逐渐增大,电子云越来越向更大的空间扩展。如图所示。
+
现代原子结构模型
原子轨道
能级 s p d f
原子轨道数
1 3 5 7
1s
2s
3s
4s
5s
2p
3p
4p
5p
3d
4d
5d
4f
5f
5g
4.s能级和p能级的原子轨道的对比
能级 s p
轨道图形
轨道形状 球形 哑铃形
轨道数目 1 3(空间相互垂直)
最多容纳电子数 2 6
相同点 ①均以原子核为对称中心 ②原子轨道的平均半径分别随能层数增大而增大,且同种能级符号的原子轨道形状相似 5.不同能层中的原子轨道
能层 能级 原子 轨道数 原子轨道名称 电子云轮廓图 形状 取向
K 1s 1 1s 球形 —
L 2s 1 2s 球形 —
2p 3 2px、2py、2pz 哑铃形 相互垂直
M 3s 1 3s 球形 —
3p 3 3px、3py、3pz 哑铃形 相互垂直
3d 5 …… …… ……
能层 能级 原子 轨道数 原子轨道名称 电子云轮廓图 形状 取向
N 4s 1 4s 球形 —
4p 3 4px、4py、4pz 哑铃形 相互垂直
4d 5 …… …… ……
4f 7 …… …… ……
…… …… …… …… …… ……
思考与讨论
(1)电子云图中的小黑点的含义是什么 小黑点的密度表示什么
提示:小黑点是电子在原子核外出现的概率密度的形象表述。小黑点密度越大,表明电子在核外出现概率密度越大。
(2)电子在原子核外出现的概率有什么规律
提示:离核越近,电子出现的概率越大,电子云越密集。
(3)不同能层的同种能级符号的原子轨道形状是否完全相同
提示:不同能层的同种能级符号的原子轨道形状相似,但不完全相同。只是原子轨道的半径不同,能级序数n越大,电子的能量越大,原子轨道的半径越大。例如1s、2s、3s轨道均为球形,原子轨道半径:r(1s)
A.电子云是用小黑点的疏密程度来表示电子在核外空间出现概率大小的图形
B.电子云实际上是电子运动形成的类似云一样的图形
C.电子云图说明离核越近,电子出现概率越大;离核越远,电子出现概率越小
D.能级类别不同,电子云的形态也不一样
B
[解析] 电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述,而不是电子的实际运动轨迹。人们常用小黑点的疏密程度来表示电子在原子核外空间出现概率的大小。从电子云图中可以看出,离核越近,电子出现概率越大;离核越远,电子出现概率越小。
例2 如图是s能级和p能级的原子轨道图,下列说法正确的是( )
A.s能级和p能级的原子轨道形状相同
B.每个p能级都有6个原子轨道
C.s能级的原子轨道半径与能层序数有关
D.钠原子的电子在11个原子轨道上高速运动
C
[解析] s轨道为球形,p轨道为哑铃形,A项错误;
每个p能级只有3个原子轨道,B项错误;
能层序数越小,s能级的原子轨道半径越小,C项正确;
钠原子的电子在6个原子轨道上高速运动,D项错误。
[易错警示]
电子云图与电子云轮廓图不是同一个概念,电子云轮廓图实际上是电子云图的大部分区域;电子云轮廓图就是我们通常所说的原子轨道图。
原子轨道
轨道形状
ns能级电子的原子轨道呈球形对称
np能级电子的原子轨道呈纺锤形或 哑铃形
各能级上的原子轨道数目
n s能级上1个轨道
n p能级上3个轨道
n d能级上5个轨道
n f能级上7个轨道
........
能量关系
(1) 同一能层上各原子轨道能量的高低:
ns<np<nd<nf……
(2)形状相同的原子轨道能量的高低:
1s<2s<3s<4s<5s……
(3)同一能层内形状相同而伸展方向不同的原子轨道的能量相等,如npx、npy和npz轨道的能量相等。
原子轨道的特点:
(1)在原子中第n能层,电子占有的轨道数最多为n2。 ( )
(2)同一原子中的npx与npy轨道形状相同,半径相同且在空间相互垂直。( )
(3)电子云图中小黑点密度的大小可表示电子的多少。( )
(4)p轨道呈哑铃形,因此p轨道上的电子运动轨迹呈哑铃形。
( )
1.判断正误(正确的打“√”,错误的打“×”)
√
√
×
×
2.如图是2pz原子轨道电子云形状的示意图,请观察图示并判断下列说法中不正确的是( )
A.2pz轨道上的电子在空间出现的概率分布是z轴对称
B.s电子的电子云形状是球形对称的
C.电子先沿z轴正半轴运动,然后再沿负半轴运动
D.2pz原子轨道形状为哑铃形
解析:电子云是表示电子在一定区域内出现概率大小的图形,它并不是电子运动的实际轨迹,故C错;s轨道是球形对称的,s电子的电子云是球形对称的,故B对;观察该图可知A对;该p轨道为哑铃形,D正确。
C
3.观察氢原子1s电子的电子云示意图,判断下列说法正确的是( )
A.一个小点表示1个自由运动的电子
B.1s原子轨道的电子云形状为圆形
C.电子在1s原子轨道上运动就像地球围绕太阳旋转
D.1s原子轨道电子云小点的疏密表示电子在某一位置出现概率的大小
D
解析:图中的小点不表示电子,只表示电子在此位置出现概率的大小。
4.图1和图2分别是1s电子的概率密度分布图和原子轨道图。下列有关认识正确的是( )
A.图1中的每个小黑点表示1个电子
B.图2表示1s电子只能在球体内出现
C.图2表明1s轨道呈圆形,有无数对称轴
D.图1中小黑点的疏密表示某一时刻电子在核外出现概率的大小
D
解析:图2只是表示电子在该区域出现的概率较大,在此之外也能出现,不过概率很小,B错误;1s轨道在空间呈球形而不是圆形,C错误。
5.下列说法正确的是( )
A.因为p轨道是“8”字形,所以p电子是“8”字形
B.能层数为3时,有3s、3p、3d 9个轨道
C.氢原子中只有1个电子,故氢原子核外只有
1个轨道
D.电子云图即是电子云轮廓图,都是用来形象描述电子运动状态的
B
[解析] p轨道呈哑铃形,是指电子出现概率高的区域,而不是电子的形状,
A项错误;
能层数为3时,有3s、3p、3d 3个能级,共有9个轨道,B项正确;
氢原子中确实只有1个电子,但轨道是人为规定的,可以是空轨道,C项错误。
6.下面是s能级、p能级的原子轨道图,据图回答下列问题:
(1)s能级的原子轨道呈 形,每个s能级有 个原子轨道;p能级中的原子轨道分别相对于x、y、z轴 ,每个p能级有 个原子轨道。
(2)s能级原子轨道、p能级原子轨道的半径与什么因素有关 是什么关系
球
对称
1
3
原子轨道的半径与能层数有关,并随能层数增大而增大
解析:s能级中的原子轨道在三维空间分布的图形为球形,p能级中的原子轨道在空间分布的图形分别相对于x、y、z轴对称;原子轨道的半径与能层数有关,并随能层数增大而增大。
