1.1.2 构造原理与电子排布式 课件 【新教材】人教版(2019)高中化学选择性必修2
文档属性
| 名称 | 1.1.2 构造原理与电子排布式 课件 【新教材】人教版(2019)高中化学选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-13 16:45:57 | ||
图片预览







文档简介
(共37张PPT)
第一节 原子结构
第三课时 构造原理与电子排布式
三、构造原理与电子排布式
1.构造原理——核外电子的填充规律
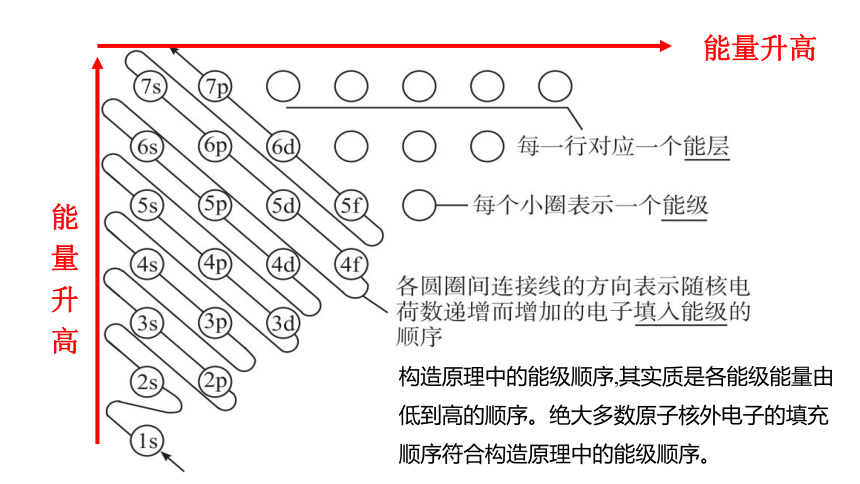
以光谱学事实为基础,从氢开始,随核电荷数递增,新增电子填入能级的顺序称为构造原理。如下图所示:
(1)内容:
(2)构造原理示意图:
构造原理中的能级顺序,其实质是各能级能量由低到高的顺序。绝大多数原子核外电子的填充顺序符合构造原理中的能级顺序。
能量升高
能量升高
7
6
5
4
3
2
1
4f
1s
2s
3s
4s
5s
6s
7s
2p
3p
4p
5p
6p
7p
6d
5d
4d
3d
5f
核
外
电
子
填
充
顺
序
图
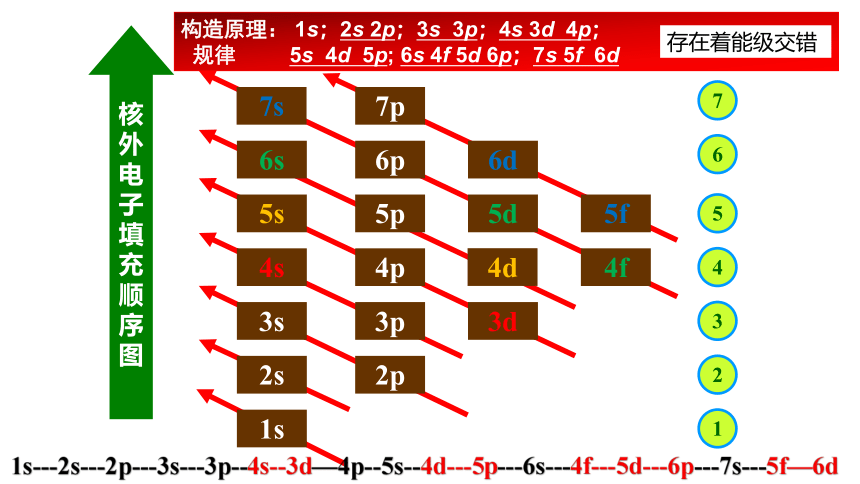
构造原理: 1s;2s 2p;3s 3p;4s 3d 4p;
规律 5s 4d 5p; 6s 4f 5d 6p;7s 5f 6d
存在着能级交错
1s---2s---2p---3s---3p--4s--3d—4p--5s--4d---5p---6s---4f---5d---6p---7s---5f—6d
2.核外电子排布的几种表示方法
(1)电子排布式
①定义:
电子排布式是用核外电子分布的能级及各能级上的电子数来表示电子排布的式子。
②表示方法:
如从氢到碳的基态原子电子排布式如下:
1s1→1s2→1s22s1→1s22s2→1s22s22p1→1s22s22p2
氢 氦 锂 铍 硼 碳
按照构造原理,元素的核电荷数每递增一个,同时增加一个核电荷和一个核外电子,就得到一个基态原子的电子排布。电子填满了一个能级,开始填入下一个能级,由此构建了元素周期系中各元素的基态原子的电子排布。
再如氮、氧、钠、氯的电子排布式分别为
在书写电子排布式时,能层低的能级要写在左边,不能按填充顺序写。
充入电子时按构造原理,而书写时按能层次序!
Fe:
1s
2
2s
2
2p
6
3s
2
3p
6
3d
6
4s
2
1s22s22p3
能级交错
1s22s22p63s23p5
1s22s22p4
1s22s22p63s1
①在书写电子排布式时,一般情况下,能层低的能级要写在左边,而不是按构造原理顺序写。
书写顺序:1s、2s、2p、3s、3p、3d、4s、4p、4d、4f、5s……
电子填充顺序(构造原理):1s、2s、2p、3s、3p、4s、3d、4p、5s……
如:Mg原子的电子排布式为
②由原子光谱得知有些过渡金属元素基态原子电子排布不符合构造原理,如Cr 和Cu的最后两个能级的电子排布分别为3d54s1和3d104s1,可见构造原理是被理想化了的。
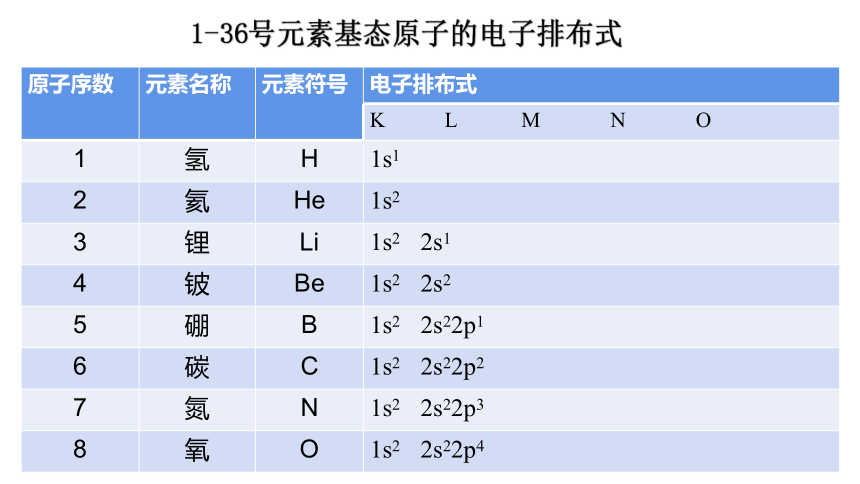
1-36号元素基态原子的电子排布式
原子序数 元素名称 元素符号 电子排布式
K L M N O
1 氢 H 1s1
2 氦 He 1s2
3 锂 Li 1s2 2s1
4 铍 Be 1s2 2s2
5 硼 B 1s2 2s22p1
6 碳 C 1s2 2s22p2
7 氮 N 1s2 2s22p3
8 氧 O 1s2 2s22p4
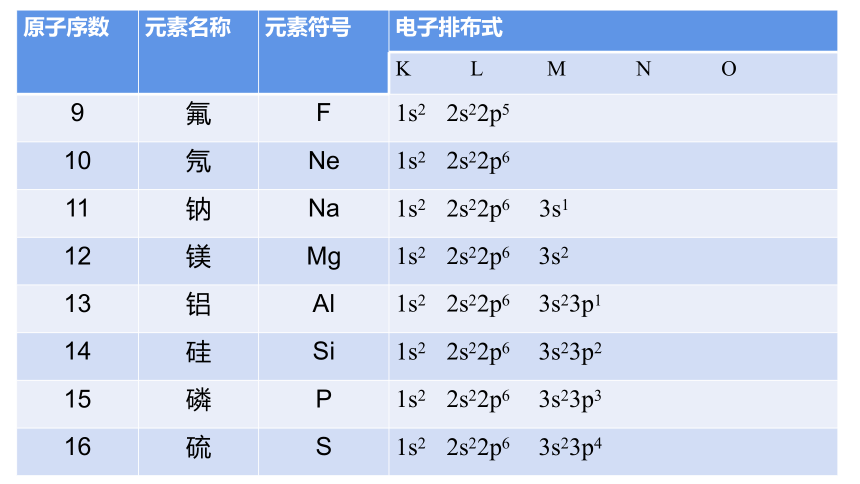
原子序数 元素名称 元素符号 电子排布式
K L M N O
9 氟 F 1s2 2s22p5
10 氖 Ne 1s2 2s22p6
11 钠 Na 1s2 2s22p6 3s1
12 镁 Mg 1s2 2s22p6 3s2
13 铝 Al 1s2 2s22p6 3s23p1
14 硅 Si 1s2 2s22p6 3s23p2
15 磷 P 1s2 2s22p6 3s23p3
16 硫 S 1s2 2s22p6 3s23p4
原子序数 元素名称 元素符号 电子排布式
K L M N O
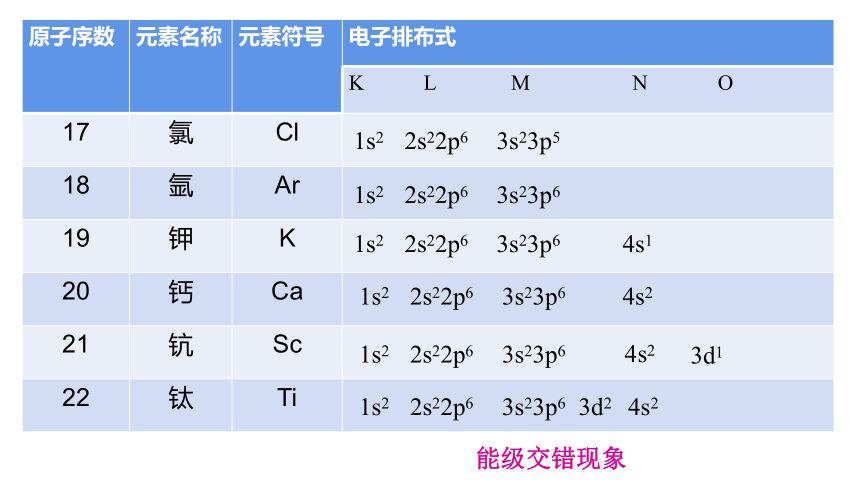
17 氯 Cl
18 氩 Ar
19 钾 K
20 钙 Ca
21 钪 Sc
22 钛 Ti
4s1
4s2
4s2
3d1
1s2 2s22p6 3s23p5
1s2 2s22p6 3s23p6
1s2 2s22p6 3s23p6
1s2 2s22p6 3s23p6
1s2 2s22p6 3s23p6
1s2 2s22p6 3s23p6
3d2 4s2
能级交错现象
构造原理告诉我们,随核电荷数递增,电子并不总是填满一个能层后再开始填入下一个能层,如电子是按3p→4s→3d的顺序而不是按3p→3d→4s的顺序填充的,这种现象被称为能级交错。
能级交错及其原因
①定义 能级交错是指电子层数较大的某些轨道的能量反而低于电子层数较少的某些轨道能量的现象。从第4电子层开始出现此现象。如:E4s构造原理呈现的能级交错源于光谱学事实,即钾和钙的光谱证实它们的最外层电子是4s1和4s2,是经验的,而不是任何理论推导的结果。构造原理是一个思维模型,是个假想过程。
②原因在原子中,除了电子与原子核之间存在相互作用外,电子与电子之间还存在相互排斥作用,这就造成了能级交错现象。电子排布按能级交错顺序书写,如21Sc的电子排布应为
1s2 2s22p6 3s23p6 3d1 4s2。
原子序数 元素名称 元素符号 电子排布式
K L M N O
23 钒 V
24 铬 Cr
25 锰 Mn
26 铁 Fe
27 钴 Co
28 镍 Ni
29 铜 Cu
30 锌 Zn
1s2 2s22p6 3s23p6
3d3 4s2
1s2 2s22p6 3s23p6
3d4 4s2
×
3d5 4s1
1s2 2s22p6 3s23p6
3d5 4s2
1s2 2s22p6 3s23p6
3d6 4s2
1s2 2s22p6 3s23p6
3d7 4s2
1s2 2s22p6 3s23p6
3d8 4s2
1s2 2s22p6 3s23p6
3d9 4s2
×
3d10 4s1
1s2 2s22p6 3s23p6
3d10 4s2
不符合构造原理
构造原理是被理想化的
原子序数 元素名称 元素符号 电子排布式
K L M N O
31 镓 Ga
32 锗 Ge
33 砷 As
34 硒 Se
35 溴 Br
36 氩 Ar
1s2 2s22p6 3s23p6
3d10 4s2
4p1
1s2 2s22p6 3s23p6
3d10 4s2
4p2
1s2 2s22p6 3s23p6
3d10 4s2
4p3
1s2 2s22p6 3s23p6
3d10 4s2
4p4
1s2 2s22p6 3s23p6
3d10 4s2
4p5
1s2 2s22p6 3s23p6
3d10 4s2
4p6
电子排布式书写
“三步法”书写电子排布式
构造原理是书写基态原子电子排布式的依据。第一步:按照构造原理写出电子填入能级的顺序,1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s……第二步:根据各能级容纳的电子数填充电子。第三步:去掉空能级,并按照能层顺序排列即可得到电子排布式。
(1)基态原子的电子排布式是按照构造原理的顺序依次书写的吗
提示:不是。基态原子按照构造原理填充电子,可能存在能级交错;而电子排布式是按照能层由低到高、同一能层按照能级由低到高的顺序书写的。
(2)查阅元素周期表可知Cr的电子排布式为1s22s22p63s23p63d54s1,Cu的电子排布式为1s22s22p63s23p63d104s1。这两种元素的原子核外电子排布不符合构造原理,是根据什么确定其电子排布的
提示:Cr、Cu两种元素基态原子的电子填充顺序与构造原理不符合,这是根据Cr、Cu的原子光谱确定的。
【思考与讨论】
(3)元素周期表中钠的电子排布式写成[Ne]3s1,方括号里的符号是什么意义 模仿写出8号、14号、26号元素的简化电子排布式。
提示:方括号里符号的意义是对应稀有气体元素原子的电子排布结构。8号、14号、26号元素分别为O、Si、Fe,其简化电子排布式分别为:O[He]2s22p4;Si[Ne]3s23p2;Fe[Ar]3d64s2。
(2)简化电子排布式
①定义:为了避免电子排布式过于烦琐,将原子中已经达到稀有气体元素原子结构的部分,用相应的稀有气体元素符号外加方括号表示的式子称为简化电子排布式。
②表示方法:
7N:
[He]2s22p3
1s2 2s22p3
11Na:
1s2 2s22p6 3s1
[Ne]3s1
20Ca:
1s2 2s22p6 3s23p6 4s2
[Ar]4s2
钾的简化电子排布式:___________,铁的简化电子排布式:____________。
[Ar]4s1
[Ar]3d64s2
(3)价层电子排布式
①价电子层的定义:为突出化合价与电子排布的关系,将在化学反应中可能发生电子变动的能级称为价电子层(简称价层)。也叫外围电子层排布。
②价电子的位置:
ⅰ对于主族元素和零族元素来说,价电子就是最外层电子
表示方法:nsx或nsxnpy
例如:Cl的价层电子排布式为3s23p5
ⅱ对于副族和第VIII族元素来说,价电子除最外层电子外,还可能包括次外层电子
表示方法:(n-1)dxnsy 或 ndx (钯4d10) 或 (n-2)fx(n-1)dynsz或(n-2)fxnsy
例如:Cr的价层电子排布式为3d54s1。
通常,元素周期表只给出价层电子排布。
查看元素周期表找出Na、Al、Fe、Mn、Br、Kr价层电子排布式
11Na:3s1
13Al:3s2 3p1
25Mn:3d5 4s2
35Br:4s24p5
26Fe:3d64s2
36Kr:4s24p6
①价电子不一定是最外层电子,只有主族元素的价电子才是最外层电子。对于过渡元素还包括部分内层电子。
②元素的价电子数不一定等于其所在族的族序数,这只对主族元素成立,对部分过渡元素是不成立的。
③同一族元素的价电子排布不一定相同,如过渡元素中的镧系元素和锕系元素就不相同,在第Ⅷ族中部分元素的价电子排布也不相同。
要求熟练书写1~36号元素原子的电子排布式
(4)简单离子电子排布式
先写原子的电子排布式,然后再考虑得失得失电子的情况。
如O2-的电子排布式,先写O原子的电子排布式为1s22s22p4,再得2个电子知O2-的电子排布式为1s22s22p6。
【练习】请写出K+、S2-、 29Cu2+ 离子的电子排布式?
K+ :1s22s22p63s23p6
S2- :1s22s22p63s23p6
Cu2+ :1s22s22p63s23p63d9
规律总结
(1)电子排布式的书写:
①要依据构造原理完成电子填充,按能层序号由低到高书写电子排布式;
②对于原子序数20号以后的元素,要注意能级交错现象;
③要关注原子电子排布式与离子电子排布式的区别。
(2)注意核外电子排布的几个特例:Cr[Ar]3d54s1;Cu[Ar]3d104s1。
提示:能层序数大,但能级的能量不一定高。部分能级有交错现象。K原子在排满第二层后,先排布3s、3p能级,3d能级能量高于4s能级,故最后一个电子排入4s能级而不是3d能级,所以它的原子结构示意图是 。
[思考]
为什么K原子的原子结构示意图不是 ,而是
例5 下列各离子或原子的电子排布式错误的是( )
A.Ca2+:1s22s22p63s23p6 B.O2-:1s22s22p4
C.K:1s22s22p63s23p64s1 D.Fe3+:1s22s22p63s23p63d5
B
[解析] 已知O原子的电子排布式为1s22s22p4,故O2-的电子排布式为1s22s22p6,
B项错误。
例6 构造原理揭示的电子排布能级顺序,实质是各能级能量高低。若以E(nl)表示某能级的能量,以下各式中正确的是( )
A.E(5s)>E(4f)>E(4s)>E(3d)
B.E(3d)>E(4s)>E(3p)>E(3s)
C.E(4s)D.E(5s)>E(4s)>E(4f)>E(3d)
B
[解析] 根据构造原理,各能级填充的电子的能量由小到大的顺序为1s、2s、2p、3s、3p、4s、3d、4p、5s……,A项和D项正确顺序为E(4f)>E(5s)>E(3d)>E(4s);对于不同能层的相同能级,能层序数越大,能量越高,C项错,其正确顺序为E(4s)>E(3s)>E(2s)>E(1s);E(3d)>E(4s)>E(3p)>E(3s)符合构造原理,B项正确。
(2)最外层电子排布式为4s1的元素一定为K。( )
(5)K的电子排布式为1s22s22p63s23p63d1。( )
(4)Mg的简化电子排布式为[Ne]3s2 ( )
(5)原子核外每一能层最多可容纳n2个电子 ( )
1.判断正误(正确的打“√”,错误的打“×”)
×
×
×
√
2.已知某+2价离子的电子排布式为1s22s22p6,该元素在周期表中所属的族是( )
A.ⅡA B.ⅡB C.Ⅷ D.ⅠB
A
解析:某+2价离子的电子排布式为1s22s22p6,该原子的电子排布式为[Ne]3s2,故为ⅡA族,故A正确。
3.下列各原子或离子的电子排布式错误的是( )
A.K+:1s22s22p63s23p6 B.As:1s22s22p63s23p63d104s24p3
C.N3-:1s22s22p6 D.Cr:1s22s22p63s23p63d44s2
D
解析:K元素原子核外有19个电子,失去一个电子生成K+,K+的电子排布式为1s22s22p63s23p6,A不符合题意;
As是33号元素,核外电子排布式为1s22s22p63s23p63d104s24p3,B不符合题意;
N元素原子核外有7个电子,获得3个电子,形成N3-,电子排布式为1s22s22p6,C不符合题意;
Cr元素原子核外电子排布式为1s22s22p63s23p63d54s1,D符合题意。
解析:氟原子2p能级应排5个电子;磷原子的3s能级应排2个电子,3p能级应排3个电子;写电子排布式时,应将同能层的能级移到一起。
D
4.下列基态原子的电子排布式,书写正确的是( )
A.9F:1s22s22p6
B.15P:1s22s22p63s33p2
C.21Sc:1s22s22p63s23p64s23d1
D.35Br:1s22s22p63s23p63d104s24p5
解析:Ca原子核外有20个电子,根据构造原理,其电子排布式为1s22s22p63s23p64s2,A项正确;Mg2+核外有10个电子,根据构造原理,其电子排布式为1s22s22p6,B项正确;F-核外有10个电子,根据构造原理,其电子排布式为1s22s22p6,C项错误;Br原子核外有35个电子,根据构造原理,其电子排布式为1s22s22p63s23p63d104s24p5,D项正确。
C
5.下列基态原子或离子的电子排布式错误的是( )
A.Ca 1s22s22p63s23p64s2
B.Mg2+ 1s22s22p6
C.F- 1s22s22p5
D.Br 1s22s22p63s23p63d104s24p5
解析:同类原子基态比激发态的能量低,A选项错误;1s22s12p1不符合构造原理,该原子处于激发态,B选项错误;原子光谱有发射光谱和吸收光谱两种,电子从激发态跃迁到基态时产生发射光谱,从基态到激发态跃迁时产生吸收光谱,D选项错误。
C
6.下列说法正确的是( )
A.基态原子的能量一定比激发态原子的能量低
B.1s22s12p1表示的是基态原子的电子排布
C.日常生活中我们看到的许多可见光,如霓虹灯光、节日焰火,都与原子核外电子发生跃迁释放能量有关
D.电子仅在激发态跃迁到基态时才会产生原子光谱
解析:根据构造原理填充各能级中的电子,按能层序数从小到大的顺序书写原子的电子排布式。注意从3d能级开始出现“能级交错”现象。
7.写出下列原子的电子排布式:
(1)11Na ; (2)16S ;
(3)34Se ; (4)19K ;
(5)31Ga ; (6)30Zn 。
1s22s22p63s1
1s22s22p63s23p4
1s22s22p63s23p63d104s24p4
1s22s22p63s23p64s1
1s22s22p63s23p63d104s24p1
1s22s22p63s23p63d104s2
8.某元素原子序数为34,则:
(1)此元素原子的电子总数是 ,有 个电子层, 个能级。
(2)它的价电子排布式为 。
解析:原子序数为34的元素,原子的电子总数是34,根据原子的核外电子数,其基态原子的电子排布式为1s22s22p63s23p63d104s24p4,有4个电子层,8个能级;它的价电子排布式为4s24p4。
34
4
8
4s24p4
9.有几种元素的粒子核外电子排布式均为1s22s22p63s23p6,其中:
(1)某电中性粒子一般不和其他元素的原子反应,这种粒子的符号是 。
(2)某粒子的盐溶液能使溴水褪色,并出现浑浊,这种粒子的符号是 。
Ar
解析:(1)符合题述核外电子排布式的电中性粒子,很难发生化学反应的应为稀有气体 Ar;
(2)能使溴水褪色,并出现浑浊,应为还原性较强的 S2-,发生反应 S2-+Br2=S↓+2Br-。
S2-
9.有几种元素的粒子核外电子排布式均为1s22s22p63s23p6,其中:
(3)某粒子氧化性很弱,但得到电子后还原性很强,且这种粒子的原子有一个单电子,这种粒子的符号是 。
(4)某粒子还原性虽弱,但失去电子后氧化性强,且这种粒子的原子得到一个电子即达稳定结构,这种粒子的符号是 。
K+
解析:(3)氧化性很弱,得电子后还原性很强,对应原子有一个单电子,应为 K+;
(4)对应原子得一个电子即达稳定结构,故该粒子应为 Cl-。
Cl-
第一节 原子结构
第三课时 构造原理与电子排布式
三、构造原理与电子排布式
1.构造原理——核外电子的填充规律
以光谱学事实为基础,从氢开始,随核电荷数递增,新增电子填入能级的顺序称为构造原理。如下图所示:
(1)内容:
(2)构造原理示意图:
构造原理中的能级顺序,其实质是各能级能量由低到高的顺序。绝大多数原子核外电子的填充顺序符合构造原理中的能级顺序。
能量升高
能量升高
7
6
5
4
3
2
1
4f
1s
2s
3s
4s
5s
6s
7s
2p
3p
4p
5p
6p
7p
6d
5d
4d
3d
5f
核
外
电
子
填
充
顺
序
图
构造原理: 1s;2s 2p;3s 3p;4s 3d 4p;
规律 5s 4d 5p; 6s 4f 5d 6p;7s 5f 6d
存在着能级交错
1s---2s---2p---3s---3p--4s--3d—4p--5s--4d---5p---6s---4f---5d---6p---7s---5f—6d
2.核外电子排布的几种表示方法
(1)电子排布式
①定义:
电子排布式是用核外电子分布的能级及各能级上的电子数来表示电子排布的式子。
②表示方法:
如从氢到碳的基态原子电子排布式如下:
1s1→1s2→1s22s1→1s22s2→1s22s22p1→1s22s22p2
氢 氦 锂 铍 硼 碳
按照构造原理,元素的核电荷数每递增一个,同时增加一个核电荷和一个核外电子,就得到一个基态原子的电子排布。电子填满了一个能级,开始填入下一个能级,由此构建了元素周期系中各元素的基态原子的电子排布。
再如氮、氧、钠、氯的电子排布式分别为
在书写电子排布式时,能层低的能级要写在左边,不能按填充顺序写。
充入电子时按构造原理,而书写时按能层次序!
Fe:
1s
2
2s
2
2p
6
3s
2
3p
6
3d
6
4s
2
1s22s22p3
能级交错
1s22s22p63s23p5
1s22s22p4
1s22s22p63s1
①在书写电子排布式时,一般情况下,能层低的能级要写在左边,而不是按构造原理顺序写。
书写顺序:1s、2s、2p、3s、3p、3d、4s、4p、4d、4f、5s……
电子填充顺序(构造原理):1s、2s、2p、3s、3p、4s、3d、4p、5s……
如:Mg原子的电子排布式为
②由原子光谱得知有些过渡金属元素基态原子电子排布不符合构造原理,如Cr 和Cu的最后两个能级的电子排布分别为3d54s1和3d104s1,可见构造原理是被理想化了的。
1-36号元素基态原子的电子排布式
原子序数 元素名称 元素符号 电子排布式
K L M N O
1 氢 H 1s1
2 氦 He 1s2
3 锂 Li 1s2 2s1
4 铍 Be 1s2 2s2
5 硼 B 1s2 2s22p1
6 碳 C 1s2 2s22p2
7 氮 N 1s2 2s22p3
8 氧 O 1s2 2s22p4
原子序数 元素名称 元素符号 电子排布式
K L M N O
9 氟 F 1s2 2s22p5
10 氖 Ne 1s2 2s22p6
11 钠 Na 1s2 2s22p6 3s1
12 镁 Mg 1s2 2s22p6 3s2
13 铝 Al 1s2 2s22p6 3s23p1
14 硅 Si 1s2 2s22p6 3s23p2
15 磷 P 1s2 2s22p6 3s23p3
16 硫 S 1s2 2s22p6 3s23p4
原子序数 元素名称 元素符号 电子排布式
K L M N O
17 氯 Cl
18 氩 Ar
19 钾 K
20 钙 Ca
21 钪 Sc
22 钛 Ti
4s1
4s2
4s2
3d1
1s2 2s22p6 3s23p5
1s2 2s22p6 3s23p6
1s2 2s22p6 3s23p6
1s2 2s22p6 3s23p6
1s2 2s22p6 3s23p6
1s2 2s22p6 3s23p6
3d2 4s2
能级交错现象
构造原理告诉我们,随核电荷数递增,电子并不总是填满一个能层后再开始填入下一个能层,如电子是按3p→4s→3d的顺序而不是按3p→3d→4s的顺序填充的,这种现象被称为能级交错。
能级交错及其原因
①定义 能级交错是指电子层数较大的某些轨道的能量反而低于电子层数较少的某些轨道能量的现象。从第4电子层开始出现此现象。如:E4s
②原因在原子中,除了电子与原子核之间存在相互作用外,电子与电子之间还存在相互排斥作用,这就造成了能级交错现象。电子排布按能级交错顺序书写,如21Sc的电子排布应为
1s2 2s22p6 3s23p6 3d1 4s2。
原子序数 元素名称 元素符号 电子排布式
K L M N O
23 钒 V
24 铬 Cr
25 锰 Mn
26 铁 Fe
27 钴 Co
28 镍 Ni
29 铜 Cu
30 锌 Zn
1s2 2s22p6 3s23p6
3d3 4s2
1s2 2s22p6 3s23p6
3d4 4s2
×
3d5 4s1
1s2 2s22p6 3s23p6
3d5 4s2
1s2 2s22p6 3s23p6
3d6 4s2
1s2 2s22p6 3s23p6
3d7 4s2
1s2 2s22p6 3s23p6
3d8 4s2
1s2 2s22p6 3s23p6
3d9 4s2
×
3d10 4s1
1s2 2s22p6 3s23p6
3d10 4s2
不符合构造原理
构造原理是被理想化的
原子序数 元素名称 元素符号 电子排布式
K L M N O
31 镓 Ga
32 锗 Ge
33 砷 As
34 硒 Se
35 溴 Br
36 氩 Ar
1s2 2s22p6 3s23p6
3d10 4s2
4p1
1s2 2s22p6 3s23p6
3d10 4s2
4p2
1s2 2s22p6 3s23p6
3d10 4s2
4p3
1s2 2s22p6 3s23p6
3d10 4s2
4p4
1s2 2s22p6 3s23p6
3d10 4s2
4p5
1s2 2s22p6 3s23p6
3d10 4s2
4p6
电子排布式书写
“三步法”书写电子排布式
构造原理是书写基态原子电子排布式的依据。第一步:按照构造原理写出电子填入能级的顺序,1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s……第二步:根据各能级容纳的电子数填充电子。第三步:去掉空能级,并按照能层顺序排列即可得到电子排布式。
(1)基态原子的电子排布式是按照构造原理的顺序依次书写的吗
提示:不是。基态原子按照构造原理填充电子,可能存在能级交错;而电子排布式是按照能层由低到高、同一能层按照能级由低到高的顺序书写的。
(2)查阅元素周期表可知Cr的电子排布式为1s22s22p63s23p63d54s1,Cu的电子排布式为1s22s22p63s23p63d104s1。这两种元素的原子核外电子排布不符合构造原理,是根据什么确定其电子排布的
提示:Cr、Cu两种元素基态原子的电子填充顺序与构造原理不符合,这是根据Cr、Cu的原子光谱确定的。
【思考与讨论】
(3)元素周期表中钠的电子排布式写成[Ne]3s1,方括号里的符号是什么意义 模仿写出8号、14号、26号元素的简化电子排布式。
提示:方括号里符号的意义是对应稀有气体元素原子的电子排布结构。8号、14号、26号元素分别为O、Si、Fe,其简化电子排布式分别为:O[He]2s22p4;Si[Ne]3s23p2;Fe[Ar]3d64s2。
(2)简化电子排布式
①定义:为了避免电子排布式过于烦琐,将原子中已经达到稀有气体元素原子结构的部分,用相应的稀有气体元素符号外加方括号表示的式子称为简化电子排布式。
②表示方法:
7N:
[He]2s22p3
1s2 2s22p3
11Na:
1s2 2s22p6 3s1
[Ne]3s1
20Ca:
1s2 2s22p6 3s23p6 4s2
[Ar]4s2
钾的简化电子排布式:___________,铁的简化电子排布式:____________。
[Ar]4s1
[Ar]3d64s2
(3)价层电子排布式
①价电子层的定义:为突出化合价与电子排布的关系,将在化学反应中可能发生电子变动的能级称为价电子层(简称价层)。也叫外围电子层排布。
②价电子的位置:
ⅰ对于主族元素和零族元素来说,价电子就是最外层电子
表示方法:nsx或nsxnpy
例如:Cl的价层电子排布式为3s23p5
ⅱ对于副族和第VIII族元素来说,价电子除最外层电子外,还可能包括次外层电子
表示方法:(n-1)dxnsy 或 ndx (钯4d10) 或 (n-2)fx(n-1)dynsz或(n-2)fxnsy
例如:Cr的价层电子排布式为3d54s1。
通常,元素周期表只给出价层电子排布。
查看元素周期表找出Na、Al、Fe、Mn、Br、Kr价层电子排布式
11Na:3s1
13Al:3s2 3p1
25Mn:3d5 4s2
35Br:4s24p5
26Fe:3d64s2
36Kr:4s24p6
①价电子不一定是最外层电子,只有主族元素的价电子才是最外层电子。对于过渡元素还包括部分内层电子。
②元素的价电子数不一定等于其所在族的族序数,这只对主族元素成立,对部分过渡元素是不成立的。
③同一族元素的价电子排布不一定相同,如过渡元素中的镧系元素和锕系元素就不相同,在第Ⅷ族中部分元素的价电子排布也不相同。
要求熟练书写1~36号元素原子的电子排布式
(4)简单离子电子排布式
先写原子的电子排布式,然后再考虑得失得失电子的情况。
如O2-的电子排布式,先写O原子的电子排布式为1s22s22p4,再得2个电子知O2-的电子排布式为1s22s22p6。
【练习】请写出K+、S2-、 29Cu2+ 离子的电子排布式?
K+ :1s22s22p63s23p6
S2- :1s22s22p63s23p6
Cu2+ :1s22s22p63s23p63d9
规律总结
(1)电子排布式的书写:
①要依据构造原理完成电子填充,按能层序号由低到高书写电子排布式;
②对于原子序数20号以后的元素,要注意能级交错现象;
③要关注原子电子排布式与离子电子排布式的区别。
(2)注意核外电子排布的几个特例:Cr[Ar]3d54s1;Cu[Ar]3d104s1。
提示:能层序数大,但能级的能量不一定高。部分能级有交错现象。K原子在排满第二层后,先排布3s、3p能级,3d能级能量高于4s能级,故最后一个电子排入4s能级而不是3d能级,所以它的原子结构示意图是 。
[思考]
为什么K原子的原子结构示意图不是 ,而是
例5 下列各离子或原子的电子排布式错误的是( )
A.Ca2+:1s22s22p63s23p6 B.O2-:1s22s22p4
C.K:1s22s22p63s23p64s1 D.Fe3+:1s22s22p63s23p63d5
B
[解析] 已知O原子的电子排布式为1s22s22p4,故O2-的电子排布式为1s22s22p6,
B项错误。
例6 构造原理揭示的电子排布能级顺序,实质是各能级能量高低。若以E(nl)表示某能级的能量,以下各式中正确的是( )
A.E(5s)>E(4f)>E(4s)>E(3d)
B.E(3d)>E(4s)>E(3p)>E(3s)
C.E(4s)
B
[解析] 根据构造原理,各能级填充的电子的能量由小到大的顺序为1s、2s、2p、3s、3p、4s、3d、4p、5s……,A项和D项正确顺序为E(4f)>E(5s)>E(3d)>E(4s);对于不同能层的相同能级,能层序数越大,能量越高,C项错,其正确顺序为E(4s)>E(3s)>E(2s)>E(1s);E(3d)>E(4s)>E(3p)>E(3s)符合构造原理,B项正确。
(2)最外层电子排布式为4s1的元素一定为K。( )
(5)K的电子排布式为1s22s22p63s23p63d1。( )
(4)Mg的简化电子排布式为[Ne]3s2 ( )
(5)原子核外每一能层最多可容纳n2个电子 ( )
1.判断正误(正确的打“√”,错误的打“×”)
×
×
×
√
2.已知某+2价离子的电子排布式为1s22s22p6,该元素在周期表中所属的族是( )
A.ⅡA B.ⅡB C.Ⅷ D.ⅠB
A
解析:某+2价离子的电子排布式为1s22s22p6,该原子的电子排布式为[Ne]3s2,故为ⅡA族,故A正确。
3.下列各原子或离子的电子排布式错误的是( )
A.K+:1s22s22p63s23p6 B.As:1s22s22p63s23p63d104s24p3
C.N3-:1s22s22p6 D.Cr:1s22s22p63s23p63d44s2
D
解析:K元素原子核外有19个电子,失去一个电子生成K+,K+的电子排布式为1s22s22p63s23p6,A不符合题意;
As是33号元素,核外电子排布式为1s22s22p63s23p63d104s24p3,B不符合题意;
N元素原子核外有7个电子,获得3个电子,形成N3-,电子排布式为1s22s22p6,C不符合题意;
Cr元素原子核外电子排布式为1s22s22p63s23p63d54s1,D符合题意。
解析:氟原子2p能级应排5个电子;磷原子的3s能级应排2个电子,3p能级应排3个电子;写电子排布式时,应将同能层的能级移到一起。
D
4.下列基态原子的电子排布式,书写正确的是( )
A.9F:1s22s22p6
B.15P:1s22s22p63s33p2
C.21Sc:1s22s22p63s23p64s23d1
D.35Br:1s22s22p63s23p63d104s24p5
解析:Ca原子核外有20个电子,根据构造原理,其电子排布式为1s22s22p63s23p64s2,A项正确;Mg2+核外有10个电子,根据构造原理,其电子排布式为1s22s22p6,B项正确;F-核外有10个电子,根据构造原理,其电子排布式为1s22s22p6,C项错误;Br原子核外有35个电子,根据构造原理,其电子排布式为1s22s22p63s23p63d104s24p5,D项正确。
C
5.下列基态原子或离子的电子排布式错误的是( )
A.Ca 1s22s22p63s23p64s2
B.Mg2+ 1s22s22p6
C.F- 1s22s22p5
D.Br 1s22s22p63s23p63d104s24p5
解析:同类原子基态比激发态的能量低,A选项错误;1s22s12p1不符合构造原理,该原子处于激发态,B选项错误;原子光谱有发射光谱和吸收光谱两种,电子从激发态跃迁到基态时产生发射光谱,从基态到激发态跃迁时产生吸收光谱,D选项错误。
C
6.下列说法正确的是( )
A.基态原子的能量一定比激发态原子的能量低
B.1s22s12p1表示的是基态原子的电子排布
C.日常生活中我们看到的许多可见光,如霓虹灯光、节日焰火,都与原子核外电子发生跃迁释放能量有关
D.电子仅在激发态跃迁到基态时才会产生原子光谱
解析:根据构造原理填充各能级中的电子,按能层序数从小到大的顺序书写原子的电子排布式。注意从3d能级开始出现“能级交错”现象。
7.写出下列原子的电子排布式:
(1)11Na ; (2)16S ;
(3)34Se ; (4)19K ;
(5)31Ga ; (6)30Zn 。
1s22s22p63s1
1s22s22p63s23p4
1s22s22p63s23p63d104s24p4
1s22s22p63s23p64s1
1s22s22p63s23p63d104s24p1
1s22s22p63s23p63d104s2
8.某元素原子序数为34,则:
(1)此元素原子的电子总数是 ,有 个电子层, 个能级。
(2)它的价电子排布式为 。
解析:原子序数为34的元素,原子的电子总数是34,根据原子的核外电子数,其基态原子的电子排布式为1s22s22p63s23p63d104s24p4,有4个电子层,8个能级;它的价电子排布式为4s24p4。
34
4
8
4s24p4
9.有几种元素的粒子核外电子排布式均为1s22s22p63s23p6,其中:
(1)某电中性粒子一般不和其他元素的原子反应,这种粒子的符号是 。
(2)某粒子的盐溶液能使溴水褪色,并出现浑浊,这种粒子的符号是 。
Ar
解析:(1)符合题述核外电子排布式的电中性粒子,很难发生化学反应的应为稀有气体 Ar;
(2)能使溴水褪色,并出现浑浊,应为还原性较强的 S2-,发生反应 S2-+Br2=S↓+2Br-。
S2-
9.有几种元素的粒子核外电子排布式均为1s22s22p63s23p6,其中:
(3)某粒子氧化性很弱,但得到电子后还原性很强,且这种粒子的原子有一个单电子,这种粒子的符号是 。
(4)某粒子还原性虽弱,但失去电子后氧化性强,且这种粒子的原子得到一个电子即达稳定结构,这种粒子的符号是 。
K+
解析:(3)氧化性很弱,得电子后还原性很强,对应原子有一个单电子,应为 K+;
(4)对应原子得一个电子即达稳定结构,故该粒子应为 Cl-。
Cl-
