2.3 共价键的极性 课件 【新教材】人教版(2019)高中化学选择性必修2
文档属性
| 名称 | 2.3 共价键的极性 课件 【新教材】人教版(2019)高中化学选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 942.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-13 16:58:40 | ||
图片预览










文档简介
(共42张PPT)
第二章 分子结构与性质
第三节 分子结构与物质的性质
第一课时 共价键的极性
1.共价键的分类
共价键
极性共价键
非极性共价键
由不同原子形成的共价键,电子对会发生偏移
由相同原子形成的共价键,电子对不发生偏移
H—Cl
δ+
δ-
氯化氢分子中的极性共价键
一、共价键的极性
共价键 分类 极性共价键 非极性共价键
成键原子 不同元素的原子 同种元素的原子
共用电子对 发生偏移 不发生偏移
成键原子 的电性 电负性较小的原子呈正电性(δ+), 电负性较大的原子呈负电性(δ-) 电中性
2.键的极性——极性键与非极性键
3.键的极性的判断方法
键的极性只取决于成键原子的元素种类或电负性的差异,与其他因素无关。
根据共用电子对是否偏移,共价键有极性键、非极性键之分。
分子的极性又是根据什么来判定呢?
以共价键结合的分子是否也有极性分子、非极性分子之分呢?
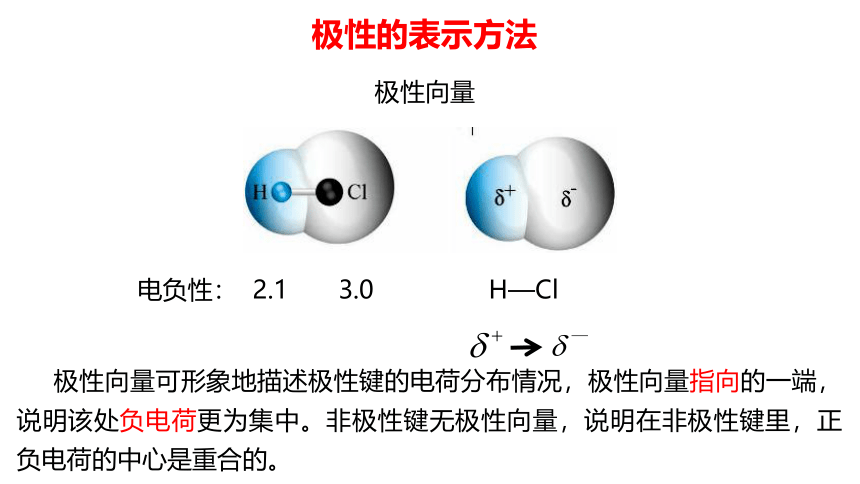
极性向量
极性的表示方法
电负性: 2.1 3.0
H—Cl
极性向量可形象地描述极性键的电荷分布情况,极性向量指向的一端,说明该处负电荷更为集中。非极性键无极性向量,说明在非极性键里,正负电荷的中心是重合的。
1.非极性分子
电荷分布均匀、对称的分子
或者:正电荷中心与负电荷中心重合,即键的极性的向量和为0
2.极性分子
电荷分布不均匀、不对称的分子
或者:正电荷中心与负电荷中心不重合,即键的极性的向量和不为0
要对分子极性进行判断,也可用极性向量。极性向量的矢量和指向的一端,说明该处负电荷更为集中,为极性分子。若矢量和为零,为非极性分子。
二、分子的极性
3.分子的极性判断方法
(1)单原子分子
(稀有气体)——非极性分子
(2)双原子分子
化合物——极性分子
单 质——非极性分子
取决于原子间的共价键是否有极性
H
Cl
共用电子对
H
Cl
HCl 分子中,共用电子对偏向Cl原子,为极性键
∴ Cl原子一端相对地显负电性,H原子一端相对地显正电性,极性向量矢量和指向Cl原子,使整个分子的电荷分布不均匀
∴ HCl 为极性分子
δ+
δ-
以极性键结合的双原子分子为极性分子
共用电子对
Cl2 分子中,共用电子对不偏向,为非极性键
极性向量矢量和为零,电荷分布均匀,为非极性分子
以非极性键结合的双原子分子均为非极性分子
Cl
Cl
Cl
Cl
(3)多原子分子(ABn型)
取决于分子的空间构型——?
ABn分子极性的判断方法
①物理模型法(从力的角度分析)
在ABn分子中,A-B键看作相互作用力,根据中心原子A所受合力是否为零来判断,F合=0,为非极性分子(极性抵消),F合≠0,为极性分子(极性不抵消)
C=O键是极性键,CO2是直线形、对称分子,两个C=O的极性互相抵消
( F合=0),∴整个分子没有极性,电荷分布均匀,是非极性分子
180
F1
F2
F合=0
O
O
C
H
O
H
105
F1
F2
F合≠0
O-H键是极性键,分子是V线
不对称分子,两个O-H键的极性不能抵消( F合≠0),∴整个分子电荷分布不均匀,是极性分子
H
H
H
N
BF3:
NH3:
120
107
三角锥形, 不对称分子,键的极性不能抵消,是极性分子
F1
F2
F3
F’
平面三角形,对称分子,键的极性互相抵消( F合=0) ,是非极性分子
C
H
H
H
H
109 28'
正四面体形 ,对称分子,C-H键的极性互相抵消( F合=0) ,是非极性分子
②化合价法
ABn型分子中
中心原子化合价的绝对值
该元素的价电子数
≠
该分子为极性分子
分子的空间结构不中心对称
V形
三角锥形
四面体
……
②化合价法
ABn型分子中
中心原子化合价的绝对值
该元素的价电子数
=
该分子为非极性分子
分子的空间结构中心对称
直线形
平面正三角形
正四面体
……
分子 BF3 CO2 PCl5 SO3 H2O NH3 SO2
化合价绝对值
价电子数
分子极性
3
3
4
4
5
5
6
6
2
6
3
5
4
6
非极性
非极性
非极性
非极性
极性
极性
极性
③根据所含共价键的类型及分子的空间结构判断
分子类型 键的极性 分子空间结构 分子极性 代表物
双原子 分子 A2 非极性键 直线形(对称) 非极性 H2、O2、
Cl2、N2等
AB 极性键 直线形(不对称) 极性 HF、HCl、CO、NO等
三原子 分子 A2B(或 AB2) 极性键 直线形(对称) 非极性 CO2、CS2
等(键角180°)
极性键 V形(不对称) 极性 H2O(键角105°)等
分子类型 键的极性 分子空间结构 分子极性 代表物
四原子 分子 AB3 极性键 平面三角 形(对称) 非极性 BF3、BCl3等
极性键 三角锥形 (不对称) 极性 NH3(键角107°)等
五原子 分子 AB4 极性键 正四面体 形(对称) 非极性 CH4、CCl4(键角
109°28')等
ABnC4-n (n<4且为整数) 极性键 四面体形 (不对称) 极性 CHCl3、CH2Cl2等
规律总结
从以下两方面判断分子的极性:
三、键的极性与分子极性的关系
①只含非极性键的分子一定是非极性分子。②含有极性键的分子,如果分子中各个键的极性的向量和等于零,则为非极性分子,否则为极性分子。③极性分子中一定有极性键,非极性分子中不一定含有非极性键。例如CH4是非极性分子,只含有极性键。含有非极性键的分子不一定为非极性分子,如H2O2是含有非极性键的极性分子。
小结
以极性键结合的多原子分子,判断分子的极性,一定要结合分子的立体构型来看。
方法:对于ABn型分子,
当其空间构型是高度对称的结构时,分子的正负电荷中心能够重合,故为非极性分子(如CO2、BF3、CH4等等);
当分子的空间构型不是高度对称结构,例如只有对称轴而无对称中心时,为极性分子(如H2O、SO2、NH3等等)。
A、都是由非极性键构成的分子一般是非极性分子。
B、极性键形成的双原子分子一定为极性分子。
C、极性键形成的多原子分子,可能为 非极性分子,也可能为极性分子。
D、多原子分子的极性,应有键的极性和分子的空间构型共同来决定。
共价键
极性键
非极性键
空间不对称
极性分子
双原子分子:HCl、NO、CO
V型分子:H2O、H2S、SO2
三角锥形分子:NH3、PH3
非正四面体:CHCl3
特别地:H2O2、O3
非极性分子
单质分子:Cl2、N2、P4、O2
直线形分子:CO2、CS2、C2H2
正三角形:SO3、BF3
平面形:苯、乙烯
正四面体:CH4、CCl4、SiF4
空间对称
1.已知H2O2分子的空间结构可在二面角中表示,如图所示:
(1)分析H2O2分子中共价键的种类有哪些
提示:H2O2分子中H—O键为极性共价键,O—O键为非极性共价键。
(2)H2O2分子中正电中心和负电中心是否重合 H2O2属于极性分子还是非极性分子
提示:不重合。H2O2属于极性分子。
思考与讨论
2.从哪些方面可以判断键的极性
提示:可从组成元素、电子对偏移、成键原子电负性大小等方面进行判断。
3.如何根据多原子分子的组成及空间结构确定分子的极性
提示:多原子分子,如果为单质,则一般为非极性分子;如果为化合物,则看分子的空间结构,若空间结构对称则为非极性分子,若空间结构不对称则为极性分子。
资料卡片
是一种重要物质。大气高空的臭氧层;
保护了地球生物的生存;空气质量预报中臭氧含量是空气质量的重要指标;它还是有机合成的氧化剂、替代氯气的净水剂……
臭氧分子的空间结构与水分子的相似,臭氧分子中的共价键是极性键,臭氧分子有极性,但很微弱。仅是水分子的极性的28%。其中心氧原子是呈正电性的,而端位的两个氧原子是呈电负性的。
臭氧是极性分子
四、键的极性对化学性质的影响
键的极性对物质的化学性质有重要影响。例如,羧酸是一大类含羧基的有机酸。羧酸的酸性可用pKa的大小来衡量,pKa越小,酸性越强。
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
pKa=-lgKa
三氟乙酸的酸性大于三氯乙酸
F的电负性
Cl的电负性
>
F-C的极性
Cl-C的极性
>
F3-C的极性
Cl3-C的极性
>
三氟乙酸的羧基中的羟基的极性更大
三氟乙酸更容易电离出氢离子
三氟乙酸的酸性强于三氯乙酸,这是由于氟的电负性大于氯的电负性,C—F键的极性大于C—Cl键,导致羧基中的O—H键的极性更大,更易电离出氢离子。
据此,酸性关系:CCl3COOH>CHCl2COOH>CH2ClCOOH
。
甲酸的酸性大于乙酸
烃基(符号R-)是推电子基团
烃基越长推电子效应越大
使羧基中的羟基的极性越小
羧酸的酸性越弱
随着烃基加长,酸性的差异越来越小
烃基(符号R—)是推电子基团,烃基越长推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。所以酸性:甲酸>乙酸>丙酸
(1)根据元素周期律判断。
①同一主族元素的非金属氢化物的酸性从上到下逐渐增强,如HF②同一周期元素的非金属氢化物的酸性从左向右逐渐增强,如H2S③同一主族元素最高价氧化物对应水化物的酸性从上到下逐渐减弱,如HClO4>HBrO4>HIO4;HNO3>H3PO4;H2CO3>H2SiO3。
④同一周期元素最高价氧化物对应水化物的酸性从左向右逐渐增强,如H3PO4判断物质酸性强弱的方法
1.极性分子中不可能含有非极性键。 ( )
2.离子化合物中不可能含有非极性键。( )
3.非极性分子中不可能含有极性键。( )
4.极性分子中一定含有极性键。( )
5.H2O、CO2、CH4都是非极性分子。( )
1.判断正误(正确的打“√”,错误的打“×”)
√
×
×
×
×
2.在下列物质中,分子中电荷空间分布对称的是( )
①CO2 ②CCl4 ③NH3 ④H2O ⑤HBr
A.①②④ B.②④⑤ C.③⑤ D.①②
解析:在由三个以上原子形成的化合物分子中,空间结构对称的分子,其电荷的空间分布对称,如直线形的CO2、正四面体形的CCl4。
D
A
3.下列物质中,由极性键形成的非极性分子是( )
A.CO2 B.Br2 C.CaCl2 D.SO2
解析:不同种元素形成的化合物中才可能含有极性键;在由三个以上原子形成的化合物分子中,空间结构对称的分子,才是非极性分子,如直线形的CO2。
4.无机含氧酸酸性的强弱规律之一为:成酸元素的化合价越高,酸性越强。下列说法正确的是( )
A.根据这一规律高氯酸是强酸
B.H3PO4的酸性比盐酸的酸性强
C.碳酸比亚硫酸的酸性强
D.硝酸与磷酸的酸性强度一样
解析:一般认为,成酸元素的化合价越高其酸性越强。盐酸为非含氧酸,不适用此规律,B项错误;碳酸与亚硫酸、硝酸与磷酸均不是同一元素的含氧酸,不能用题述规律进行比较,C、D两项错误。
A
5.下列关于粒子结构的描述不正确的是( )
A.H2S和NH3均是价电子总数为8的极性分子
B.HS-和HCl均是含1个极性键的18电子粒子
C.CH2Cl2和CCl4均是空间结构为四面体形的非极性分子
D.SO2和SO3中心原子的杂化轨道类型均为sp2,空间构型分别为V形、平面三角形
C
解析:H2S分子中氢、硫原子间形成极性键,且空间结构不对称,属于极性分子;NH3分子中含有极性键,空间结构为三角锥形,正负电荷中心不重合,属于极性分子,A项正确。HS-和HCl都只含一个极性键,都具有18个电子,B项正确。CH2Cl2正负电荷的中心不重合,是极性分子,C项错误。SO2中硫原子形成两个σ键,孤电子对数为 ×(6-2×2)=1,价层电子对数为3,为sp2杂化,分子空间结构为V形;SO3分子中,中心原子硫原子最外层有6个电子,外围有三个原子,所以不含孤电子对,价层电子对数为σ键个数+孤电子对数=3+ ×(6-3×2)=3,为sp2杂化,SO3分子为平面三角形结构,D项正确。
6.下列物质:①BeCl2 ②Ar ③白磷 ④BF3 ⑤NH3 ⑥H2O2,其中含极性键的非极性分子是( )
A.①④⑥ B.②③⑥ C.①④ D.①③④⑤
解析:①BeCl2空间结构是直线形,Cl—Be—Cl是含极性键的非极性分子;②Ar为稀有气体,分子中不含化学键;③白磷分子式为P4,不含极性键,含有的是非极性键;④BF3是平面三角形结构,是极性键构成的非极性分子;⑤过氧化氢是由极性键和非极性键构成的极性分子。故C项符合题目要求。
C
7.下列各组物质的分子中,都属于含极性键的非极性分子的是( )
A.CO2、H2S B.C2H4、CH4
C.Cl2、C2H2 D.NH3、HCl
解析:两种不同原子之间的共价键具有极性,C项Cl2分子中无极性键。根据分子的空间结构可以判断A项中H2S,D项中NH3、HCl分子中正负电荷中心不重合,属于极性分子。故正确答案为B。
B
8.下列各组酸中,酸性依次增强的是( )
A.H2CO3、H2SiO3、H3PO4
B.HNO3、H3PO4、H2SO4
C.HI、HCl、H2S
D.HClO、HClO3、HClO4
解析:将含氧酸写成通式:(HO)mROn,R相同,n值越大,酸性越强;再根据元素非金属性强弱进行判断。A项中由于非金属性:C>Si,故酸性:H2CO3>H2SiO3;B项中由于非金属性:N>P,故酸性:HNO3>H3PO4;C项中HCl是强酸,H2S是弱酸;D项可根据通式(HO)mClOn判断出非羟基氧原子数n值依次为0、2、3,从而得出酸性强弱关系。
D
9.下列各组物质中,酸性由强到弱排列顺序错误的是( )
A.HClO4>H2SO4>H3PO4 B.HClO4>HClO3>HClO2
C.HClO>HBrO4>HIO4 D.H2SO4>H2SO3>H2CO3
解析:元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,A项正确;无机含氧酸酸性强弱的判断:同一元素的含氧酸,该元素价态越高,酸性越强,B项正确;HClO中的氯不是最高价,C项错误;酸性:H2SO4(强酸)>H2SO3(中强酸)>H2CO3(弱酸),D项正确。
C
第二章 分子结构与性质
第三节 分子结构与物质的性质
第一课时 共价键的极性
1.共价键的分类
共价键
极性共价键
非极性共价键
由不同原子形成的共价键,电子对会发生偏移
由相同原子形成的共价键,电子对不发生偏移
H—Cl
δ+
δ-
氯化氢分子中的极性共价键
一、共价键的极性
共价键 分类 极性共价键 非极性共价键
成键原子 不同元素的原子 同种元素的原子
共用电子对 发生偏移 不发生偏移
成键原子 的电性 电负性较小的原子呈正电性(δ+), 电负性较大的原子呈负电性(δ-) 电中性
2.键的极性——极性键与非极性键
3.键的极性的判断方法
键的极性只取决于成键原子的元素种类或电负性的差异,与其他因素无关。
根据共用电子对是否偏移,共价键有极性键、非极性键之分。
分子的极性又是根据什么来判定呢?
以共价键结合的分子是否也有极性分子、非极性分子之分呢?
极性向量
极性的表示方法
电负性: 2.1 3.0
H—Cl
极性向量可形象地描述极性键的电荷分布情况,极性向量指向的一端,说明该处负电荷更为集中。非极性键无极性向量,说明在非极性键里,正负电荷的中心是重合的。
1.非极性分子
电荷分布均匀、对称的分子
或者:正电荷中心与负电荷中心重合,即键的极性的向量和为0
2.极性分子
电荷分布不均匀、不对称的分子
或者:正电荷中心与负电荷中心不重合,即键的极性的向量和不为0
要对分子极性进行判断,也可用极性向量。极性向量的矢量和指向的一端,说明该处负电荷更为集中,为极性分子。若矢量和为零,为非极性分子。
二、分子的极性
3.分子的极性判断方法
(1)单原子分子
(稀有气体)——非极性分子
(2)双原子分子
化合物——极性分子
单 质——非极性分子
取决于原子间的共价键是否有极性
H
Cl
共用电子对
H
Cl
HCl 分子中,共用电子对偏向Cl原子,为极性键
∴ Cl原子一端相对地显负电性,H原子一端相对地显正电性,极性向量矢量和指向Cl原子,使整个分子的电荷分布不均匀
∴ HCl 为极性分子
δ+
δ-
以极性键结合的双原子分子为极性分子
共用电子对
Cl2 分子中,共用电子对不偏向,为非极性键
极性向量矢量和为零,电荷分布均匀,为非极性分子
以非极性键结合的双原子分子均为非极性分子
Cl
Cl
Cl
Cl
(3)多原子分子(ABn型)
取决于分子的空间构型——?
ABn分子极性的判断方法
①物理模型法(从力的角度分析)
在ABn分子中,A-B键看作相互作用力,根据中心原子A所受合力是否为零来判断,F合=0,为非极性分子(极性抵消),F合≠0,为极性分子(极性不抵消)
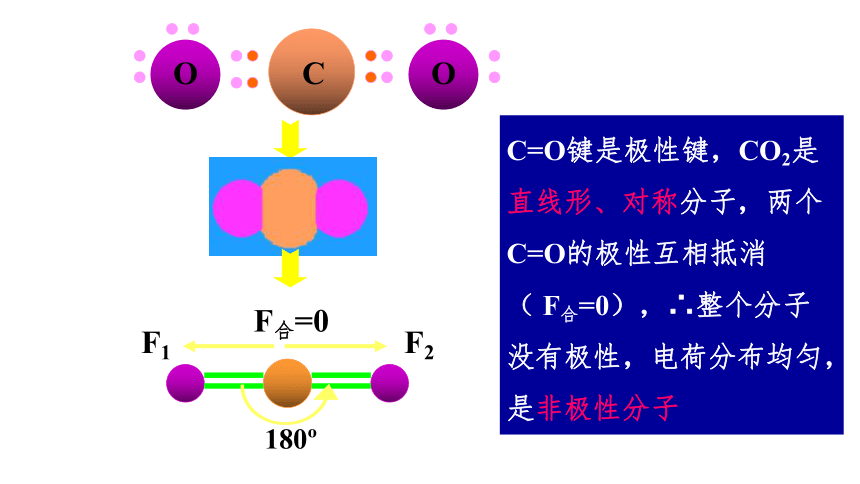
C=O键是极性键,CO2是直线形、对称分子,两个C=O的极性互相抵消
( F合=0),∴整个分子没有极性,电荷分布均匀,是非极性分子
180
F1
F2
F合=0
O
O
C
H
O
H
105
F1
F2
F合≠0
O-H键是极性键,分子是V线
不对称分子,两个O-H键的极性不能抵消( F合≠0),∴整个分子电荷分布不均匀,是极性分子
H
H
H
N
BF3:
NH3:
120
107
三角锥形, 不对称分子,键的极性不能抵消,是极性分子
F1
F2
F3
F’
平面三角形,对称分子,键的极性互相抵消( F合=0) ,是非极性分子
C
H
H
H
H
109 28'
正四面体形 ,对称分子,C-H键的极性互相抵消( F合=0) ,是非极性分子
②化合价法
ABn型分子中
中心原子化合价的绝对值
该元素的价电子数
≠
该分子为极性分子
分子的空间结构不中心对称
V形
三角锥形
四面体
……
②化合价法
ABn型分子中
中心原子化合价的绝对值
该元素的价电子数
=
该分子为非极性分子
分子的空间结构中心对称
直线形
平面正三角形
正四面体
……
分子 BF3 CO2 PCl5 SO3 H2O NH3 SO2
化合价绝对值
价电子数
分子极性
3
3
4
4
5
5
6
6
2
6
3
5
4
6
非极性
非极性
非极性
非极性
极性
极性
极性
③根据所含共价键的类型及分子的空间结构判断
分子类型 键的极性 分子空间结构 分子极性 代表物
双原子 分子 A2 非极性键 直线形(对称) 非极性 H2、O2、
Cl2、N2等
AB 极性键 直线形(不对称) 极性 HF、HCl、CO、NO等
三原子 分子 A2B(或 AB2) 极性键 直线形(对称) 非极性 CO2、CS2
等(键角180°)
极性键 V形(不对称) 极性 H2O(键角105°)等
分子类型 键的极性 分子空间结构 分子极性 代表物
四原子 分子 AB3 极性键 平面三角 形(对称) 非极性 BF3、BCl3等
极性键 三角锥形 (不对称) 极性 NH3(键角107°)等
五原子 分子 AB4 极性键 正四面体 形(对称) 非极性 CH4、CCl4(键角
109°28')等
ABnC4-n (n<4且为整数) 极性键 四面体形 (不对称) 极性 CHCl3、CH2Cl2等
规律总结
从以下两方面判断分子的极性:
三、键的极性与分子极性的关系
①只含非极性键的分子一定是非极性分子。②含有极性键的分子,如果分子中各个键的极性的向量和等于零,则为非极性分子,否则为极性分子。③极性分子中一定有极性键,非极性分子中不一定含有非极性键。例如CH4是非极性分子,只含有极性键。含有非极性键的分子不一定为非极性分子,如H2O2是含有非极性键的极性分子。
小结
以极性键结合的多原子分子,判断分子的极性,一定要结合分子的立体构型来看。
方法:对于ABn型分子,
当其空间构型是高度对称的结构时,分子的正负电荷中心能够重合,故为非极性分子(如CO2、BF3、CH4等等);
当分子的空间构型不是高度对称结构,例如只有对称轴而无对称中心时,为极性分子(如H2O、SO2、NH3等等)。
A、都是由非极性键构成的分子一般是非极性分子。
B、极性键形成的双原子分子一定为极性分子。
C、极性键形成的多原子分子,可能为 非极性分子,也可能为极性分子。
D、多原子分子的极性,应有键的极性和分子的空间构型共同来决定。
共价键
极性键
非极性键
空间不对称
极性分子
双原子分子:HCl、NO、CO
V型分子:H2O、H2S、SO2
三角锥形分子:NH3、PH3
非正四面体:CHCl3
特别地:H2O2、O3
非极性分子
单质分子:Cl2、N2、P4、O2
直线形分子:CO2、CS2、C2H2
正三角形:SO3、BF3
平面形:苯、乙烯
正四面体:CH4、CCl4、SiF4
空间对称
1.已知H2O2分子的空间结构可在二面角中表示,如图所示:
(1)分析H2O2分子中共价键的种类有哪些
提示:H2O2分子中H—O键为极性共价键,O—O键为非极性共价键。
(2)H2O2分子中正电中心和负电中心是否重合 H2O2属于极性分子还是非极性分子
提示:不重合。H2O2属于极性分子。
思考与讨论
2.从哪些方面可以判断键的极性
提示:可从组成元素、电子对偏移、成键原子电负性大小等方面进行判断。
3.如何根据多原子分子的组成及空间结构确定分子的极性
提示:多原子分子,如果为单质,则一般为非极性分子;如果为化合物,则看分子的空间结构,若空间结构对称则为非极性分子,若空间结构不对称则为极性分子。
资料卡片
是一种重要物质。大气高空的臭氧层;
保护了地球生物的生存;空气质量预报中臭氧含量是空气质量的重要指标;它还是有机合成的氧化剂、替代氯气的净水剂……
臭氧分子的空间结构与水分子的相似,臭氧分子中的共价键是极性键,臭氧分子有极性,但很微弱。仅是水分子的极性的28%。其中心氧原子是呈正电性的,而端位的两个氧原子是呈电负性的。
臭氧是极性分子
四、键的极性对化学性质的影响
键的极性对物质的化学性质有重要影响。例如,羧酸是一大类含羧基的有机酸。羧酸的酸性可用pKa的大小来衡量,pKa越小,酸性越强。
羧酸 pKa
丙酸(C2H5COOH) 4.88
乙酸(CH3COOH) 4.76
甲酸(HCOOH) 3.75
氯乙酸(CH2ClCOOH) 2.86
二氯乙酸(CHCl2COOH) 1.29
三氯乙酸(CCl3COOH) 0.65
三氟乙酸(CF3COOH) 0.23
pKa=-lgKa
三氟乙酸的酸性大于三氯乙酸
F的电负性
Cl的电负性
>
F-C的极性
Cl-C的极性
>
F3-C的极性
Cl3-C的极性
>
三氟乙酸的羧基中的羟基的极性更大
三氟乙酸更容易电离出氢离子
三氟乙酸的酸性强于三氯乙酸,这是由于氟的电负性大于氯的电负性,C—F键的极性大于C—Cl键,导致羧基中的O—H键的极性更大,更易电离出氢离子。
据此,酸性关系:CCl3COOH>CHCl2COOH>CH2ClCOOH
。
甲酸的酸性大于乙酸
烃基(符号R-)是推电子基团
烃基越长推电子效应越大
使羧基中的羟基的极性越小
羧酸的酸性越弱
随着烃基加长,酸性的差异越来越小
烃基(符号R—)是推电子基团,烃基越长推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。所以酸性:甲酸>乙酸>丙酸
(1)根据元素周期律判断。
①同一主族元素的非金属氢化物的酸性从上到下逐渐增强,如HF
④同一周期元素最高价氧化物对应水化物的酸性从左向右逐渐增强,如H3PO4
1.极性分子中不可能含有非极性键。 ( )
2.离子化合物中不可能含有非极性键。( )
3.非极性分子中不可能含有极性键。( )
4.极性分子中一定含有极性键。( )
5.H2O、CO2、CH4都是非极性分子。( )
1.判断正误(正确的打“√”,错误的打“×”)
√
×
×
×
×
2.在下列物质中,分子中电荷空间分布对称的是( )
①CO2 ②CCl4 ③NH3 ④H2O ⑤HBr
A.①②④ B.②④⑤ C.③⑤ D.①②
解析:在由三个以上原子形成的化合物分子中,空间结构对称的分子,其电荷的空间分布对称,如直线形的CO2、正四面体形的CCl4。
D
A
3.下列物质中,由极性键形成的非极性分子是( )
A.CO2 B.Br2 C.CaCl2 D.SO2
解析:不同种元素形成的化合物中才可能含有极性键;在由三个以上原子形成的化合物分子中,空间结构对称的分子,才是非极性分子,如直线形的CO2。
4.无机含氧酸酸性的强弱规律之一为:成酸元素的化合价越高,酸性越强。下列说法正确的是( )
A.根据这一规律高氯酸是强酸
B.H3PO4的酸性比盐酸的酸性强
C.碳酸比亚硫酸的酸性强
D.硝酸与磷酸的酸性强度一样
解析:一般认为,成酸元素的化合价越高其酸性越强。盐酸为非含氧酸,不适用此规律,B项错误;碳酸与亚硫酸、硝酸与磷酸均不是同一元素的含氧酸,不能用题述规律进行比较,C、D两项错误。
A
5.下列关于粒子结构的描述不正确的是( )
A.H2S和NH3均是价电子总数为8的极性分子
B.HS-和HCl均是含1个极性键的18电子粒子
C.CH2Cl2和CCl4均是空间结构为四面体形的非极性分子
D.SO2和SO3中心原子的杂化轨道类型均为sp2,空间构型分别为V形、平面三角形
C
解析:H2S分子中氢、硫原子间形成极性键,且空间结构不对称,属于极性分子;NH3分子中含有极性键,空间结构为三角锥形,正负电荷中心不重合,属于极性分子,A项正确。HS-和HCl都只含一个极性键,都具有18个电子,B项正确。CH2Cl2正负电荷的中心不重合,是极性分子,C项错误。SO2中硫原子形成两个σ键,孤电子对数为 ×(6-2×2)=1,价层电子对数为3,为sp2杂化,分子空间结构为V形;SO3分子中,中心原子硫原子最外层有6个电子,外围有三个原子,所以不含孤电子对,价层电子对数为σ键个数+孤电子对数=3+ ×(6-3×2)=3,为sp2杂化,SO3分子为平面三角形结构,D项正确。
6.下列物质:①BeCl2 ②Ar ③白磷 ④BF3 ⑤NH3 ⑥H2O2,其中含极性键的非极性分子是( )
A.①④⑥ B.②③⑥ C.①④ D.①③④⑤
解析:①BeCl2空间结构是直线形,Cl—Be—Cl是含极性键的非极性分子;②Ar为稀有气体,分子中不含化学键;③白磷分子式为P4,不含极性键,含有的是非极性键;④BF3是平面三角形结构,是极性键构成的非极性分子;⑤过氧化氢是由极性键和非极性键构成的极性分子。故C项符合题目要求。
C
7.下列各组物质的分子中,都属于含极性键的非极性分子的是( )
A.CO2、H2S B.C2H4、CH4
C.Cl2、C2H2 D.NH3、HCl
解析:两种不同原子之间的共价键具有极性,C项Cl2分子中无极性键。根据分子的空间结构可以判断A项中H2S,D项中NH3、HCl分子中正负电荷中心不重合,属于极性分子。故正确答案为B。
B
8.下列各组酸中,酸性依次增强的是( )
A.H2CO3、H2SiO3、H3PO4
B.HNO3、H3PO4、H2SO4
C.HI、HCl、H2S
D.HClO、HClO3、HClO4
解析:将含氧酸写成通式:(HO)mROn,R相同,n值越大,酸性越强;再根据元素非金属性强弱进行判断。A项中由于非金属性:C>Si,故酸性:H2CO3>H2SiO3;B项中由于非金属性:N>P,故酸性:HNO3>H3PO4;C项中HCl是强酸,H2S是弱酸;D项可根据通式(HO)mClOn判断出非羟基氧原子数n值依次为0、2、3,从而得出酸性强弱关系。
D
9.下列各组物质中,酸性由强到弱排列顺序错误的是( )
A.HClO4>H2SO4>H3PO4 B.HClO4>HClO3>HClO2
C.HClO>HBrO4>HIO4 D.H2SO4>H2SO3>H2CO3
解析:元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,A项正确;无机含氧酸酸性强弱的判断:同一元素的含氧酸,该元素价态越高,酸性越强,B项正确;HClO中的氯不是最高价,C项错误;酸性:H2SO4(强酸)>H2SO3(中强酸)>H2CO3(弱酸),D项正确。
C
