3.2 分子晶体 课件 【新教材】人教版(2019)高中化学选择性必修2
文档属性
| 名称 | 3.2 分子晶体 课件 【新教材】人教版(2019)高中化学选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 856.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-13 17:04:37 | ||
图片预览






文档简介
(共34张PPT)
第三章 晶体结构与性质
第二节 分子晶体与共价晶体
第一课时 分子晶体
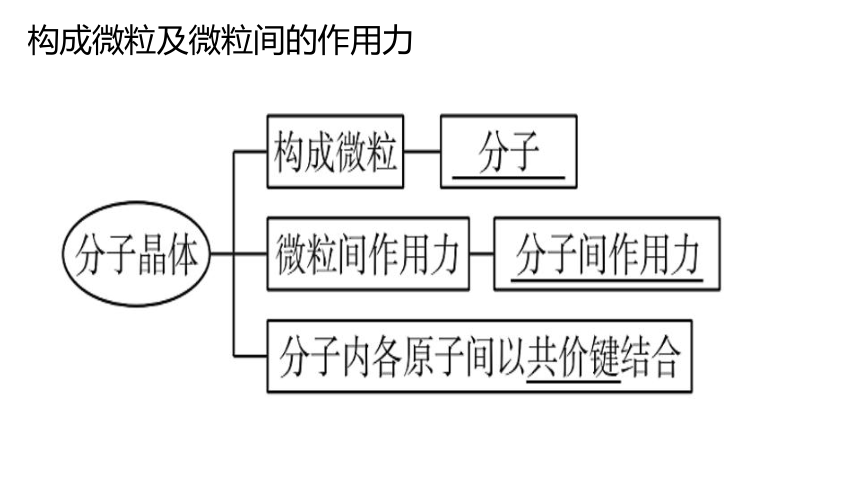
一、分子晶体
1.分子晶体的概念
只含分子的晶体叫做分子晶体。如:I2、H2O、NH3、H3PO4、萘等在固态时都是分子晶体。
2.构成分子晶体的微粒
构成分子晶体的微粒是分子,分子晶体中相邻分子间靠分子间作用力相互吸引,而分子内各原子间通常以共价键结合。
3.分子晶体中微粒间的作用
分子晶体中相邻的分子间以分子间作用力相互吸引。
构成微粒及微粒间的作用力
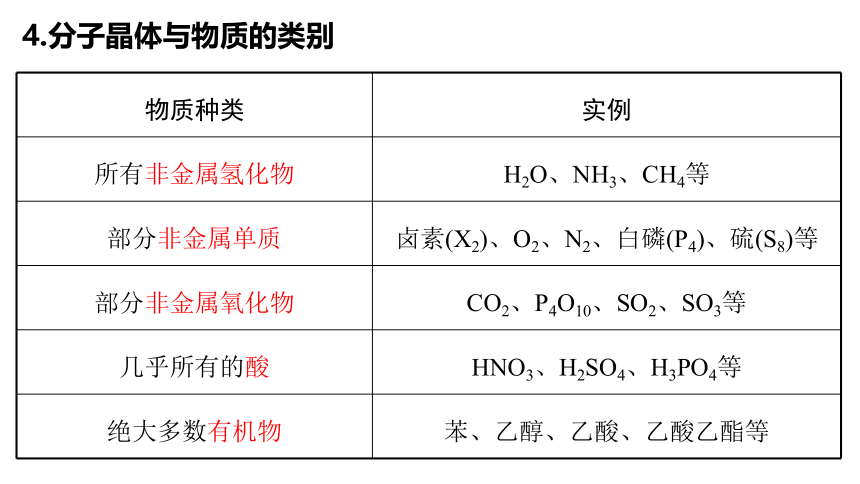
物质种类 实例
所有非金属氢化物 H2O、NH3、CH4等
部分非金属单质 卤素(X2)、O2、N2、白磷(P4)、硫(S8)等
部分非金属氧化物 CO2、P4O10、SO2、SO3等
几乎所有的酸 HNO3、H2SO4、H3PO4等
绝大多数有机物 苯、乙醇、乙酸、乙酸乙酯等
4.分子晶体与物质的类别
①若分子间作用力只有范德华力,则分子晶体有分子密堆积特征,即每个分子周围有12个紧邻的分子。
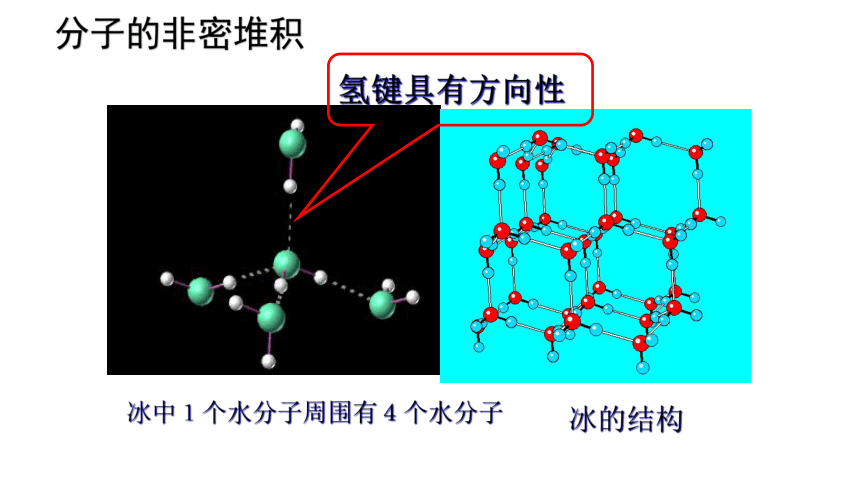
②若分子间还含有其他作用力,如氢键,则每个分子周围紧邻的分子要少于12个。如冰中每个水分子周围只有4个紧邻的水分子。
5.分子晶体的常见堆积方式
①密堆积
有分子间氢键——氢键具有方向性,使晶体中的空间利率不高,留有相当大的空隙.这种晶体不具有分子密堆积特征。如:HF 、NH3、冰(每个水分子周围只有4个紧邻的水分子)。
②非密堆积
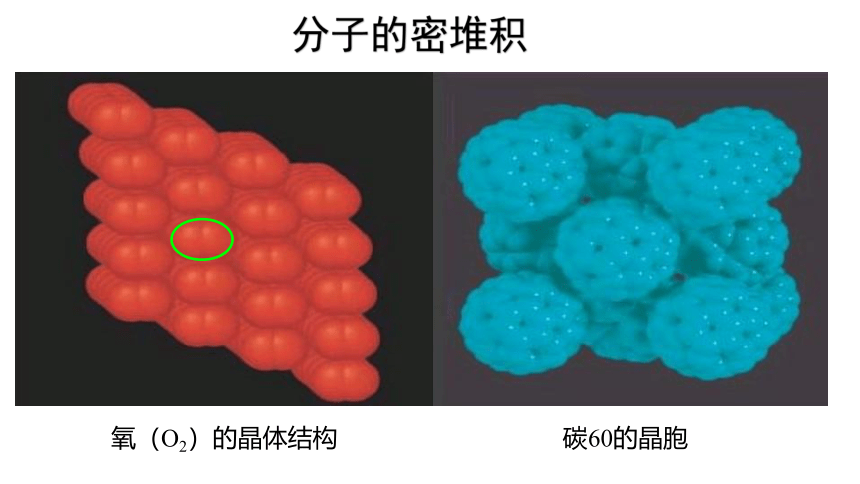
只有范德华力,无分子间氢键——分子密堆积。这类晶体每个分子周围一般有12个紧邻的分子,如:C60、干冰 、I2、O2。
分子的密堆积
氧(O2)的晶体结构
碳60的晶胞
分子的密堆积
(与CO2分子距离最近的CO2分子共有12个 )
干冰的晶体结构图
冰中1个水分子周围有4个水分子
冰的结构
氢键具有方向性
分子的非密堆积
(1)分子晶体具有较低的熔、沸点和较小的硬度。
分子晶体熔化时要破坏分子间作用力,由于分子间作用力很弱,所以分子晶体的熔、沸点一般较低,部分分子晶体易升华(如干冰、碘、红磷、萘等),且硬度较小。
(2)分子晶体不导电。
分子晶体在固态和熔融状态下均不存在自由移动的离子或自由电子,因而分子晶体在固态和熔融状态下都不能导电。有些分子晶体的水溶液能导电,如HI、乙酸等。
6.分子晶体的特性
(3)分子晶体的溶解性一般符合“相似相溶”规律,即极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂。如:H2O是极性溶剂,SO2、H2S、HBr等都是极性分子,它们在水中的溶解度比N2、O2、CH4等非极性分子在水中的溶解度大。苯、CCl4是非极性溶剂,则Br2、I2等非极性分子易溶于其中,而水则不溶于苯和CCl4中。
二、两种典型的分子晶体的组成和结构
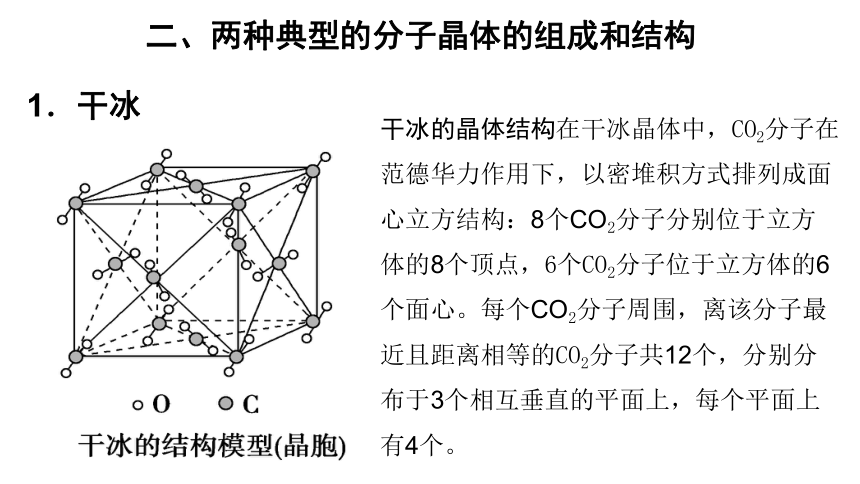
1.干冰
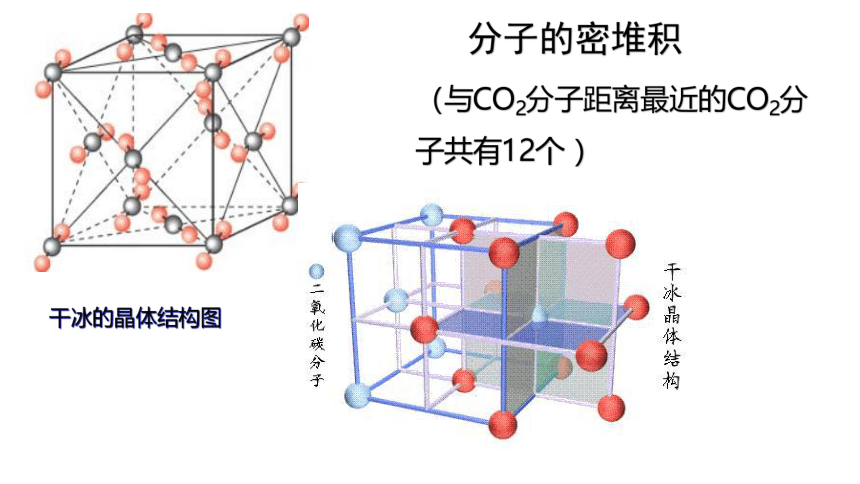
干冰的晶体结构在干冰晶体中,CO2分子在范德华力作用下,以密堆积方式排列成面心立方结构:8个CO2分子分别位于立方体的8个顶点,6个CO2分子位于立方体的6个面心。每个CO2分子周围,离该分子最近且距离相等的CO2分子共12个,分别分布于3个相互垂直的平面上,每个平面上有4个。
(1)干冰中的CO2分子间只存在范德华力,不存在氢键。
(2)每个晶胞中均摊4个CO2分子,含有12个原子。
(3)每个CO2分子周围等距离紧邻的CO2分子数为12个。
(4)干冰在常压下极易升华,在工业上广泛用作制冷剂。
1.冰
冰晶体的结构由于水分子中O原子采取sp3杂化,因此成键电子对与孤对电子之间有特定的伸展方向,所以分子间氢键的形成也有特定的方向和数目。每个H2O分子只能通过氢键与4个H2O直接相邻排列。每个氧原子周围都有4个氢原子,其中2个氢原子是通过共价键结合,距离较近,另外2个氢原子通过氢键结合,距离较远,因此冰晶体中每个水分子均在氢键的作用下形成以它为中心其他4个水分子为顶点的变形四面体结构。
①水分子之间的作用力有范德华力、氢键,但主要是氢键。
②由于氢键具有方向性,使四面体中心的每个水分子与四面体顶点的4个相邻的水分子相互吸引。
③冰的硬度和干冰相似,而熔点比干冰的熔点高得多。
(1)分子晶体熔、沸点的特点
三、分子晶体熔沸点的比较
分子晶体是分子在分子间作用力的作用下形成的晶体,熔化时,只破坏分子间作用力不破坏化学键。分子晶体的熔、沸点的高低是由分子间作用力决定的,而分子间作用力与化学键相比是一种较弱的作用,所以分子晶体在熔、沸点上表现出共性,即熔、沸点均较低,有些分子晶体具有易挥发、升华的性质。
(2)分子晶体熔、沸点高低的判断方法
①少数含氢键的分子晶体,比一般的分子晶体的熔点高,如含有H—F、H—O、H—N等共价键的分子间可以形成氢键,所以HF、H2O、NH3、醇、氨基酸、糖等物质的熔点相对较高。
②组成和结构相似,分子之间不含氢键而利用范德华力形成的分子晶体,随着相对分子质量的增大,物质的熔点逐渐升高。例如,常温下Cl2为气态,Br2为液态,而I2为固态,CO2为气态,CS2为液态。
③相对分子质量相等或相近的极性分子构成的分子晶体,其熔点一般比非极性分子构成的分子晶体的熔、沸点高,如CO的熔、沸点比N2的熔、沸点高。
④有机物中组成和结构相似且不存在氢键的同分异构体,相对分子质量相同,一般支链越多,分子间的相互作用力越弱,熔、沸点越低,如熔、沸点:正戊烷>异戊烷>新戊烷。
四、分子晶体的判断方法
(1)依据物质的类别判断,部分非金属单质、所有非金属氢化物、部分非金属氧化物、几乎所有的酸、绝大多数有机物的晶体都是分子晶体。(2)依据组成晶体的粒子及粒子间作用判断,组成分子晶体的粒子是分子,粒子间作用是分子间作用力。(3)依据物质的性质判断,分子晶体的硬度小,熔、沸点低,在熔融状态或固体时均不导电。
观察下图冰和干冰的晶体结构,回答下列问题:
思考与讨论
(1)为什么干冰的熔点比冰低而密度却比冰大
提示:冰中水分子间除了范德华力外还有氢键作用,而干冰中CO2分子间只有范德华力,所以冰的熔点比干冰高。由于水分子间形成的氢键具有方向性,导致冰晶体不具有分子密堆积特征,晶体中有较大的空隙,所以相同状况下冰的密度较小。由于干冰中CO2分子采取密堆积方式形成晶体,所以干冰的密度较大。
(2)干冰升华过程中破坏共价键吗
提示:干冰升华过程中只破坏范德华力,不破坏共价键。
1.判断正误(对的在括号内打“√”,错的在括号内打“×”。)
(1)分子晶体中只存在分子间作用力 ( )(2)分子晶体熔化时共价键断裂 ( )(3)分子晶体中氢键越强,分子越稳定 ( )(4)分子晶体中一定含有分子间作用力,不一定含有化学键 ( )
×
×
×
√
2.下列各组物质各自形成晶体,均属于分子晶体的化合物是
( )A.NH3、P4、C10H8 B.PCl3、CO2、H2SO4C.SO2、SiO2、P2O5 D.CCl4、H2O、Na2O2
解析:A中,P4(白磷)为单质,不是化合物;C中,SiO2为共价晶体;D中,Na2O2是离子化合物、离子晶体。
B
3.下列有关冰和干冰的叙述不正确的是( )A.干冰和冰都是由分子密堆积形成的晶体B.冰晶体中每个水分子周围只有4个紧邻的水分子C.干冰比冰的熔点低得多,常压下易升华D.干冰中只存在范德华力不存在氢键,一个分子周围有12个紧邻的分子
解析:干冰晶体中CO2分子间作用力只是范德华力,分子采取密堆积,一个分子周围有12个紧邻的分子;冰晶体中水分子间除了范德华力之外还存在氢键,由于氢键具有方向性和饱和性,故每个水分子周围只有4个紧邻的水分子,采取非密堆积的方式,空间利用率小,因而密度小。干冰熔化只需克服范德华力,冰融化需要克服范德华力和氢键,由于氢键作用力比范德华力大,所以干冰比冰的熔点低得多,而且常压下易升华。
A
4.下列有关分子晶体的说法中一定正确的是( )A.分子内均存在共价键B.分子间一定存在范德华力C.分子间一定存在氢键D.其结构一定为分子密堆积
解析:稀有气体元素组成的分子晶体中,不存在由多个原子组成的分子,而是原子间通过范德华力结合成晶体,所以不存在任何化学键,A错误;分子间作用力包括范德华力和氢键,范德华力存在于所有的分子晶体中,而氢键只存在于含有与电负性较强的N、O、F原子结合的氢原子的分子之间或者分子之内,B正确,C错误;只存在范德华力的分子晶体才采取分子密堆积的方式,D错误。
B
5.HF分子晶体、NH3分子晶体与冰的结构极为相似,在HF分子晶体中,与F原子距离最近的HF分子有( )A.3个 B.4个 C.5个 D.12个
解析:根据HF分子晶体与冰结构相似可知,每个HF分子周围有4个HF分子与之最近,构成四面体,故B项正确。
B
6.下列物质按熔、沸点由高到低顺序排列,正确的一组是( )A.HF、HCl、HBr、HI B.F2、Cl2、Br2、I2C.H2O、H2S、H2Se、H2TeD.CI4、CBr4、CCl4、CF4
解析:对结构和组成相似的分子晶体,其熔、沸点随着相对分子质量的增大而升高,但HF、H2O分子之间都存在氢键,熔、沸点反常。所以A中应为HF>HI>HBr>HCl;B中应为I2>Br2>Cl2>F2;C中应为H2O>H2Te>H2Se>H2S;只有D正确。
D
7.下列各组物质各自形成的晶体中,均属于分子晶体的化合物是( )
A.NH3、HD、C8H10 B.PCl3、CO2、H2SO4
C.SO2、SO3、C60 D.CCl4、Na2S、H2O2
解析:A项中HD是单质,不是化合物;C项中C60是单质,不是化合物;D项中Na2S是盐,不是分子晶体。
B
8.水的状态除了气态、液态和固态外,还有玻璃态。它是由液态水急速冷却到165 K时形成的,玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态水的密度相同,有关玻璃态水的叙述正确的是( )
A.水由液态变为玻璃态,体积缩小
B.玻璃态水具有固定的熔点
C.玻璃态是水的一种特殊状态
D.玻璃态水是分子晶体
解析:由玻璃态水的密度与普通液态水的密度相同,可知质量相同时体积相同,A错误;玻璃态的水不是晶体,则无固定的熔点,B错误;由水的状态除了气态、液态和固态外,还有玻璃态,可知玻璃态是水的一种特殊状态,C正确;玻璃态的水无固定形状,不是分子晶体,D错误。
C
9.下列有关冰和干冰的叙述不正确的是( )
A.干冰和冰都是由分子密堆积形成的晶体
B.冰晶体中,每个水分子周围只有4个紧邻的水分子
C.干冰比冰的熔点低得多,常压下易升华
D.干冰中CO2分子间只存在范德华力,不存在氢键,一个分子周围有12个紧邻的分子
A
解析:干冰晶体中,CO2分子间作用力只是范德华力,分子采取密堆积,一个分子周围有12个紧邻的分子;冰晶体中水分子间除了范德华力之外还存在氢键,由于氢键具有方向性和饱和性,故每个水分子周围只有4个紧邻的水分子,采取非密堆积的方式,空间利用率小,因而密度小。干冰熔化只需克服范德华力,冰融化需要克服范德华力和氢键,由于氢键作用力比范德华力大,所以干冰比冰的熔点低得多,而且常压下易升华。
10.(1)CO能与金属Fe形成Fe(CO)5,该化合物熔点为253 K,沸点为376 K,其固体属于________晶体。(2)F2与其他卤素单质反应可以形成卤素互化物,如ClF3、BrF3,常温下它们都是易挥发的液体。ClF3的熔、沸点比BrF3的________(填“高”或“低”)。
(3)下图为CO2分子晶体结构的一部分,观察图形。试说明每个CO2分子周围有________个与之紧邻的CO2分子;该结构单元平均占有________个CO2分子。
分子
低
4
12
解析:
(1)该化合物熔点为253 K,沸点为376 K,熔、沸点较低,所以为分子晶体。
(2)组成和结构相似的分子晶体,相对分子质量越大,范德华力越大,熔、沸点越高,所以ClF3的熔、沸点比BrF3的低。
11.(1)比较下列化合物熔、沸点的高低(填“>”或“<”)。①CO2________SO2 ②NH3________PH3 ③O3________O2 ④Ne________Ar ⑤CH3CH2OH________CH3OH ⑥CO________N2(2)已知AlCl3的熔点为190 ℃(2.02×105 Pa),但它在180 ℃即开始升华。请回答:①AlCl3固体是________晶体。②设计一个可靠的实验,判断氯化铝是离子化合物还是共价化合物。你设计的实验是_______________________________________。
<
<
>
>
>
>
分子
在熔融状态下,试验其是否导电,若不导电是共价化合物,若导电是离子化合物
解析:
(1)各组物质均为分子晶体,根据分子晶体熔、沸点的判断规律,分子间作用力越大,相对分子质量越大,分子极性越大,则晶体的熔、沸点越高,较容易比较六组物质熔、沸点的高低。(2)由AlCl3的熔点低以及在180 ℃时开始升华判断AlCl3晶体为分子晶体。若验证一种化合物是共价化合物还是离子化合物,可测其熔融状态下是否导电,若不导电是共价化合物,导电则是离子化合物。
第三章 晶体结构与性质
第二节 分子晶体与共价晶体
第一课时 分子晶体
一、分子晶体
1.分子晶体的概念
只含分子的晶体叫做分子晶体。如:I2、H2O、NH3、H3PO4、萘等在固态时都是分子晶体。
2.构成分子晶体的微粒
构成分子晶体的微粒是分子,分子晶体中相邻分子间靠分子间作用力相互吸引,而分子内各原子间通常以共价键结合。
3.分子晶体中微粒间的作用
分子晶体中相邻的分子间以分子间作用力相互吸引。
构成微粒及微粒间的作用力
物质种类 实例
所有非金属氢化物 H2O、NH3、CH4等
部分非金属单质 卤素(X2)、O2、N2、白磷(P4)、硫(S8)等
部分非金属氧化物 CO2、P4O10、SO2、SO3等
几乎所有的酸 HNO3、H2SO4、H3PO4等
绝大多数有机物 苯、乙醇、乙酸、乙酸乙酯等
4.分子晶体与物质的类别
①若分子间作用力只有范德华力,则分子晶体有分子密堆积特征,即每个分子周围有12个紧邻的分子。
②若分子间还含有其他作用力,如氢键,则每个分子周围紧邻的分子要少于12个。如冰中每个水分子周围只有4个紧邻的水分子。
5.分子晶体的常见堆积方式
①密堆积
有分子间氢键——氢键具有方向性,使晶体中的空间利率不高,留有相当大的空隙.这种晶体不具有分子密堆积特征。如:HF 、NH3、冰(每个水分子周围只有4个紧邻的水分子)。
②非密堆积
只有范德华力,无分子间氢键——分子密堆积。这类晶体每个分子周围一般有12个紧邻的分子,如:C60、干冰 、I2、O2。
分子的密堆积
氧(O2)的晶体结构
碳60的晶胞
分子的密堆积
(与CO2分子距离最近的CO2分子共有12个 )
干冰的晶体结构图
冰中1个水分子周围有4个水分子
冰的结构
氢键具有方向性
分子的非密堆积
(1)分子晶体具有较低的熔、沸点和较小的硬度。
分子晶体熔化时要破坏分子间作用力,由于分子间作用力很弱,所以分子晶体的熔、沸点一般较低,部分分子晶体易升华(如干冰、碘、红磷、萘等),且硬度较小。
(2)分子晶体不导电。
分子晶体在固态和熔融状态下均不存在自由移动的离子或自由电子,因而分子晶体在固态和熔融状态下都不能导电。有些分子晶体的水溶液能导电,如HI、乙酸等。
6.分子晶体的特性
(3)分子晶体的溶解性一般符合“相似相溶”规律,即极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂。如:H2O是极性溶剂,SO2、H2S、HBr等都是极性分子,它们在水中的溶解度比N2、O2、CH4等非极性分子在水中的溶解度大。苯、CCl4是非极性溶剂,则Br2、I2等非极性分子易溶于其中,而水则不溶于苯和CCl4中。
二、两种典型的分子晶体的组成和结构
1.干冰
干冰的晶体结构在干冰晶体中,CO2分子在范德华力作用下,以密堆积方式排列成面心立方结构:8个CO2分子分别位于立方体的8个顶点,6个CO2分子位于立方体的6个面心。每个CO2分子周围,离该分子最近且距离相等的CO2分子共12个,分别分布于3个相互垂直的平面上,每个平面上有4个。
(1)干冰中的CO2分子间只存在范德华力,不存在氢键。
(2)每个晶胞中均摊4个CO2分子,含有12个原子。
(3)每个CO2分子周围等距离紧邻的CO2分子数为12个。
(4)干冰在常压下极易升华,在工业上广泛用作制冷剂。
1.冰
冰晶体的结构由于水分子中O原子采取sp3杂化,因此成键电子对与孤对电子之间有特定的伸展方向,所以分子间氢键的形成也有特定的方向和数目。每个H2O分子只能通过氢键与4个H2O直接相邻排列。每个氧原子周围都有4个氢原子,其中2个氢原子是通过共价键结合,距离较近,另外2个氢原子通过氢键结合,距离较远,因此冰晶体中每个水分子均在氢键的作用下形成以它为中心其他4个水分子为顶点的变形四面体结构。
①水分子之间的作用力有范德华力、氢键,但主要是氢键。
②由于氢键具有方向性,使四面体中心的每个水分子与四面体顶点的4个相邻的水分子相互吸引。
③冰的硬度和干冰相似,而熔点比干冰的熔点高得多。
(1)分子晶体熔、沸点的特点
三、分子晶体熔沸点的比较
分子晶体是分子在分子间作用力的作用下形成的晶体,熔化时,只破坏分子间作用力不破坏化学键。分子晶体的熔、沸点的高低是由分子间作用力决定的,而分子间作用力与化学键相比是一种较弱的作用,所以分子晶体在熔、沸点上表现出共性,即熔、沸点均较低,有些分子晶体具有易挥发、升华的性质。
(2)分子晶体熔、沸点高低的判断方法
①少数含氢键的分子晶体,比一般的分子晶体的熔点高,如含有H—F、H—O、H—N等共价键的分子间可以形成氢键,所以HF、H2O、NH3、醇、氨基酸、糖等物质的熔点相对较高。
②组成和结构相似,分子之间不含氢键而利用范德华力形成的分子晶体,随着相对分子质量的增大,物质的熔点逐渐升高。例如,常温下Cl2为气态,Br2为液态,而I2为固态,CO2为气态,CS2为液态。
③相对分子质量相等或相近的极性分子构成的分子晶体,其熔点一般比非极性分子构成的分子晶体的熔、沸点高,如CO的熔、沸点比N2的熔、沸点高。
④有机物中组成和结构相似且不存在氢键的同分异构体,相对分子质量相同,一般支链越多,分子间的相互作用力越弱,熔、沸点越低,如熔、沸点:正戊烷>异戊烷>新戊烷。
四、分子晶体的判断方法
(1)依据物质的类别判断,部分非金属单质、所有非金属氢化物、部分非金属氧化物、几乎所有的酸、绝大多数有机物的晶体都是分子晶体。(2)依据组成晶体的粒子及粒子间作用判断,组成分子晶体的粒子是分子,粒子间作用是分子间作用力。(3)依据物质的性质判断,分子晶体的硬度小,熔、沸点低,在熔融状态或固体时均不导电。
观察下图冰和干冰的晶体结构,回答下列问题:
思考与讨论
(1)为什么干冰的熔点比冰低而密度却比冰大
提示:冰中水分子间除了范德华力外还有氢键作用,而干冰中CO2分子间只有范德华力,所以冰的熔点比干冰高。由于水分子间形成的氢键具有方向性,导致冰晶体不具有分子密堆积特征,晶体中有较大的空隙,所以相同状况下冰的密度较小。由于干冰中CO2分子采取密堆积方式形成晶体,所以干冰的密度较大。
(2)干冰升华过程中破坏共价键吗
提示:干冰升华过程中只破坏范德华力,不破坏共价键。
1.判断正误(对的在括号内打“√”,错的在括号内打“×”。)
(1)分子晶体中只存在分子间作用力 ( )(2)分子晶体熔化时共价键断裂 ( )(3)分子晶体中氢键越强,分子越稳定 ( )(4)分子晶体中一定含有分子间作用力,不一定含有化学键 ( )
×
×
×
√
2.下列各组物质各自形成晶体,均属于分子晶体的化合物是
( )A.NH3、P4、C10H8 B.PCl3、CO2、H2SO4C.SO2、SiO2、P2O5 D.CCl4、H2O、Na2O2
解析:A中,P4(白磷)为单质,不是化合物;C中,SiO2为共价晶体;D中,Na2O2是离子化合物、离子晶体。
B
3.下列有关冰和干冰的叙述不正确的是( )A.干冰和冰都是由分子密堆积形成的晶体B.冰晶体中每个水分子周围只有4个紧邻的水分子C.干冰比冰的熔点低得多,常压下易升华D.干冰中只存在范德华力不存在氢键,一个分子周围有12个紧邻的分子
解析:干冰晶体中CO2分子间作用力只是范德华力,分子采取密堆积,一个分子周围有12个紧邻的分子;冰晶体中水分子间除了范德华力之外还存在氢键,由于氢键具有方向性和饱和性,故每个水分子周围只有4个紧邻的水分子,采取非密堆积的方式,空间利用率小,因而密度小。干冰熔化只需克服范德华力,冰融化需要克服范德华力和氢键,由于氢键作用力比范德华力大,所以干冰比冰的熔点低得多,而且常压下易升华。
A
4.下列有关分子晶体的说法中一定正确的是( )A.分子内均存在共价键B.分子间一定存在范德华力C.分子间一定存在氢键D.其结构一定为分子密堆积
解析:稀有气体元素组成的分子晶体中,不存在由多个原子组成的分子,而是原子间通过范德华力结合成晶体,所以不存在任何化学键,A错误;分子间作用力包括范德华力和氢键,范德华力存在于所有的分子晶体中,而氢键只存在于含有与电负性较强的N、O、F原子结合的氢原子的分子之间或者分子之内,B正确,C错误;只存在范德华力的分子晶体才采取分子密堆积的方式,D错误。
B
5.HF分子晶体、NH3分子晶体与冰的结构极为相似,在HF分子晶体中,与F原子距离最近的HF分子有( )A.3个 B.4个 C.5个 D.12个
解析:根据HF分子晶体与冰结构相似可知,每个HF分子周围有4个HF分子与之最近,构成四面体,故B项正确。
B
6.下列物质按熔、沸点由高到低顺序排列,正确的一组是( )A.HF、HCl、HBr、HI B.F2、Cl2、Br2、I2C.H2O、H2S、H2Se、H2TeD.CI4、CBr4、CCl4、CF4
解析:对结构和组成相似的分子晶体,其熔、沸点随着相对分子质量的增大而升高,但HF、H2O分子之间都存在氢键,熔、沸点反常。所以A中应为HF>HI>HBr>HCl;B中应为I2>Br2>Cl2>F2;C中应为H2O>H2Te>H2Se>H2S;只有D正确。
D
7.下列各组物质各自形成的晶体中,均属于分子晶体的化合物是( )
A.NH3、HD、C8H10 B.PCl3、CO2、H2SO4
C.SO2、SO3、C60 D.CCl4、Na2S、H2O2
解析:A项中HD是单质,不是化合物;C项中C60是单质,不是化合物;D项中Na2S是盐,不是分子晶体。
B
8.水的状态除了气态、液态和固态外,还有玻璃态。它是由液态水急速冷却到165 K时形成的,玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态水的密度相同,有关玻璃态水的叙述正确的是( )
A.水由液态变为玻璃态,体积缩小
B.玻璃态水具有固定的熔点
C.玻璃态是水的一种特殊状态
D.玻璃态水是分子晶体
解析:由玻璃态水的密度与普通液态水的密度相同,可知质量相同时体积相同,A错误;玻璃态的水不是晶体,则无固定的熔点,B错误;由水的状态除了气态、液态和固态外,还有玻璃态,可知玻璃态是水的一种特殊状态,C正确;玻璃态的水无固定形状,不是分子晶体,D错误。
C
9.下列有关冰和干冰的叙述不正确的是( )
A.干冰和冰都是由分子密堆积形成的晶体
B.冰晶体中,每个水分子周围只有4个紧邻的水分子
C.干冰比冰的熔点低得多,常压下易升华
D.干冰中CO2分子间只存在范德华力,不存在氢键,一个分子周围有12个紧邻的分子
A
解析:干冰晶体中,CO2分子间作用力只是范德华力,分子采取密堆积,一个分子周围有12个紧邻的分子;冰晶体中水分子间除了范德华力之外还存在氢键,由于氢键具有方向性和饱和性,故每个水分子周围只有4个紧邻的水分子,采取非密堆积的方式,空间利用率小,因而密度小。干冰熔化只需克服范德华力,冰融化需要克服范德华力和氢键,由于氢键作用力比范德华力大,所以干冰比冰的熔点低得多,而且常压下易升华。
10.(1)CO能与金属Fe形成Fe(CO)5,该化合物熔点为253 K,沸点为376 K,其固体属于________晶体。(2)F2与其他卤素单质反应可以形成卤素互化物,如ClF3、BrF3,常温下它们都是易挥发的液体。ClF3的熔、沸点比BrF3的________(填“高”或“低”)。
(3)下图为CO2分子晶体结构的一部分,观察图形。试说明每个CO2分子周围有________个与之紧邻的CO2分子;该结构单元平均占有________个CO2分子。
分子
低
4
12
解析:
(1)该化合物熔点为253 K,沸点为376 K,熔、沸点较低,所以为分子晶体。
(2)组成和结构相似的分子晶体,相对分子质量越大,范德华力越大,熔、沸点越高,所以ClF3的熔、沸点比BrF3的低。
11.(1)比较下列化合物熔、沸点的高低(填“>”或“<”)。①CO2________SO2 ②NH3________PH3 ③O3________O2 ④Ne________Ar ⑤CH3CH2OH________CH3OH ⑥CO________N2(2)已知AlCl3的熔点为190 ℃(2.02×105 Pa),但它在180 ℃即开始升华。请回答:①AlCl3固体是________晶体。②设计一个可靠的实验,判断氯化铝是离子化合物还是共价化合物。你设计的实验是_______________________________________。
<
<
>
>
>
>
分子
在熔融状态下,试验其是否导电,若不导电是共价化合物,若导电是离子化合物
解析:
(1)各组物质均为分子晶体,根据分子晶体熔、沸点的判断规律,分子间作用力越大,相对分子质量越大,分子极性越大,则晶体的熔、沸点越高,较容易比较六组物质熔、沸点的高低。(2)由AlCl3的熔点低以及在180 ℃时开始升华判断AlCl3晶体为分子晶体。若验证一种化合物是共价化合物还是离子化合物,可测其熔融状态下是否导电,若不导电是共价化合物,导电则是离子化合物。
