3.4 配合物和超分子 课件 【新教材】人教版(2019)高中化学选择性必修2
文档属性
| 名称 | 3.4 配合物和超分子 课件 【新教材】人教版(2019)高中化学选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-13 00:00:00 | ||
图片预览










文档简介
(共33张PPT)
第三章 晶体结构与性质
第四节 配合物和超分子
无水CuSO4是白色的,为什么CuSO4·5H2O晶体却是蓝色的?
思考与讨论
一、配合物
1.配位键与配合物
固体
溶液颜色
无色离子:
CuSO4
CuCl2 2H2O
CuBr2
NaCl
K2SO4
KBr
什么离子呈天蓝色:
白色
白色
白色
白色
绿色
深褐色
[Cu(H2O)4]2+
SO42 –
天蓝色
天蓝色
天蓝色
无色
无色
无色
Na+
Cl-
K +
Br -
K +
实验[2—1]
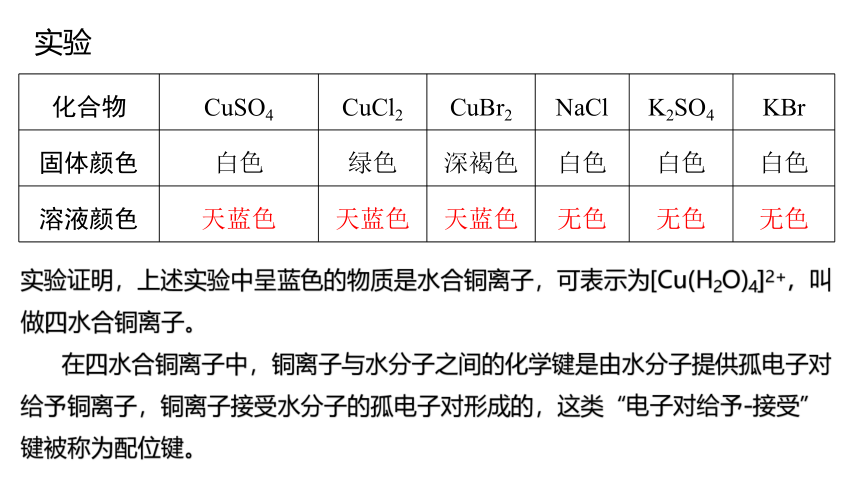
向盛有下表中固体样品的试管中,分别加入足量的水,观察实验现象并填写下表
化合物 CuSO4 CuCl2 CuBr2 NaCl K2SO4 KBr
固体颜色 白色 绿色 深褐色 白色 白色 白色
溶液颜色 天蓝色 天蓝色 天蓝色 无色 无色 无色
实验
实验证明,上述实验中呈蓝色的物质是水合铜离子,可表示为[Cu(H2O)4]2+,叫做四水合铜离子。
在四水合铜离子中,铜离子与水分子之间的化学键是由水分子提供孤电子对给予铜离子,铜离子接受水分子的孤电子对形成的,这类“电子对给予-接受”键被称为配位键。
①定义
②形成条件
一方提供孤电子对(配体)
一方提供空轨道
常见的配体
X-
CO
CN
H2O
NH3
SCN-
(1)配位键
由一个原子单方面提供孤电子对而另一个原子接受孤电子对形成的共价键,即“电子对给予——接受”键被称为配位键。提供空轨道的原子或离子称为中心原子或离子,提供孤电子的原子对应的分子或离子称为配体或配位体。
中心原子(离子):提供空轨道,接受孤电子对。通常是过渡元素的原子或离子,如Fe、Ni、Fe3+、Cu2+、Zn2+、Ag+、Co3+、Cr3+等。
配位体:提供孤电子对的分子或离子,如分子CO、NH3、H2O等,阴离子F-、CN-、Cl-等。
注意:
①配位键是一种特殊的共价键,配位键与共价键性质完全相同.
②配位键同样具有饱和性和方向性,一般来说,多数过渡金属的原子或离子形成配位键的数目是基本不变的,如Ag+形成2个配位键;Cu2+形成4个配位键等。
③H3O+、NH4+中含有配位键.
③配位键的表示方法
H
O
H
H
Cu
H2O
H2O
H2O
OH2
2+
请你写出NH4+的配位键的表示法?
平面正方形结构
[Cu(H2O)4]2+
(电子对给予体)A→B(电子对接受体)或A—B
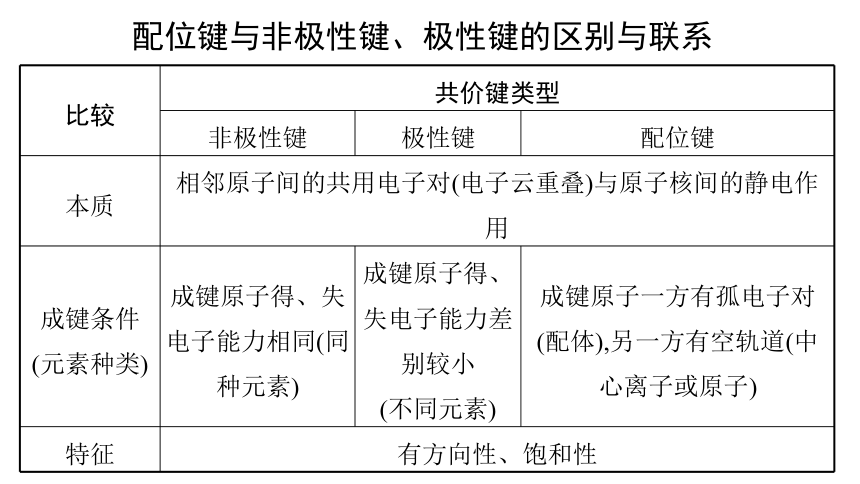
配位键与非极性键、极性键的区别与联系
比较 共价键类型 非极性键 极性键 配位键
本质 相邻原子间的共用电子对(电子云重叠)与原子核间的静电作用 成键条件 (元素种类) 成键原子得、失电子能力相同(同种元素) 成键原子得、失电子能力差别较小 (不同元素) 成键原子一方有孤电子对(配体),另一方有空轨道(中心离子或原子)
特征 有方向性、饱和性 配位键实质上是一种特殊的共价键。配位键的共用电子对由成键原子单方面提供,普通共价键的共用电子对则由成键原子双方共同提供,但实质是相同的。
思考与讨论
(1) 中的配位键与其他三个N—H键的键参数是否相同
提示:相同。 可看成NH3分子结合1个H+后形成的,在NH3分子中中心原子氮采取sp3杂化,孤电子对占据一个杂化轨道,3个未成对电子分别占据另3个杂化轨道,分
别结合3个H原子形成3个σ键,由于孤电子对的排斥,所以NH3分子的空间结构为三角锥形,键角压缩至107°。当遇到H+时,N原子的孤电子对会进入H+的空轨道,以配位键形成 ,这样N原子就不再存在孤电子对,键角恢复至109°28',故 为正四面体形,4个N—H键完全相同,配位键与普通共价键形成过程不同,但各种键参数完全相同。
(2)配合物[Cu(NH3)4]SO4中含有的化学键类型有哪些
提示:[Cu(NH3)4]SO4中含有的化学键有离子键、共价键和配位键。
(3)NH3和BF3可以通过配位键形成NH3·BF3,试分析提供孤电子对、空轨道的分别是哪种原子
提示:N原子提供孤电子对,B原子提供空轨道。
(4)配制银氨溶液时,向AgNO3溶液中滴加氨水,先生成白色沉淀,后沉淀逐渐溶解,为什么
提示:氨水呈弱碱性,滴入AgNO3溶液中会生成AgOH白色沉淀;继续滴加氨水时,NH3分子与Ag+形成[Ag(NH3)2]+配合离子,使AgOH逐渐溶解,反应过程如下:
(2)配合物
金属离子(或原子)与某些分子或离子(称为配体或配位体)以配位键结合形成的化合物,称为配位化合物,简称配合物。
①定义
②配合物的组成
金属离子或原子与某些分子或离子(称为配体)以配位键结合而形成的化合物称为配位化合物。配位化合物的组成如图:
一般中心原子(或中心离子)的配位数是2、4、6。
③配合物的命名
①配离子念法:配位数→配体名称→合→中心原子(离子)名称
②配合物→类似于盐(酸、碱)的念法
六氰合铁酸钾
氢氧化二氨合银
三氯一氨合铂酸钾
硫酸四氨合铜
[Cu(NH3)4] SO4
K3[Fe(CN)6]
[Ag(NH3)2]OH
K[Pt(NH3)Cl3]
练习:
(1)溶解性的影响
如:AgCl→[Ag(NH3)2]Cl,由不溶于水的沉淀,转变为易溶于水的物质。
(2)颜色的改变
当简单离子形成配离子时其性质往往有很大变化。颜色变化就是一种常见的现象,我们根据颜色的变化就可以判断是否有配离子生成。如Fe3+与SCN-在溶液中可生成配位数为1~6的配离子,这些配离子的颜色是红色的。
⑤配合物的形成对性质的影响
(3)稳定性增强
配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。当中心离子相同时,配合物的稳定性与配体的性质有关。例如,血红素中的Fe2+与CO分子形成的配位键比Fe2+与O2分子形成的配位键强,因此血红素中的Fe2+与CO分子结合后,就很难再与O2分子结合,导致血红素失去输送氧气的功能,这是CO使人体中毒的原理。
④形成配合物的条件
(1)配体有孤电子对。
(2)中心原子(或离子)有空轨道。
实验[2—2] 向盛有4ml0.1mol.L-1硫酸铜溶液试管中滴加几滴1mol.L-1氨水,首先形成难溶物,继续添加氨水并振荡试管,观察实验现象;再向试管中加入8ml95%乙醇,并用玻璃棒摩擦试管壁,观察实验现象。
配合物的形成
实验操作 实验现象 实验原理
向盛有4mL 0.1mol/L CuSO4溶液的试管里滴加几滴1 mol/L 氨水
继续添加氨水并振荡试管
再向试管中加入极性较小的溶剂(如加入8 mL 95%乙醇),并用玻璃棒摩擦试管壁
形成难溶物
难溶物溶解,得到深蓝色的透明溶液
析出深蓝色晶体
Cu2+ + 2NH3·H2O = Cu(OH)2↓+2NH4+
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
深蓝色晶体为[Cu(NH3)4]SO4·H2O,说明该配合物在乙醇中的溶解度小于在水中的溶解度
实验证明,无论在得到的深蓝色透明溶液中,还是在析出的深蓝色的晶体中,深蓝色都是由于存在 [Cu(NH3)4]2+,它是Cu2+的另一种常见配离子,中心离子仍然是Cu2+,而配体是NH3,配位数为4。
实验2-3
向盛有少量0.1mol.L-1氯化铁溶液(或任何含有的Fe3+溶液)的试管中滴加1滴0.1mol.L-1硫氰化钾(KSCN)溶液,观察实验现象。
现象:生成血红色溶液
原因:生成[Fe(SCN)n]3-n(n=1~6)
作用:检验或鉴定Fe3+,用于电影特技和魔术表演
⑤配合物的形成实验
实验 操作
实验 现象 滴加氨水后,试管中首先出现蓝色沉淀,氨水过量后沉淀逐渐溶解,滴加乙醇后析出深蓝色晶体 溶液颜色变成 红色 先产生白色沉淀,滴加氨水后白色沉淀溶解
有关 离子 方程 式或 化学 方程 式 Cu2++2NH3·H2O=== Cu(OH)2↓+2 , Cu(OH)2+4NH3=== [Cu(NH3)4](OH)2, [Cu(NH3)4]2++ +H2O === [Cu(NH3)4]SO4·H2O↓ Fe3++3SCN-===Fe(SCN)3 Ag++Cl-===AgCl↓;
AgCl+2NH3=== [Ag(NH3)2]Cl-
配合物广泛存在于自然界中,跟人类生活有密切关系。例如,在人和动物体内起输送氧气作用的血红素,是Fe2+的配合物。配合物在生产和科学技术方面的应用也很广泛。
⑥配合物的用途
1.超分子是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体。超分子是广义的,包括离子。
2.超分子实例
(1)用超分子分离C60和C70。
二、超分子
冠醚识别碱金属离子。不同大小的冠醚可以识别不同大小的碱金属离子。
冠醚 适合的粒子(直径/pm)
12-冠-4 15-冠-5 18-冠-6 21-冠-7 Li+
Na+
K+
Rb+
Cs+
(2)冠醚识别碱金属离子(如K+)。
冠醚是皇冠状的分子,可有不同大小的空穴适配不同大小的碱金属离子
(3)超分子两个的重要特征——分子识别、自组装。
1.形成配位键的条件是一方有空轨道,另一方有孤电子对。 ( )
2.配位键是一种特殊的共价键。( )
3.配位化合物中的配体可以是分子也可以是阴离子。( )
4.共价键的形成条件是成键原子必须有未成对电子。( )
5.超分子是相对分子质量很大的有机化合物。( )
1.判断正误(正确的打“√”,错误的打“×”)
√
√
√
×
×
2.向盛有硫酸铜水溶液的试管里滴加氨水,首先形成难溶物,继续滴加氨水,难溶物溶解得到深蓝色的透明溶液,下列对此现象的说法正确的是( )
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的物质的量不变
B.沉淀溶解后,生成深蓝色的配离子[Cu(NH3)4]2+
C.向反应后的溶液中加入乙醇,溶液将不会发生变化,因为[Cu(NH3)4]2+不会与乙醇发生反应
D.在[Cu(NH3)4]2+中,Cu2+给出孤电子对,NH3提供空轨道
B
解析:向CuSO4溶液中加入过量氨水发生的反应是CuSO4+2NH3·H2O === Cu(OH)2↓+(NH4)2SO4;
Cu(OH)2+2NH3·H2O+(NH4)2SO4 ===[Cu(NH3)4]SO4+4H2O,故A项不正确,B项正确;由于[Cu(NH3)4]SO4在乙醇中的溶解度远小于在水中的溶解度,故加入乙醇会产生沉淀,C项不正确;在生成[Cu(NH3)4]2+过程中,Cu2+提供空轨道,NH3给出孤电子对,D项不正确。
规律总结 准确判断配位键的方法:(1)掌握好配位键的形成条件:①一种原子或离子有空轨道,常见的可提供空轨道的是过渡元素的离子或原子,如Cu2+、Ag+、Fe、Ni等;②另一种原子或离子有孤电子对,常见的含孤电子对的配体有:分子如CO、NH3、H2O等,离子如Cl-、CN-、N等;(2)正确分析原子的最外层电子排布和成键情况。
3.下列关于[Cr(H2O)4Br2]Br·2H2O的说法正确的是( )
A.配体为水分子,配位原子为O,外界为Br-
B.中心离子的配位数为6
C.中心离子Cr3+采取sp3杂化
D.中心离子的化合价为+2价
解析:[Cr(H2O)4Br2]Br·2H2O中内界为[Cr(H2O)4Br2]+,Cr3+为中心离子,配体为H2O、Br-,配位数为6,外界为Br-、H2O,Cr3+提供的空轨道数为6,中心离子不是采取sp3杂化。
B
4.下列关于配位化合物的叙述中,不正确的是( )
A.配位化合物中必定存在配位键
B.配位化合物中只有配位键
C.[Fe(SCN)6]3-中的Fe3+提供空轨道,SCN-中的硫原子提供孤电子对形成配位键
D.许多过渡元素的离子(如Cu2+、Ag+等)和某些主族元素的离子或分子(如Cl-、NH3等)能形成配合物
解析:配位化合物中一定含有配位键,但也可能含有离子键等其他化学键,A正确,B错误;Fe3+、Cu2+、Ag+等过渡元素的离子有空轨道,可与有孤电子对的分子或离子形成配合物;NH3中的氮原子、SCN-中的硫原子等有孤电子对,可以形成配合物,C、D均正确。
B
5.下列微粒中含配位键的是( )
A.①②④⑦⑧ B.③④⑤⑥⑦
C.①④⑤⑥⑦⑧ D.①②③④⑤⑥⑦⑧
解析:形成配位键的条件是一个原子(或离子)有孤电子对,另一个原子(或离子)有空轨道。
C
6.(1)下列不属于配合物的是 。
A.[Cu(H2O)4]SO4·H2O
B.[Ag(NH3)2]OH
C.KAl(SO4)2·12H2O
D.Na[Al(OH)4]
(2)在配合物[Fe(SCN)]2+中,提供空轨道接受孤电子对的微粒是 ;画出配合物离子[Cu(NH3)4]2+中的配位键 。
C
Fe3+
7.Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
(1)[Cu(NH3)4]2+中存在的化学键类型有 (填字母)。
A.配位键 B.极性共价键
C.非极性共价键 D.离子键
(2)[Cu(NH3)4]2+具有对称的空间结构,[Cu(NH3)4]2+中的两个NH3分子被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间结构为 。
(3)某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:HOCH2CH=CH2→CH3CH2CHO。在丙烯醇分子中发生某种方式杂化的碳原子数,是丙醛分子中发生同样方式杂化的碳原子数的2倍,则这类碳原子的杂化方式为 。
AB
平面正方形
sp2
解析:[Cu(NH3)4]2+由铜离子与氨分子通过配位键形成,氨分子内部的化学键是极性共价键。根据[Cu(NH3)2Cl2]有两种不同的结构,可知[Cu(NH3)4]2+的空间结构是平面正方形。HOCH2CH=CH2中的C原子,有一个采取sp3杂化,两个采取sp2杂化;CH3CH2CHO中的C原子有两个采取sp3杂化,一个采取sp2杂化。
第三章 晶体结构与性质
第四节 配合物和超分子
无水CuSO4是白色的,为什么CuSO4·5H2O晶体却是蓝色的?
思考与讨论
一、配合物
1.配位键与配合物
固体
溶液颜色
无色离子:
CuSO4
CuCl2 2H2O
CuBr2
NaCl
K2SO4
KBr
什么离子呈天蓝色:
白色
白色
白色
白色
绿色
深褐色
[Cu(H2O)4]2+
SO42 –
天蓝色
天蓝色
天蓝色
无色
无色
无色
Na+
Cl-
K +
Br -
K +
实验[2—1]
向盛有下表中固体样品的试管中,分别加入足量的水,观察实验现象并填写下表
化合物 CuSO4 CuCl2 CuBr2 NaCl K2SO4 KBr
固体颜色 白色 绿色 深褐色 白色 白色 白色
溶液颜色 天蓝色 天蓝色 天蓝色 无色 无色 无色
实验
实验证明,上述实验中呈蓝色的物质是水合铜离子,可表示为[Cu(H2O)4]2+,叫做四水合铜离子。
在四水合铜离子中,铜离子与水分子之间的化学键是由水分子提供孤电子对给予铜离子,铜离子接受水分子的孤电子对形成的,这类“电子对给予-接受”键被称为配位键。
①定义
②形成条件
一方提供孤电子对(配体)
一方提供空轨道
常见的配体
X-
CO
CN
H2O
NH3
SCN-
(1)配位键
由一个原子单方面提供孤电子对而另一个原子接受孤电子对形成的共价键,即“电子对给予——接受”键被称为配位键。提供空轨道的原子或离子称为中心原子或离子,提供孤电子的原子对应的分子或离子称为配体或配位体。
中心原子(离子):提供空轨道,接受孤电子对。通常是过渡元素的原子或离子,如Fe、Ni、Fe3+、Cu2+、Zn2+、Ag+、Co3+、Cr3+等。
配位体:提供孤电子对的分子或离子,如分子CO、NH3、H2O等,阴离子F-、CN-、Cl-等。
注意:
①配位键是一种特殊的共价键,配位键与共价键性质完全相同.
②配位键同样具有饱和性和方向性,一般来说,多数过渡金属的原子或离子形成配位键的数目是基本不变的,如Ag+形成2个配位键;Cu2+形成4个配位键等。
③H3O+、NH4+中含有配位键.
③配位键的表示方法
H
O
H
H
Cu
H2O
H2O
H2O
OH2
2+
请你写出NH4+的配位键的表示法?
平面正方形结构
[Cu(H2O)4]2+
(电子对给予体)A→B(电子对接受体)或A—B
配位键与非极性键、极性键的区别与联系
比较 共价键类型 非极性键 极性键 配位键
本质 相邻原子间的共用电子对(电子云重叠)与原子核间的静电作用 成键条件 (元素种类) 成键原子得、失电子能力相同(同种元素) 成键原子得、失电子能力差别较小 (不同元素) 成键原子一方有孤电子对(配体),另一方有空轨道(中心离子或原子)
特征 有方向性、饱和性 配位键实质上是一种特殊的共价键。配位键的共用电子对由成键原子单方面提供,普通共价键的共用电子对则由成键原子双方共同提供,但实质是相同的。
思考与讨论
(1) 中的配位键与其他三个N—H键的键参数是否相同
提示:相同。 可看成NH3分子结合1个H+后形成的,在NH3分子中中心原子氮采取sp3杂化,孤电子对占据一个杂化轨道,3个未成对电子分别占据另3个杂化轨道,分
别结合3个H原子形成3个σ键,由于孤电子对的排斥,所以NH3分子的空间结构为三角锥形,键角压缩至107°。当遇到H+时,N原子的孤电子对会进入H+的空轨道,以配位键形成 ,这样N原子就不再存在孤电子对,键角恢复至109°28',故 为正四面体形,4个N—H键完全相同,配位键与普通共价键形成过程不同,但各种键参数完全相同。
(2)配合物[Cu(NH3)4]SO4中含有的化学键类型有哪些
提示:[Cu(NH3)4]SO4中含有的化学键有离子键、共价键和配位键。
(3)NH3和BF3可以通过配位键形成NH3·BF3,试分析提供孤电子对、空轨道的分别是哪种原子
提示:N原子提供孤电子对,B原子提供空轨道。
(4)配制银氨溶液时,向AgNO3溶液中滴加氨水,先生成白色沉淀,后沉淀逐渐溶解,为什么
提示:氨水呈弱碱性,滴入AgNO3溶液中会生成AgOH白色沉淀;继续滴加氨水时,NH3分子与Ag+形成[Ag(NH3)2]+配合离子,使AgOH逐渐溶解,反应过程如下:
(2)配合物
金属离子(或原子)与某些分子或离子(称为配体或配位体)以配位键结合形成的化合物,称为配位化合物,简称配合物。
①定义
②配合物的组成
金属离子或原子与某些分子或离子(称为配体)以配位键结合而形成的化合物称为配位化合物。配位化合物的组成如图:
一般中心原子(或中心离子)的配位数是2、4、6。
③配合物的命名
①配离子念法:配位数→配体名称→合→中心原子(离子)名称
②配合物→类似于盐(酸、碱)的念法
六氰合铁酸钾
氢氧化二氨合银
三氯一氨合铂酸钾
硫酸四氨合铜
[Cu(NH3)4] SO4
K3[Fe(CN)6]
[Ag(NH3)2]OH
K[Pt(NH3)Cl3]
练习:
(1)溶解性的影响
如:AgCl→[Ag(NH3)2]Cl,由不溶于水的沉淀,转变为易溶于水的物质。
(2)颜色的改变
当简单离子形成配离子时其性质往往有很大变化。颜色变化就是一种常见的现象,我们根据颜色的变化就可以判断是否有配离子生成。如Fe3+与SCN-在溶液中可生成配位数为1~6的配离子,这些配离子的颜色是红色的。
⑤配合物的形成对性质的影响
(3)稳定性增强
配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。当中心离子相同时,配合物的稳定性与配体的性质有关。例如,血红素中的Fe2+与CO分子形成的配位键比Fe2+与O2分子形成的配位键强,因此血红素中的Fe2+与CO分子结合后,就很难再与O2分子结合,导致血红素失去输送氧气的功能,这是CO使人体中毒的原理。
④形成配合物的条件
(1)配体有孤电子对。
(2)中心原子(或离子)有空轨道。
实验[2—2] 向盛有4ml0.1mol.L-1硫酸铜溶液试管中滴加几滴1mol.L-1氨水,首先形成难溶物,继续添加氨水并振荡试管,观察实验现象;再向试管中加入8ml95%乙醇,并用玻璃棒摩擦试管壁,观察实验现象。
配合物的形成
实验操作 实验现象 实验原理
向盛有4mL 0.1mol/L CuSO4溶液的试管里滴加几滴1 mol/L 氨水
继续添加氨水并振荡试管
再向试管中加入极性较小的溶剂(如加入8 mL 95%乙醇),并用玻璃棒摩擦试管壁
形成难溶物
难溶物溶解,得到深蓝色的透明溶液
析出深蓝色晶体
Cu2+ + 2NH3·H2O = Cu(OH)2↓+2NH4+
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
深蓝色晶体为[Cu(NH3)4]SO4·H2O,说明该配合物在乙醇中的溶解度小于在水中的溶解度
实验证明,无论在得到的深蓝色透明溶液中,还是在析出的深蓝色的晶体中,深蓝色都是由于存在 [Cu(NH3)4]2+,它是Cu2+的另一种常见配离子,中心离子仍然是Cu2+,而配体是NH3,配位数为4。
实验2-3
向盛有少量0.1mol.L-1氯化铁溶液(或任何含有的Fe3+溶液)的试管中滴加1滴0.1mol.L-1硫氰化钾(KSCN)溶液,观察实验现象。
现象:生成血红色溶液
原因:生成[Fe(SCN)n]3-n(n=1~6)
作用:检验或鉴定Fe3+,用于电影特技和魔术表演
⑤配合物的形成实验
实验 操作
实验 现象 滴加氨水后,试管中首先出现蓝色沉淀,氨水过量后沉淀逐渐溶解,滴加乙醇后析出深蓝色晶体 溶液颜色变成 红色 先产生白色沉淀,滴加氨水后白色沉淀溶解
有关 离子 方程 式或 化学 方程 式 Cu2++2NH3·H2O=== Cu(OH)2↓+2 , Cu(OH)2+4NH3=== [Cu(NH3)4](OH)2, [Cu(NH3)4]2++ +H2O === [Cu(NH3)4]SO4·H2O↓ Fe3++3SCN-===Fe(SCN)3 Ag++Cl-===AgCl↓;
AgCl+2NH3=== [Ag(NH3)2]Cl-
配合物广泛存在于自然界中,跟人类生活有密切关系。例如,在人和动物体内起输送氧气作用的血红素,是Fe2+的配合物。配合物在生产和科学技术方面的应用也很广泛。
⑥配合物的用途
1.超分子是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体。超分子是广义的,包括离子。
2.超分子实例
(1)用超分子分离C60和C70。
二、超分子
冠醚识别碱金属离子。不同大小的冠醚可以识别不同大小的碱金属离子。
冠醚 适合的粒子(直径/pm)
12-冠-4 15-冠-5 18-冠-6 21-冠-7 Li+
Na+
K+
Rb+
Cs+
(2)冠醚识别碱金属离子(如K+)。
冠醚是皇冠状的分子,可有不同大小的空穴适配不同大小的碱金属离子
(3)超分子两个的重要特征——分子识别、自组装。
1.形成配位键的条件是一方有空轨道,另一方有孤电子对。 ( )
2.配位键是一种特殊的共价键。( )
3.配位化合物中的配体可以是分子也可以是阴离子。( )
4.共价键的形成条件是成键原子必须有未成对电子。( )
5.超分子是相对分子质量很大的有机化合物。( )
1.判断正误(正确的打“√”,错误的打“×”)
√
√
√
×
×
2.向盛有硫酸铜水溶液的试管里滴加氨水,首先形成难溶物,继续滴加氨水,难溶物溶解得到深蓝色的透明溶液,下列对此现象的说法正确的是( )
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的物质的量不变
B.沉淀溶解后,生成深蓝色的配离子[Cu(NH3)4]2+
C.向反应后的溶液中加入乙醇,溶液将不会发生变化,因为[Cu(NH3)4]2+不会与乙醇发生反应
D.在[Cu(NH3)4]2+中,Cu2+给出孤电子对,NH3提供空轨道
B
解析:向CuSO4溶液中加入过量氨水发生的反应是CuSO4+2NH3·H2O === Cu(OH)2↓+(NH4)2SO4;
Cu(OH)2+2NH3·H2O+(NH4)2SO4 ===[Cu(NH3)4]SO4+4H2O,故A项不正确,B项正确;由于[Cu(NH3)4]SO4在乙醇中的溶解度远小于在水中的溶解度,故加入乙醇会产生沉淀,C项不正确;在生成[Cu(NH3)4]2+过程中,Cu2+提供空轨道,NH3给出孤电子对,D项不正确。
规律总结 准确判断配位键的方法:(1)掌握好配位键的形成条件:①一种原子或离子有空轨道,常见的可提供空轨道的是过渡元素的离子或原子,如Cu2+、Ag+、Fe、Ni等;②另一种原子或离子有孤电子对,常见的含孤电子对的配体有:分子如CO、NH3、H2O等,离子如Cl-、CN-、N等;(2)正确分析原子的最外层电子排布和成键情况。
3.下列关于[Cr(H2O)4Br2]Br·2H2O的说法正确的是( )
A.配体为水分子,配位原子为O,外界为Br-
B.中心离子的配位数为6
C.中心离子Cr3+采取sp3杂化
D.中心离子的化合价为+2价
解析:[Cr(H2O)4Br2]Br·2H2O中内界为[Cr(H2O)4Br2]+,Cr3+为中心离子,配体为H2O、Br-,配位数为6,外界为Br-、H2O,Cr3+提供的空轨道数为6,中心离子不是采取sp3杂化。
B
4.下列关于配位化合物的叙述中,不正确的是( )
A.配位化合物中必定存在配位键
B.配位化合物中只有配位键
C.[Fe(SCN)6]3-中的Fe3+提供空轨道,SCN-中的硫原子提供孤电子对形成配位键
D.许多过渡元素的离子(如Cu2+、Ag+等)和某些主族元素的离子或分子(如Cl-、NH3等)能形成配合物
解析:配位化合物中一定含有配位键,但也可能含有离子键等其他化学键,A正确,B错误;Fe3+、Cu2+、Ag+等过渡元素的离子有空轨道,可与有孤电子对的分子或离子形成配合物;NH3中的氮原子、SCN-中的硫原子等有孤电子对,可以形成配合物,C、D均正确。
B
5.下列微粒中含配位键的是( )
A.①②④⑦⑧ B.③④⑤⑥⑦
C.①④⑤⑥⑦⑧ D.①②③④⑤⑥⑦⑧
解析:形成配位键的条件是一个原子(或离子)有孤电子对,另一个原子(或离子)有空轨道。
C
6.(1)下列不属于配合物的是 。
A.[Cu(H2O)4]SO4·H2O
B.[Ag(NH3)2]OH
C.KAl(SO4)2·12H2O
D.Na[Al(OH)4]
(2)在配合物[Fe(SCN)]2+中,提供空轨道接受孤电子对的微粒是 ;画出配合物离子[Cu(NH3)4]2+中的配位键 。
C
Fe3+
7.Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
(1)[Cu(NH3)4]2+中存在的化学键类型有 (填字母)。
A.配位键 B.极性共价键
C.非极性共价键 D.离子键
(2)[Cu(NH3)4]2+具有对称的空间结构,[Cu(NH3)4]2+中的两个NH3分子被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间结构为 。
(3)某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:HOCH2CH=CH2→CH3CH2CHO。在丙烯醇分子中发生某种方式杂化的碳原子数,是丙醛分子中发生同样方式杂化的碳原子数的2倍,则这类碳原子的杂化方式为 。
AB
平面正方形
sp2
解析:[Cu(NH3)4]2+由铜离子与氨分子通过配位键形成,氨分子内部的化学键是极性共价键。根据[Cu(NH3)2Cl2]有两种不同的结构,可知[Cu(NH3)4]2+的空间结构是平面正方形。HOCH2CH=CH2中的C原子,有一个采取sp3杂化,两个采取sp2杂化;CH3CH2CHO中的C原子有两个采取sp3杂化,一个采取sp2杂化。
