化学必修Ⅰ人教新课标第三章金属及其化合物课件
文档属性
| 名称 | 化学必修Ⅰ人教新课标第三章金属及其化合物课件 |

|
|
| 格式 | zip | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-08-13 00:00:00 | ||
图片预览






文档简介
(共20张PPT)
第三章 金属及其化合物
第二节 几种重要的金属化合物
(第三课时)
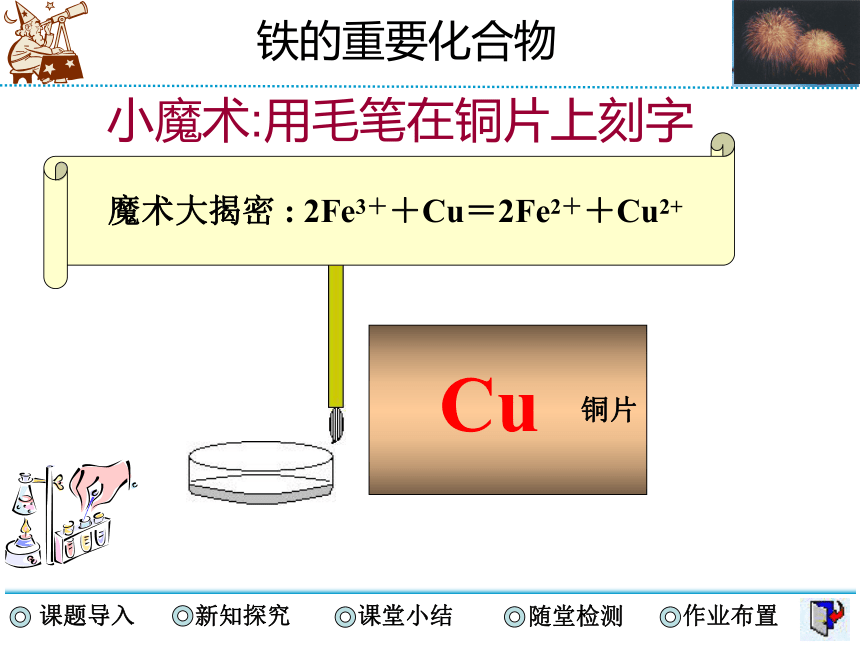
小魔术:用毛笔在铜片上刻字
铜片
Cu
魔术大揭密 : 2Fe3++Cu=2Fe2++Cu2+
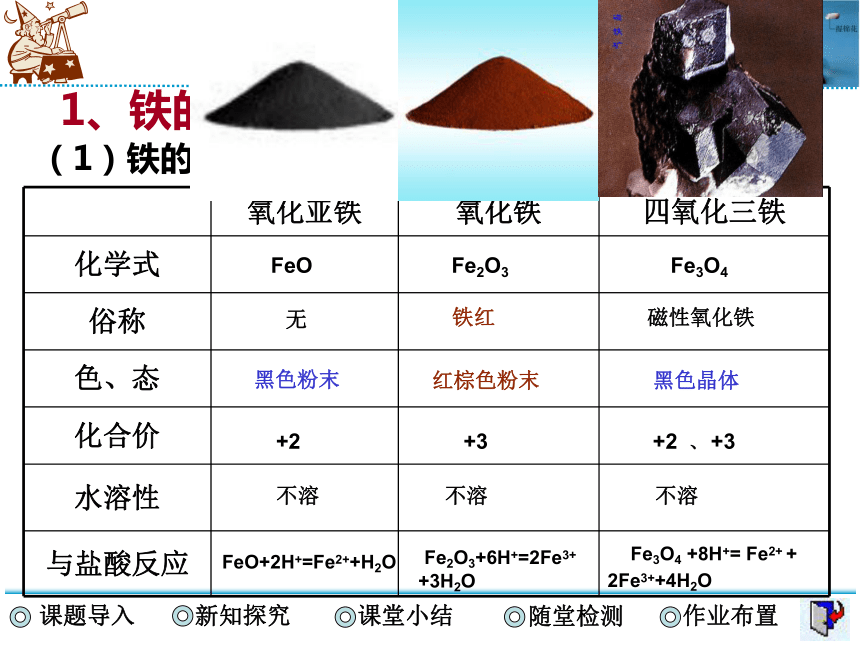
1、铁的氧化物
(1)铁的氧化物的性质比较
氧化亚铁 氧化铁 四氧化三铁
化学式
俗称
色、态
化合价
水溶性
与盐酸反应
FeO
无
黑色粉末
+2
不溶 不溶 不溶
FeO+2H+=Fe2++H2O
Fe2O3+6H+=2Fe3+
+3H2O
Fe3O4 +8H+= Fe2+ + 2Fe3++4H2O
Fe2O3
Fe3O4
铁红
磁性氧化铁
红棕色粉末
黑色晶体
+3
+2 、+3
(2) 铁的氧化物的用途
Ⅰ. 作为冶炼金属的原料
Fe2O3+3CO===2Fe+3CO2
Ⅱ. 氧化铁常用于制造红色油漆和涂料
氧化铁作外墙涂料
高温
2 、铁的氢氧化物
思考:如何制备Fe(OH)3 Fe(OH)2 ?
有两种:Fe(OH)3 、Fe(OH)2
【实验3-9】
FeCl3、FeSO4溶液分别与NaOH溶液的反应
加入NaOH溶液产生的现象
离子
方程式
FeCl3溶液
FeSO4溶液
产生红褐色的沉淀
先有灰白色的沉淀,
迅速变成灰绿色,
最后变成红褐色沉淀
Fe3++3OH- =Fe(OH)3↓
Fe2++2OH-=Fe(OH)2 ↓
4Fe(OH)2+O2+2H2O=
4Fe(OH)3
结 论
铁盐和亚铁盐溶液与氢氧化钠溶液反应,分别生成了不同颜色的
沉淀。故可以用氢氧化钠溶液对二者进行鉴定。
(1) Fe(OH)3 、Fe(OH) 2 的制备
Fe(OH)2转变过程
FeSO4+2NaOH=Fe(OH)2↓+Na2SO4
4Fe(OH)2+O2+2H2O=4Fe(OH)3
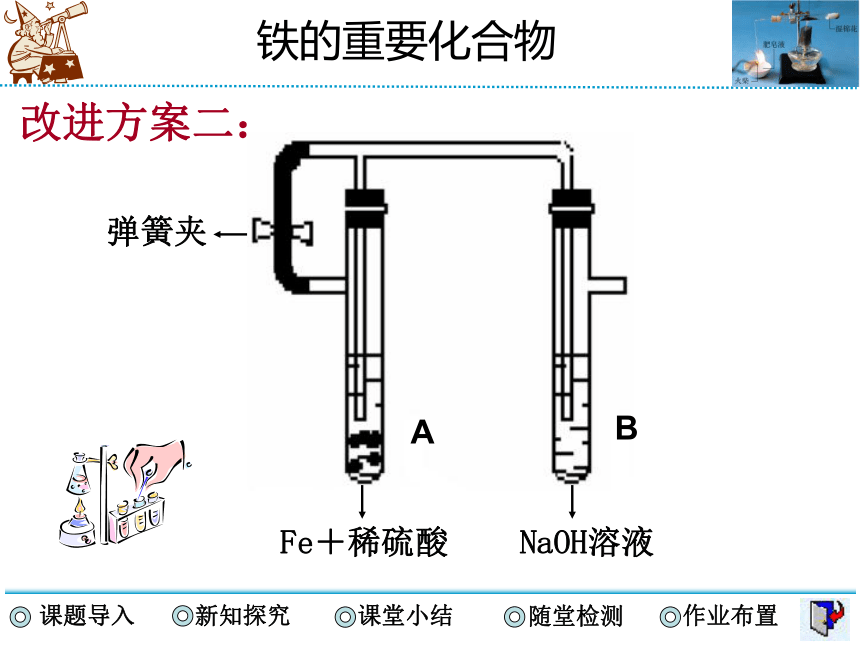
怎样才能使Fe(OH)2的氧化速率变慢?请根据Fe(OH)2的性质,设计一个制取Fe(OH)2实验的改进装置。
思考
改进实验方案一:
用煮沸过蒸馏水配制的NaOH溶液
植物油或苯
新配制的FeSO4溶液
改进方案二:
弹簧夹
Fe+稀硫酸
NaOH溶液
A
B
改进方案三:将纯净的FeSO4溶液和NaHCO3溶液混合
原理: (利用盐类的水解反应)
FeSO4+2NaHCO3= Fe(OH)2↓+2CO2↑+Na2SO4
优点:(1)操作简单
(2)现象明显
反应中不断产生的二氧化碳气体将体系中的氧气排出,降低了氢氧化亚铁被氧化的几率,能比较持久地观察到白色的沉淀
⑵铁的氢氧化物的化学性质:
Fe(OH)2+2H+= Fe2++2H2O;
Fe(OH)3+3H+= Fe3++3H2O;
△
2Fe(OH)3==== Fe2O3+3H2O;
3、铁盐和亚铁盐
常见的铁盐和亚铁盐
铁盐:FeCl3 、 Fe2(SO4)3 、 Fe(NO3)3
亚铁盐: FeCl2 、Fe(SO4)2 、Fe(NO3)2
[实验3-10]在2支试管里注入少量FeSO4和FeCl3溶液,各滴入几滴KSCN溶液。
滴加KSCN溶液
FeSO4(左)
FeCl3(右)
溶液呈血红色
溶液颜色没有变化
Fe3++3SCN-=Fe(SCN)3(血红色)
结论:
(1)、Fe3+离子的检验
在FeCl3溶液中加入Fe粉,振荡。再滴入几滴KSCN
溶液,观察现象。
反应方程式: 2FeCl3 + Fe = 3FeCl2
(氧化剂)
(还原剂)
(氧化剂)
(还原剂)
现象:
结论:
离子方程式: 2Fe3++ Fe = 3Fe2+
金属铜也能将Fe3+还原: 2FeCl3 + Cu = 2FeCl2+CuCl2
科学探究1:
溶液不显血红色
溶液中不含Fe3+
(2)Fe2+和Fe3+的转化
在以上所得到的FeCl2和KSCN的混合溶液中,滴加氯水(Cl2),观察现象。
现象:
结论:
反应方程式: 2FeCl2 + Cl2 = 2FeCl3
离子方程式: 2Fe2+ + Cl2 = 2Fe3++2Cl-
(还原剂)
(氧化剂)
科学探究2:
溶液变成血红色
原溶液中的Fe2+转变成Fe3+
总结:
+氧化剂(Cl2)
+还原剂(Fe)
Fe2+
Fe3+
还原剂
氧化剂
随堂检测
1.将下列四种化合物溶于稀盐酸,滴加硫氰化钾溶液没有颜色变化的是: ( )
A.FeS B.Fe2O3
C.FeCl3 D.Fe2(SO4)3
随堂检测
2. 硫酸亚铁溶液含有杂质硫酸铜和硫酸铁,为除去杂质,提纯硫酸亚铁,应该加入下列哪种物质 ( )
A.锌粉 B.镁粉
C.铁粉 D. 铝粉
作业
1、课内作业:完成课本P63页习题8、9、10 、 11。
2、实践活动:
尝试设计一个制取Fe(OH)2的实验装置或利用本节课所学知识设计一个趣味实验 。(一周后交)
第三章 金属及其化合物
第二节 几种重要的金属化合物
(第三课时)
小魔术:用毛笔在铜片上刻字
铜片
Cu
魔术大揭密 : 2Fe3++Cu=2Fe2++Cu2+
1、铁的氧化物
(1)铁的氧化物的性质比较
氧化亚铁 氧化铁 四氧化三铁
化学式
俗称
色、态
化合价
水溶性
与盐酸反应
FeO
无
黑色粉末
+2
不溶 不溶 不溶
FeO+2H+=Fe2++H2O
Fe2O3+6H+=2Fe3+
+3H2O
Fe3O4 +8H+= Fe2+ + 2Fe3++4H2O
Fe2O3
Fe3O4
铁红
磁性氧化铁
红棕色粉末
黑色晶体
+3
+2 、+3
(2) 铁的氧化物的用途
Ⅰ. 作为冶炼金属的原料
Fe2O3+3CO===2Fe+3CO2
Ⅱ. 氧化铁常用于制造红色油漆和涂料
氧化铁作外墙涂料
高温
2 、铁的氢氧化物
思考:如何制备Fe(OH)3 Fe(OH)2 ?
有两种:Fe(OH)3 、Fe(OH)2
【实验3-9】
FeCl3、FeSO4溶液分别与NaOH溶液的反应
加入NaOH溶液产生的现象
离子
方程式
FeCl3溶液
FeSO4溶液
产生红褐色的沉淀
先有灰白色的沉淀,
迅速变成灰绿色,
最后变成红褐色沉淀
Fe3++3OH- =Fe(OH)3↓
Fe2++2OH-=Fe(OH)2 ↓
4Fe(OH)2+O2+2H2O=
4Fe(OH)3
结 论
铁盐和亚铁盐溶液与氢氧化钠溶液反应,分别生成了不同颜色的
沉淀。故可以用氢氧化钠溶液对二者进行鉴定。
(1) Fe(OH)3 、Fe(OH) 2 的制备
Fe(OH)2转变过程
FeSO4+2NaOH=Fe(OH)2↓+Na2SO4
4Fe(OH)2+O2+2H2O=4Fe(OH)3
怎样才能使Fe(OH)2的氧化速率变慢?请根据Fe(OH)2的性质,设计一个制取Fe(OH)2实验的改进装置。
思考
改进实验方案一:
用煮沸过蒸馏水配制的NaOH溶液
植物油或苯
新配制的FeSO4溶液
改进方案二:
弹簧夹
Fe+稀硫酸
NaOH溶液
A
B
改进方案三:将纯净的FeSO4溶液和NaHCO3溶液混合
原理: (利用盐类的水解反应)
FeSO4+2NaHCO3= Fe(OH)2↓+2CO2↑+Na2SO4
优点:(1)操作简单
(2)现象明显
反应中不断产生的二氧化碳气体将体系中的氧气排出,降低了氢氧化亚铁被氧化的几率,能比较持久地观察到白色的沉淀
⑵铁的氢氧化物的化学性质:
Fe(OH)2+2H+= Fe2++2H2O;
Fe(OH)3+3H+= Fe3++3H2O;
△
2Fe(OH)3==== Fe2O3+3H2O;
3、铁盐和亚铁盐
常见的铁盐和亚铁盐
铁盐:FeCl3 、 Fe2(SO4)3 、 Fe(NO3)3
亚铁盐: FeCl2 、Fe(SO4)2 、Fe(NO3)2
[实验3-10]在2支试管里注入少量FeSO4和FeCl3溶液,各滴入几滴KSCN溶液。
滴加KSCN溶液
FeSO4(左)
FeCl3(右)
溶液呈血红色
溶液颜色没有变化
Fe3++3SCN-=Fe(SCN)3(血红色)
结论:
(1)、Fe3+离子的检验
在FeCl3溶液中加入Fe粉,振荡。再滴入几滴KSCN
溶液,观察现象。
反应方程式: 2FeCl3 + Fe = 3FeCl2
(氧化剂)
(还原剂)
(氧化剂)
(还原剂)
现象:
结论:
离子方程式: 2Fe3++ Fe = 3Fe2+
金属铜也能将Fe3+还原: 2FeCl3 + Cu = 2FeCl2+CuCl2
科学探究1:
溶液不显血红色
溶液中不含Fe3+
(2)Fe2+和Fe3+的转化
在以上所得到的FeCl2和KSCN的混合溶液中,滴加氯水(Cl2),观察现象。
现象:
结论:
反应方程式: 2FeCl2 + Cl2 = 2FeCl3
离子方程式: 2Fe2+ + Cl2 = 2Fe3++2Cl-
(还原剂)
(氧化剂)
科学探究2:
溶液变成血红色
原溶液中的Fe2+转变成Fe3+
总结:
+氧化剂(Cl2)
+还原剂(Fe)
Fe2+
Fe3+
还原剂
氧化剂
随堂检测
1.将下列四种化合物溶于稀盐酸,滴加硫氰化钾溶液没有颜色变化的是: ( )
A.FeS B.Fe2O3
C.FeCl3 D.Fe2(SO4)3
随堂检测
2. 硫酸亚铁溶液含有杂质硫酸铜和硫酸铁,为除去杂质,提纯硫酸亚铁,应该加入下列哪种物质 ( )
A.锌粉 B.镁粉
C.铁粉 D. 铝粉
作业
1、课内作业:完成课本P63页习题8、9、10 、 11。
2、实践活动:
尝试设计一个制取Fe(OH)2的实验装置或利用本节课所学知识设计一个趣味实验 。(一周后交)
