化学必修I人教版3.1金属的化学性质课件1
文档属性
| 名称 | 化学必修I人教版3.1金属的化学性质课件1 |  | |
| 格式 | zip | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-08-13 16:54:48 | ||
图片预览







文档简介
(共38张PPT)
第三章 金属及其化合物
第一节 金属的化学性质(第1课时)
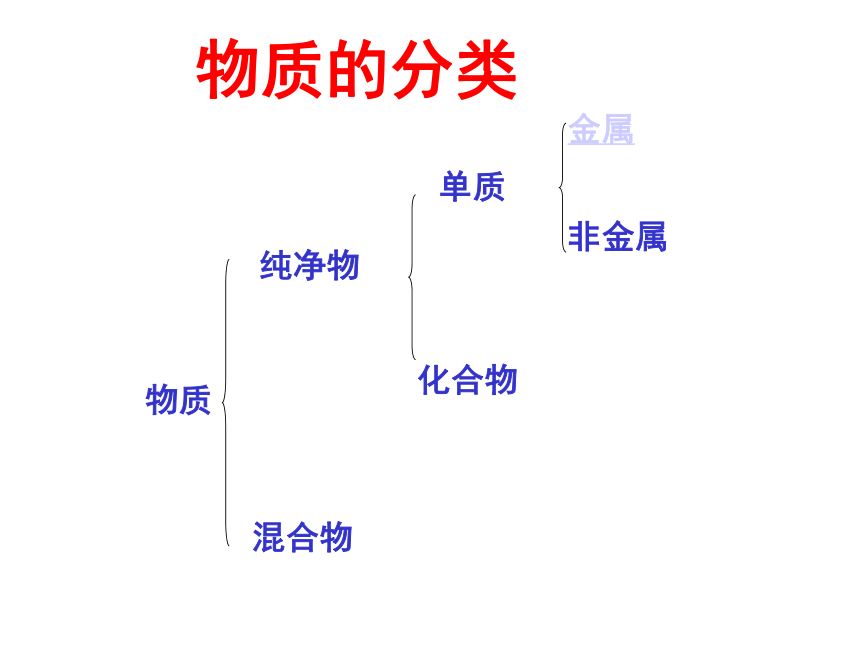
物质
纯净物
混合物
单质
化合物
金属
非金属
物质的分类
青铜器
铁器
铝合金
铁
合金
铜
银
金
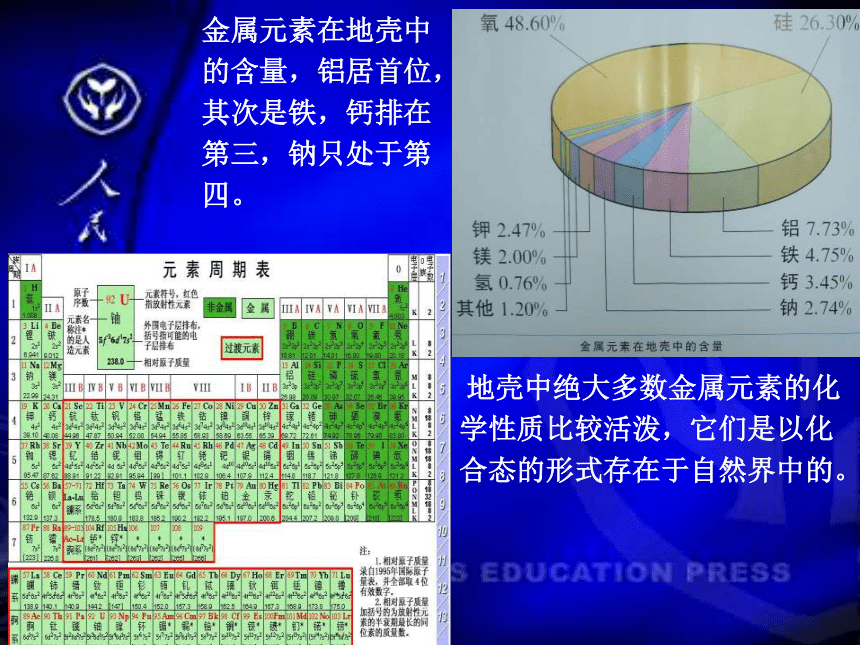
地壳中绝大多数金属元素的化学性质比较活泼,它们是以化合态的形式存在于自然界中的。
金属元素在地壳中的含量,铝居首位,其次是铁,钙排在第三,钠只处于第四。
金属在自然界里的分布
1.人类发现的一百多种元素中,约80%是 金属元素。在元素周期表中,有16种非金属,6种惰性气体元素,87种金属元素。金属大约占五分之四。金属在周期表中的位置:分布在斜线左下方.
见周期表
2、金属在自然界里的存在形式:
①化合态:绝大多数:如Fe2O3、CuS、NaCl、MgSO4等
②游离态(单质):极少数.如:铂、金。
研究物质的性质,常用的步骤是什么?
①物理性质:色态味,溶解性、熔沸点、密度、硬度、导电导热性、延展性等.
②化学性质:化学特性以及与非金属、酸、碱、盐溶液等的反应情况。
启发:是拿过来一一研究,还是选几个代表?
金属那么多,郁闷啊! 怎么学啊?
1、金属的颜色、光泽
绝大多数金属都是银白色,具有金属光泽,
少数金属是特殊颜色如铜是紫红色,金是金
黄色。
3、延展性
延性:拉成细丝的性质。
展性:压成薄片的性质。
黑色金属:铁Fe、铬Cr、锰Mn;
有色金属:除铁、铬、锰外的金属。
一、金属的物理性质--通性
2、良好的导电、导热性
金属的原子结构特点
Na
Mg
Al
结构决定性质.性质反映结构!
启发:为什么大多数金属以化合态形式存在于自然界中?
分析:金属最外层一般是少于4个电子,反应中很容易
失去,表现出较强的还原性。很容易被氧气等活
泼的非金属单质所氧化,其在金属活动顺序表
中越靠左越易发生化学反应.
2.分析下列图片中的反应,写出反应的化学方程式。
①
铝丝与硫酸铜溶液反应
②
镁条燃烧
③
铜丝与硝酸银溶液反应
④
镁条与稀盐酸反应
思考与交流
1.结合初中化学,说明金属能与哪些物质发生化反应?
2Al+3CuSO4=Al2(SO4 )3+3Cu
Cu+2AgNO3=Cu(NO3)2+2Ag
Mg+2HCl=MgCl2+H2
2Mg+O2===2MgO
点燃
④
①
②
③
1、钠与氧气的反应
一、金属与非金属的反应
金属钠的介绍:
钠的密度是0.97g/cm3,质地柔软,化学性质很活泼,容易和氧气、水等物质反应。
保存方法:保存在煤油中。
原理:钠密度大于煤油,沉在底部,
隔绝了与空气的接触。
钠也可以用石蜡(膏状物)封存。
实验3-1:用镊子夹取存放在煤油中的金属钠,用滤纸吸干钠及镊子表面的煤油,用镊子夹紧放在玻璃片上,用小刀切去一端的外皮。观察钠的颜色、光泽、感受钠的硬度。
注意事项:凡是接触钠的用具都必须是干燥的。取用钠后剩余的钠应放回原瓶,残余的钠的碎屑不能随意乱扔。
实验探究3—2:钠在空气中加热
2Na + O2 === Na2O2
加热
常温下
4Na + O2 == 2Na2O
(白色)
加热或点燃
0
0
+1
-1
失去2e-
得到2e-
0
0
+1
-2
失去4e-
得到4e-
注意: 条件不一样,产物不同
不稳定
稳定
点燃
1.钠与氧气反应
2Na +O2 == Na2O2 (淡黄色)
过氧化钠
一、金属与非金属的反应
钠与其他非金属反应
反应剧烈
2Na + S =研磨= Na2S
点燃
2Na + Cl2 == 2NaCl
燃烧
白烟
爆炸
钠与氯气反应
钠与硫反应
一、金属与非金属的反应
科学探究:铝箔在空气中加热
未打磨的铝箔加热
打磨过的铝箔加热
4Al + 3O2 == 2Al2O3
加热
2、铝与氧气的反应
一、金属与非金属的反应
4Al + 3O2 === 2Al2O3
加热
强调:生活中Al2O3很多,如烧水用的铝壶,用一段时间后会发现表面变成灰色,这一层就是Al2O3,它很致密,起到保护内层金属的作用,故在洗刷时,不要将它硬刷掉。
Al2O3:白色固体
许多金属都能与氧气反应,反应的剧烈程度与其活泼性有关。其中越活泼的金属越容易反应,如Na、K等在空气中就能反应;Mg、Fe、Al等在加热或点燃时与氧气反应;不活泼金属反应时条件强一些。
金属与氧气反应的规律:
4、铝与某些氧化物的反应—铝热反应
2Al+Fe2O3===2Fe+Al2O3
4Al+3MnO2===3Mn+2Al2O3
3、镁与其它非金属和氧化物反应(N2、CO2等)
3Mg+N2===Mg3N2
2Mg+CO2===2MgO+C 2Mg+SO2===2MgO+S
应用:用来冶炼高熔点金属。
一、金属与非金属的反应
加热
点燃
加热
点燃
点燃
铝热剂:铝与高熔点金属氧化物
原理:Al为还原剂,放热,生成液态金属。
5、铁与非金属反应
点燃
△
3Fe + 2O2 Fe3O4
结论:根据Fe与O2、Cl2、S反应后的生成物中铁
元素的化合价,比较这三种非金属单质的
氧化性强弱。
2Fe + 3Cl2 2FeCl3
点燃
Fe + S == FeS
第三章 金属及其化合物
第一节 金属的化学性质(第1课时)
物质
纯净物
混合物
单质
化合物
金属
非金属
物质的分类
青铜器
铁器
铝合金
铁
合金
铜
银
金
地壳中绝大多数金属元素的化学性质比较活泼,它们是以化合态的形式存在于自然界中的。
金属元素在地壳中的含量,铝居首位,其次是铁,钙排在第三,钠只处于第四。
金属在自然界里的分布
1.人类发现的一百多种元素中,约80%是 金属元素。在元素周期表中,有16种非金属,6种惰性气体元素,87种金属元素。金属大约占五分之四。金属在周期表中的位置:分布在斜线左下方.
见周期表
2、金属在自然界里的存在形式:
①化合态:绝大多数:如Fe2O3、CuS、NaCl、MgSO4等
②游离态(单质):极少数.如:铂、金。
研究物质的性质,常用的步骤是什么?
①物理性质:色态味,溶解性、熔沸点、密度、硬度、导电导热性、延展性等.
②化学性质:化学特性以及与非金属、酸、碱、盐溶液等的反应情况。
启发:是拿过来一一研究,还是选几个代表?
金属那么多,郁闷啊! 怎么学啊?
1、金属的颜色、光泽
绝大多数金属都是银白色,具有金属光泽,
少数金属是特殊颜色如铜是紫红色,金是金
黄色。
3、延展性
延性:拉成细丝的性质。
展性:压成薄片的性质。
黑色金属:铁Fe、铬Cr、锰Mn;
有色金属:除铁、铬、锰外的金属。
一、金属的物理性质--通性
2、良好的导电、导热性
金属的原子结构特点
Na
Mg
Al
结构决定性质.性质反映结构!
启发:为什么大多数金属以化合态形式存在于自然界中?
分析:金属最外层一般是少于4个电子,反应中很容易
失去,表现出较强的还原性。很容易被氧气等活
泼的非金属单质所氧化,其在金属活动顺序表
中越靠左越易发生化学反应.
2.分析下列图片中的反应,写出反应的化学方程式。
①
铝丝与硫酸铜溶液反应
②
镁条燃烧
③
铜丝与硝酸银溶液反应
④
镁条与稀盐酸反应
思考与交流
1.结合初中化学,说明金属能与哪些物质发生化反应?
2Al+3CuSO4=Al2(SO4 )3+3Cu
Cu+2AgNO3=Cu(NO3)2+2Ag
Mg+2HCl=MgCl2+H2
2Mg+O2===2MgO
点燃
④
①
②
③
1、钠与氧气的反应
一、金属与非金属的反应
金属钠的介绍:
钠的密度是0.97g/cm3,质地柔软,化学性质很活泼,容易和氧气、水等物质反应。
保存方法:保存在煤油中。
原理:钠密度大于煤油,沉在底部,
隔绝了与空气的接触。
钠也可以用石蜡(膏状物)封存。
实验3-1:用镊子夹取存放在煤油中的金属钠,用滤纸吸干钠及镊子表面的煤油,用镊子夹紧放在玻璃片上,用小刀切去一端的外皮。观察钠的颜色、光泽、感受钠的硬度。
注意事项:凡是接触钠的用具都必须是干燥的。取用钠后剩余的钠应放回原瓶,残余的钠的碎屑不能随意乱扔。
实验探究3—2:钠在空气中加热
2Na + O2 === Na2O2
加热
常温下
4Na + O2 == 2Na2O
(白色)
加热或点燃
0
0
+1
-1
失去2e-
得到2e-
0
0
+1
-2
失去4e-
得到4e-
注意: 条件不一样,产物不同
不稳定
稳定
点燃
1.钠与氧气反应
2Na +O2 == Na2O2 (淡黄色)
过氧化钠
一、金属与非金属的反应
钠与其他非金属反应
反应剧烈
2Na + S =研磨= Na2S
点燃
2Na + Cl2 == 2NaCl
燃烧
白烟
爆炸
钠与氯气反应
钠与硫反应
一、金属与非金属的反应
科学探究:铝箔在空气中加热
未打磨的铝箔加热
打磨过的铝箔加热
4Al + 3O2 == 2Al2O3
加热
2、铝与氧气的反应
一、金属与非金属的反应
4Al + 3O2 === 2Al2O3
加热
强调:生活中Al2O3很多,如烧水用的铝壶,用一段时间后会发现表面变成灰色,这一层就是Al2O3,它很致密,起到保护内层金属的作用,故在洗刷时,不要将它硬刷掉。
Al2O3:白色固体
许多金属都能与氧气反应,反应的剧烈程度与其活泼性有关。其中越活泼的金属越容易反应,如Na、K等在空气中就能反应;Mg、Fe、Al等在加热或点燃时与氧气反应;不活泼金属反应时条件强一些。
金属与氧气反应的规律:
4、铝与某些氧化物的反应—铝热反应
2Al+Fe2O3===2Fe+Al2O3
4Al+3MnO2===3Mn+2Al2O3
3、镁与其它非金属和氧化物反应(N2、CO2等)
3Mg+N2===Mg3N2
2Mg+CO2===2MgO+C 2Mg+SO2===2MgO+S
应用:用来冶炼高熔点金属。
一、金属与非金属的反应
加热
点燃
加热
点燃
点燃
铝热剂:铝与高熔点金属氧化物
原理:Al为还原剂,放热,生成液态金属。
5、铁与非金属反应
点燃
△
3Fe + 2O2 Fe3O4
结论:根据Fe与O2、Cl2、S反应后的生成物中铁
元素的化合价,比较这三种非金属单质的
氧化性强弱。
2Fe + 3Cl2 2FeCl3
点燃
Fe + S == FeS
