化学高中二年级人教版3.3盐类的水解
文档属性
| 名称 | 化学高中二年级人教版3.3盐类的水解 |  | |
| 格式 | zip | ||
| 文件大小 | 8.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-08-13 16:57:33 | ||
图片预览










文档简介
(共36张PPT)
热烈欢迎
各位老师莅临指导!
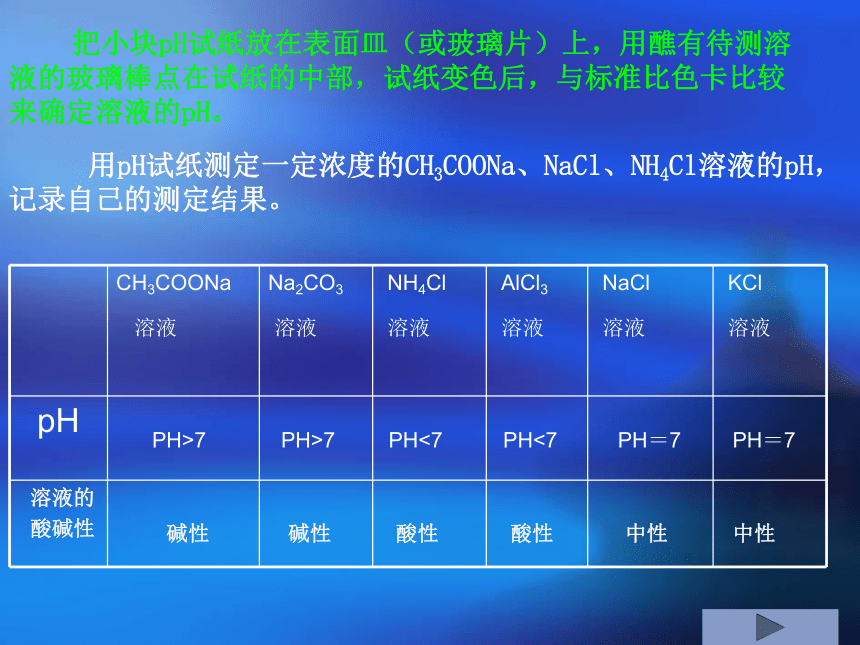
用pH试纸测定溶液的pH,正确操作是:
把小块pH试纸放在表面皿(或玻璃片)上,用醮有待测溶液的玻璃棒点在试纸的中部,试纸变色后,与标准比色卡比较来确定溶液的pH。
用pH试纸测定一定浓度的CH3COONa、NaCl、NH4Cl溶液的pH,记录自己的测定结果。
CH3COONa
溶液 Na2CO3
溶液 NH4Cl
溶液
AlCl3
溶液 NaCl
溶液 KCl
溶液
pH
溶液的
酸碱性
PH<7
PH<7
PH>7
PH>7
PH=7
PH=7
碱性
碱性
酸性
酸性
中性
中性
把小块pH试纸放在表面皿(或玻璃片)上,用醮有待测溶液的玻璃棒点在试纸的中部,试纸变色后,与标准比色卡比较来确定溶液的pH。
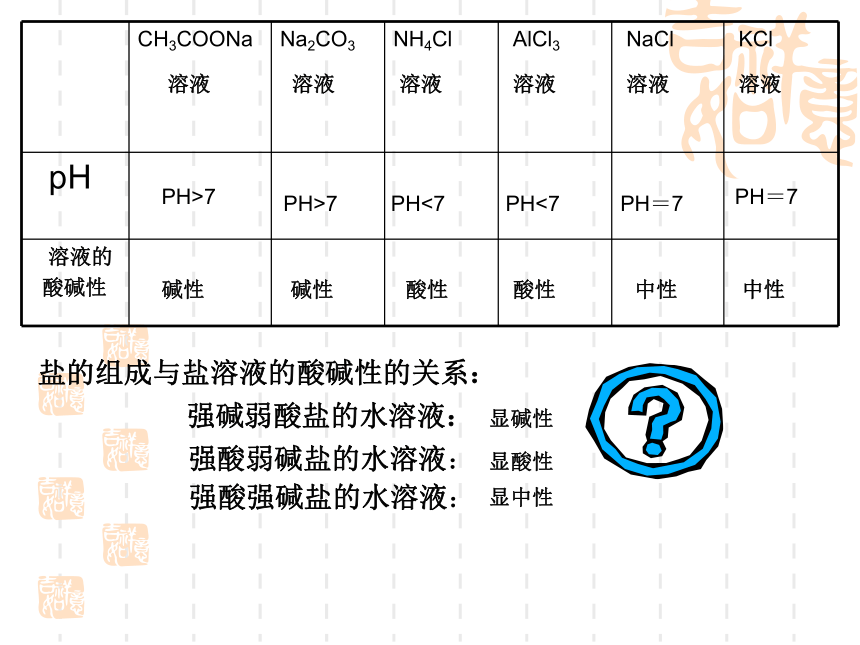
同样为盐溶液,Na2CO3、NaCl、NH4Cl等溶液,却表现出不同的酸碱性,溶液的酸碱性与生成该盐的酸和碱的强弱间有什么关系?
CH3COONa
溶液 Na2CO3
溶液 NH4Cl
溶液
AlCl3
溶液 NaCl
溶液 KCl
溶液
pH
溶液的
酸碱性
PH<7
PH<7
PH>7
PH>7
PH=7
PH=7
碱性
碱性
酸性
酸性
中性
中性
强碱弱酸盐的水溶液:
强酸弱碱盐的水溶液:
强酸强碱盐的水溶液:
显碱性
显酸性
显中性
盐的组成与盐溶液的酸碱性的关系:
OH-与H+毫无疑问都来自于水的电离;按理说,由水电离出来的H+和OH-的物质的量浓度总是相等的, 即c(OH-)=c(H+),为什么某些盐溶液中会出现不相等的情况,表现出不同的酸碱性呢?
CH3COONa=CH3COO - + Na+
H2O H+ + OH-
CH3COOH
CH3COONa的水溶液显碱性的原因
CH3COONa + H2O CH3COOH+NaOH
CH3COO-+H2O CH3COOH+OH_
1. CH3COONa的电离
2. 水的电离
CH3COONa溶于水时,CH3COONa电离出的CH3COO-和水电离出的H+结合生成弱电解质CH3COOH,消耗了溶液中的H+,破坏了水的电离平衡,使水的电离平衡向右移动,产生更多的OH-,建立新平衡时,c(OH-)>c(H+),从而使溶液显碱性。
一、盐类的水解
在溶液中盐电离出的离子跟水所电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。
水解的条件:
水解的实质:
水解的结果:
水解反应与中和反应的关系:
酸+碱 盐+水
中和
水解
生成弱电解质。
破坏了水的电离平衡,促进了水的电离。
使溶液中C(H+) ≠C(OH-)
CH3COONa=CH3COO - + Na+
1.强碱弱酸盐的水解
H2O H+ + OH-
CH3COOH
CH3COO- +H2O CH3COOH+OH-
CH3COONa + H2O CH3COOH+NaOH
多元弱酸 强碱盐的水解:
分步水解
Na2CO3=2Na++CO32-
第一步水解:
第二步水解:
两步的水解程度第一步大于第二步水解,以第一步为主。溶液中的OH-主要来自于第一步水解.
一般盐类水解的程度很小,水解产物很少。通常不生成沉淀和和气体,也不发生分解。在书写离子方程式时一般不标“↓”和“↑”,也不把生成物(如H2CO3等)写成其分解产物的形式。
CO3 + H2O HCO3 +OH
2-
—
—
其他的强碱弱酸盐如K2CO3、Na2S、Na3PO4等的水解也是这种类型。
Na2CO3的水解
NH4Cl = NH4+ + Cl-
2.强酸弱碱盐的水解
NH3·H2O
H2O OH- + H+
NH4+ + H2O NH3·H2O + H+
NH4Cl +H2O NH3.H2O + HCl
其他的强酸弱碱盐如Cu(NO3)2、Al2(SO4)3、(NH4)2SO4等的水解也是这种类型。
NH4Cl的水解:
多元弱碱的强酸盐的水解
多元弱碱的阳离子水解过程较为复杂,通常写成一步完成。
Fe3++3H2O Fe(OH)3 + 3H+
3.强酸强碱盐
FeCl3+3H2O Fe(OH)3 + 3HCl
例如:氯化铁
盐
类 实
例 能否
水解 发生水解的离子 对水电离平衡的影响 溶液的
酸碱性
CH3COONa
能
弱酸阴
离子
促进水的电离
碱性
NH4Cl
能
弱碱阳
离子
促进水的电离
酸性
NaCl
不能
无
无
中性
强碱
弱酸盐
强酸
弱碱盐
强碱
强酸盐
小结
从表中反映的信息,你能否发现一些规律?
水解规律:
有弱才水解;
无弱不水解;
谁弱谁水解;
谁强显谁性。
二、盐类水解方程式的书写
3.弱碱阳离子参与水解,生成弱碱;多元弱碱阳离子分步水解,水解离子方程式一步完成,水的系数为阳离子的电荷数。
2.弱酸根阴离子参与水解,生成弱酸或酸式弱酸根;多元弱酸根阴离子分步水解,(阴离子带几个电荷就要水解几步)水解离子方程式步步照写,水的系数始终是1。不过,第一步水解最易,第二步较难,第三步水解更难。
1、盐类水解一般是比较微弱的,通常用“ ” 表示,同时不产生沉淀和气体,也不发生分解。在书写离子方程式时一般不标“↓”和“↑”,也不把生成物(如H2CO3、NH3.H2O等)写成其分解产物的形式。
4.盐类水解反应可视作中和反应的逆反应。
5.注意配平方程式。
例、书写下列物质水解的离子方程式: (NH4)2SO4 、Na2S
(NH4)2SO4 +2H2O 2NH3.H2O+H2SO4
NH4 +H2O NH3.H2O+H
+
+
Na2S+H2O NaHS+NaOH
NaHS+H2O NaOH+H2S
S +H2O HS +OH
2—
—
—
HS +H2O H2 S +OH
—
—
{
小结:
有弱才水解;
无弱不水解;
谁弱谁水解;
谁强显谁性。
水解规律:
水解方程式的书写:
酸+碱 盐+水
中和
水解
这里有4个问题,你想回答哪一个?
幻灯片 4222
幻灯片 423
幻灯片 424
幻灯片 1
开 心 辞 典
AlCl3+3H2O Al(OH)3+3HCl
Al +3H2O Al(OH)3+3H
3+
+
NaF + H2O HF+NaOH
F- + H2O HF+OH-
练习1:
请写出NaF 、AlCl3水解的离子方程式:
练一练
下列物质能使水的电离程度增大的( )
A NaOH B Na2CO3
C H2SO4 D KNO3
B
想一想
练习2:
下列离子在水溶液中不会发生水解的是( )
A 、 NH4+ B、 SO42_ C 、 Al3+ D 、 F_
练习3:
B
想一想
某浓度的NH4Cl溶液中,离子浓度关系正确的是( )
A. C(NH4+)= C( Cl- )
B. C( H+ ) < C( OH-)
C. C( H+ ) = C(OH-)
D. C( Cl- ) > C(NH4+)
D
练习4:
想一想
作业:
1.完成课本相关习题;
2.写出 HS- 的电离方程式与水解方程式;
3.阅读课本第二部分,了解水解的应用.
4.课后探究:
课后探究:
灭火器原理
玻璃筒里面放入的是Al2(SO4)3溶液。
外筒(钢质)放入的是NaHCO3溶液
该灭火器的灭火原理怎样?灭火器中发生了怎样的反应?
可访问:http://baike./view/414134.htm
理解1:在溶液中盐电离出的离子跟水电离出的H+或OH—生成弱电解质(弱酸或弱碱),从而破坏水的电离平衡,使溶液显示出不同程度的酸碱性。
理解2:弱酸的阴离子,结合了水所电离出来的H+或弱碱的阳离子结合了水所电离出来的OH— 生成弱电解质,破坏水的电离平衡,从而使溶液中H+与OH—量的关系发生变化,进而使溶液显示出不同程度的酸碱性。
Na2CO3的水解
Na2CO3的水解较CH3COONa的水解复杂,分两步进行:第一步 CO32-先与水电离出来的 H+结合为HCO3-
CO3 + H2O HCO3 +OH
2-
—
—
第二步水解的HCO3-进一步与水电离产生的H+结合为碳酸分子,但由于受到第一步水解的抑制,第二步水解程度很小。
Na2CO3=2Na++CO32-
H2O H+ + OH-
HCO3-
想一想
某些肉类食品中加入适量的亚硝钠(NaNO2),可改善食品的外观和增加香味。但NaNO2剧毒,其外观和食盐相似而且有咸味,因而将它误认为食盐使用发生的中毒事件时有发生,你知道如何用简单的方法鉴别他们吗?
(提示:HNO2为弱酸)
热烈欢迎
各位老师莅临指导!
用pH试纸测定溶液的pH,正确操作是:
把小块pH试纸放在表面皿(或玻璃片)上,用醮有待测溶液的玻璃棒点在试纸的中部,试纸变色后,与标准比色卡比较来确定溶液的pH。
用pH试纸测定一定浓度的CH3COONa、NaCl、NH4Cl溶液的pH,记录自己的测定结果。
CH3COONa
溶液 Na2CO3
溶液 NH4Cl
溶液
AlCl3
溶液 NaCl
溶液 KCl
溶液
pH
溶液的
酸碱性
PH<7
PH<7
PH>7
PH>7
PH=7
PH=7
碱性
碱性
酸性
酸性
中性
中性
把小块pH试纸放在表面皿(或玻璃片)上,用醮有待测溶液的玻璃棒点在试纸的中部,试纸变色后,与标准比色卡比较来确定溶液的pH。
同样为盐溶液,Na2CO3、NaCl、NH4Cl等溶液,却表现出不同的酸碱性,溶液的酸碱性与生成该盐的酸和碱的强弱间有什么关系?
CH3COONa
溶液 Na2CO3
溶液 NH4Cl
溶液
AlCl3
溶液 NaCl
溶液 KCl
溶液
pH
溶液的
酸碱性
PH<7
PH<7
PH>7
PH>7
PH=7
PH=7
碱性
碱性
酸性
酸性
中性
中性
强碱弱酸盐的水溶液:
强酸弱碱盐的水溶液:
强酸强碱盐的水溶液:
显碱性
显酸性
显中性
盐的组成与盐溶液的酸碱性的关系:
OH-与H+毫无疑问都来自于水的电离;按理说,由水电离出来的H+和OH-的物质的量浓度总是相等的, 即c(OH-)=c(H+),为什么某些盐溶液中会出现不相等的情况,表现出不同的酸碱性呢?
CH3COONa=CH3COO - + Na+
H2O H+ + OH-
CH3COOH
CH3COONa的水溶液显碱性的原因
CH3COONa + H2O CH3COOH+NaOH
CH3COO-+H2O CH3COOH+OH_
1. CH3COONa的电离
2. 水的电离
CH3COONa溶于水时,CH3COONa电离出的CH3COO-和水电离出的H+结合生成弱电解质CH3COOH,消耗了溶液中的H+,破坏了水的电离平衡,使水的电离平衡向右移动,产生更多的OH-,建立新平衡时,c(OH-)>c(H+),从而使溶液显碱性。
一、盐类的水解
在溶液中盐电离出的离子跟水所电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。
水解的条件:
水解的实质:
水解的结果:
水解反应与中和反应的关系:
酸+碱 盐+水
中和
水解
生成弱电解质。
破坏了水的电离平衡,促进了水的电离。
使溶液中C(H+) ≠C(OH-)
CH3COONa=CH3COO - + Na+
1.强碱弱酸盐的水解
H2O H+ + OH-
CH3COOH
CH3COO- +H2O CH3COOH+OH-
CH3COONa + H2O CH3COOH+NaOH
多元弱酸 强碱盐的水解:
分步水解
Na2CO3=2Na++CO32-
第一步水解:
第二步水解:
两步的水解程度第一步大于第二步水解,以第一步为主。溶液中的OH-主要来自于第一步水解.
一般盐类水解的程度很小,水解产物很少。通常不生成沉淀和和气体,也不发生分解。在书写离子方程式时一般不标“↓”和“↑”,也不把生成物(如H2CO3等)写成其分解产物的形式。
CO3 + H2O HCO3 +OH
2-
—
—
其他的强碱弱酸盐如K2CO3、Na2S、Na3PO4等的水解也是这种类型。
Na2CO3的水解
NH4Cl = NH4+ + Cl-
2.强酸弱碱盐的水解
NH3·H2O
H2O OH- + H+
NH4+ + H2O NH3·H2O + H+
NH4Cl +H2O NH3.H2O + HCl
其他的强酸弱碱盐如Cu(NO3)2、Al2(SO4)3、(NH4)2SO4等的水解也是这种类型。
NH4Cl的水解:
多元弱碱的强酸盐的水解
多元弱碱的阳离子水解过程较为复杂,通常写成一步完成。
Fe3++3H2O Fe(OH)3 + 3H+
3.强酸强碱盐
FeCl3+3H2O Fe(OH)3 + 3HCl
例如:氯化铁
盐
类 实
例 能否
水解 发生水解的离子 对水电离平衡的影响 溶液的
酸碱性
CH3COONa
能
弱酸阴
离子
促进水的电离
碱性
NH4Cl
能
弱碱阳
离子
促进水的电离
酸性
NaCl
不能
无
无
中性
强碱
弱酸盐
强酸
弱碱盐
强碱
强酸盐
小结
从表中反映的信息,你能否发现一些规律?
水解规律:
有弱才水解;
无弱不水解;
谁弱谁水解;
谁强显谁性。
二、盐类水解方程式的书写
3.弱碱阳离子参与水解,生成弱碱;多元弱碱阳离子分步水解,水解离子方程式一步完成,水的系数为阳离子的电荷数。
2.弱酸根阴离子参与水解,生成弱酸或酸式弱酸根;多元弱酸根阴离子分步水解,(阴离子带几个电荷就要水解几步)水解离子方程式步步照写,水的系数始终是1。不过,第一步水解最易,第二步较难,第三步水解更难。
1、盐类水解一般是比较微弱的,通常用“ ” 表示,同时不产生沉淀和气体,也不发生分解。在书写离子方程式时一般不标“↓”和“↑”,也不把生成物(如H2CO3、NH3.H2O等)写成其分解产物的形式。
4.盐类水解反应可视作中和反应的逆反应。
5.注意配平方程式。
例、书写下列物质水解的离子方程式: (NH4)2SO4 、Na2S
(NH4)2SO4 +2H2O 2NH3.H2O+H2SO4
NH4 +H2O NH3.H2O+H
+
+
Na2S+H2O NaHS+NaOH
NaHS+H2O NaOH+H2S
S +H2O HS +OH
2—
—
—
HS +H2O H2 S +OH
—
—
{
小结:
有弱才水解;
无弱不水解;
谁弱谁水解;
谁强显谁性。
水解规律:
水解方程式的书写:
酸+碱 盐+水
中和
水解
这里有4个问题,你想回答哪一个?
幻灯片 4222
幻灯片 423
幻灯片 424
幻灯片 1
开 心 辞 典
AlCl3+3H2O Al(OH)3+3HCl
Al +3H2O Al(OH)3+3H
3+
+
NaF + H2O HF+NaOH
F- + H2O HF+OH-
练习1:
请写出NaF 、AlCl3水解的离子方程式:
练一练
下列物质能使水的电离程度增大的( )
A NaOH B Na2CO3
C H2SO4 D KNO3
B
想一想
练习2:
下列离子在水溶液中不会发生水解的是( )
A 、 NH4+ B、 SO42_ C 、 Al3+ D 、 F_
练习3:
B
想一想
某浓度的NH4Cl溶液中,离子浓度关系正确的是( )
A. C(NH4+)= C( Cl- )
B. C( H+ ) < C( OH-)
C. C( H+ ) = C(OH-)
D. C( Cl- ) > C(NH4+)
D
练习4:
想一想
作业:
1.完成课本相关习题;
2.写出 HS- 的电离方程式与水解方程式;
3.阅读课本第二部分,了解水解的应用.
4.课后探究:
课后探究:
灭火器原理
玻璃筒里面放入的是Al2(SO4)3溶液。
外筒(钢质)放入的是NaHCO3溶液
该灭火器的灭火原理怎样?灭火器中发生了怎样的反应?
可访问:http://baike./view/414134.htm
理解1:在溶液中盐电离出的离子跟水电离出的H+或OH—生成弱电解质(弱酸或弱碱),从而破坏水的电离平衡,使溶液显示出不同程度的酸碱性。
理解2:弱酸的阴离子,结合了水所电离出来的H+或弱碱的阳离子结合了水所电离出来的OH— 生成弱电解质,破坏水的电离平衡,从而使溶液中H+与OH—量的关系发生变化,进而使溶液显示出不同程度的酸碱性。
Na2CO3的水解
Na2CO3的水解较CH3COONa的水解复杂,分两步进行:第一步 CO32-先与水电离出来的 H+结合为HCO3-
CO3 + H2O HCO3 +OH
2-
—
—
第二步水解的HCO3-进一步与水电离产生的H+结合为碳酸分子,但由于受到第一步水解的抑制,第二步水解程度很小。
Na2CO3=2Na++CO32-
H2O H+ + OH-
HCO3-
想一想
某些肉类食品中加入适量的亚硝钠(NaNO2),可改善食品的外观和增加香味。但NaNO2剧毒,其外观和食盐相似而且有咸味,因而将它误认为食盐使用发生的中毒事件时有发生,你知道如何用简单的方法鉴别他们吗?
(提示:HNO2为弱酸)
