1.3 物质的溶解性 习题——2021-2022学年鲁教版(五四制)九年级化学(word版 含解析)
文档属性
| 名称 | 1.3 物质的溶解性 习题——2021-2022学年鲁教版(五四制)九年级化学(word版 含解析) |

|
|
| 格式 | zip | ||
| 文件大小 | 71.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-14 11:03:44 | ||
图片预览


文档简介
物质的溶解性
一、单选题
a、b、c 三种物质的溶解度曲线如图所示。取等质量的 a、b、c 三种物质的饱和溶液,分别蒸发等量水后恢复至下列说法不正确的是
A. 原饱和溶液中,溶质的质量分数:
B. 恢复至 时,析出溶质的质量:
C. 恢复至时,三种溶液一定都是饱和溶液
D. 若继续降温至 ,三种溶液一定都是饱和溶液
依据下列时的实验和数据回答下列各题
已知:时,NaCl和的溶解度分别为和。
序号
固体种类 NaCl NaCl
固体的质量 30 60 30 60 90
水的质量 100 100 100 100 100
所得溶液属于饱和溶液的是
A. B. C. D.
下列关于所得溶液的说法不正确的是
A. 溶质质量:
B. 溶液质量:
C. 溶质质量分数:
D. 中溶质与溶剂的质量比为9:10
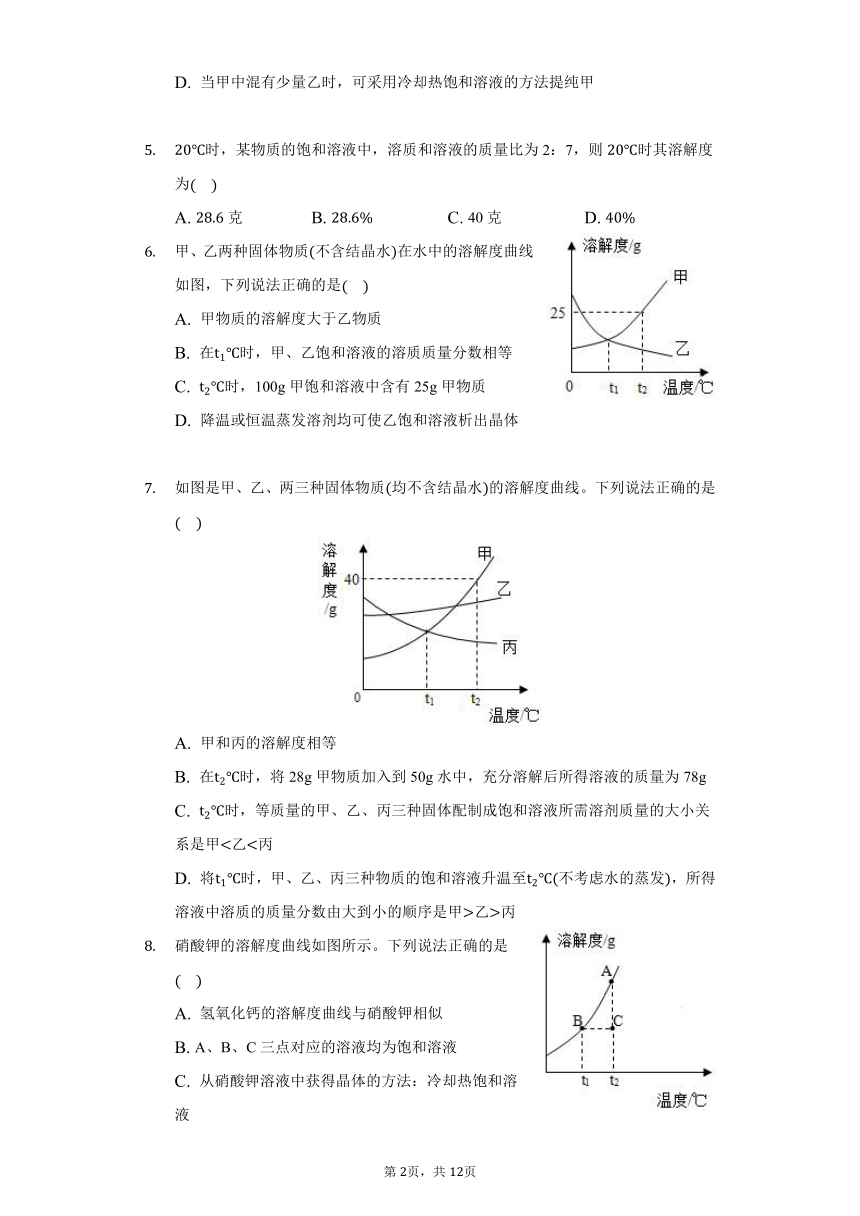
根据如图的溶解度曲线,判断下列说法中不正确的是
A. 甲物质的溶解度小于乙物质的溶解度
B. 时,甲物质和乙物质的溶解度相同
C. 将时甲、乙两物质的饱和溶液降温到时都会析出晶体
D. 当甲中混有少量乙时,可采用冷却热饱和溶液的方法提纯甲
时,某物质的饱和溶液中,溶质和溶液的质量比为2:7,则时其溶解度为
A. 克 B. C. 40克 D.
甲、乙两种固体物质不含结晶水在水中的溶解度曲线如图,下列说法正确的是
A. 甲物质的溶解度大于乙物质
B. 在时,甲、乙饱和溶液的溶质质量分数相等
C. 时,100g甲饱和溶液中含有25g甲物质
D. 降温或恒温蒸发溶剂均可使乙饱和溶液析出晶体
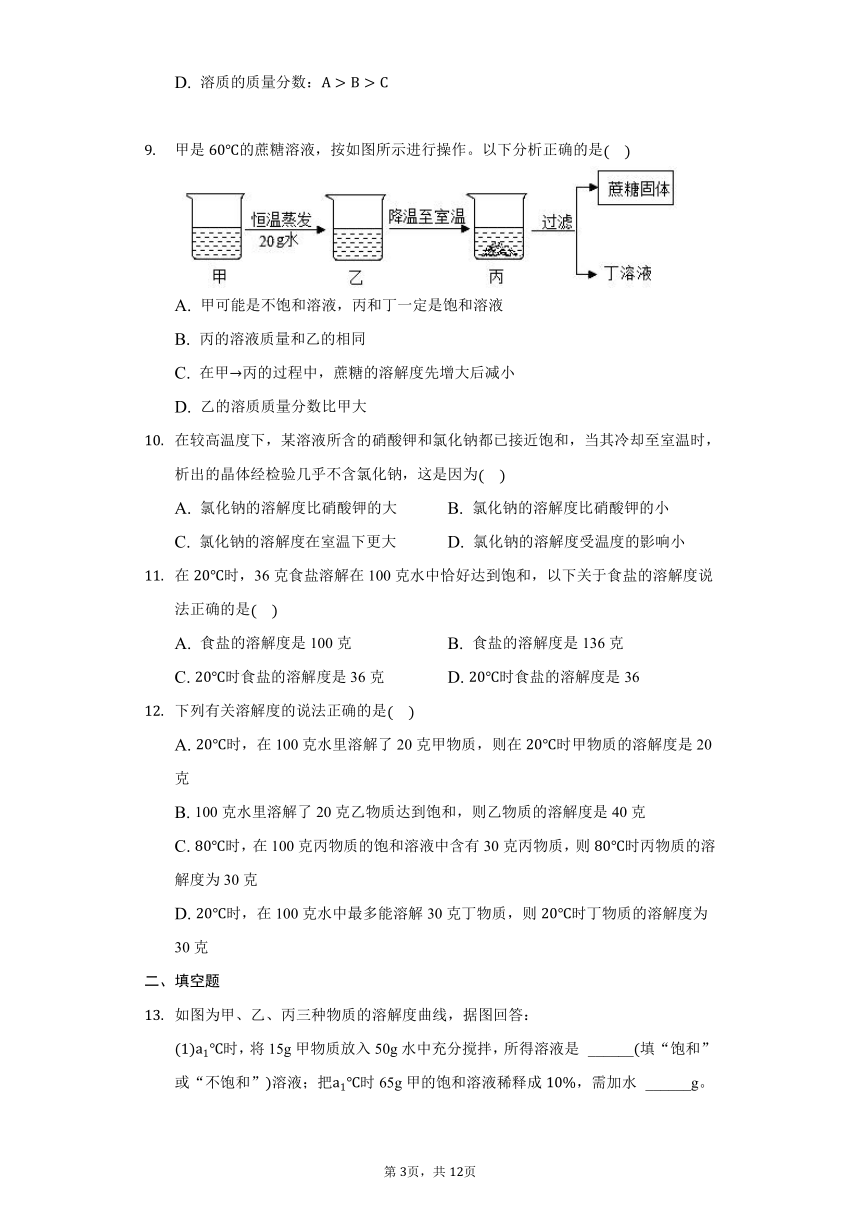
如图是甲、乙、两三种固体物质均不含结晶水的溶解度曲线。下列说法正确的是
A. 甲和丙的溶解度相等
B. 在时,将28g甲物质加入到50g水中,充分溶解后所得溶液的质量为78g
C. 时,等质量的甲、乙、丙三种固体配制成饱和溶液所需溶剂质量的大小关系是甲乙丙
D. 将时,甲、乙、丙三种物质的饱和溶液升温至不考虑水的蒸发,所得溶液中溶质的质量分数由大到小的顺序是甲乙丙
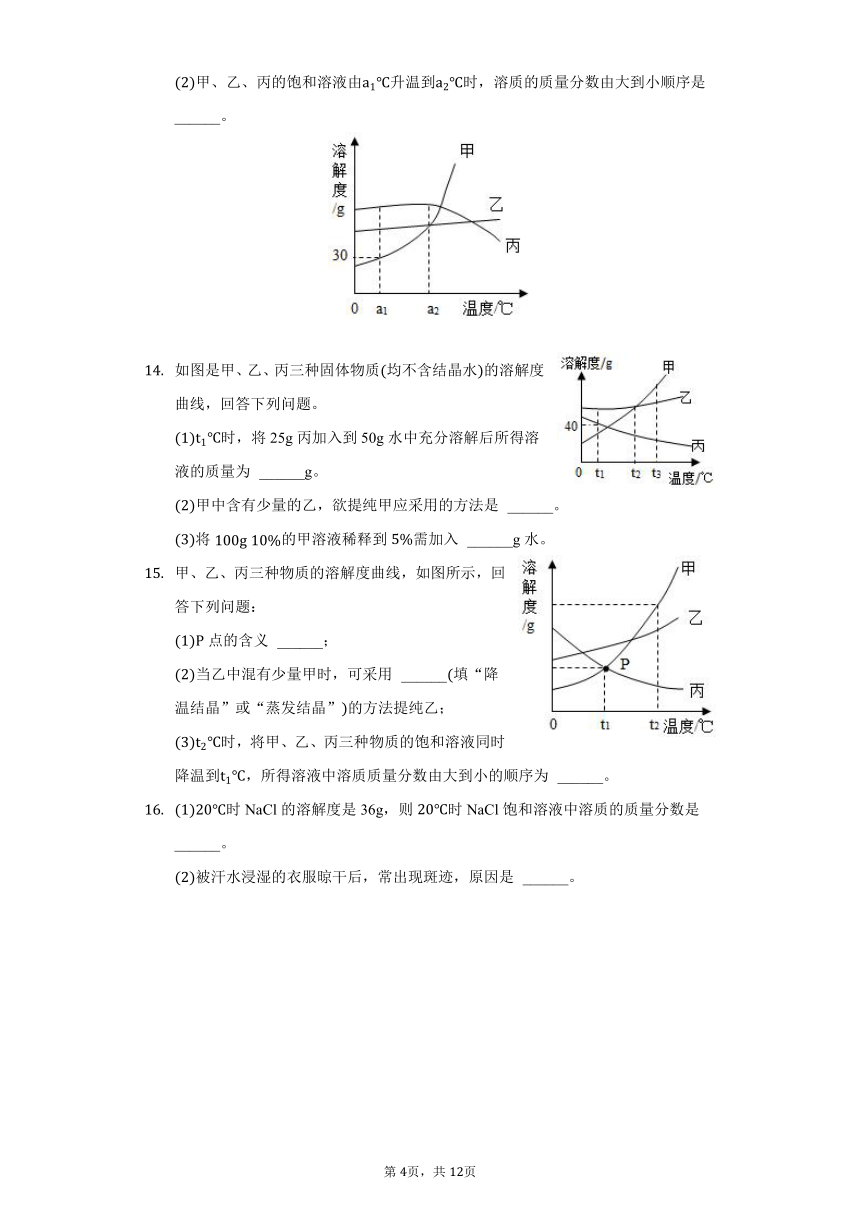
硝酸钾的溶解度曲线如图所示。下列说法正确的是
A. 氢氧化钙的溶解度曲线与硝酸钾相似
B. A、B、C三点对应的溶液均为饱和溶液
C. 从硝酸钾溶液中获得晶体的方法:冷却热饱和溶液
D. 溶质的质量分数:
甲是的蔗糖溶液,按如图所示进行操作。以下分析正确的是
A. 甲可能是不饱和溶液,丙和丁一定是饱和溶液
B. 丙的溶液质量和乙的相同
C. 在甲丙的过程中,蔗糖的溶解度先增大后减小
D. 乙的溶质质量分数比甲大
在较高温度下,某溶液所含的硝酸钾和氯化钠都已接近饱和,当其冷却至室温时,析出的晶体经检验几乎不含氯化钠,这是因为
A. 氯化钠的溶解度比硝酸钾的大 B. 氯化钠的溶解度比硝酸钾的小
C. 氯化钠的溶解度在室温下更大 D. 氯化钠的溶解度受温度的影响小
在时,36克食盐溶解在100克水中恰好达到饱和,以下关于食盐的溶解度说法正确的是
A. 食盐的溶解度是100克 B. 食盐的溶解度是136克
C. 时食盐的溶解度是36克 D. 时食盐的溶解度是36
下列有关溶解度的说法正确的是
A. 时,在100克水里溶解了20克甲物质,则在时甲物质的溶解度是20克
B. 100克水里溶解了20克乙物质达到饱和,则乙物质的溶解度是40克
C. 时,在100 克丙物质的饱和溶液中含有30克丙物质,则时丙物质的溶解度为30克
D. 时,在100克水中最多能溶解30克丁物质,则时丁物质的溶解度为30克
二、填空题
如图为甲、乙、丙三种物质的溶解度曲线,据图回答:
时,将15g甲物质放入50g水中充分搅拌,所得溶液是 ______填“饱和”或“不饱和”溶液;把时65g甲的饱和溶液稀释成,需加水 ______g。
甲、乙、丙的饱和溶液由升温到时,溶质的质量分数由大到小顺序是 ______。
如图是甲、乙、丙三种固体物质均不含结晶水的溶解度曲线,回答下列问题。
时,将25g丙加入到50g水中充分溶解后所得溶液的质量为 ______g。
甲中含有少量的乙,欲提纯甲应采用的方法是 ______。
将的甲溶液稀释到需加入 ______g水。
甲、乙、丙三种物质的溶解度曲线,如图所示,回答下列问题:
点的含义 ______;
当乙中混有少量甲时,可采用 ______填“降温结晶”或“蒸发结晶”的方法提纯乙;
时,将甲、乙、丙三种物质的饱和溶液同时降温到,所得溶液中溶质质量分数由大到小的顺序为 ______。
时NaCl的溶解度是36g,则时NaCl饱和溶液中溶质的质量分数是 ______。
被汗水浸湿的衣服晾干后,常出现斑迹,原因是 ______。
答案和解析
1.【答案】D
【解析】解:A、时,溶解度大小:,则原饱和溶液中,溶质的质量分数:,A选项不符合题意;
B、蒸发等量水,恢复至 时,因为析出的溶质若假设溶进蒸发掉的水中,也形成饱和溶液,原饱和溶液溶质的质量分数:,则析出溶质的质量:,B选项不符合题意;
C、恢复至时,三种溶液一定都是饱和溶液,因为原来就是饱和溶液,蒸发溶剂,溶质按一定的比例析出,C选项不符合题意;
D、若继续降温至 ,c不饱和,因为c的溶解度随温度的升高而减小,D选项符合题意;
故选:D。
本题考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关饱和溶液和不饱和溶液的转化等,本考点主要出现在选择题和填空题中。
2.【答案】
【小题1】C 【小题2】D
【解析】
【分析】
本题难度不大,掌握饱和溶液的特征、溶解度的含义是正确解答本题的关键。根据题意,时,NaCl和的溶解度分别为36g和88g,则该温度下100g水中最多溶解NaCl和的质量分别是36g和88g,进行分析判断。
【解答】
时,NaCl和的溶解度分别为36g和88g,则该温度下100g水中最多溶解NaCl和的质量分别是36g和88g,加入溶质的质量大于或等于36g和88g,能形成饱和溶液,则所得溶液属于饱和溶液的是。
故选C。
【分析】
本题难度不大,掌握饱和溶液的特征、溶解度的含义以及溶质的质量分数的计算是正确解答本题的关键。根据物质的溶解度判断固体是否能完全溶解在水中,然后根据所溶解的溶质的质量以及溶质的质量分数来分析解答。
【解答】
已知时,NaCl和的溶解度分别为36g和88g,所以能完全溶解,且为不饱和溶液;而中只能溶解36g氯化钠形成饱和溶液,中只能溶解88g硝酸钠形成饱和溶液;
A.溶液中溶质的质量为30g,中溶质的质量为36g,故A正确,但不符合题意;
B.溶液的质量为:;溶液的质量为:,故B正确,但不符合题意;
C.溶液和均是在100g水中溶解了30g溶质,故所得溶液中溶质的质量分数相等,故C正确,但不符合题意;
D.溶液是在100g水中溶解了88g硝酸钠,所以中溶质与溶剂的质量比为88::25,故D错误,但符合题意。
故选D。
4.【答案】A
【解析】解:A、比较溶解度大小须确定温度,温度大于时,甲物质的溶解度大于乙物质的溶解度,故错误;
B、时,甲物质和乙物质的溶解度相同,正确;
C、甲乙的溶解度均随温度的降低而减小,所以将时甲、乙两物质的饱和溶液降温到时都会析出晶体,正确;
D、甲的溶解度受温度影响较大,乙的溶解度受温度影响较小,所以当甲中混有少量乙时,可采用冷却热饱和溶液的方法提纯甲,正确;
故选:A。
A、比较溶解度大小须确定温度;
B、溶解度曲线的交点表示该温度下两物质的溶解度相等;
C、甲乙的溶解度均随温度的降低而减小,据此分析解答;
D、据甲乙的溶解度随温度变化情况分析提纯的方法.
解答本题的关键是知道溶解度曲线表示的意义,交点表示的意义,物质从溶液中结晶析出的方法等知识,考查了学生分析、解决问题的能力.
5.【答案】C
【解析】解:设则时其溶解度为x,,;
故选:C。
固体溶解度是指:在一定温度下,某固体物质在100克溶剂里达到饱和状态所溶解的质量;固体的溶解度由四个要点:一定温度、100g溶剂、达到饱和状态、溶解的溶质的质量;根据溶质和溶液的质量比,求溶解度。
本考点考查了固体物质的溶解度,溶解度的概念有四个要点:指明温度;克溶剂;达到饱和状态;质量即单位是克。本考点是中考的一个重要考点,一定要加强记忆,理解应用。
6.【答案】B
【解析】解:A、在比较物质的溶解度时,需要指明温度,温度不能确定,溶解度大小也不能确定,故A错误;
B、在时,甲、乙物质的溶解度相等,饱和溶液溶质质量分数,所以饱和溶液的溶质质量分数相等,故B正确;
C、时,甲物质的溶解度是25g,所以125g甲饱和溶液中含有25g甲物质,故C错误;
D、乙物质的溶解度随温度的升高而减小,所以升温或恒温蒸发溶剂均可使乙饱和溶液析出晶体,故D错误。
故选:B。
根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度,从而确定饱和溶液的溶质质量;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断温度改变后,饱和溶液中是否会析出晶体。
本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
7.【答案】C
【解析】解:A、在比较物质的溶解度时,需要指明温度,温度不能确定,溶解度大小也不能确定,故A错误;
B、在时,甲物质的溶解度是40g,将28g甲物质加入到50g水中,只能溶解20g的固体,所以充分溶解后所得溶液的质量为70g,故B错误;
C、时,甲物质的溶解度最大,丙物质的溶解度最小,所以等质量的甲、乙、丙三种固体配制成饱和溶液所需溶剂质量的大小关系是甲乙丙,故C正确;
D、时,乙物质的溶解度最大,甲、丙物质的溶解度相等,甲、乙、丙三种物质的饱和溶液升温至不考虑水的蒸发,甲、乙物质的溶解度增大,不会析出固体,乙物质的溶解度减小,析出固体,应该按照时的溶解度计算,所以所得溶液中溶质的质量分数由大到小的顺序是乙甲丙,故D错误。
故选:C。
根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度,从而确定形成溶液的质量;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断提纯晶体的方法。
本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
8.【答案】C
【解析】解:A、硝酸钾的溶解度随温度的升高而增大,氢氧化钙的溶解度随温度的升高而减小,故A错误;
B、A、B对应的溶液均为饱和溶液,C点对应的溶液为不饱和溶液,故B错误;
C、硝酸钾的溶解度受温度变化影响较大,所以从硝酸钾溶液中获得晶体的方法:冷却热饱和溶液,故C正确;
D、溶质的质量分数:,是因为A、B都是饱和溶液,C是B通过升高温度得到的不饱和溶液,故D错误。
故选:C。
根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度;可以判断物质的溶解度随温度变化的变化情况,从而判断从溶液中得到晶体的方法。
本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
9.【答案】D
【解析】解:A、甲是的蔗糖溶液,恒温蒸发,没有晶体析出,得到乙溶液,说明甲一定是不饱和溶液,故选项说法错误。
B、甲是的蔗糖溶液,恒温蒸发,没有晶体析出,得到乙溶液,乙溶液降温结晶有晶体析出,得到丙溶液,丙的溶液质量和乙的一定不同,故选项说法错误。
C、在甲丙的过程中,甲是的蔗糖溶液,恒温蒸发,温度不变,蔗糖的溶解度不变;再降温结晶,蔗糖的溶解度减小,故选项说法错误。
D、甲是的蔗糖溶液,恒温蒸发,没有晶体析出,得到乙溶液,甲、乙中所含溶质质量相等,乙中溶剂质量比甲中少,则乙的溶质质量分数比甲大,故选项说法正确。
故选:D。
根据甲是的蔗糖溶液,恒温蒸发,没有晶体析出,得到乙溶液,乙溶液降温结晶有晶体析出,得到丙溶液,进行分析判断。
本题难度不大,明确变化过程中溶液组成的变化、溶解度的影响因素等是正确解答本题的关键。
10.【答案】D
【解析】解:冷却硝酸钾和氯化钠的热饱和溶液,析出的晶体中几乎不含氯化钠,是因为氯化钠的溶解度受温度变化影响很小,几乎不随温度的降低而降低,故几乎不析出氯化钠晶体;
故选:D。
根据课本知识可知,不同物质的溶解度受温度变化影响不同,氯化钠的溶解度受温度变化影响不大,在冷却热饱和溶液时不容易析出晶体.
硝酸钾的溶解度随温度升高而升高,氯化钠的溶解度随温度变化比较小,熟石灰的溶解度随温度的升高而降低.
11.【答案】C
【解析】解:A、100克是溶剂的质量,故A错误;
B、136克是饱和溶液中溶质与溶剂的质量之和,故B错误;
C、在时,36克食盐溶解在100克水中恰好达到饱和,所以时食盐溶解度为36克,故C正确;
D、溶解度的单位是克,缺少单位,故D错误;
故选:C。
根据溶解度的四要素:一定温度、100g溶剂、饱和状态、溶解的质量进行分析。
解答本题关键是要熟悉溶解度的四要素:一定温度、100g溶剂、饱和状态、溶解的质量。
12.【答案】D
【解析】解:A、“100克水里溶解了20克甲物质”中没指明溶液的状态是否达到饱和状态,无法确定该温度下此物质的溶解度,故A不正确;
B、在描述某一物质的溶解度是必须指明温度,这里没有说温度;故B不正确;
C、时,在100 克丙物质的饱和溶液中含有30克丙物质,说明70g水中溶解了30g丙物质,所以时丙物质的溶解度大于30克,故C说法不正确;
D、时,在100克水中最多能溶解30克丁物质,则时丁物质的溶解度为30克。故D正确。
故选:D。
解决本题要注意溶解度的四个要素:条件:在一定温度下;标准:在100g溶剂里;状态:达到饱和状态; 单位:g。
考查学生对于溶解度的掌握情况,解决这类题目时要根据溶解度四要素来分析解答,其中对于溶解度的标准是易错点,要多加注意。
13.【答案】饱和 85 丙、乙、甲
【解析】解:时甲的溶解度是30g,将15g甲物质放入50g水中充分搅拌,所得溶液是饱和溶液;
设需加水的质量为x,
根据题意有:,
。
故填:饱和;85。
甲、乙、丙的饱和溶液由升温到时,甲、乙、丙变成不饱和溶液,质量分数不变,时,丙的溶解度大于乙,乙的溶解度大于甲,因此溶质的质量分数由大到小顺序是丙、乙、甲。
故填:丙、乙、甲。
根据物质的溶解度曲线可以判断某一温度时物质的溶解度大小比较;
根据物质的溶解度曲线可以判断随着温度的变化,物质的溶解度变化情况;
饱和溶液和不饱和溶液之间可以相互转化;
饱和溶液的溶质质量分数。
溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同.
14.【答案】70 冷却热饱和溶液或降温结晶 100
【解析】解:时,丙物质的溶解度是40g,即在该温度下,100g水中最多溶解40g,50g水中最多溶解20g,所以时,将25g丙加入到50g水中充分溶解后所得溶液的质量为:;
甲的溶解度受温度影响较大,用降温结晶的方法提纯甲;
设加入水的质量为x则:,解得。
故答案为:;
冷却热饱和溶液或降温结晶;
。
根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度,从而确定溶解度相同时的温度;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断温度改变后,溶液中各种成分的变化程度。
本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液结晶的方法等,本考点主要出现在选择题和填空题中。
15.【答案】在时,甲和丙的溶解度相等 蒸发结晶 乙甲丙
【解析】解:点的含义:在时,甲和丙的溶解度相等;故答案为:在时,甲和丙的溶解度相等;
当乙中混有少量甲时,可采用蒸发结晶的方法提纯乙,因为乙的溶解度受温度的影响变化不大;故答案为:蒸发结晶;
时,将甲、乙、丙三种物质的饱和溶液同时降温到,所得溶液中溶质质量分数由大到小的顺序为乙甲丙,因为降温后乙的溶解度大于甲的溶解度,丙的质量分数不变,还是最小;故答案为:乙甲丙。
根据题目信息和溶解度曲线可知:甲、乙两种固体物质的溶解度,都是随温度升高而增大,而丙的溶解度随温度的升高而减少;
交点的含义;
溶液结晶的方法;
溶液中溶质质量分数大小的比较。
本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液和溶质质量分数的变化等,本考点主要出现在选择题和填空题中.
16.【答案】 汗水中含有氯化钠,氯化钠溶液蒸发以后,剩余白色固体
【解析】解:时NaCl的溶解度是36g,则时NaCl饱和溶液中溶质的质量分数是.
被汗水浸湿的衣服晾干后,常出现斑迹,原因是汗水中含有氯化钠,氯化钠溶液蒸发以后,剩余白色固体。
故答案为:
;
汗水中含有氯化钠,氯化钠溶液蒸发以后,剩余白色固体。
根据饱和溶液中溶质质量分数,进行分析解答。
根据汗水中含有氯化钠,进行分析解答。
本题难度不大,明确饱和溶液中溶质质量分数、汗水中含有氯化钠是正确解答本题的关键。
第2页,共2页
第1页,共1页
一、单选题
a、b、c 三种物质的溶解度曲线如图所示。取等质量的 a、b、c 三种物质的饱和溶液,分别蒸发等量水后恢复至下列说法不正确的是
A. 原饱和溶液中,溶质的质量分数:
B. 恢复至 时,析出溶质的质量:
C. 恢复至时,三种溶液一定都是饱和溶液
D. 若继续降温至 ,三种溶液一定都是饱和溶液
依据下列时的实验和数据回答下列各题
已知:时,NaCl和的溶解度分别为和。
序号
固体种类 NaCl NaCl
固体的质量 30 60 30 60 90
水的质量 100 100 100 100 100
所得溶液属于饱和溶液的是
A. B. C. D.
下列关于所得溶液的说法不正确的是
A. 溶质质量:
B. 溶液质量:
C. 溶质质量分数:
D. 中溶质与溶剂的质量比为9:10
根据如图的溶解度曲线,判断下列说法中不正确的是
A. 甲物质的溶解度小于乙物质的溶解度
B. 时,甲物质和乙物质的溶解度相同
C. 将时甲、乙两物质的饱和溶液降温到时都会析出晶体
D. 当甲中混有少量乙时,可采用冷却热饱和溶液的方法提纯甲
时,某物质的饱和溶液中,溶质和溶液的质量比为2:7,则时其溶解度为
A. 克 B. C. 40克 D.
甲、乙两种固体物质不含结晶水在水中的溶解度曲线如图,下列说法正确的是
A. 甲物质的溶解度大于乙物质
B. 在时,甲、乙饱和溶液的溶质质量分数相等
C. 时,100g甲饱和溶液中含有25g甲物质
D. 降温或恒温蒸发溶剂均可使乙饱和溶液析出晶体
如图是甲、乙、两三种固体物质均不含结晶水的溶解度曲线。下列说法正确的是
A. 甲和丙的溶解度相等
B. 在时,将28g甲物质加入到50g水中,充分溶解后所得溶液的质量为78g
C. 时,等质量的甲、乙、丙三种固体配制成饱和溶液所需溶剂质量的大小关系是甲乙丙
D. 将时,甲、乙、丙三种物质的饱和溶液升温至不考虑水的蒸发,所得溶液中溶质的质量分数由大到小的顺序是甲乙丙
硝酸钾的溶解度曲线如图所示。下列说法正确的是
A. 氢氧化钙的溶解度曲线与硝酸钾相似
B. A、B、C三点对应的溶液均为饱和溶液
C. 从硝酸钾溶液中获得晶体的方法:冷却热饱和溶液
D. 溶质的质量分数:
甲是的蔗糖溶液,按如图所示进行操作。以下分析正确的是
A. 甲可能是不饱和溶液,丙和丁一定是饱和溶液
B. 丙的溶液质量和乙的相同
C. 在甲丙的过程中,蔗糖的溶解度先增大后减小
D. 乙的溶质质量分数比甲大
在较高温度下,某溶液所含的硝酸钾和氯化钠都已接近饱和,当其冷却至室温时,析出的晶体经检验几乎不含氯化钠,这是因为
A. 氯化钠的溶解度比硝酸钾的大 B. 氯化钠的溶解度比硝酸钾的小
C. 氯化钠的溶解度在室温下更大 D. 氯化钠的溶解度受温度的影响小
在时,36克食盐溶解在100克水中恰好达到饱和,以下关于食盐的溶解度说法正确的是
A. 食盐的溶解度是100克 B. 食盐的溶解度是136克
C. 时食盐的溶解度是36克 D. 时食盐的溶解度是36
下列有关溶解度的说法正确的是
A. 时,在100克水里溶解了20克甲物质,则在时甲物质的溶解度是20克
B. 100克水里溶解了20克乙物质达到饱和,则乙物质的溶解度是40克
C. 时,在100 克丙物质的饱和溶液中含有30克丙物质,则时丙物质的溶解度为30克
D. 时,在100克水中最多能溶解30克丁物质,则时丁物质的溶解度为30克
二、填空题
如图为甲、乙、丙三种物质的溶解度曲线,据图回答:
时,将15g甲物质放入50g水中充分搅拌,所得溶液是 ______填“饱和”或“不饱和”溶液;把时65g甲的饱和溶液稀释成,需加水 ______g。
甲、乙、丙的饱和溶液由升温到时,溶质的质量分数由大到小顺序是 ______。
如图是甲、乙、丙三种固体物质均不含结晶水的溶解度曲线,回答下列问题。
时,将25g丙加入到50g水中充分溶解后所得溶液的质量为 ______g。
甲中含有少量的乙,欲提纯甲应采用的方法是 ______。
将的甲溶液稀释到需加入 ______g水。
甲、乙、丙三种物质的溶解度曲线,如图所示,回答下列问题:
点的含义 ______;
当乙中混有少量甲时,可采用 ______填“降温结晶”或“蒸发结晶”的方法提纯乙;
时,将甲、乙、丙三种物质的饱和溶液同时降温到,所得溶液中溶质质量分数由大到小的顺序为 ______。
时NaCl的溶解度是36g,则时NaCl饱和溶液中溶质的质量分数是 ______。
被汗水浸湿的衣服晾干后,常出现斑迹,原因是 ______。
答案和解析
1.【答案】D
【解析】解:A、时,溶解度大小:,则原饱和溶液中,溶质的质量分数:,A选项不符合题意;
B、蒸发等量水,恢复至 时,因为析出的溶质若假设溶进蒸发掉的水中,也形成饱和溶液,原饱和溶液溶质的质量分数:,则析出溶质的质量:,B选项不符合题意;
C、恢复至时,三种溶液一定都是饱和溶液,因为原来就是饱和溶液,蒸发溶剂,溶质按一定的比例析出,C选项不符合题意;
D、若继续降温至 ,c不饱和,因为c的溶解度随温度的升高而减小,D选项符合题意;
故选:D。
本题考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关饱和溶液和不饱和溶液的转化等,本考点主要出现在选择题和填空题中。
2.【答案】
【小题1】C 【小题2】D
【解析】
【分析】
本题难度不大,掌握饱和溶液的特征、溶解度的含义是正确解答本题的关键。根据题意,时,NaCl和的溶解度分别为36g和88g,则该温度下100g水中最多溶解NaCl和的质量分别是36g和88g,进行分析判断。
【解答】
时,NaCl和的溶解度分别为36g和88g,则该温度下100g水中最多溶解NaCl和的质量分别是36g和88g,加入溶质的质量大于或等于36g和88g,能形成饱和溶液,则所得溶液属于饱和溶液的是。
故选C。
【分析】
本题难度不大,掌握饱和溶液的特征、溶解度的含义以及溶质的质量分数的计算是正确解答本题的关键。根据物质的溶解度判断固体是否能完全溶解在水中,然后根据所溶解的溶质的质量以及溶质的质量分数来分析解答。
【解答】
已知时,NaCl和的溶解度分别为36g和88g,所以能完全溶解,且为不饱和溶液;而中只能溶解36g氯化钠形成饱和溶液,中只能溶解88g硝酸钠形成饱和溶液;
A.溶液中溶质的质量为30g,中溶质的质量为36g,故A正确,但不符合题意;
B.溶液的质量为:;溶液的质量为:,故B正确,但不符合题意;
C.溶液和均是在100g水中溶解了30g溶质,故所得溶液中溶质的质量分数相等,故C正确,但不符合题意;
D.溶液是在100g水中溶解了88g硝酸钠,所以中溶质与溶剂的质量比为88::25,故D错误,但符合题意。
故选D。
4.【答案】A
【解析】解:A、比较溶解度大小须确定温度,温度大于时,甲物质的溶解度大于乙物质的溶解度,故错误;
B、时,甲物质和乙物质的溶解度相同,正确;
C、甲乙的溶解度均随温度的降低而减小,所以将时甲、乙两物质的饱和溶液降温到时都会析出晶体,正确;
D、甲的溶解度受温度影响较大,乙的溶解度受温度影响较小,所以当甲中混有少量乙时,可采用冷却热饱和溶液的方法提纯甲,正确;
故选:A。
A、比较溶解度大小须确定温度;
B、溶解度曲线的交点表示该温度下两物质的溶解度相等;
C、甲乙的溶解度均随温度的降低而减小,据此分析解答;
D、据甲乙的溶解度随温度变化情况分析提纯的方法.
解答本题的关键是知道溶解度曲线表示的意义,交点表示的意义,物质从溶液中结晶析出的方法等知识,考查了学生分析、解决问题的能力.
5.【答案】C
【解析】解:设则时其溶解度为x,,;
故选:C。
固体溶解度是指:在一定温度下,某固体物质在100克溶剂里达到饱和状态所溶解的质量;固体的溶解度由四个要点:一定温度、100g溶剂、达到饱和状态、溶解的溶质的质量;根据溶质和溶液的质量比,求溶解度。
本考点考查了固体物质的溶解度,溶解度的概念有四个要点:指明温度;克溶剂;达到饱和状态;质量即单位是克。本考点是中考的一个重要考点,一定要加强记忆,理解应用。
6.【答案】B
【解析】解:A、在比较物质的溶解度时,需要指明温度,温度不能确定,溶解度大小也不能确定,故A错误;
B、在时,甲、乙物质的溶解度相等,饱和溶液溶质质量分数,所以饱和溶液的溶质质量分数相等,故B正确;
C、时,甲物质的溶解度是25g,所以125g甲饱和溶液中含有25g甲物质,故C错误;
D、乙物质的溶解度随温度的升高而减小,所以升温或恒温蒸发溶剂均可使乙饱和溶液析出晶体,故D错误。
故选:B。
根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度,从而确定饱和溶液的溶质质量;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断温度改变后,饱和溶液中是否会析出晶体。
本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
7.【答案】C
【解析】解:A、在比较物质的溶解度时,需要指明温度,温度不能确定,溶解度大小也不能确定,故A错误;
B、在时,甲物质的溶解度是40g,将28g甲物质加入到50g水中,只能溶解20g的固体,所以充分溶解后所得溶液的质量为70g,故B错误;
C、时,甲物质的溶解度最大,丙物质的溶解度最小,所以等质量的甲、乙、丙三种固体配制成饱和溶液所需溶剂质量的大小关系是甲乙丙,故C正确;
D、时,乙物质的溶解度最大,甲、丙物质的溶解度相等,甲、乙、丙三种物质的饱和溶液升温至不考虑水的蒸发,甲、乙物质的溶解度增大,不会析出固体,乙物质的溶解度减小,析出固体,应该按照时的溶解度计算,所以所得溶液中溶质的质量分数由大到小的顺序是乙甲丙,故D错误。
故选:C。
根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度,从而确定形成溶液的质量;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断提纯晶体的方法。
本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
8.【答案】C
【解析】解:A、硝酸钾的溶解度随温度的升高而增大,氢氧化钙的溶解度随温度的升高而减小,故A错误;
B、A、B对应的溶液均为饱和溶液,C点对应的溶液为不饱和溶液,故B错误;
C、硝酸钾的溶解度受温度变化影响较大,所以从硝酸钾溶液中获得晶体的方法:冷却热饱和溶液,故C正确;
D、溶质的质量分数:,是因为A、B都是饱和溶液,C是B通过升高温度得到的不饱和溶液,故D错误。
故选:C。
根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度;可以判断物质的溶解度随温度变化的变化情况,从而判断从溶液中得到晶体的方法。
本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
9.【答案】D
【解析】解:A、甲是的蔗糖溶液,恒温蒸发,没有晶体析出,得到乙溶液,说明甲一定是不饱和溶液,故选项说法错误。
B、甲是的蔗糖溶液,恒温蒸发,没有晶体析出,得到乙溶液,乙溶液降温结晶有晶体析出,得到丙溶液,丙的溶液质量和乙的一定不同,故选项说法错误。
C、在甲丙的过程中,甲是的蔗糖溶液,恒温蒸发,温度不变,蔗糖的溶解度不变;再降温结晶,蔗糖的溶解度减小,故选项说法错误。
D、甲是的蔗糖溶液,恒温蒸发,没有晶体析出,得到乙溶液,甲、乙中所含溶质质量相等,乙中溶剂质量比甲中少,则乙的溶质质量分数比甲大,故选项说法正确。
故选:D。
根据甲是的蔗糖溶液,恒温蒸发,没有晶体析出,得到乙溶液,乙溶液降温结晶有晶体析出,得到丙溶液,进行分析判断。
本题难度不大,明确变化过程中溶液组成的变化、溶解度的影响因素等是正确解答本题的关键。
10.【答案】D
【解析】解:冷却硝酸钾和氯化钠的热饱和溶液,析出的晶体中几乎不含氯化钠,是因为氯化钠的溶解度受温度变化影响很小,几乎不随温度的降低而降低,故几乎不析出氯化钠晶体;
故选:D。
根据课本知识可知,不同物质的溶解度受温度变化影响不同,氯化钠的溶解度受温度变化影响不大,在冷却热饱和溶液时不容易析出晶体.
硝酸钾的溶解度随温度升高而升高,氯化钠的溶解度随温度变化比较小,熟石灰的溶解度随温度的升高而降低.
11.【答案】C
【解析】解:A、100克是溶剂的质量,故A错误;
B、136克是饱和溶液中溶质与溶剂的质量之和,故B错误;
C、在时,36克食盐溶解在100克水中恰好达到饱和,所以时食盐溶解度为36克,故C正确;
D、溶解度的单位是克,缺少单位,故D错误;
故选:C。
根据溶解度的四要素:一定温度、100g溶剂、饱和状态、溶解的质量进行分析。
解答本题关键是要熟悉溶解度的四要素:一定温度、100g溶剂、饱和状态、溶解的质量。
12.【答案】D
【解析】解:A、“100克水里溶解了20克甲物质”中没指明溶液的状态是否达到饱和状态,无法确定该温度下此物质的溶解度,故A不正确;
B、在描述某一物质的溶解度是必须指明温度,这里没有说温度;故B不正确;
C、时,在100 克丙物质的饱和溶液中含有30克丙物质,说明70g水中溶解了30g丙物质,所以时丙物质的溶解度大于30克,故C说法不正确;
D、时,在100克水中最多能溶解30克丁物质,则时丁物质的溶解度为30克。故D正确。
故选:D。
解决本题要注意溶解度的四个要素:条件:在一定温度下;标准:在100g溶剂里;状态:达到饱和状态; 单位:g。
考查学生对于溶解度的掌握情况,解决这类题目时要根据溶解度四要素来分析解答,其中对于溶解度的标准是易错点,要多加注意。
13.【答案】饱和 85 丙、乙、甲
【解析】解:时甲的溶解度是30g,将15g甲物质放入50g水中充分搅拌,所得溶液是饱和溶液;
设需加水的质量为x,
根据题意有:,
。
故填:饱和;85。
甲、乙、丙的饱和溶液由升温到时,甲、乙、丙变成不饱和溶液,质量分数不变,时,丙的溶解度大于乙,乙的溶解度大于甲,因此溶质的质量分数由大到小顺序是丙、乙、甲。
故填:丙、乙、甲。
根据物质的溶解度曲线可以判断某一温度时物质的溶解度大小比较;
根据物质的溶解度曲线可以判断随着温度的变化,物质的溶解度变化情况;
饱和溶液和不饱和溶液之间可以相互转化;
饱和溶液的溶质质量分数。
溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同.
14.【答案】70 冷却热饱和溶液或降温结晶 100
【解析】解:时,丙物质的溶解度是40g,即在该温度下,100g水中最多溶解40g,50g水中最多溶解20g,所以时,将25g丙加入到50g水中充分溶解后所得溶液的质量为:;
甲的溶解度受温度影响较大,用降温结晶的方法提纯甲;
设加入水的质量为x则:,解得。
故答案为:;
冷却热饱和溶液或降温结晶;
。
根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度,从而确定溶解度相同时的温度;可以比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小;可以判断物质的溶解度随温度变化的变化情况,从而判断温度改变后,溶液中各种成分的变化程度。
本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液结晶的方法等,本考点主要出现在选择题和填空题中。
15.【答案】在时,甲和丙的溶解度相等 蒸发结晶 乙甲丙
【解析】解:点的含义:在时,甲和丙的溶解度相等;故答案为:在时,甲和丙的溶解度相等;
当乙中混有少量甲时,可采用蒸发结晶的方法提纯乙,因为乙的溶解度受温度的影响变化不大;故答案为:蒸发结晶;
时,将甲、乙、丙三种物质的饱和溶液同时降温到,所得溶液中溶质质量分数由大到小的顺序为乙甲丙,因为降温后乙的溶解度大于甲的溶解度,丙的质量分数不变,还是最小;故答案为:乙甲丙。
根据题目信息和溶解度曲线可知:甲、乙两种固体物质的溶解度,都是随温度升高而增大,而丙的溶解度随温度的升高而减少;
交点的含义;
溶液结晶的方法;
溶液中溶质质量分数大小的比较。
本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液和溶质质量分数的变化等,本考点主要出现在选择题和填空题中.
16.【答案】 汗水中含有氯化钠,氯化钠溶液蒸发以后,剩余白色固体
【解析】解:时NaCl的溶解度是36g,则时NaCl饱和溶液中溶质的质量分数是.
被汗水浸湿的衣服晾干后,常出现斑迹,原因是汗水中含有氯化钠,氯化钠溶液蒸发以后,剩余白色固体。
故答案为:
;
汗水中含有氯化钠,氯化钠溶液蒸发以后,剩余白色固体。
根据饱和溶液中溶质质量分数,进行分析解答。
根据汗水中含有氯化钠,进行分析解答。
本题难度不大,明确饱和溶液中溶质质量分数、汗水中含有氯化钠是正确解答本题的关键。
第2页,共2页
第1页,共1页
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
