鲁教版五四制九年级化学3.2海水晒盐同步练习(含解析)
文档属性
| 名称 | 鲁教版五四制九年级化学3.2海水晒盐同步练习(含解析) |
|
|
| 格式 | zip | ||
| 文件大小 | 161.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-10-14 14:32:04 | ||
图片预览



文档简介
海水晒盐
一、单选题
食盐是重要的调味品,精盐是由粗盐提纯而来,在提纯过程中通常不需要的操作是
A. 蒸发 B. 吸附 C. 过滤 D. 溶解
下列关于粗盐提纯过程的基本实验操作说法不正确的是
A. 粗盐中难溶性杂质的去除步骤为溶解、过滤、蒸发
B. 每步操作中都用到了玻璃棒,它们的作用各不相同
C. 过滤时液面高于滤纸边缘,可能会导致滤液仍然浑浊
D. 蒸发结晶时,要将滤液完全蒸干才能停止加热,否则会导致产率偏大
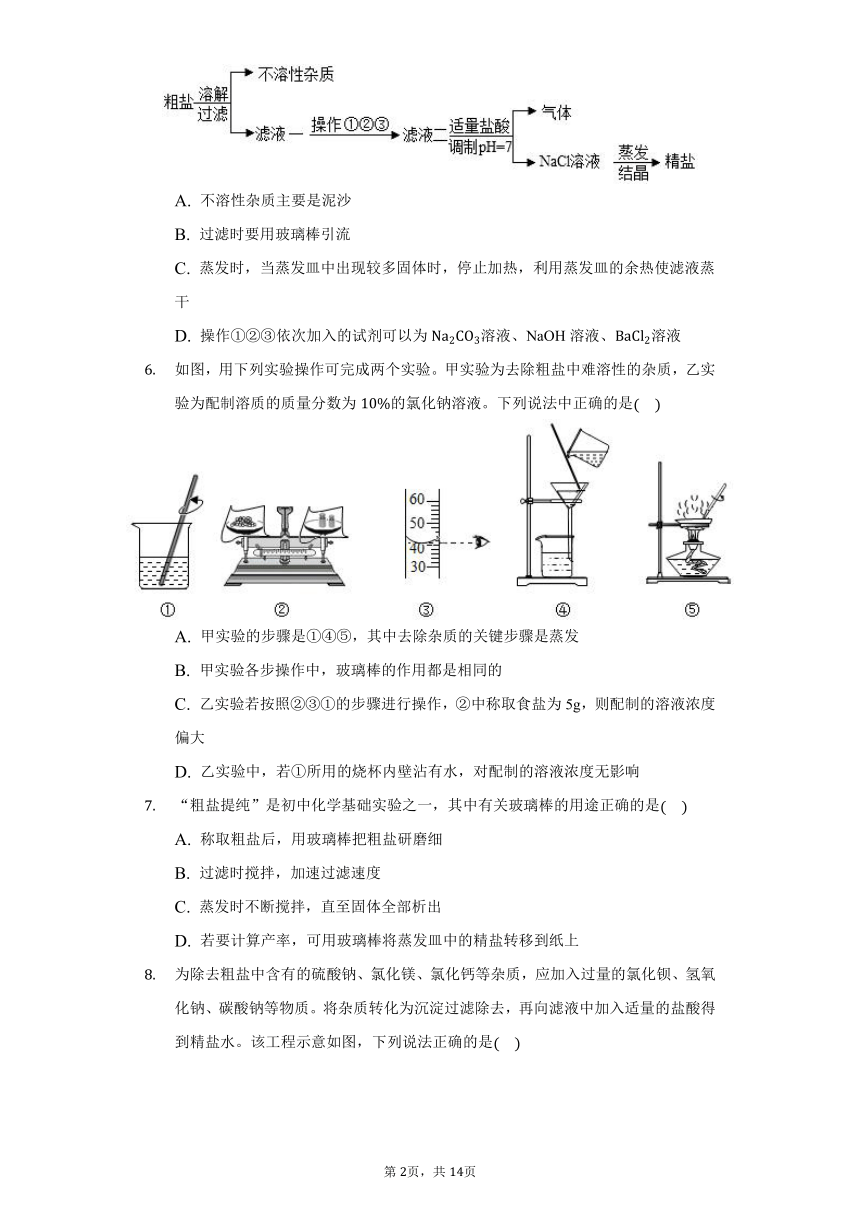
下列有关“粗盐的初步提纯”的实验操作不符合规范要求的是
A. 称量 B. 溶解
C. 过滤 D. 蒸发
提纯后的精盐中还含有、、等杂质离子,为得到较纯的氯化钠,进行如下的实验操作加入过量的溶液;加入过量的溶液;加入过量的NaOH溶液;加入适量的盐酸调节溶液的pH等于7;过滤;蒸发。下列操作顺序正确的是
A. B. C. D.
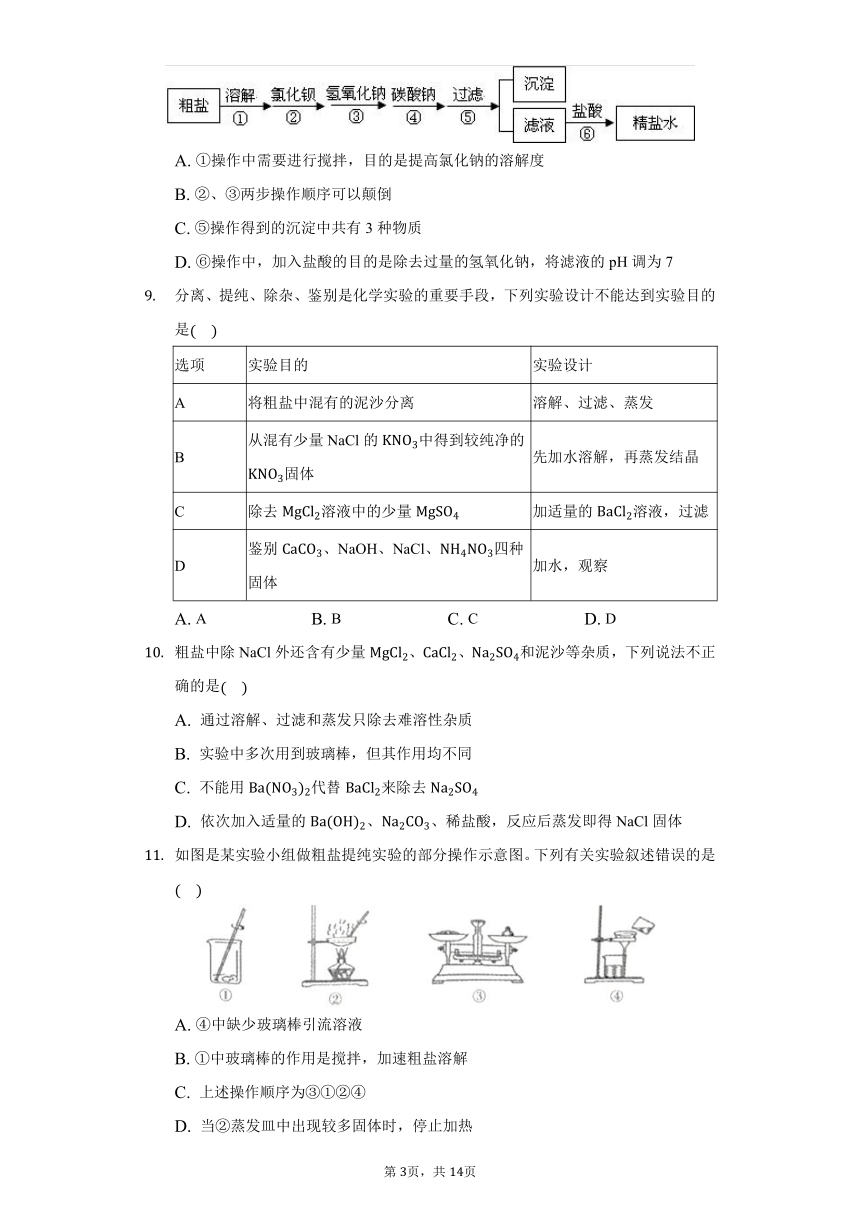
从海水中得到的粗盐中往往含有可溶性杂质主要有、、和不溶性杂质泥沙等,必须进行分离和提纯后才能使用。实验室粗盐提纯的部分流程如图,有关该流程说法错误的是
A. 不溶性杂质主要是泥沙
B. 过滤时要用玻璃棒引流
C. 蒸发时,当蒸发皿中出现较多固体时,停止加热,利用蒸发皿的余热使滤液蒸干
D. 操作依次加入的试剂可以为溶液、NaOH溶液、溶液
如图,用下列实验操作可完成两个实验。甲实验为去除粗盐中难溶性的杂质,乙实验为配制溶质的质量分数为 的氯化钠溶液。下列说法中正确的是
A. 甲实验的步骤是,其中去除杂质的关键步骤是蒸发
B. 甲实验各步操作中,玻璃棒的作用都是相同的
C. 乙实验若按照的步骤进行操作,中称取食盐为5g,则配制的溶液浓度偏大
D. 乙实验中,若所用的烧杯内壁沾有水,对配制的溶液浓度无影响
“粗盐提纯”是初中化学基础实验之一,其中有关玻璃棒的用途正确的是
A. 称取粗盐后,用玻璃棒把粗盐研磨细
B. 过滤时搅拌,加速过滤速度
C. 蒸发时不断搅拌,直至固体全部析出
D. 若要计算产率,可用玻璃棒将蒸发皿中的精盐转移到纸上
为除去粗盐中含有的硫酸钠、氯化镁、氯化钙等杂质,应加入过量的氯化钡、氢氧化钠、碳酸钠等物质。将杂质转化为沉淀过滤除去,再向滤液中加入适量的盐酸得到精盐水。该工程示意如图,下列说法正确的是
A. 操作中需要进行搅拌,目的是提高氯化钠的溶解度
B. 、两步操作顺序可以颠倒
C. 操作得到的沉淀中共有3种物质
D. 操作中,加入盐酸的目的是除去过量的氢氧化钠,将滤液的pH调为7
分离、提纯、除杂、鉴别是化学实验的重要手段,下列实验设计不能达到实验目的是
选项 实验目的 实验设计
A 将粗盐中混有的泥沙分离 溶解、过滤、蒸发
B 从混有少量NaCl的中得到较纯净的固体 先加水溶解,再蒸发结晶
C 除去溶液中的少量 加适量的溶液,过滤
D 鉴别、NaOH、NaCl、四种固体 加水,观察
A. A B. B C. C D. D
粗盐中除NaCl外还含有少量、、和泥沙等杂质,下列说法不正确的是
A. 通过溶解、过滤和蒸发只除去难溶性杂质
B. 实验中多次用到玻璃棒,但其作用均不同
C. 不能用代替来除去
D. 依次加入适量的、、稀盐酸,反应后蒸发即得NaCl固体
如图是某实验小组做粗盐提纯实验的部分操作示意图。下列有关实验叙述错误的是
A. 中缺少玻璃棒引流溶液
B. 中玻璃棒的作用是搅拌,加速粗盐溶解
C. 上述操作顺序为
D. 当蒸发皿中出现较多固体时,停止加热
除去食盐水中的、和杂质的操作有:
加过量的溶液;
过滤;
加过量溶液;
蒸发结晶;
加适量盐酸;
加过量溶液。
下列操作顺序正确的是提示、难溶于水
A. B. C. D.
关于粗盐提纯的说法错误的是
A. 该实验的主要操作步骤是溶解、过滤、蒸发
B. 上面三步中都要用到玻璃棒,它们的作用是相同的
C. 过滤时液面要低于滤纸边缘,防止滤液浑浊
D. 蒸发时看到大量食盐析出时,停止加热用余热将水蒸干
二、流程题
海水晒盐工业流程中,得到的粗盐常含有、等杂质,工业提纯粗盐的流程如图所示:
步骤操作a中需要用到玻璃棒,玻璃棒的作用是______;
步骤中操作b的名称是:______;
如果将步骤和步骤的顺序颠倒,则所制得的精盐水中还含有______.
重庆多地曾出现过盐井,从天然盐井中获取粗盐含泥沙、、、等杂质。为了除去以上杂质得到精盐,小明设计如下实验:
【提示】杂质含量较少,不考虑微溶物形成沉淀。
过滤操作中用到的玻璃仪器有烧杯、玻璃棒和 ______ 。
沉淀b所含物质为和 ______ 。
物质X是 ______ 。
滤液c中加入稀盐酸后发生中和反应的化学方程式为 ______ 。
为了证明滴加的溶液已过量,取少许上层清液于试管中加入一种试剂即可。下列物质的溶液能达到实验目的的有 ______ 。
A.
B.
C.
D.KCl
三、实验题
某化学兴趣小组的同学做粗盐含有难溶性杂质提纯实验。下图是同学们做粗盐提纯实验的操作示意图。
请回答下列问题:
操作中用玻璃棒搅拌的作用是_______________________________________;
以下操作有可能造成计算出的精盐产率偏低的是__________________________;
A、蒸发时,得到的固体潮湿 B、过滤时,滤液浑浊
C、蒸发时,液滴飞溅 D、溶解时,粗盐未充分溶解
操作中用于量取一定体积液体的仪器为_______________。
操作中,当观察到_____________________________时,停止加热。_______________________________________________________________________________________________________________
答案和解析
1.【答案】B
【解析】略
2.【答案】D
【解析】解:A、粗盐提纯步骤是溶解、过滤、蒸发,正确;
B、每步操作中都用到了玻璃棒,溶解中玻璃棒作用是加快粗盐溶解速率,过滤中玻璃棒作用是引流,蒸发中玻璃棒作用是搅拌,防止局部温度过高,造成液滴飞溅,正确;
C、过滤时液面高于滤纸边缘,可能会导致滤液仍然浑浊,正确;
D、蒸发时,当蒸发皿中出现较多固体时停止加热,靠余热蒸干,错误。
故选:D。
A、根据粗盐提纯步骤分析解答;
B、根据玻璃棒作用分析;
C、根据过滤操作注意事项分析;
D、根据蒸发皿蒸发过程中的注意事项分析.
本题是粗盐中难溶性杂质的去除的考查,主要涉及到过滤和蒸发的操作,步骤等,关键是明确过滤及蒸发过程的注意事项及操作原理。
3.【答案】A
【解析】解:A、托盘天平的使用要遵循“左物右码”的原则,图中所示操作砝码与药品位置放反了,图中所示操作错误。
B、配制溶液时,溶解操作应在烧杯中进行,用玻璃棒不断搅拌,图中所示操作正确。
C、过滤液体时,要注意“一贴、二低、三靠”的原则,图中所示操作正确。
D、蒸发时,应用玻璃棒不断搅拌,以防止局部温度过高,造成液体飞溅,图中所示操作正确。
故选:A。
A、根据托盘天平的使用要遵循“左物右码”的原则进行分析判断。
B、根据溶解操作的方法,进行分析判断。
C、过滤液体时,注意“一贴、二低、三靠”的原则。
D、根据蒸发操作的注意事项进行分析判断。
本题难度不大,掌握粗盐提纯的原理、实验步骤溶解、过滤、蒸发、注意事项是正确解答本题的关键。
4.【答案】A
【解析】解:氢氧化钠与氯化镁反应生成氢氧化镁沉淀和氯化钠;加入过量的氯化钡,氯化钡与硫酸钠反应生成硫酸钡沉淀和氯化钠,加入过量碳酸钠,碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,碳酸钠与过量的氯化钡反应生成碳酸钡沉淀和氯化钠,所以氯化钡要在碳酸钠之前加入。过量的碳酸钠和氢氧化钠可用稀盐酸除去。故操作顺序为或或。
故选:A。
氢氧化钠与氯化镁反应生成氢氧化镁沉淀和氯化钠;加入过量的氯化钡,氯化钡与硫酸钠反应生成硫酸钡沉淀和氯化钠,加入过量碳酸钠,碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,碳酸钠与过量的氯化钡反应生成碳酸钡沉淀和氯化钠,所以氯化钡要在碳酸钠之前加入。过量的碳酸钠和氢氧化钠可用稀盐酸除去。
本题属于物质的除杂,综合性较强,在除去杂质时要注意通过离子间的反应把离子转化为沉淀和气体除去,但要注意加入试剂的量,最后不能引入新的杂质。
5.【答案】D
【解析】解:A、由题意,粗盐中含有不溶性杂质泥沙等,则不溶性杂质主要是泥沙,A说法正确。
B、过滤时玻璃棒的作用是引流,B说法正确。
C、蒸发时,当蒸发皿中出现较多固体时,停止加热,利用蒸发皿的余热使滤液蒸干,C说法正确。
D、加入过量的氢氧化钠可将镁离子除去;加入过量的氯化钡溶液将硫酸根离子沉淀除去;加入过量的碳酸钠溶液将钙离子和过量的氯化钡转化为沉淀除去,故加入的碳酸钠溶液要放在加入氯化钡溶液之后;操作依次加入的试剂顺序为溶液、NaOH溶液、溶液时,过量的氯化钡无法除去,D错误;
故选:D。
A、根据粗盐中不溶性杂质泥沙等,进行分析判断。
B、根据过滤时玻璃棒的作用,进行分析判断。
C、根据蒸发操作的注意事项,进行分析判断。
D、根据盐的化学性质,进行分析判断
本题难度较大,考查了粗盐提纯中离子的除杂,除去多种杂质离子时,要考虑除杂的顺序、后面加入的试剂要能除去前面加入的过量的试剂。
6.【答案】C
【解析】解:A、甲实验的步骤是,其中去除杂质的关键步骤是过滤,该选项说法不正确;
B、溶解、过滤、蒸发中,玻璃棒的作用分别是加快溶解速率、引流、防止液体飞溅,该选项说法不正确;
C、量取水的体积是42mL,水的质量是42g,则配制的溶液浓度,该选项说法正确;
D、若所用的烧杯内壁沾有水,会导致水的质量偏大,从而导致对配制的溶液浓度偏小,该选项说法不正确。
故选:C。
过滤能够除去不溶于水的物质;
玻璃棒用途:搅拌、引流、转移物质等;
溶液浓度。
合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础。
7.【答案】D
【解析】解:A、称取粗盐后,用杵在研钵中把粗盐研磨细,不是用玻璃棒,故A错误;
B、过滤时不能用玻璃棒搅拌,过滤时用玻璃棒引流,故B错误;
C、蒸发时不断搅拌,防止局部温度过高,液滴飞溅,出现较多固体停止加热,故C错误。
D、若要计算产率,可用玻璃棒将蒸发皿中的精盐转移到纸上,故D正确。
故选:D。
根据粗盐提纯实验操作中玻璃棒的作用,进行分析判断.
本题难度不大,掌握粗盐提纯的原理、实验步骤溶解、过滤、蒸发、所需的仪器是正确解答本题的关键。
8.【答案】B
【解析】解:A、操作是溶解,需要用玻璃棒进行搅拌,目的是提高氯化钠的溶解速率,故A错误。
B、加入过量的氯化钡除去硫酸钠、加入过量氢氧化钠是除去氯化镁,这两步操作顺序可以颠倒,故B正确。
C、操作得到的沉淀有碳酸钙、氢氧化镁、碳酸钡、硫酸钡共四种,故C错误。
D、操作中,加入盐酸的目的是除去过量的氢氧化钠和碳酸钠,且盐酸是过量的,故D错误。
故选:B。
氢氧化钠与氯化镁反应生成氢氧化镁沉淀和氯化钠;加入过量的氯化钡,氯化钡与硫酸钠反应生成硫酸钡沉淀和氯化钠,加入过量碳酸钠,碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,碳酸钠与过量的氯化钡反应生成碳酸钡沉淀和氯化钠,所以氯化钡要在碳酸钠之前加入。过量的碳酸钠和氢氧化钠可用稀盐酸除去。盐酸与氢氧化钠反应生成氯化钠和水,与碳酸钠反应生成氯化钠、水和二氧化碳。
本题属于物质的除杂,综合性较强,在除去杂质时要注意通过离子间的反应把离子转化为沉淀和气体除去,但要注意加入试剂的量,最后不能引入新的杂质。
9.【答案】B
【解析】解:粗盐中的氯化钠能溶于水,泥沙不溶于水,所以可用溶解、过滤、蒸发结晶的方法除去粗盐中的泥沙,故正确;
B.氯化钠的溶解度受温度影响比较小,硝酸钾的溶解度受温度影响比较大,所以从混有少量NaCl的中得到较纯净的固体,先加热水溶解制成饱和溶液,再冷却结晶,过滤即可,故错误;
C.氯化钡与氯化镁不反应,能与硫酸镁反应生成硫酸钡沉淀和氯化镁,所以可用适量的溶液除去溶液中的少量,过滤即可,故正确;
D.碳酸钙不溶于水,氢氧化钠溶于水放热,温度会升高,硝酸铵溶于水吸热,温度会降低,而氯化钠溶于水,温度几乎不变,所以可用加水,观察的方法加以鉴别,故正确。
故选:B。
A.根据难溶性杂质的去除方法来分析;
B.根据物质的溶解度受温度的影响情况来分析;
C.根据盐的性质来分析;
D.根据物质的溶解性以及溶于水时的温度变化来分析。
本题难度不是很大,化学实验方案的设计是考查学生能力的主要类型,同时也是实验教与学难点,在具体设计时要对其原理透彻理解,可根据物质的物理性质和化学性质结合实验目的进行分析判断。
10.【答案】D
【解析】解:A、通过溶解、过滤和蒸发只除去难溶性杂质,不能除去可溶性杂质,故选项说法正确。
B、实验中多次用到玻璃棒,但其作用均不同,在溶解、过滤、蒸发操作中都要用到的玻璃仪器是玻璃棒,在溶解操作中,玻璃棒的作用是搅拌,加快粗盐的溶解速率的作用;过滤操作中,玻璃棒的作用是引流;蒸发操作中,玻璃棒的作用搅拌,防止局部温度过高,造成液滴飞溅;故选项说法正确。
C、不能用代替来除去,否则会生成新的杂质硝酸钠,故选项说法正确。
D、镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,但是加入碳酸钠溶液要放在加入的含钡离子的溶液之后,这样碳酸钠会除去反应剩余的钡离子;完全反应后,应进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,再蒸发即得NaCl固体,故选项说法错误。
故选:D。
根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,进行分析判断。
本题难度较大,考查了粗盐提纯中离子的除杂,除去多种杂质离子时,要考虑除杂的顺序、后面加入的试剂要能除去前面加入的过量的试剂。
11.【答案】C
【解析】解:A、过滤液体时,要注意“一贴、二低、三靠”的原则,图中缺少玻璃棒引流,故选项说法正确。
B、溶解时玻璃棒的作用是搅拌,加快溶解速率,故选项说法正确。
C、粗盐的主要成分是氯化钠,粗盐提纯是通过溶解把不溶物与食盐初步分离、过滤把不溶物彻底除去、蒸发食盐从溶液中分离出来而得到食盐得到精盐的过程,蒸发应在过滤之后,故选项说法错误。
D、蒸发时,待蒸发皿中出现较多固体时,应停止加热,利用余热将剩余液体蒸干,故选项说法正确。
故选:C。
A、过滤液体时,注意“一贴、二低、三靠”的原则。
B、根据溶解操作中玻璃棒的作用,进行分析判断。
C、根据粗盐提纯是将粗盐中含有的泥沙等不溶物除去,进行分析判断。
D、根据蒸发操作的注意事项进行分析判断。
本题难度不大,掌握粗盐提纯的原理、实验步骤溶解、过滤、蒸发、所需的仪器是正确解答本题的关键。
12.【答案】D
【解析】解:镁离子用氢氧根离子沉淀,加入过量的氢氧化钠溶液可以将镁离子沉淀;硫酸根离子用钡离子沉淀,加入过量的氯化钡溶液可以将硫酸根离子沉淀;至于先除镁离子,还是先除硫酸根离子都可以;钙离子用碳酸根离子沉淀,除钙离子加入过量的碳酸钠溶液转化为沉淀,但是加入碳酸钠溶液要放在加入的氯化钡溶液之后,这样碳酸钠会除去反应剩余的氯化钡;完全反应后,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以正确的顺序为:或。
故选:D。
根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,进行分析解答。
本题难度较大,考查了粗盐提纯中离子的除杂,除去多种杂质离子时,要考虑除杂的顺序、后面加入的试剂要能除去前面加入的过量的试剂。
13.【答案】B
【解析】解:该实验的主要操作步骤是溶解、过滤、蒸发,故A说法正确;
B.上面三步中都要用到玻璃棒,它们的作用是不相同的,故B说法错误;
C.过滤时液面要低于滤纸边缘,防止滤液浑浊,故C说法正确;
D.蒸发时看到大量食盐析出时,停止加热用余热将水蒸干,故D说法正确。
故选B。
根据粗盐提纯的操作、注意事项等分析判断有关的说法。
本题难度不大,掌握粗盐提纯的原理、实验步骤溶解、过滤、蒸发、所需的仪器是正确解答本题的关键。
14.【答案】引流
蒸发
氯化钙
【解析】解:步骤操作a是将沉淀与滤液分离,该操作是过滤操作,玻璃棒的作用是引流;
步骤中操作b是从精盐水中获得精盐,氯化钠的溶解度受温度影响变化不大,采用的是蒸发的方法;
步骤和步骤分别是加入过量的氢氧化钙溶液、碳酸钠溶液,分别是用于除去粗盐中的氯化镁、氯化钙,但是加入碳酸钠溶液要放在加入的氢氧化钙溶液之后,这样碳酸钠会除去反应剩余的氢氧化钙;如果将步骤和步骤的顺序颠倒,过量的氢氧化钙与会和加入的稀盐酸反应生成氯化钙和水,则所制得的精盐水中还含有氯化钙。
故答案为:引流;蒸发;氯化钙。
步骤操作a是将沉淀与滤液分离,该操作是过滤操作,进行分析解答;
步骤中操作b是从精盐水中获得精盐,进行分析解答;
步骤和步骤分别是加入过量的氢氧化钙溶液、碳酸钠溶液,分别是用于除去粗盐中的氯化镁、氯化钙的,进行分析解答。
本题难度不大,掌握粗盐提纯的原理、盐的化学性质是正确解答本题的关键;还要考虑除杂的顺序、后面加入的试剂要能除去前面加入的过量的试剂。
15.【答案】漏斗
【解析】解:过滤操作中用到的玻璃仪器有烧杯、玻璃棒和漏斗;故填:漏斗;
氢氧化钡和硫酸钠反应生成硫酸钡沉淀和氢氧化钠,氢氧化钡和氯化镁反应生成氢氧化镁沉淀和氯化钡,所以沉淀b所含物质为和硫酸钡;故填:;
碳酸钠能和氯化钙反应生成碳酸钙沉淀和氯化钠,碳酸钠和氢氧化钡反应生成碳酸钡沉淀和氢氧化钠,氯化钡和碳酸钠反应生成碳酸钡沉淀和氯化钠,所以除去氯化钠中的氯化钙、氯化钡以及氢氧化钡,需要加入的试剂为碳酸钠;故填:;
滤液c中含有氢氧化钠,所以加入稀盐酸后发生中和反应是氢氧化钠和盐酸反应生成氯化钠和水,反应的化学方程式为;故填:;
证明滴加的溶液已过量,就是检验氢氧化钡是否有剩余,所以可用碳酸钾溶液或硫酸钡溶液,观察是否出现白色沉淀。故选:BC。
本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
16.【答案】使受热均匀,防止液滴飞溅
量筒
蒸发皿中出现较多晶体
【解析】
【分析】
本题考查了粗盐的提纯,掌握粗盐提纯的操作和误差的分析进行分析解答。
【解答】
蒸发时用玻璃棒不断搅拌,可以使受热均匀,防止液滴飞溅;故填:使受热均匀,防止液滴飞溅;
蒸发时,得到的固体潮湿,计算出的精盐产率偏高,不符合题意;
B.过滤时,滤液浑浊,计算出的精盐产率偏高,不符合题意;
C.蒸发时,液滴飞溅,造成溶液有损失,得到的精盐减少,计算出的精盐产率偏低,符合题意;
D.溶解时,粗盐未充分溶解,导致计算出的精盐产率偏低,符合题意。
故选CD;
量取一定体积液体时,用量筒量取,故填:量筒;
蒸发时,当观察到蒸发皿中出现较多晶体时,停止加热,利用余热蒸干,故填:蒸发皿中出现较多晶体。
第2页,共2页
第1页,共1页
一、单选题
食盐是重要的调味品,精盐是由粗盐提纯而来,在提纯过程中通常不需要的操作是
A. 蒸发 B. 吸附 C. 过滤 D. 溶解
下列关于粗盐提纯过程的基本实验操作说法不正确的是
A. 粗盐中难溶性杂质的去除步骤为溶解、过滤、蒸发
B. 每步操作中都用到了玻璃棒,它们的作用各不相同
C. 过滤时液面高于滤纸边缘,可能会导致滤液仍然浑浊
D. 蒸发结晶时,要将滤液完全蒸干才能停止加热,否则会导致产率偏大
下列有关“粗盐的初步提纯”的实验操作不符合规范要求的是
A. 称量 B. 溶解
C. 过滤 D. 蒸发
提纯后的精盐中还含有、、等杂质离子,为得到较纯的氯化钠,进行如下的实验操作加入过量的溶液;加入过量的溶液;加入过量的NaOH溶液;加入适量的盐酸调节溶液的pH等于7;过滤;蒸发。下列操作顺序正确的是
A. B. C. D.
从海水中得到的粗盐中往往含有可溶性杂质主要有、、和不溶性杂质泥沙等,必须进行分离和提纯后才能使用。实验室粗盐提纯的部分流程如图,有关该流程说法错误的是
A. 不溶性杂质主要是泥沙
B. 过滤时要用玻璃棒引流
C. 蒸发时,当蒸发皿中出现较多固体时,停止加热,利用蒸发皿的余热使滤液蒸干
D. 操作依次加入的试剂可以为溶液、NaOH溶液、溶液
如图,用下列实验操作可完成两个实验。甲实验为去除粗盐中难溶性的杂质,乙实验为配制溶质的质量分数为 的氯化钠溶液。下列说法中正确的是
A. 甲实验的步骤是,其中去除杂质的关键步骤是蒸发
B. 甲实验各步操作中,玻璃棒的作用都是相同的
C. 乙实验若按照的步骤进行操作,中称取食盐为5g,则配制的溶液浓度偏大
D. 乙实验中,若所用的烧杯内壁沾有水,对配制的溶液浓度无影响
“粗盐提纯”是初中化学基础实验之一,其中有关玻璃棒的用途正确的是
A. 称取粗盐后,用玻璃棒把粗盐研磨细
B. 过滤时搅拌,加速过滤速度
C. 蒸发时不断搅拌,直至固体全部析出
D. 若要计算产率,可用玻璃棒将蒸发皿中的精盐转移到纸上
为除去粗盐中含有的硫酸钠、氯化镁、氯化钙等杂质,应加入过量的氯化钡、氢氧化钠、碳酸钠等物质。将杂质转化为沉淀过滤除去,再向滤液中加入适量的盐酸得到精盐水。该工程示意如图,下列说法正确的是
A. 操作中需要进行搅拌,目的是提高氯化钠的溶解度
B. 、两步操作顺序可以颠倒
C. 操作得到的沉淀中共有3种物质
D. 操作中,加入盐酸的目的是除去过量的氢氧化钠,将滤液的pH调为7
分离、提纯、除杂、鉴别是化学实验的重要手段,下列实验设计不能达到实验目的是
选项 实验目的 实验设计
A 将粗盐中混有的泥沙分离 溶解、过滤、蒸发
B 从混有少量NaCl的中得到较纯净的固体 先加水溶解,再蒸发结晶
C 除去溶液中的少量 加适量的溶液,过滤
D 鉴别、NaOH、NaCl、四种固体 加水,观察
A. A B. B C. C D. D
粗盐中除NaCl外还含有少量、、和泥沙等杂质,下列说法不正确的是
A. 通过溶解、过滤和蒸发只除去难溶性杂质
B. 实验中多次用到玻璃棒,但其作用均不同
C. 不能用代替来除去
D. 依次加入适量的、、稀盐酸,反应后蒸发即得NaCl固体
如图是某实验小组做粗盐提纯实验的部分操作示意图。下列有关实验叙述错误的是
A. 中缺少玻璃棒引流溶液
B. 中玻璃棒的作用是搅拌,加速粗盐溶解
C. 上述操作顺序为
D. 当蒸发皿中出现较多固体时,停止加热
除去食盐水中的、和杂质的操作有:
加过量的溶液;
过滤;
加过量溶液;
蒸发结晶;
加适量盐酸;
加过量溶液。
下列操作顺序正确的是提示、难溶于水
A. B. C. D.
关于粗盐提纯的说法错误的是
A. 该实验的主要操作步骤是溶解、过滤、蒸发
B. 上面三步中都要用到玻璃棒,它们的作用是相同的
C. 过滤时液面要低于滤纸边缘,防止滤液浑浊
D. 蒸发时看到大量食盐析出时,停止加热用余热将水蒸干
二、流程题
海水晒盐工业流程中,得到的粗盐常含有、等杂质,工业提纯粗盐的流程如图所示:
步骤操作a中需要用到玻璃棒,玻璃棒的作用是______;
步骤中操作b的名称是:______;
如果将步骤和步骤的顺序颠倒,则所制得的精盐水中还含有______.
重庆多地曾出现过盐井,从天然盐井中获取粗盐含泥沙、、、等杂质。为了除去以上杂质得到精盐,小明设计如下实验:
【提示】杂质含量较少,不考虑微溶物形成沉淀。
过滤操作中用到的玻璃仪器有烧杯、玻璃棒和 ______ 。
沉淀b所含物质为和 ______ 。
物质X是 ______ 。
滤液c中加入稀盐酸后发生中和反应的化学方程式为 ______ 。
为了证明滴加的溶液已过量,取少许上层清液于试管中加入一种试剂即可。下列物质的溶液能达到实验目的的有 ______ 。
A.
B.
C.
D.KCl
三、实验题
某化学兴趣小组的同学做粗盐含有难溶性杂质提纯实验。下图是同学们做粗盐提纯实验的操作示意图。
请回答下列问题:
操作中用玻璃棒搅拌的作用是_______________________________________;
以下操作有可能造成计算出的精盐产率偏低的是__________________________;
A、蒸发时,得到的固体潮湿 B、过滤时,滤液浑浊
C、蒸发时,液滴飞溅 D、溶解时,粗盐未充分溶解
操作中用于量取一定体积液体的仪器为_______________。
操作中,当观察到_____________________________时,停止加热。_______________________________________________________________________________________________________________
答案和解析
1.【答案】B
【解析】略
2.【答案】D
【解析】解:A、粗盐提纯步骤是溶解、过滤、蒸发,正确;
B、每步操作中都用到了玻璃棒,溶解中玻璃棒作用是加快粗盐溶解速率,过滤中玻璃棒作用是引流,蒸发中玻璃棒作用是搅拌,防止局部温度过高,造成液滴飞溅,正确;
C、过滤时液面高于滤纸边缘,可能会导致滤液仍然浑浊,正确;
D、蒸发时,当蒸发皿中出现较多固体时停止加热,靠余热蒸干,错误。
故选:D。
A、根据粗盐提纯步骤分析解答;
B、根据玻璃棒作用分析;
C、根据过滤操作注意事项分析;
D、根据蒸发皿蒸发过程中的注意事项分析.
本题是粗盐中难溶性杂质的去除的考查,主要涉及到过滤和蒸发的操作,步骤等,关键是明确过滤及蒸发过程的注意事项及操作原理。
3.【答案】A
【解析】解:A、托盘天平的使用要遵循“左物右码”的原则,图中所示操作砝码与药品位置放反了,图中所示操作错误。
B、配制溶液时,溶解操作应在烧杯中进行,用玻璃棒不断搅拌,图中所示操作正确。
C、过滤液体时,要注意“一贴、二低、三靠”的原则,图中所示操作正确。
D、蒸发时,应用玻璃棒不断搅拌,以防止局部温度过高,造成液体飞溅,图中所示操作正确。
故选:A。
A、根据托盘天平的使用要遵循“左物右码”的原则进行分析判断。
B、根据溶解操作的方法,进行分析判断。
C、过滤液体时,注意“一贴、二低、三靠”的原则。
D、根据蒸发操作的注意事项进行分析判断。
本题难度不大,掌握粗盐提纯的原理、实验步骤溶解、过滤、蒸发、注意事项是正确解答本题的关键。
4.【答案】A
【解析】解:氢氧化钠与氯化镁反应生成氢氧化镁沉淀和氯化钠;加入过量的氯化钡,氯化钡与硫酸钠反应生成硫酸钡沉淀和氯化钠,加入过量碳酸钠,碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,碳酸钠与过量的氯化钡反应生成碳酸钡沉淀和氯化钠,所以氯化钡要在碳酸钠之前加入。过量的碳酸钠和氢氧化钠可用稀盐酸除去。故操作顺序为或或。
故选:A。
氢氧化钠与氯化镁反应生成氢氧化镁沉淀和氯化钠;加入过量的氯化钡,氯化钡与硫酸钠反应生成硫酸钡沉淀和氯化钠,加入过量碳酸钠,碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,碳酸钠与过量的氯化钡反应生成碳酸钡沉淀和氯化钠,所以氯化钡要在碳酸钠之前加入。过量的碳酸钠和氢氧化钠可用稀盐酸除去。
本题属于物质的除杂,综合性较强,在除去杂质时要注意通过离子间的反应把离子转化为沉淀和气体除去,但要注意加入试剂的量,最后不能引入新的杂质。
5.【答案】D
【解析】解:A、由题意,粗盐中含有不溶性杂质泥沙等,则不溶性杂质主要是泥沙,A说法正确。
B、过滤时玻璃棒的作用是引流,B说法正确。
C、蒸发时,当蒸发皿中出现较多固体时,停止加热,利用蒸发皿的余热使滤液蒸干,C说法正确。
D、加入过量的氢氧化钠可将镁离子除去;加入过量的氯化钡溶液将硫酸根离子沉淀除去;加入过量的碳酸钠溶液将钙离子和过量的氯化钡转化为沉淀除去,故加入的碳酸钠溶液要放在加入氯化钡溶液之后;操作依次加入的试剂顺序为溶液、NaOH溶液、溶液时,过量的氯化钡无法除去,D错误;
故选:D。
A、根据粗盐中不溶性杂质泥沙等,进行分析判断。
B、根据过滤时玻璃棒的作用,进行分析判断。
C、根据蒸发操作的注意事项,进行分析判断。
D、根据盐的化学性质,进行分析判断
本题难度较大,考查了粗盐提纯中离子的除杂,除去多种杂质离子时,要考虑除杂的顺序、后面加入的试剂要能除去前面加入的过量的试剂。
6.【答案】C
【解析】解:A、甲实验的步骤是,其中去除杂质的关键步骤是过滤,该选项说法不正确;
B、溶解、过滤、蒸发中,玻璃棒的作用分别是加快溶解速率、引流、防止液体飞溅,该选项说法不正确;
C、量取水的体积是42mL,水的质量是42g,则配制的溶液浓度,该选项说法正确;
D、若所用的烧杯内壁沾有水,会导致水的质量偏大,从而导致对配制的溶液浓度偏小,该选项说法不正确。
故选:C。
过滤能够除去不溶于水的物质;
玻璃棒用途:搅拌、引流、转移物质等;
溶液浓度。
合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础。
7.【答案】D
【解析】解:A、称取粗盐后,用杵在研钵中把粗盐研磨细,不是用玻璃棒,故A错误;
B、过滤时不能用玻璃棒搅拌,过滤时用玻璃棒引流,故B错误;
C、蒸发时不断搅拌,防止局部温度过高,液滴飞溅,出现较多固体停止加热,故C错误。
D、若要计算产率,可用玻璃棒将蒸发皿中的精盐转移到纸上,故D正确。
故选:D。
根据粗盐提纯实验操作中玻璃棒的作用,进行分析判断.
本题难度不大,掌握粗盐提纯的原理、实验步骤溶解、过滤、蒸发、所需的仪器是正确解答本题的关键。
8.【答案】B
【解析】解:A、操作是溶解,需要用玻璃棒进行搅拌,目的是提高氯化钠的溶解速率,故A错误。
B、加入过量的氯化钡除去硫酸钠、加入过量氢氧化钠是除去氯化镁,这两步操作顺序可以颠倒,故B正确。
C、操作得到的沉淀有碳酸钙、氢氧化镁、碳酸钡、硫酸钡共四种,故C错误。
D、操作中,加入盐酸的目的是除去过量的氢氧化钠和碳酸钠,且盐酸是过量的,故D错误。
故选:B。
氢氧化钠与氯化镁反应生成氢氧化镁沉淀和氯化钠;加入过量的氯化钡,氯化钡与硫酸钠反应生成硫酸钡沉淀和氯化钠,加入过量碳酸钠,碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,碳酸钠与过量的氯化钡反应生成碳酸钡沉淀和氯化钠,所以氯化钡要在碳酸钠之前加入。过量的碳酸钠和氢氧化钠可用稀盐酸除去。盐酸与氢氧化钠反应生成氯化钠和水,与碳酸钠反应生成氯化钠、水和二氧化碳。
本题属于物质的除杂,综合性较强,在除去杂质时要注意通过离子间的反应把离子转化为沉淀和气体除去,但要注意加入试剂的量,最后不能引入新的杂质。
9.【答案】B
【解析】解:粗盐中的氯化钠能溶于水,泥沙不溶于水,所以可用溶解、过滤、蒸发结晶的方法除去粗盐中的泥沙,故正确;
B.氯化钠的溶解度受温度影响比较小,硝酸钾的溶解度受温度影响比较大,所以从混有少量NaCl的中得到较纯净的固体,先加热水溶解制成饱和溶液,再冷却结晶,过滤即可,故错误;
C.氯化钡与氯化镁不反应,能与硫酸镁反应生成硫酸钡沉淀和氯化镁,所以可用适量的溶液除去溶液中的少量,过滤即可,故正确;
D.碳酸钙不溶于水,氢氧化钠溶于水放热,温度会升高,硝酸铵溶于水吸热,温度会降低,而氯化钠溶于水,温度几乎不变,所以可用加水,观察的方法加以鉴别,故正确。
故选:B。
A.根据难溶性杂质的去除方法来分析;
B.根据物质的溶解度受温度的影响情况来分析;
C.根据盐的性质来分析;
D.根据物质的溶解性以及溶于水时的温度变化来分析。
本题难度不是很大,化学实验方案的设计是考查学生能力的主要类型,同时也是实验教与学难点,在具体设计时要对其原理透彻理解,可根据物质的物理性质和化学性质结合实验目的进行分析判断。
10.【答案】D
【解析】解:A、通过溶解、过滤和蒸发只除去难溶性杂质,不能除去可溶性杂质,故选项说法正确。
B、实验中多次用到玻璃棒,但其作用均不同,在溶解、过滤、蒸发操作中都要用到的玻璃仪器是玻璃棒,在溶解操作中,玻璃棒的作用是搅拌,加快粗盐的溶解速率的作用;过滤操作中,玻璃棒的作用是引流;蒸发操作中,玻璃棒的作用搅拌,防止局部温度过高,造成液滴飞溅;故选项说法正确。
C、不能用代替来除去,否则会生成新的杂质硝酸钠,故选项说法正确。
D、镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,但是加入碳酸钠溶液要放在加入的含钡离子的溶液之后,这样碳酸钠会除去反应剩余的钡离子;完全反应后,应进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,再蒸发即得NaCl固体,故选项说法错误。
故选:D。
根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,进行分析判断。
本题难度较大,考查了粗盐提纯中离子的除杂,除去多种杂质离子时,要考虑除杂的顺序、后面加入的试剂要能除去前面加入的过量的试剂。
11.【答案】C
【解析】解:A、过滤液体时,要注意“一贴、二低、三靠”的原则,图中缺少玻璃棒引流,故选项说法正确。
B、溶解时玻璃棒的作用是搅拌,加快溶解速率,故选项说法正确。
C、粗盐的主要成分是氯化钠,粗盐提纯是通过溶解把不溶物与食盐初步分离、过滤把不溶物彻底除去、蒸发食盐从溶液中分离出来而得到食盐得到精盐的过程,蒸发应在过滤之后,故选项说法错误。
D、蒸发时,待蒸发皿中出现较多固体时,应停止加热,利用余热将剩余液体蒸干,故选项说法正确。
故选:C。
A、过滤液体时,注意“一贴、二低、三靠”的原则。
B、根据溶解操作中玻璃棒的作用,进行分析判断。
C、根据粗盐提纯是将粗盐中含有的泥沙等不溶物除去,进行分析判断。
D、根据蒸发操作的注意事项进行分析判断。
本题难度不大,掌握粗盐提纯的原理、实验步骤溶解、过滤、蒸发、所需的仪器是正确解答本题的关键。
12.【答案】D
【解析】解:镁离子用氢氧根离子沉淀,加入过量的氢氧化钠溶液可以将镁离子沉淀;硫酸根离子用钡离子沉淀,加入过量的氯化钡溶液可以将硫酸根离子沉淀;至于先除镁离子,还是先除硫酸根离子都可以;钙离子用碳酸根离子沉淀,除钙离子加入过量的碳酸钠溶液转化为沉淀,但是加入碳酸钠溶液要放在加入的氯化钡溶液之后,这样碳酸钠会除去反应剩余的氯化钡;完全反应后,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以正确的顺序为:或。
故选:D。
根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,进行分析解答。
本题难度较大,考查了粗盐提纯中离子的除杂,除去多种杂质离子时,要考虑除杂的顺序、后面加入的试剂要能除去前面加入的过量的试剂。
13.【答案】B
【解析】解:该实验的主要操作步骤是溶解、过滤、蒸发,故A说法正确;
B.上面三步中都要用到玻璃棒,它们的作用是不相同的,故B说法错误;
C.过滤时液面要低于滤纸边缘,防止滤液浑浊,故C说法正确;
D.蒸发时看到大量食盐析出时,停止加热用余热将水蒸干,故D说法正确。
故选B。
根据粗盐提纯的操作、注意事项等分析判断有关的说法。
本题难度不大,掌握粗盐提纯的原理、实验步骤溶解、过滤、蒸发、所需的仪器是正确解答本题的关键。
14.【答案】引流
蒸发
氯化钙
【解析】解:步骤操作a是将沉淀与滤液分离,该操作是过滤操作,玻璃棒的作用是引流;
步骤中操作b是从精盐水中获得精盐,氯化钠的溶解度受温度影响变化不大,采用的是蒸发的方法;
步骤和步骤分别是加入过量的氢氧化钙溶液、碳酸钠溶液,分别是用于除去粗盐中的氯化镁、氯化钙,但是加入碳酸钠溶液要放在加入的氢氧化钙溶液之后,这样碳酸钠会除去反应剩余的氢氧化钙;如果将步骤和步骤的顺序颠倒,过量的氢氧化钙与会和加入的稀盐酸反应生成氯化钙和水,则所制得的精盐水中还含有氯化钙。
故答案为:引流;蒸发;氯化钙。
步骤操作a是将沉淀与滤液分离,该操作是过滤操作,进行分析解答;
步骤中操作b是从精盐水中获得精盐,进行分析解答;
步骤和步骤分别是加入过量的氢氧化钙溶液、碳酸钠溶液,分别是用于除去粗盐中的氯化镁、氯化钙的,进行分析解答。
本题难度不大,掌握粗盐提纯的原理、盐的化学性质是正确解答本题的关键;还要考虑除杂的顺序、后面加入的试剂要能除去前面加入的过量的试剂。
15.【答案】漏斗
【解析】解:过滤操作中用到的玻璃仪器有烧杯、玻璃棒和漏斗;故填:漏斗;
氢氧化钡和硫酸钠反应生成硫酸钡沉淀和氢氧化钠,氢氧化钡和氯化镁反应生成氢氧化镁沉淀和氯化钡,所以沉淀b所含物质为和硫酸钡;故填:;
碳酸钠能和氯化钙反应生成碳酸钙沉淀和氯化钠,碳酸钠和氢氧化钡反应生成碳酸钡沉淀和氢氧化钠,氯化钡和碳酸钠反应生成碳酸钡沉淀和氯化钠,所以除去氯化钠中的氯化钙、氯化钡以及氢氧化钡,需要加入的试剂为碳酸钠;故填:;
滤液c中含有氢氧化钠,所以加入稀盐酸后发生中和反应是氢氧化钠和盐酸反应生成氯化钠和水,反应的化学方程式为;故填:;
证明滴加的溶液已过量,就是检验氢氧化钡是否有剩余,所以可用碳酸钾溶液或硫酸钡溶液,观察是否出现白色沉淀。故选:BC。
本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
16.【答案】使受热均匀,防止液滴飞溅
量筒
蒸发皿中出现较多晶体
【解析】
【分析】
本题考查了粗盐的提纯,掌握粗盐提纯的操作和误差的分析进行分析解答。
【解答】
蒸发时用玻璃棒不断搅拌,可以使受热均匀,防止液滴飞溅;故填:使受热均匀,防止液滴飞溅;
蒸发时,得到的固体潮湿,计算出的精盐产率偏高,不符合题意;
B.过滤时,滤液浑浊,计算出的精盐产率偏高,不符合题意;
C.蒸发时,液滴飞溅,造成溶液有损失,得到的精盐减少,计算出的精盐产率偏低,符合题意;
D.溶解时,粗盐未充分溶解,导致计算出的精盐产率偏低,符合题意。
故选CD;
量取一定体积液体时,用量筒量取,故填:量筒;
蒸发时,当观察到蒸发皿中出现较多晶体时,停止加热,利用余热蒸干,故填:蒸发皿中出现较多晶体。
第2页,共2页
第1页,共1页
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
